博文
干细胞衰老会降低其形成肿瘤的能力  精选
精选
|
干细胞衰老会降低其形成肿瘤的能力
肺干细胞衰老会导致铁缺乏并降低细胞形成肿瘤的能力,这一发现对于癌症治疗和再生医学具有潜在影响。
衰老对癌症有何影响?庄等人在《自然》杂志上发表的文章报道了我们对衰老如何影响癌症风险的认知中一个令人惊讶的转折。
癌症是人类主要的致死原因之一,鉴于其发病率通常会随着个体年龄增长而稳步上升,它被视为一种与衰老相关的疾病。然而,一些长寿的哺乳动物物种比人类更不容易患癌症。在人类身上,癌症和衰老有着共同特征,包括DNA损伤(基因组不稳定性)和慢性炎症。随着人体衰老,正常细胞会积累促进癌症的“驱动”突变。这些基因变化会促进肿瘤形成以及癌细胞向远处器官的转移,往往会导致死亡。不过,或许与预期相反的是,在人们达到80 - 85岁之后,观察到了相反的趋势,即衰老与癌症发展倾向降低相关联。
研究衰老对癌症的影响是一项颇具挑战性的工作,因为科学家必须通过实验证明他们所使用的动物模型能够很好地重现人类疾病的特征。在这里,庄及其同事利用基因工程小鼠来研究衰老对肺干细胞引发肿瘤及促进癌症发展能力的影响。这与其他实验策略形成对比,那些策略是将细胞移植到近交系小鼠体内,并不适合用于研究肿瘤起始的早期阶段,因为此类移植细胞是肿瘤生长后期阶段的模型。
庄及其同事将驱动突变引入肺肺泡结构的干细胞(即AT2细胞)中。这些细胞也能在应对损伤时协助组织再生,并且是引发人类一种名为腺癌的肺癌的细胞类型。为了诱导肿瘤形成,作者对促进癌症的酶Kras进行了基因改造,并删除了编码肿瘤抑制蛋白p53的基因。令人惊讶的是,携带这些突变的老年小鼠的存活率更高,而且与具有这些基因改造变化的年轻小鼠相比,其肺部肿瘤的发病率有所降低,这表明AT2细胞的促肿瘤潜能会随着年龄增长而下降。对分离出的AT2细胞进一步分析显示,干细胞在衰老过程中会发生变化,进而导致干细胞特性(“干性”)丧失——换句话说,就是细胞引发肿瘤的能力丧失了。
作者研究了老年AT2细胞干性及肿瘤形成潜能丧失的分子基础(图1)。通过运用前沿技术评估基因表达水平,作者发现老年和年轻AT2细胞之间存在显著差异。例如,编码蛋白Nupr1的基因Nupr1在老年AT2细胞中高度表达。Nupr1能激活特定基因的表达,其中一些基因参与铁水平的调控,这包括编码蛋白Lcn2的基因Lcn2。因此,与年轻的AT2细胞相比,老年AT2细胞内的细胞铁可利用性降低了。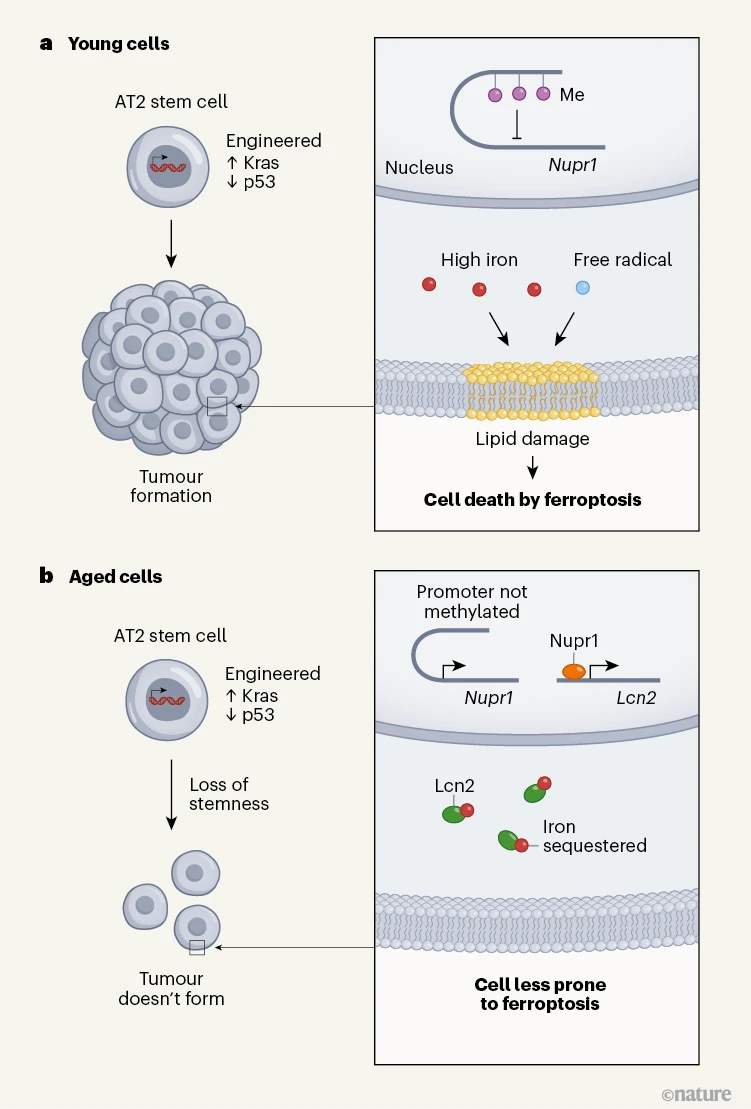 图1 | 干细胞衰老如何影响其形成肿瘤的可能性。庄等人研究了一个肺癌形成的小鼠模型,在该模型中,名为AT2细胞的肺干细胞经过基因改造发生了驱动癌症形成的变化:促进癌症的基因Kras活性升高以及肿瘤抑制基因p53缺失。a,在年轻动物中,经过改造的干细胞会引发肿瘤。这些动物会抑制基因Nupr1的表达,这种抑制作用是由基因组中控制Nupr1表达的区域(启动子)的DNA上存在甲基基团介导的。当Nupr1蛋白不表达时,可利用的铁水平较高。铁以及被称为自由基的分子的存在,会使肿瘤细胞发生一种名为铁死亡的细胞死亡类型,这种死亡是由细胞膜中脂质的裂解介导的。人们对触发这种细胞死亡类型作为杀死癌细胞的一种方式很感兴趣。b,相比之下,老年动物中经过改造的干细胞丧失了部分干细胞特性(“干性”),包括增殖以及形成不同类型细胞的能力。这些干细胞不会形成肿瘤。这些动物的DNA缺乏高水平的甲基修饰,这意味着Nupr1存在。它的存在会驱动一种蛋白Lcn2的表达,Lcn2会结合并螯合铁,使得这些细胞不太容易发生铁死亡。
庄等人接着表明,在老年小鼠中使Nupr1基因失活可恢复肿瘤进展,从而证明了Nupr1的表达会抑制衰老过程中AT2细胞形成肿瘤。与铁缺乏是老年小鼠中Nupr1上调结果这一模型相符的是,庄及其同事发现,尽管在体外,Nupr1基因受到抑制的AT2细胞能够自我更新并形成球形癌组织,但当使用一种螯合铁的分子(即铁螯合剂去铁胺)时,这种特性就会被阻断。癌细胞在体外形成肿瘤球为这些细胞在体内引发肿瘤的能力提供了一个指标。此外,给这些细胞补充铁会促进球体形成。这些实验使作者得出结论:铁能使年轻的AT2干细胞形成肿瘤,而铁缺乏会抑制老年AT2细胞的干性——这种自我更新和分化能力是它们产生癌症倾向的基础。
老年和年轻AT2细胞中铁可利用性的差异促使庄及其同事去研究这些细胞对一种依赖铁的细胞死亡形式(即铁死亡)的易感性。这种细胞死亡类型是由氧化膜脂质无限制积累导致的,这可能是细胞中存在的一种活性形式的铁(氧化还原活性铁)造成的结果。事实上,作者发现老年AT2细胞对铁死亡有抵抗力,而年轻的AT2细胞则较易受其影响。进一步研究显示,在老年细胞中,基因组内调控基因表达的特定区域(即增强子和启动子)的一种名为甲基化的DNA修饰水平较低。这些调控区域的DNA甲基化会抑制基因表达,而低水平(称为低甲基化)是衰老的另一个特征。
这一发现为老年AT2细胞中Nupr1和Lcn2表达升高提供了一种机制上的解释。在年轻的AT2细胞中,对介导DNA甲基化的酶(DNA甲基转移酶)进行药理抑制或基因抑制,会使其基因表达谱变得与老年AT2细胞相似。
分化的乳腺癌细胞可以恢复到类干细胞状态,促进癌症扩散并产生耐药性。铁通过影响被称为组蛋白的DNA结合蛋白的甲基化来调控这种细胞状态转变,而且这些细胞中高水平的铁必然使其易受铁死亡影响。在肺癌的背景下,弄清楚铁如何维持年轻AT2细胞的干性将会很有意思。此外,是什么导致衰老过程中特定基因组DNA位点出现低甲基化仍有待完全弄清楚。
不过,这项研究指出了在癌症临床管理和再生医学方面值得探究的治疗途径。例如,研究结果表明,诱导铁死亡在年轻癌症患者身上可能比在老年癌症患者身上更有效。同理,在再生医学背景下抑制铁死亡在年轻个体身上预计会比在老年个体身上更有效。这项工作也提出了一个问题,即是否可以通过调控铁的可利用性来降低患癌风险或促进长寿。最后,确定在其他组织发生的癌症的干细胞中是否也会出现铁水平变化将会很有意思。
《自然》637卷,36 - 37页(2025年)
doi: https://doi.org/10.1038/d41586-024-03721-7
图1 | 干细胞衰老如何影响其形成肿瘤的可能性。庄等人研究了一个肺癌形成的小鼠模型,在该模型中,名为AT2细胞的肺干细胞经过基因改造发生了驱动癌症形成的变化:促进癌症的基因Kras活性升高以及肿瘤抑制基因p53缺失。a,在年轻动物中,经过改造的干细胞会引发肿瘤。这些动物会抑制基因Nupr1的表达,这种抑制作用是由基因组中控制Nupr1表达的区域(启动子)的DNA上存在甲基基团介导的。当Nupr1蛋白不表达时,可利用的铁水平较高。铁以及被称为自由基的分子的存在,会使肿瘤细胞发生一种名为铁死亡的细胞死亡类型,这种死亡是由细胞膜中脂质的裂解介导的。人们对触发这种细胞死亡类型作为杀死癌细胞的一种方式很感兴趣。b,相比之下,老年动物中经过改造的干细胞丧失了部分干细胞特性(“干性”),包括增殖以及形成不同类型细胞的能力。这些干细胞不会形成肿瘤。这些动物的DNA缺乏高水平的甲基修饰,这意味着Nupr1存在。它的存在会驱动一种蛋白Lcn2的表达,Lcn2会结合并螯合铁,使得这些细胞不太容易发生铁死亡。
庄等人接着表明,在老年小鼠中使Nupr1基因失活可恢复肿瘤进展,从而证明了Nupr1的表达会抑制衰老过程中AT2细胞形成肿瘤。与铁缺乏是老年小鼠中Nupr1上调结果这一模型相符的是,庄及其同事发现,尽管在体外,Nupr1基因受到抑制的AT2细胞能够自我更新并形成球形癌组织,但当使用一种螯合铁的分子(即铁螯合剂去铁胺)时,这种特性就会被阻断。癌细胞在体外形成肿瘤球为这些细胞在体内引发肿瘤的能力提供了一个指标。此外,给这些细胞补充铁会促进球体形成。这些实验使作者得出结论:铁能使年轻的AT2干细胞形成肿瘤,而铁缺乏会抑制老年AT2细胞的干性——这种自我更新和分化能力是它们产生癌症倾向的基础。
老年和年轻AT2细胞中铁可利用性的差异促使庄及其同事去研究这些细胞对一种依赖铁的细胞死亡形式(即铁死亡)的易感性。这种细胞死亡类型是由氧化膜脂质无限制积累导致的,这可能是细胞中存在的一种活性形式的铁(氧化还原活性铁)造成的结果。事实上,作者发现老年AT2细胞对铁死亡有抵抗力,而年轻的AT2细胞则较易受其影响。进一步研究显示,在老年细胞中,基因组内调控基因表达的特定区域(即增强子和启动子)的一种名为甲基化的DNA修饰水平较低。这些调控区域的DNA甲基化会抑制基因表达,而低水平(称为低甲基化)是衰老的另一个特征。
这一发现为老年AT2细胞中Nupr1和Lcn2表达升高提供了一种机制上的解释。在年轻的AT2细胞中,对介导DNA甲基化的酶(DNA甲基转移酶)进行药理抑制或基因抑制,会使其基因表达谱变得与老年AT2细胞相似。
分化的乳腺癌细胞可以恢复到类干细胞状态,促进癌症扩散并产生耐药性。铁通过影响被称为组蛋白的DNA结合蛋白的甲基化来调控这种细胞状态转变,而且这些细胞中高水平的铁必然使其易受铁死亡影响。在肺癌的背景下,弄清楚铁如何维持年轻AT2细胞的干性将会很有意思。此外,是什么导致衰老过程中特定基因组DNA位点出现低甲基化仍有待完全弄清楚。
不过,这项研究指出了在癌症临床管理和再生医学方面值得探究的治疗途径。例如,研究结果表明,诱导铁死亡在年轻癌症患者身上可能比在老年癌症患者身上更有效。同理,在再生医学背景下抑制铁死亡在年轻个体身上预计会比在老年个体身上更有效。这项工作也提出了一个问题,即是否可以通过调控铁的可利用性来降低患癌风险或促进长寿。最后,确定在其他组织发生的癌症的干细胞中是否也会出现铁水平变化将会很有意思。
《自然》637卷,36 - 37页(2025年)
doi: https://doi.org/10.1038/d41586-024-03721-7
https://wap.sciencenet.cn/blog-41174-1466985.html
上一篇:关节炎微环境调控的产氢纳米颗粒
下一篇:氢气对失血性休克效果不理想【202501】