博文
光合产氢活菌活体注射治疗肿瘤的探索【中山】
||
光合产氢活菌活体注射治疗肿瘤的探索
论文作者分别来自中山大学深圳园区和中国科学院先进技术研究院等机构。
本研究基于氢气具有理想生物学效应,但存在给药困难的原因,通过使用光合产氢气细菌的方法,结合近红外(NIR)介导的光热疗法,结果发现局部照射能让细菌产生氢气并发挥效应。当然这属于概念验证性研究,短时间很难克服直接使用细菌和材料的规则限制。但这种想法仍然值得鼓励。
氢气(H2)疗法以其固有的生物安全性在抗癌策略中展现出巨大的潜力。然而,由于依赖全身性气体给药或化学反应生成,氢气治疗方式的效率低、靶向性差且利用率不高。在本研究中,我们使用光合细菌红假单胞菌(Rhodobacter sphaeroides)作为活体治疗手段,通过近红外(NIR)介导的光热疗法进行原位产生氢气。活体红假单胞菌在NIR光谱中表现出强烈的吸收能力,有效将光能转化为热能,同时生成氢气。这种双重功能促进了肿瘤细胞死亡的靶向诱导,并显著减少了对邻近正常组织的附带损伤。研究结果表明,通过光合细菌介导的氢疗与光热效应的结合,提供了一种强大的双模式方法,增强了肿瘤治疗的总体效果。这种活体治疗策略不仅利用了氢气和光热治疗两种治疗方式的治疗潜力,还保护了健康组织,标志着癌症治疗技术的重大进步。
1 引言
癌症仍然是全球范围内最重大的健康威胁,但传统的治疗方式如化疗和放疗常常显示出有限的效果和对正常组织的非特异性毒性,从而给患者带来相当大的不适。[1] 纳米生物技术的快速发展催生了多种治疗平台,提高了癌症治疗的精准性和有效性。[2] 这些平台促进了多功能纳米药物的开发,包括基于气体的治疗方式,可以在保护健康细胞的同时专门消除癌细胞,从而最小化传统癌症疗法常见的副作用。[3] 几种生理气体分子如氧气(O2)、[4] 一氧化氮(NO)、[5] 硫化氢(H2S)、[6] 一氧化碳(CO)、[7] 二氧化硫(SO2)和氢气(H2)[8] 在生理和病理过程中具有调节血管扩张、神经传递、抗炎和抗氧化反应的功能。其在从心血管疾病到神经退行性疾病和癌症等疾病中的特定治疗效果已被记录,这得益于其调节生理功能的能力。
氢气是自然界中最轻的分子,约占地球大气的0.5ppm。自1975年以来的研究突显了氢气在癌症治疗中的潜力,特别是由于其选择性抗氧化特性,可以调节癌细胞内的活性氧物种(ROS)水平。[9] 目前,氢气疗法因其选择性抗氧化特性、出色的安全性、广泛的治疗应用、与其他疗法的协同潜力以及最小干扰正常细胞过程而优于其他基于气体的治疗。[10] 然而,当前的氢气输送方法受到其高扩散性、非极性和在生理条件下低溶解度的限制,阻碍了长期释放并降低了治疗效率。[11] 原位氢气生成技术,如自分解纳米系统和光介导的水分解,常因催化效率低下而受到影响。[12] 解决这些输送和长期原位生成的挑战对于最大化氢气疗法的临床益处至关重要。此外,将氢气疗法与传统治疗方式如化疗和放疗结合已显示出显著的协同治疗效果。[13] 生物制氢提供可持续、环保和高效的能源生成方式,来自可再生能源,提供多功能和经济可行的应用,[14] 包括增强治疗效率的长期氢气释放潜力。[15] 光合细菌如紫色非硫细菌(PNSB)因其能够在光照下通过氢酶高效产生和释放氢气,并且能够代谢广泛底物的能力而受到青睐,[16] 可作为活体治疗手段。活体治疗的优点特别是在疗效、精确控制和安全性方面,凸显了其变革性的潜力,重新定义并扩展了未来治疗策略的范围。这一创新方法提供了利用活体系统进行更有针对性的、适应性强的和可持续治疗的能力,成为下一代医学的重要进步。[17]
在这项工作中,我们开发了利用光合细菌红假单胞菌(Rhodobacter sphaeroides)的活体治疗策略,用于在近红外光(NIR)照射下进行长期氢气产生和高热诱导,以实现肿瘤氢-光热疗法。红假单胞菌是一种兼性厌氧细菌,非常适合在缺氧条件下生长,并表现出向光运动的特性。[18] 这些独特的特性增强了其适应肿瘤微环境并向光照区域迁移的能力,使其成为肿瘤靶向和治疗的理想候选者。活体红假单胞菌作为光合产氢菌表现出色,具有显著的近红外吸收、高效的近红外光转热能力、高光热稳定性以及可忽略的细胞毒性效应。因此,我们假设红假单胞菌可以在808纳米激光照射下同时产生氢气和热量,从而实现结合氢气产生与光热效应的双重模式治疗。利用这种细菌作为氢气和光热效应的双重供应源,可以实现更精确和可控的氢气输送,同时也显示出较高的生物相容性。重要的是,红假单胞菌介导的协同氢-光热疗法对正常细胞没有明显影响,强调了其在保护健康正常细胞免受高热损伤的同时选择性靶向肿瘤细胞的潜力。进一步研究表明,这种协同策略显著增加了癌细胞内的活性氧生成,破坏其氧化还原平衡并损害线粒体功能,最终导致细胞凋亡(图1)。通过利用红假单胞菌的内在生物学能力,本研究提供了一种潜在的高效活体治疗策略,以减缓肿瘤进展同时保护健康细胞。这种双重作用策略不仅精确靶向恶性细胞,还最大限度地减少了对周围非癌组织的附带损伤,从而为推进癌症治疗提供了一条有希望的途径。
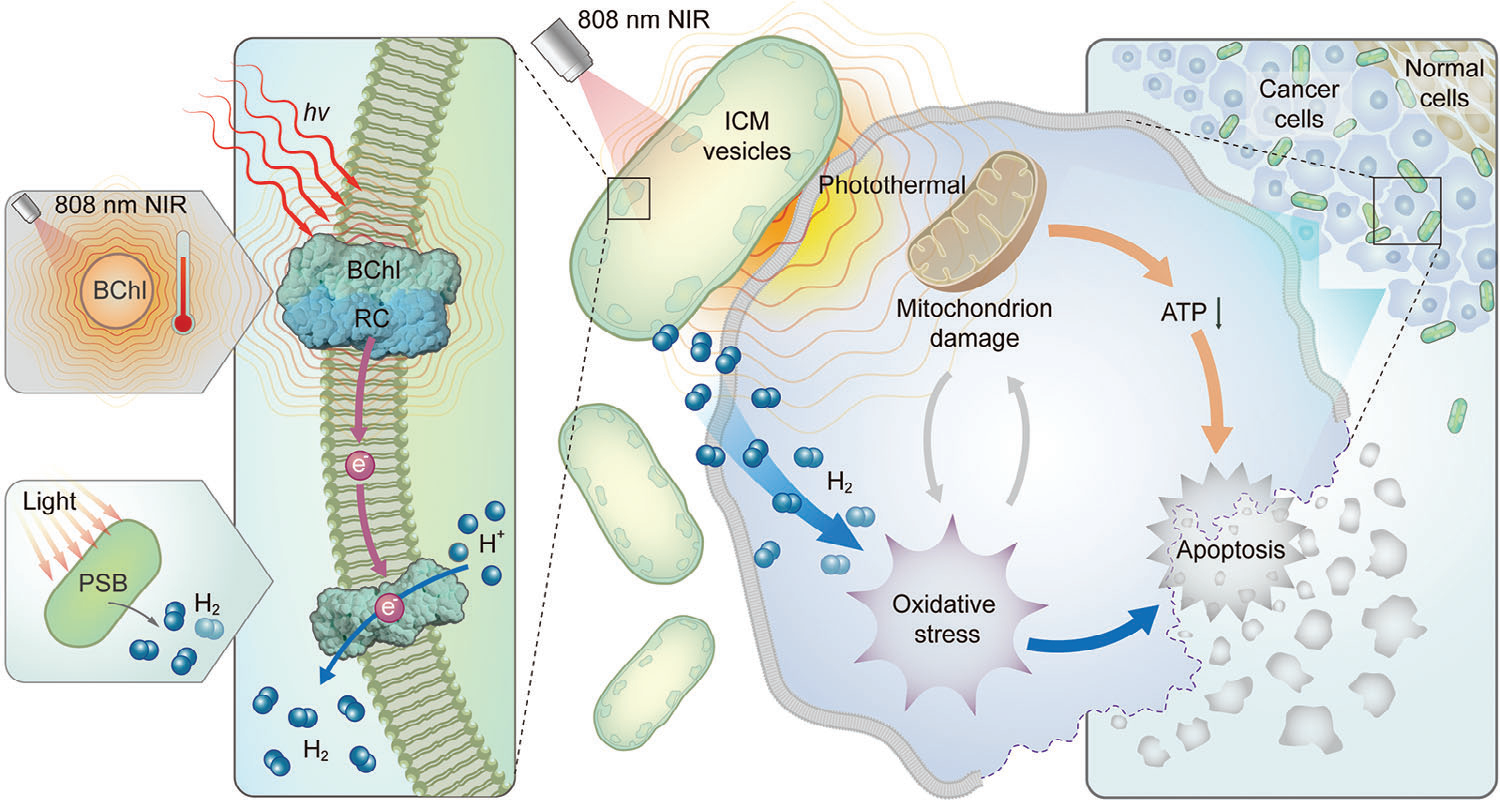
图1示意图展示了红假单胞菌生物产氢和光热转换的过程,用于协同氢-光热疗法。BChl,细菌叶绿素;RC,反应中心;PSB,光合细菌;ICM,胞内膜。
2 结果与讨论
2.1 红假单胞菌的氢气产生和光热效应相结合
红假单胞菌是最常用的紫色非硫光合细菌模型,表现出多功能代谢能力,包括有氧和无氧呼吸、光合作用和发酵。[18c] 我们使用Luria Broth(LB)培养基培养红假单胞菌并进行表征。扫描电镜(SEM)和透射电镜(TEM)显示其卵形形状,直径约为2微米(图2a,b)。在LB培养基中培养12小时后,红假单胞菌变为红色(图2c)。紫外-可见光谱表明其吸收范围广泛,峰值分别在808纳米和850纳米处(图2e),这是细菌叶绿素(BChl)的特征吸收峰。BChl作为捕光天线,利用光能进行光合作用。[16] 如图2d和e所示,细菌悬浮液的颜色和吸收强度均呈浓度依赖性。为了确认吸收特性来源于BChl,我们从红假单胞菌中提取了BChl并分析其吸收光谱,结果显示其吸收峰与红假单胞菌在近红外区域的吸收峰一致(图2f)。在胞内膜(ICM)中,BChl吸收光子并将能量传递给光合作用反应中心(图2g),启动光合作用电子传递链,生成高能电子,随后由氢化酶利用。氢化酶捕获来自铁氧还蛋白的电子,促进质子通过腺苷三磷酸(ATP)合成酶跨膜转运,最终产生H2。[20]
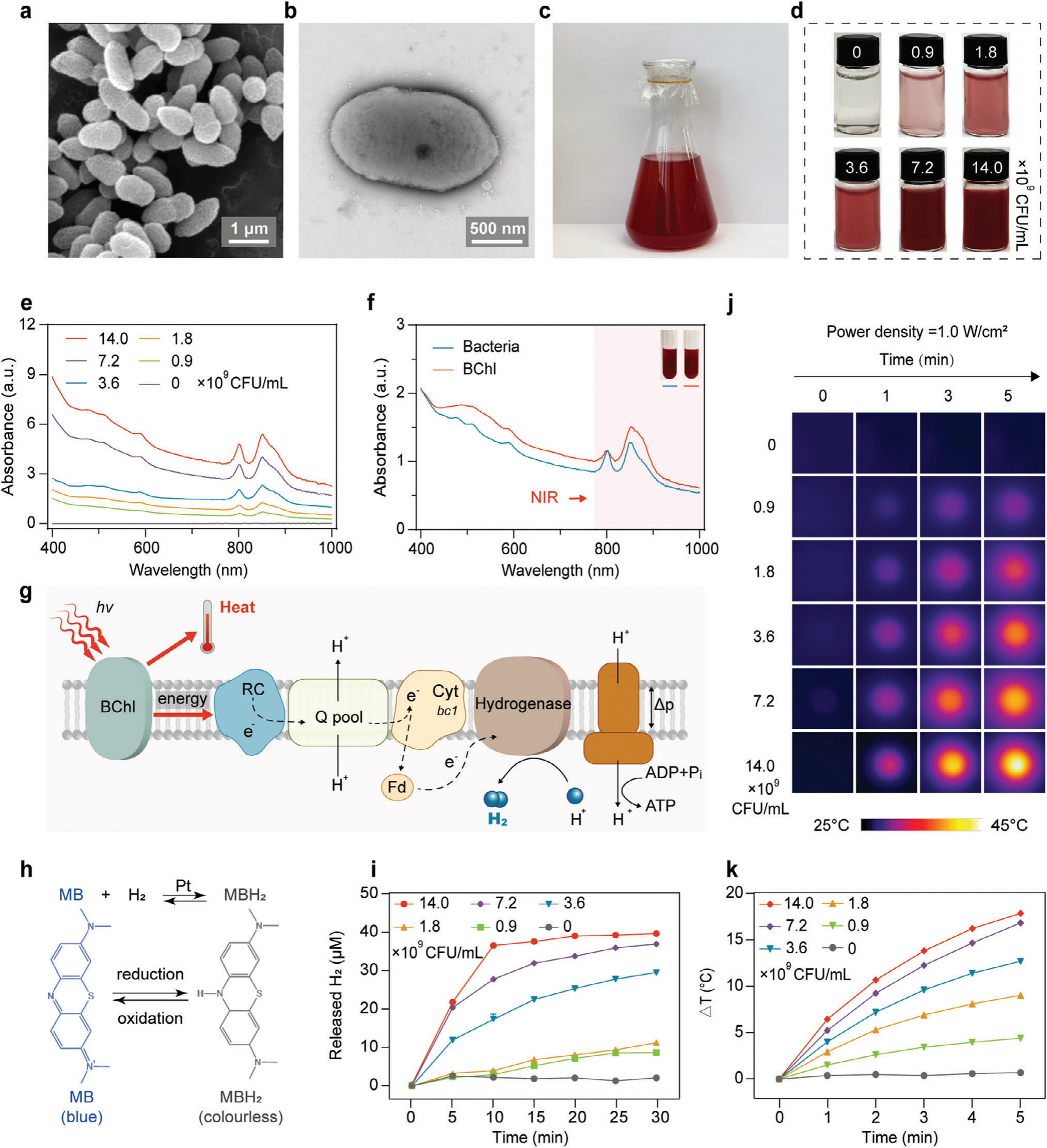
图2.红假单胞菌的表征。a) 红假单胞菌的SEM图像。b) 红假单胞菌的TEM图像。c) 在LB培养基中培养的红假单胞菌的照片。d) 不同浓度的红假单胞菌在PBS中的悬浮液照片。e) 不同浓度的红假单胞菌的吸收光谱(0, 0.9×10^9, 1.8×10^9 3.6×10^9 7.2×10^9 和 1.4×10^10 CFU/mL)。f) 红假单胞菌及其BChl的吸收光谱。g) 示意图展示红假单胞菌在NIR光照射下的H2产生和光热转换过程。(Q池,泛醌池;Fd,铁氧还蛋白;Cyt bc1,细胞色素bc1;Δp,质子动力;Pi,无机磷酸盐)。h) 示意图显示使用MB作为探针监测H2产生。i) 不同浓度的红假单胞菌悬浮液在0.06W/cm^2的808nm LED照射下30分钟释放的H2(n=3个独立的生物样本)。j) 不同浓度的红假单胞菌悬浮液在27°C下暴露于1.0W/cm^2的808nm激光5分钟时的红外热成像。k) 不同浓度的红假单胞菌悬浮液在1.0W/cm^2的808nm激光照射5分钟的光热温度曲线(n=3个独立的生物样本)。数据以平均值±标准差(SD)表示。
为了测量红假单胞菌在近红外光(NIR)控制下产生H2的能力,我们收集了红假单胞菌细胞,并将它们重新悬浮在不同细菌浓度的磷酸盐缓冲液(PBS)中,然后在808纳米发光二极管(LED)光(0.06瓦每平方厘米)下照射。使用亚甲基蓝(MB)还原测定法来定量H2的产生(图2h)。随着细菌细胞浓度的增加,释放的H2产量也增强(图S1和S2,支持信息)。当细菌浓度为1.4×10^10 CFU/mL时,30分钟内累积产生的H2达到38.9微摩尔(图2i),与细菌浓度为9.0×10^8 CFU/mL相比增加了4倍,与PBS对照组相比增加了17倍(图2i)。在细菌浓度为1.4×10^10 CFU/mL的条件下,前10分钟内达到了最大的H2释放速率,分别为1.3微摩尔每分钟和0.3微摩尔每分钟(图S3,支持信息)。这些结果表明,在控制的NIR照射下,红假单胞菌能够高效地产生并释放H2。
BChl在800-810纳米范围内表现出明显的吸收带,表明红假单胞菌能有效地将NIR光转换为热能(图2g)。通过暴露不同浓度的细菌细胞于808纳米激光(1.0瓦每平方厘米)下,并使用热成像相机监测温度变化来评估红假单胞菌的光热转换性能。如图2j-k所示,我们发现所有测试的细胞浓度都显示出显著的温度升高,而PBS没有明显的温度增加。光热转换效应与细菌浓度呈正相关。值得注意的是,当红假单胞菌的浓度为7.2×10^9 CFU/mL和1.4×10^10 CFU/mL时,温度变化(ΔT)分别增加了16.8°C和17.8°C,温度可分别达到43.8°C和44.8°C(图2j-k;图S4,支持信息)。因此,在1.4×10^10到7.2×10^9 CFU/mL之间的浓度下,光热转换效率相似,我们选择了7.2×10^9 CFU/mL的浓度进行后续实验。如图S5(支持信息)所示,随着激光功率密度低于1.5瓦每平方厘米,加速的温度增加,而在1.5瓦每平方厘米(52.3°C)和2.0瓦每平方厘米(53.5°C)下的功率下温度相似。因此,选择1.5瓦每平方厘米的激光功率进行光热实验。此外,经过4次重复的开/关808纳米激光照射周期后,红假单胞菌显示出没有显著的恶化,突显其光热稳定性(图S6,支持信息)。红假单胞菌的光热转换效率(η)计算为7.4%(图S7,支持信息)。[21] 值得注意的是,红假单胞菌表现出高度的耐热性,即使在55°C下也能增殖(图S8,支持信息),在808纳米激光照射下与无激光照射条件下的增殖没有显著差异。相比之下,对于没有BChl的细菌,如集胞藻长丝体、枯草芽孢杆菌和大肠杆菌,这些菌株在相同功率和细胞浓度的808纳米激光照射下没有显示出光热转换能力(图S9,支持信息),这表明BChl在光热转换中的重要作用。总的来说,我们的结果表明红假单胞菌在控制的NIR光下结合产氢和光热效应的独特能力,使其成为癌症治疗的有效候选药物。
2.2 体外氢-光热疗法
我们首先探索了红假单胞菌和BChl在控制的NIR光下同时产生H2和热量的效率。如图S10(支持信息)所示,用808纳米激光(1.5瓦每平方厘米,实验组)照射的细菌可以产生42.2微摩尔的H2并将ΔT增加到24.9°C。而对照组,包括用808纳米LED光(0.08瓦每平方厘米)照射的细菌,产生H2(46.6微摩尔),这与实验组相当,代表氢疗。只用808纳米激光(1.5瓦每平方厘米)照射的BChl只产生热量(ΔT = 23.0°C),这代表光热疗法(PTT),而用808纳米LED光(0.08瓦每平方厘米)照射的BChl既不产生H2也不产生热量。因此,实施了体外的氢疗、PTT和协同的氢-光热疗法。
我们使用细胞计数试剂盒-8(CCK-8)对癌细胞系(4T1细胞)和正常细胞系(HEK-293T细胞)评估了红假单胞菌的细胞毒性。在没有808纳米激光/LED照射的情况下,即使浓度达到7.2×10^9 CFU/mL,红假单胞菌也表现出可忽略不计的细胞毒性,证明了其在体外的生物安全性(图3a)。使用细菌和808纳米LED光进行的氢疗(G4)选择性杀死癌细胞(图3b)。指定用于PTT的BChl与808纳米激光组(G5),对癌细胞和正常细胞都具有致命性。值得注意的是,使用细菌和808纳米激光照射(指定的氢-光热疗法,G6)相比PTT组显示出增强的对癌细胞的致死性,同时最小化对正常细胞的损害。活/死细胞染色进一步证实,G6在所有组中诱导了4T1细胞的最高细胞死亡率,同时保持了HEK-293T细胞的活性,证明了协同治疗的有效性(图3c)。相比之下,G5导致HEK-293T细胞死亡,表明PTT可能对正常细胞造成损害。通过双重染色荧光素异硫氰酸酯(FITC)标记的膜联蛋白V和碘化丙啶(PI)进行的流式细胞术分析显示,G6氢-光热疗法在4T1细胞中显著增强了凋亡,达到64.6%,而在HEK-293T细胞中仅8.0%凋亡(图3d)。这些结果表明氢-光热疗法增强了抗癌效果,同时最小化对正常细胞的损害,表明了抗癌效果的选择性及有效性。
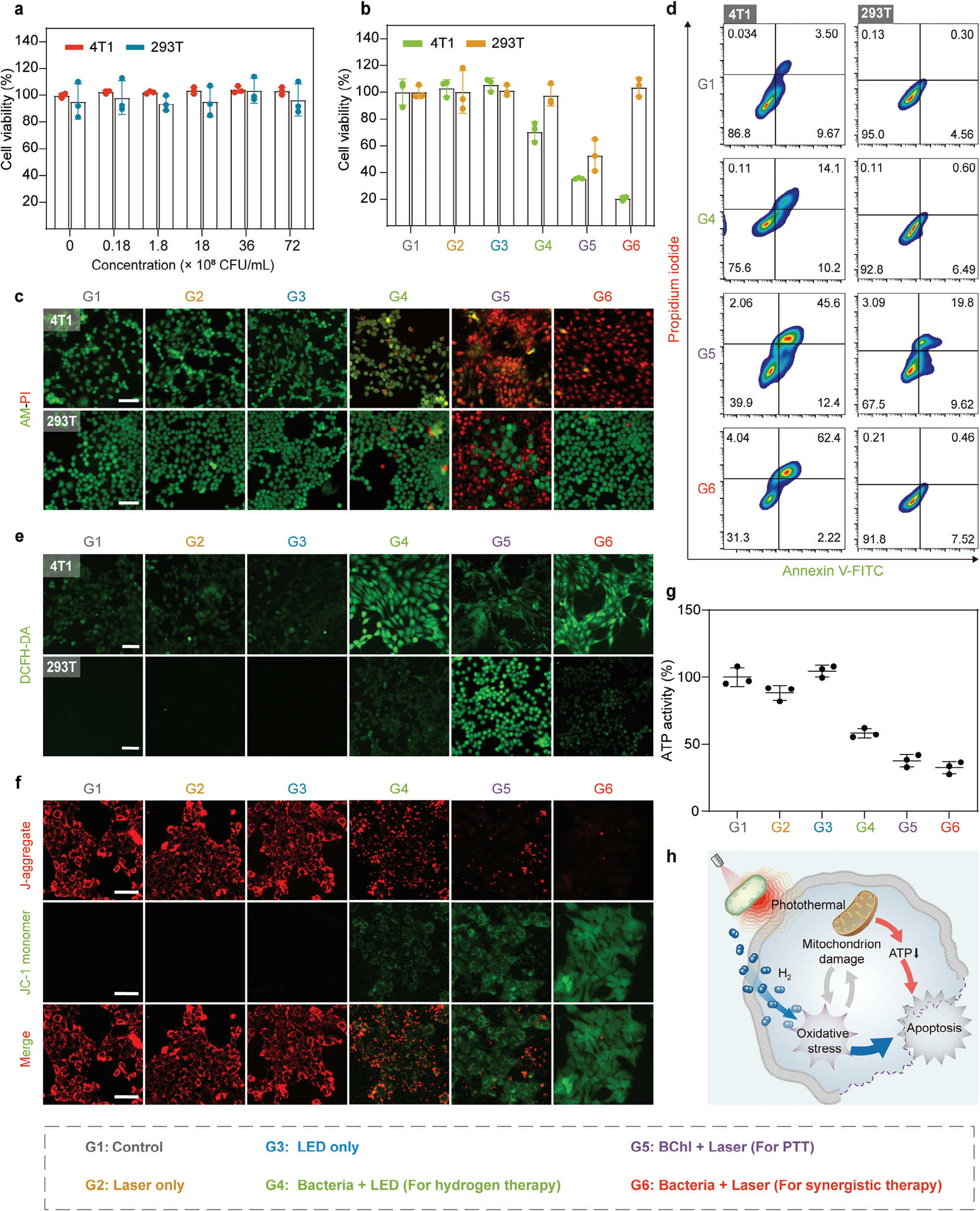
图3使用红假单胞菌的体外氢-光热疗法。a) 不同浓度(0, 0.18×10^8, 1.8×10^8, 18×10^8, 36×10^8, 和72×10^8 CFU/mL)的红假单胞菌孵育的4T1细胞和293T细胞的细胞活力(n=3个生物学独立样本)。b) 不同处理后4T1细胞和293T细胞的细胞活力(n=3个生物学独立样本)。c) 不同处理后用钙黄绿素-AM和PI染色的4T1细胞和293T细胞的共聚焦显微镜图像(绿色:活细胞;红色:死细胞)。比例尺,100微米。d) 用PI和Annexin V-FITC染色的4T1细胞和293T细胞的流式细胞术分析。e) 不同处理后用2',7'-二氯二氢荧光素二乙酸酯(DCFH-DA)染色的4T1细胞和293T细胞的共聚焦显微镜图像。比例尺,100微米。f) 不同处理后用JC-1染色的4T1细胞的共聚焦显微镜图像。比例尺,50微米。g) 不同处理后4T1细胞中的ATP活性(n=3个生物学独立样本)。h) 显示红假单胞菌介导的氢-光热疗法机制的示意图。数据以均值±标准差表示。
评估了细胞内ROS水平以评价氧化还原稳态。氢疗和联合氢-光热疗法后,4T1细胞显示出ROS显著增加,表明H2在癌细胞中诱导了氧化应激(图3e)。相反,HEK-293T细胞仅在BChl和808纳米激光照射的PTT后显示出ROS产生的增加。值得注意的是,H2帮助恢复正常细胞的氧化还原稳态,这表明协同治疗可能保护正常细胞免受热量引起的氧化损伤。考虑到癌细胞中ROS的天然高水平,由于其还原性质,氢最初可以降低ROS水平。然而,鉴于细胞中氧化还原稳态的能力,这种减少可能会促使ROS补偿性增加,可能导致癌细胞死亡。[10,22]相比之下,氢缓解了正常细胞由光热效应引起的氧化损伤。[3,8,23]
我们还研究了氢-光热疗法对线粒体膜电位(MMP)和细胞内ATP水平的影响,以阐明抗肿瘤机制。如图3f和g所示,氢-光热疗法导致MMP显著下降,并且在4T1细胞中观察到ATP水平的显著降低,主要是由于高温引起的损伤。过量ROS与线粒体损伤之间的关系是互补的。过量的ROS导致线粒体的氧化损伤,当功能失调时,会释放大量的ROS作为回报。[24]因此,氢疗因过量ROS生成而在癌细胞中引起轻微的线粒体损伤,而PTT导致癌细胞内轻微的ROS上调,可能是由于受损线粒体的释放(图3h)。此外,我们还深入探讨了氢-光热疗法对癌细胞中其他细胞器的影响。结果表明,该策略在4T1细胞中诱导了内质网(ER)应激和溶酶体损伤(图S11和S12,支持信息)。这些发现强调了红假单胞菌结合产氢和光热效应的双重功能,为靶向癌症治疗提供了一种高效且具有选择性的方法。
2.3 氢-光热疗法的机制
为了阐明红假单胞菌在4T1细胞中驱动的抗肿瘤效应的潜在机制,进行了RNA测序(RNA-seq)分析。共鉴定出16083个表达基因(图S13,支持信息),随后的差异表达分析显示不同治疗组之间存在显著变异(图4a,b;图S14,支持信息)。具体来说,与对照组(未经处理)相比,氢-光热联合治疗组表现出2408个差异表达基因(DEGs),其中979个基因上调,1429个基因下调(|倍数变化|≥1,p<0.05,图4c)。相比之下,仅与PTT组单独比较时观察到949个DEGs(599个上调,350个下调,图4d)。此外,对照组与PTT组之间的比较揭示了1922个差异基因(623个上调,1299个下调,图4e),表明在协同治疗的背景下,热量显著促进了肿瘤细胞中的基因表达改变。

图4红假单胞菌介导的氢-光热治疗的转录机制。a) 控制组、PTT组和联合治疗组之间转录组学概况的维恩图。b) 控制组、PTT组和联合治疗组之间的差异基因统计。火山图显示了在c) 联合治疗组和对照组之间、d) 联合治疗组和PTT组之间以及e) PTT组和对照组之间识别出的上调和下调基因。f) 控制组与联合治疗组之间识别出的DEGs的GO途径富集分析。g) 控制组与联合治疗组之间识别出的DEGs的KEGG途径富集分析。h) 热图展示了与控制组、PTT组和联合治疗组相关的线粒体呼吸链、线粒体损伤和ROS代谢过程的DEGs。
对这些DEGs进行基因本体论(GO)途径富集分析和京都基因与基因组百科全书(KEGG)分析,以评估它们在代谢途径中的参与情况。联合治疗组在与线粒体功能和信号传导相关的途径中显示出显著富集(图4f)。KEGG分析进一步强调了在调控氧化还原稳态和线粒体功能的途径中显著富集,如ROS产生、氧化磷酸化、p53、有丝分裂原活化蛋白激酶(MAPK)信号通路和凋亡(图4g)。这些DEGs富集在PI3K/Akt信号通路和NF-κB信号通路中,表明这种协同策略可能通过这些关键通路诱导细胞凋亡。[25]这些发现表明,协同治疗深刻影响了肿瘤细胞中的氧化还原稳态和线粒体功能。
在这些途径内的DEGs的热图分析揭示,与线粒体呼吸链相关的基因,如细胞色素c氧化酶装配蛋白15(Cox15),在PTT和联合治疗后下调,而与线粒体损伤相关的基因,如离子肽酶1(Lonp1),则上调(图4h)。因此,在这一策略中,光热疗法可能通过异常激活与线粒体相关的信号通路或促进某些线粒体蛋白的非典型表达而导致线粒体功能障碍。[26]此外,涉及ROS代谢过程的基因,如中性粒细胞胞质因子1(Ncf1),在联合治疗后主要上调,表明线粒体功能的破坏主要归因于热量,而ROS的改变则主要受H2影响。[27]此外,与应激信号和损伤反应相关的上调基因,如生长停滞和DNA损伤可诱导α(Gadd45a)[28]以及其他显著改变的基因,如与肿瘤抑制相关的B细胞淋巴瘤-2(Bcl-2)[29],表明协同策略可能通过调节这些下游调节因子触发细胞凋亡过程(图S15,支持信息)。RNA-seq结果全面展示了红假单胞菌介导的氢-光热治疗损害了癌细胞中的线粒体功能并破坏了氧化还原稳态,导致氧化应激,最终导致肿瘤细胞的凋亡(图S16,支持信息)。
2.4 体内氢-光热疗法
为了评估氢-光热治疗的体内疗效,我们首先通过静脉注射红假单胞菌到健康的BALB/c小鼠中来研究其生物相容性。在为期21天的观察期内,没有发生死亡,且未检测到体重的显著变化,表明红假单胞菌没有系统性毒性(图5c和表S1,支持信息)。此外,在这一时期结束时进行的全面血常规和血液生化检查显示,所有指标均处于正常范围内,即使在7.2×10^9 CFU mL^(-1)的浓度下也是如此(图5a;图S17,支持信息),表明与血液的良好兼容性,对肝脏或肾脏功能没有可辨别的毒性。通过苏木精-伊红(H&E)染色对包括心脏、肝脏、脾脏、肺和肾脏在内的主要器官的组织病理学分析证实了红假单胞菌的高血兼容性,没有可见的器官损伤,确认了红假单胞菌的兼容性(图5b)。因此,使用红假单胞菌作为治疗剂在小鼠中已被证明是安全的,但需要在大型动物模型或人类上进行更广泛的安全评估以应用于临床。随后构建了4T1乳腺癌荷瘤小鼠模型,并在小鼠肿瘤周围注射细菌。在808 nm激光照射肿瘤区域期间,肿瘤区域的温度在10分钟内达到高达55°C,这足以有效消融肿瘤细胞(图5d, e;图S18,支持信息),表明红假单胞菌有潜力在体内有效消融癌细胞。

图5.红假单胞菌的体内生物相容性和光热性能调查。a) 经不同浓度(0, 1.8×10^9, 3.6×10^9, 和7.2×10^9 CFU mL^(-1))红假单胞菌处理后的小鼠血常规和血液生化(n=5个生物学独立的动物)。b) 经不同浓度(0, 1.8×10^9, 3.6×10^9, 和7.2×10^9 CFU mL^(-1))红假单胞菌处理的小鼠主要器官的病理学分析。c) 静脉注射不同浓度(0, 1.8×10^9, 3.6×10^9, 和7.2×10^9 CFU mL^(-1))红假单胞菌后观察21天的小鼠体重变化(n=5个生物学独立的动物)。d) 在808 nm激光照射(1.5 W cm^(-2) 10分钟)下,未经处理的小鼠(仅激光)和注射红假单胞菌的小鼠(红假单胞菌+激光)4T1肿瘤区域的光热温度曲线。e) 在808 nm激光照射(1.5 W cm^(-2) 10分钟)下,未经处理的小鼠和注射红假单胞菌的小鼠4T1肿瘤的热图像。数据以平均值±标准偏差表示。
氢-光热疗法的抗肿瘤效果在分为四组的4T1荷瘤小鼠中进行了调查:未接受任何治疗的对照组(I组),接受激光照射的治疗组(II组),接受红假单胞菌治疗的治疗组(III组),以及接受红假单胞菌并在激光照射下的治疗组(IV组)(图6a)。值得注意的是,IV组显示出显著的肿瘤抑制(图6b-e),肿瘤抑制率接近97%(图6f)。此外,在所有四个治疗组中没有明显的体重变化(图6g),强调了治疗策略的生物安全性。然后对小鼠实施安乐死,并通过H&E染色、TdT介导的dUTP缺口末端标记(TUNEL)染色和Ki-67染色分析进一步研究了抗肿瘤活性(图6h)。与其他组相比,IV组的肿瘤组织H&E染色显示了广泛的肿瘤组织破坏、细胞和核收缩以及完全的核消失,而主要器官没有形态学变化(图6h;图S19,支持信息)。TUNEL染色的肿瘤切片图像显示IV组中有较高比例的凋亡细胞,而其他组中没有或比例较低。此外,通过Ki-67染色,IV组与其他对照组相比,肿瘤增殖和恶性程度显著降低(图6h)。这些发现共同证明了使用红假单胞菌进行协同氢-光热疗法的生物兼容性和显著疗效,有望在癌症治疗中取得重大进展。

图6.体内红假单胞菌介导的氢-光热疗法。a) 示意图显示治疗计划。b) 不同治疗后4T1荷瘤小鼠的个体肿瘤生长曲线(n=5个生物学独立的动物)。c) 不同治疗后4T1荷瘤小鼠的平均肿瘤生长曲线(n=5个生物学独立的动物)。d) 不同治疗后从4T1荷瘤小鼠切除的肿瘤照片(n=5个生物学独立的动物)。e) 不同治疗后从4T1荷瘤小鼠切除的肿瘤重量(n=5个生物学独立的动物)。f) 不同治疗后4T1荷瘤小鼠的肿瘤抑制率(n=5个生物学独立的动物)。g) 不同治疗后4T1荷瘤小鼠的体重(n=5个生物学独立的动物)。h) 不同治疗后4T1荷瘤小鼠肿瘤的H&E、TUNEL和Ki-67染色分析。数据以平均值±标准偏差表示。P值通过双尾学生t检验计算(****P<0.0001, ** P<0.01)。
3 结论
本研究介绍了一种独特的治疗模式,利用活体光合细菌,特别是红假单胞菌,在近红外光照射下同时产生氢气并诱导高温,用于靶向癌症治疗。研究结果证实,红假单胞菌具有强大的近红外吸收能力,能够在肿瘤部位持续产生氢气并将光能高效转化为热能。这种双重功能对于实验中观察到的治疗效果至关重要。体外和体内的结果均表明,这种氢-光热疗法方法产生了选择性和协同的抗肿瘤效果。值得注意的是,氢气的产生与近红外触发的高热相结合,显著增强了整体肿瘤抑制效果。这种双重作用策略不仅精确针对恶性细胞,还最大限度地减少了对周围健康组织的附带损害。观察到的增强肿瘤抑制效果归因于氢气和高热的互补效应。氢气通过调节ROS水平发挥其治疗效果,导致癌细胞中的氧化应激和凋亡。同时,近红外引发的高热破坏线粒体功能,进一步增加ROS水平,加剧了对肿瘤细胞的细胞毒性效果。重要的是,协同治疗为正常细胞和组织提供了保护,很可能是由于氢气的双向调节作用。在正常细胞中,氢气增强了保护机制,从而减轻了氧化损伤并维持细胞稳态。相反,在肿瘤细胞中,氢气通过氧化应激增强了细胞毒性,展示了其选择性作用。这种双向调节强调了氢气区分癌性和健康细胞的潜力,使其成为一种多功能的治疗剂。我们的研究突显了氢-光热疗法作为一种全面而有效癌症治疗策略的潜力,为对传统治疗无反应的患者提供了一个有希望的替代方案。红假单胞菌在产生氢气和引发高热方面的生物相容性和高效性表明,这种方法可以进一步发展和优化,以用于临床应用。未来的研究应专注于详细调查红假单胞菌在体内的分布、活性和寿命,以确保生物安全性并最大化治疗效果。总之,这项工作建立了一种利用活体光合细菌进行氢-光热疗法的代表方法,证明了在靶向癌症治疗方面取得了重大进展。此外,许多光合细菌表现出了显著的光氢生产能力,这为氢疗法带来了巨大的希望。例如,蓝藻作为原始原核生物,可以在特定条件下进行光合作用并产生氢气。我们预计,进一步的研究将探索多种光合细菌与其他治疗方式的结合,旨在促进活体治疗剂在新型癌症治疗策略发展中的临床转化。
https://wap.sciencenet.cn/blog-41174-1458814.html
上一篇:干燥综合征患者氢疗案例【台湾】
下一篇:做实验抗体不起作用怎么办!