博文
细胞干性可恢复T细胞活性  精选
精选
|
T细胞耗竭特征是细胞因子产生的丧失和持续性表达抑制性受体或免疫检查点(如程序性细胞死亡蛋白1,PD-1),这在包括免疫检查点阻断(ICB)和过继细胞疗法在内的癌症免疫治疗中构成了主要障碍。持续的CD8+ T细胞反应,如在癌症和慢性感染中发现的反应,是由所谓的耗竭T细胞前体(TPEX)细胞维持的,这些细胞展现出干细胞样的特征,使它们能够自我更新,同时也能产生效应器样的耗竭T(TEX)细胞后代。干细胞性和效应器分化之间的平衡决定了T细胞反应的质量,并使TPEX细胞成为治疗操纵的主要目标。在本刊第165页,Kang等人报告称,删除关键的表观遗传调控因子可以在慢性抗原暴露期间保留对ICB有响应的TPEX细胞,揭示了克服T细胞耗竭并获得持久ICB治疗反应的潜在靶标。
近期研究提供了关于表观遗传调控因子在执行耗竭程序中的作用的见解,该程序限制了慢性疾病中的T细胞功能及其被ICB重新激活的能力。全基因组分析揭示了与急性刺激相比,慢性刺激的T细胞经历了广泛的表观遗传重编程,包括数千个差异可及区域和特定情境下的甲基化程序。Kang等人调查了三种表观遗传调控因子,包括已知驱动耗竭的DNA甲基转移酶3α(Dnmt3a)(8);已知限制嵌合抗原受体(CAR)T细胞耐久性的十十一易位2(Tet2)(9);以及与一部分骨髓增生异常综合征患者在接受ICB治疗后存活相关的额外性别梳样1(Asxl1)(10)。值得注意的是,所有三个基因在克隆造血(CH)中常见突变,这是一种由赋予造血干细胞不适当的增殖适应性的体细胞突变驱动的现象,导致其后代的克隆偏向性扩展(11, 12)。
使用CRISPR-Cas9技术,Kang等人在针对淋巴细胞脉络丛脑膜炎病毒(LCMV)的T细胞受体转基因CD8+ T细胞中破坏了这些CH因子,并调查了它们在慢性LCMV感染期间在种群扩展和维护中的作用。每个因子的破坏都改善了CD8+ T细胞的长期维护,在所有情况下都与增强的TPEX细胞维护和增加的细胞因子生产能力相关联。值得注意的是,缺乏这些因子的CD8+ T细胞对ICB的反应比对照组更为强烈。CH因子的破坏改变了TEX细胞亚群的转录景观,其特征是与T细胞干细胞性相关的基因表达增加。这些基因包括Tcf7、Lef1和Myb(分别编码转录因子T细胞因子1(TCF1)、淋巴细胞增强子结合因子1(LEF1)和髓母细胞瘤原癌基因蛋白(MYB))以及与效应器功能相关的基因,如Ifng(编码干扰素γ(IFN-γ))。缺乏CH因子的CD8+ T细胞在没有恶性转化迹象的情况下保持数量稳定长达一年。因为CAR T细胞的致癌转化在过继细胞疗法中仍然是一个主要关注点(13),这些观察强调了针对CH因子进行治疗目的的可行性。
Kang等人将注意力集中在Asxl1上,并分析了Asxl1缺陷和对照T细胞中的染色质可及性、DNA甲基化和组蛋白修饰,以定义Asxl1介导的干细胞性调节的分子机制。尽管他们没有观察到DNA甲基化的任何主要差异,但他们发现Asxl1充足和Asxl1缺陷T细胞之间在染色质可及性上有显著差异。这些差异在TPEX细胞及其TEX细胞后代中都很普遍,表明Asxl1影响了TEX细胞两个主要亚群的分化和功能。进一步的机制分析揭示了组蛋白修饰的显著差异。具体而言,Kang等人展示了Asxl1通过多梳集团–压制性去泛素化酶负责组蛋白2A赖氨酸残基119(H2AK119)的去泛素化。因此,T细胞中Asxl1的缺失导致整个基因组中泛素化H2A(H2AK119Ub)的区域特异性增加。H2AK119Ub富集的区域,而非那些同时富含三甲基化组蛋白3(H3K27me3)的区域,与Tcf7和Lef1等基因中的染色质可及区域相关联。这些表观遗传模式也反映了在人类CD8+ T细胞中发现的模式,其中由ASXL1控制的H2AK119Ub在未成熟细胞中相对于更分化的效应记忆T细胞中富集。
染色质重塑塑造T细胞中的干细胞性
在慢性感染和癌症中,CD8+ T细胞反应通过具有干细胞特征的耗竭T细胞前体(TPEX)细胞维持,这些细胞能够自我更新,同时产生效应器样的耗竭T(TEX)细胞后代。破坏额外性别梳样1(ASXL1)导致组蛋白2A泛素化,从而允许染色质区域开放,促进T细胞干细胞性和功能的基因表达,从而改善维持和对免疫检查点阻断的反应。
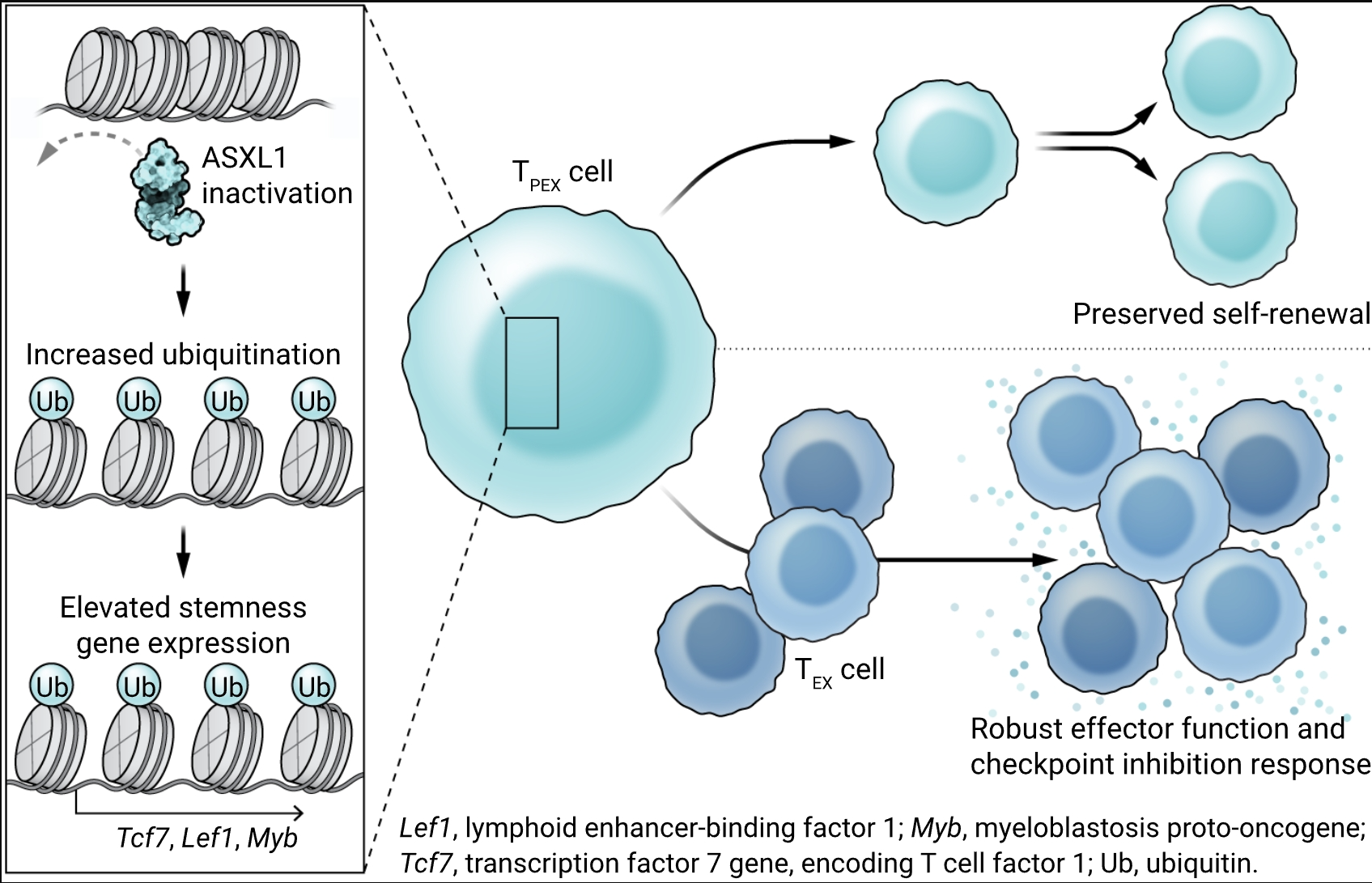
使用癌症小鼠模型,Kang等人展示了Asxl1缺陷在T细胞中增强了TPEX细胞维持、TCF1表达和IFN-γ的产生,并单独或与ICB协同作用时提供了更好的肿瘤控制。最近的研究显示,肿瘤引流淋巴结在抗肿瘤T细胞反应中发挥作用(14)。ASXL1缺失的效果部分独立于来自肿瘤引流淋巴结的输入,这表明ASXL1依赖的表观遗传重编程可以抵消肿瘤微环境中的免疫抑制信号。与ASXL1限制癌症中ICB反应的观点一致,作者发现高ASXL1表达与接受ICB治疗的骨髓增生异常综合征癌症患者的生存率较差相关。此外,ICB治疗对携带破坏性ASXL1突变的T细胞产生了选择性生存优势。因此,Kang等人不仅确定了ASXL1是改善T细胞干细胞性的潜在生物标志物和靶标,还为癌症患者对ICB反应的一些差异提供了解释。
Kang等人定义了一个以前未知的表观遗传调控途径,该途径控制T细胞的干细胞性,为可能改善抗癌疗法的新策略铺平了道路(见图)。通过将慢性T细胞反应与异常造血进行类比,这些发现以及之前的一项研究(15)展示了转录和表观遗传调控因子在支持造血系统中的干细胞性和自我更新方面的简约性质。这再次强调了跨学科生物学研究的重要性。
https://wap.sciencenet.cn/blog-41174-1455154.html
上一篇:热量限制延长寿命悖论:少吃增寿非瘦
下一篇:木卫二上是否有生命?NASA启动任务寻找线索