博文
干细胞通过输出线粒体协助内皮细胞血管增生
|
细胞破坏捐赠的线粒体以构建血管
目前主流观点认为,线粒体起源于一种细菌,是一种共生关系。源于其他细胞的线粒体为细胞共生体产生能量,也能带来细胞死亡的后果。逻辑上讲,线粒体移植可以作为一种疾病治疗方法,其基本逻辑是给损伤的细胞提供健康的线粒体。但让人意外的是,最新研究发现,线粒体进入内皮细胞后,不是和受体细胞共生,而是先自杀,或者线粒体自噬,以协助和帮助细胞建立自身的健康线粒体功能。
称为线粒体的细胞器通过支持细胞转移到血管形成细胞。出乎意料的是,这些线粒体被降解,启动了新线粒体的产生并促进了血管的形成。
血管将氧气和营养物质输送到组织,并清除其中的废物。当这些血管变窄或阻塞时,血液供应和废物清除就会被阻止,导致所谓的缺血,进而导致冠心病和心脏病发作等疾病1.Writing in Nature, Lin et al.2报告一种创新的移植策略,以帮助修复缺血组织;它依赖于称为线粒体的能量产生细胞器从一个细胞转移到另一个细胞。
血管内衬有内皮细胞,内皮细胞对血管的形成和血液流动至关重要。为了治疗缺血性疾病,将内皮细胞移植到血管阻塞部位附近,以促进血管的形成并恢复组织血流3.然而,这种疗法的一个相当大的局限性是内皮细胞必须与称为间充质基质细胞的未分化干细胞共同移植,这些干细胞支持组织修复和再生4.到目前为止,基质细胞促进内皮细胞植入的机制知之甚少。
Lin及其同事发现,基质细胞将线粒体转移到内皮细胞。出乎意料的是,这些线粒体在转移后被降解,促使内皮细胞产生自己的新线粒体。作者表明,人工将线粒体移植到内皮细胞中以模拟这种自然转移可以通过移植的内皮细胞刺激血管形成,为仅需要移植一种细胞类型的缺血性疾病的治疗铺平道路(图1)。
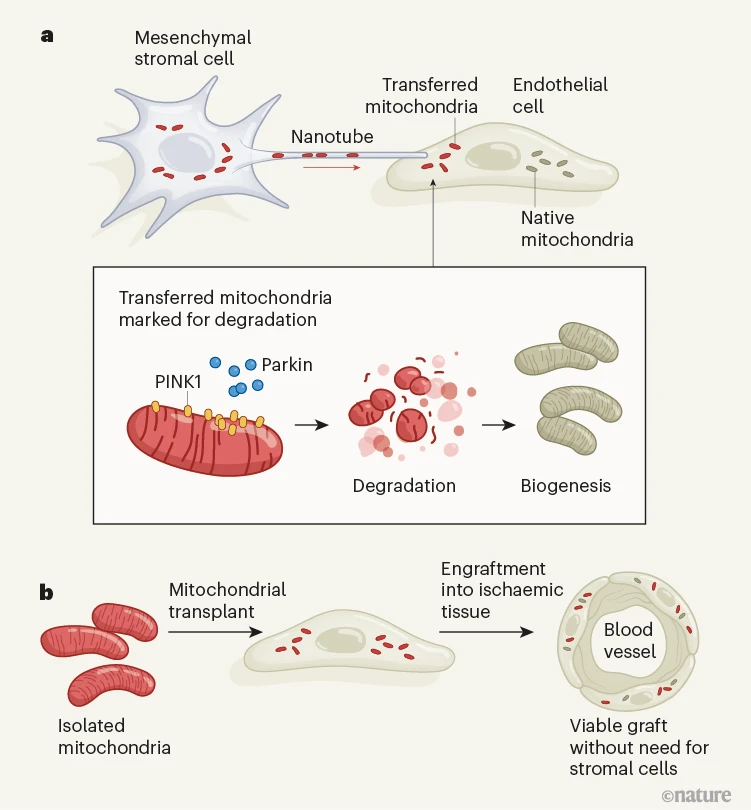
图1 |线粒体细胞器的转移增强了血管的形成。为了在因缺乏血液供应(缺血)而受损的组织中生长新的血管,可以将排列在血管壁上的内皮细胞移植到受损组织中。然而,这些细胞只有在与称为间充质基质细胞的干细胞共同移植时才能成功形成新的血管——这是这种疗法的一个相当大的局限性。a, Lin et al.2发现基质细胞通过称为纳米管的细胞突起将其部分线粒体转移到内皮细胞。转移的线粒体被蛋白质 PINK1 和 Parkin 快速标记为降解,从而刺激新线粒体的产生(生物发生),增强内皮细胞功能。b,为了模拟自然线粒体转移,作者人工将从基质细胞中分离的线粒体移植到内皮细胞中,发现这些线粒体增强的内皮细胞移植物是可行的,并且在不需要基质细胞的情况下刺激血管的形成。
首先,Lin等人。在存在或不存在支持基质细胞的情况下,将人内皮细胞移植到小鼠的皮肤下,并证实只有共同移植的移植物才具有形成功能性血管的活内皮细胞。在过去的十年中,基质细胞已被证明可以自然地将线粒体转移到其他细胞类型,并且线粒体转移已被证明可以促进因缺血而受损的组织再生5.为了研究这是否是基质细胞成功植入内皮细胞的方式,作者用一种叫做DsRed的荧光蛋白标记了基质细胞中的线粒体。
作者观察到DsRed标记的线粒体在长突起中,称为纳米管,从基质细胞延伸并与内皮细胞直接接触。24小时后,在排列新血管的内皮细胞内可以看到DsRed标记的线粒体。然而,线粒体转移是令人惊讶的暂时的:它在共同移植后立即开始,并在血管稳定后停止。此外,选择性阻断纳米管的形成会破坏线粒体转移并损害血管形成。这些发现表明,线粒体通过纳米管的瞬时转移是基质细胞支持内皮细胞移植物活力的方式。
由于目前治疗缺血的方法存在局限性,作者询问用线粒体人工启动内皮细胞是否可以模仿共同移植的效果。为此,作者将从基质细胞中分离的线粒体与内皮细胞一起孵育,以便线粒体可以通过称为内吞作用的过程被吸收。这种人工线粒体移植复制了自然转移过程,这在受体内皮细胞的代谢活性增强中很明显。将这些线粒体引发的内皮细胞移植到缺血小鼠组织中可以防止组织死亡,因为新血管的形成和血流的改善。
有趣的是,从基质细胞转移的线粒体不需要具有增强内皮细胞移植物的功能,因为转移的线粒体不是与现有的线粒体池融合,而是在称为线粒体自噬的过程中迅速降解。在线粒体自噬过程中,受损的线粒体被蛋白质 PINK1 和 Parkin 破坏,导致它们被称为自噬体的细胞内囊泡吞噬,并被称为溶酶体的细胞器降解6.作者在内皮细胞的自噬体中观察到人工移植的线粒体,但是当他们通过沉默编码PINK1或Parkin的基因的表达来损害线粒体自噬时,这阻止了线粒体被这些囊泡吞噬,并减少了内皮细胞移植物中血管的形成。值得注意的是,线粒体自噬诱导受体内皮细胞产生新的线粒体(线粒体生物发生),从而增强细胞功能并刺激血管形成。
细胞间线粒体转移的许多细节尚不清楚7,8.Lin及其同事发现,在低氧条件下增加基质细胞与内皮细胞或生长细胞的比例会增加线粒体转移。此外,阻断TNF-α(一种介导炎症的蛋白质)或调节TNF-α活性的蛋白质之一的作用,减少了纳米管的形成。然而,稳定和破坏纳米管的机制仍有待建立。作者使用的基质细胞和内皮细胞共培养系统可以提供一种开始解决这些基本机制的方法。
相比之下,线粒体生物发生和线粒体自噬之间的相互作用已经确立9.作者发现,在培养的内皮细胞中,只有一个转移的线粒体可以以ATP分子的形式显着增加线粒体能量的产生。在小鼠的共同移植中,在自噬体中观察到约20%的转移线粒体,这意味着适度的线粒体自噬会触发强大的线粒体生物发生。
令人惊讶的是,消耗基质细胞中的PINK1或内皮细胞中的Parkin阻止了线粒体的降解。这表明,在线粒体转移到内皮细胞之前,PINK1必须积聚在基质细胞的线粒体外膜上,PINK1在内皮细胞中招募Parkin。这一发现很重要,因为它表明这个过程是特异性的:只有转移的线粒体才会触发内皮细胞中的线粒体自噬。但是,如果PINK1在线粒体上积累,那么线粒体如何避免在基质细胞中降解呢?此外,如果这些细胞器没有积累 PINK1,那么转移到内皮细胞的线粒体会发生什么?
Lin及其同事的方法有可能克服现有缺血移植疗法的局限性,这些缺血疗法因需要将内皮细胞与基质细胞共同移植而变得复杂。值得注意的是,来自不同哺乳动物物种和细胞类型的线粒体被成功植入内皮细胞,这表明线粒体的存在比它们的起源更重要。然而,线粒体转移是否会触发受体细胞的免疫反应尚不清楚。例如,如果供体细胞和受体细胞不相容,受体细胞可以启动炎症信号传导,以防止潜在有害的外来线粒体。
此外,线粒体被认为主要是能量生产者,但它们也会触发细胞死亡并含有自己的DNA,这很容易发生突变。Lin及其同事认为,捐赠的线粒体是降解的,但未降解的线粒体有可能在受体细胞中引发不必要的反应。最后,目前尚不清楚生成和移植人工引发的内皮细胞的可行性。即使存在这些不确定性,人们也很容易推测基于线粒体转移的疗法如何用于治疗缺血性疾病以外的疾病。
https://wap.sciencenet.cn/blog-41174-1432375.html
上一篇:父亲肠道菌群对胎儿健康也很重要
下一篇:耐力运动引起多器官全身分子反应