博文
Phenomics | 中南大学湘雅二医院黎志宏教授团队综述:肉瘤 3D 模型,开启精准医疗新维度
|
近日,《表型组学(英文)》(Phenomics)在线发表了中南大学湘雅二医院黎志宏教授团队题为 “3D Models of Sarcomas: The Next-generation Tool for Personalized Medicine”的综述文章。
该综述系统总结了近年来肉瘤三维模型(特别是类器官/organoid)构建与应用的前沿进展,揭示了其在机制研究、药物筛选、免疫治疗及精准医学中的巨大潜力。
文末点击“阅读原文”可在线阅读文章。

扫描二维码 | 下载PDF原文
论文DOI链接:
https://doi.org/10.1007/s43657-023-00111-3
论文引用格式:
Xu, R., Chen, R., Tu, C. et al. 3D Models of Sarcomas: The Next-generation Tool for Personalized Medicine. Phenomics 4, 171–186 (2024). https://doi.org/10.1007/s43657-023-00111-3
研究背景
肉瘤(Sarcoma)是一类源自间充质组织的恶性肿瘤,涵盖骨肉瘤、滑膜肉瘤、脂肪肉瘤等多个亚型,具有发病率低、异质性强、转移风险高的典型特点。
尽管传统的2D细胞系和PDX模型在肿瘤研究中应用广泛,但在肉瘤研究中却暴露出诸多不足:
(1)二维培养无法真实模拟肿瘤微环境(TME);
(2)动物模型成本高、周期长、异种背景干扰大;
(3)组织样本稀缺导致模型建立效率低;
(4)缺乏高度异质性与个体差异的反映。
与此同时,三维培养系统(3D models),特别是患者来源类器官(PDOs),因其能够更好地保留原发肿瘤的组织结构、遗传信息和药物反应性,正在成为新一代个体化研究的重要模型。然而,目前3D类器官在肉瘤领域的应用仍处于探索阶段,缺乏系统性总结和机制梳理。
研究结果
1. 建模方法与体系优化
(1)分类解析3D球体(spheroids)与类器官(organoids)两类三维模型;
(2)详细介绍了支架型(如Matrigel、胶原)与非支架型培养系统;
(3)总结了3D打印、生物墨水、ALl培养、免疫细胞共培养等创新技术在肉瘤PDO构建中的尝试;
(4)汇总目前已报道的不同肉瘤亚型的PDO构建成功率、培养时间、培养基成分等关键参数(表1,表2)。
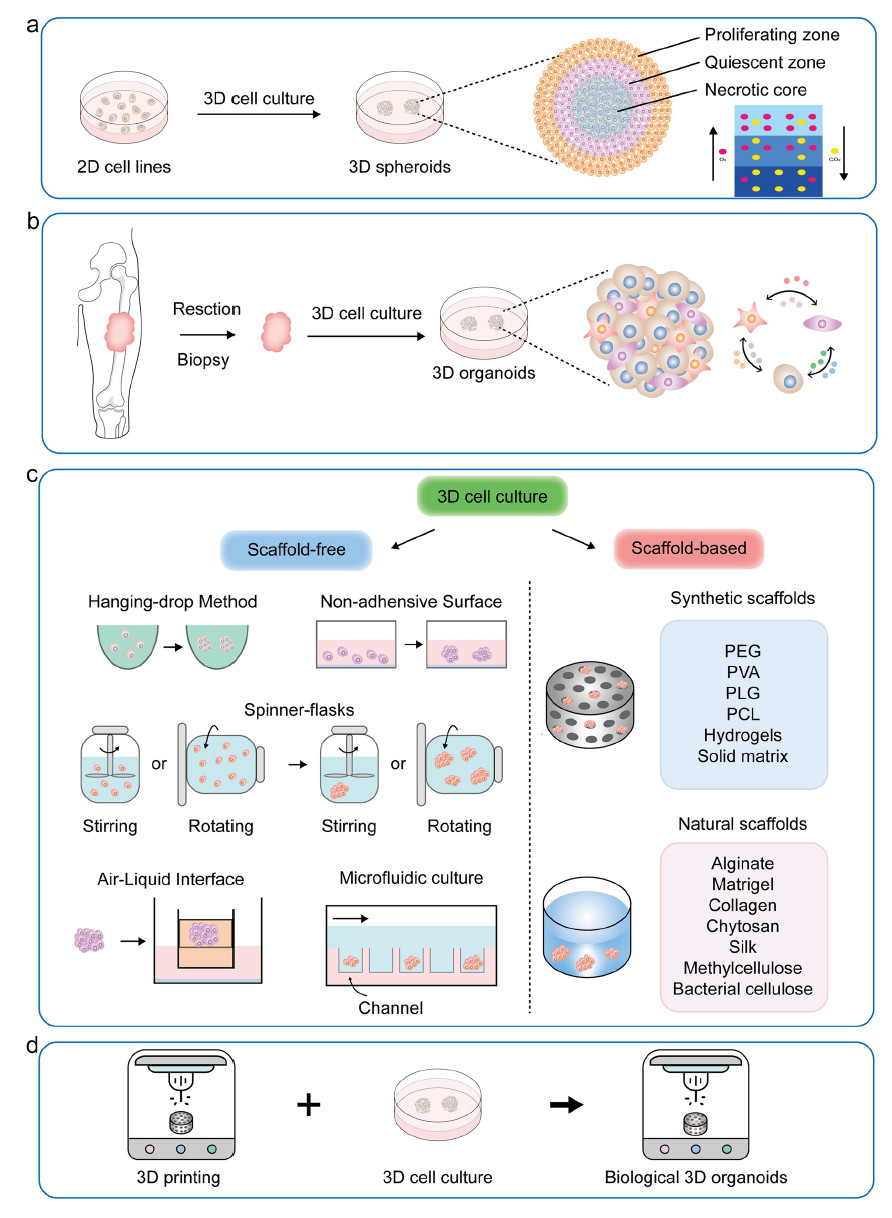 图1.a 球体的形成过程,b 类器官的形成过程,e 3D培养方法概述,d 3D打印与类器官的结合
图1.a 球体的形成过程,b 类器官的形成过程,e 3D培养方法概述,d 3D打印与类器官的结合
2. 肉瘤PDO的多重功能应用
(1)药物筛选与个体化治疗:PDO可用于预测患者个体化的药物敏感性,提升临床药物选择精准度。文中回顾了多个实证研究案例,包括脂肪肉瘤、滑膜肉瘤等亚型的高通量药敏筛选数据。
(2)耐药机制解析:通过对原发与转移灶组织建立类器官并联合NGS分析,揭示如GPC3等关键突变与多药耐药机制相关。
(3)免疫治疗评估平台:构建包含肿瘤浸润T细胞或外源免疫细胞的“iPDO”,可用于模拟免疫检查点抑制(ICB)反应。
(4)表观遗传机制研究:通过滑膜肉瘤类器官结合染色质可及性分析,识别SS18-SSX融合驱动的染色质重塑过程。
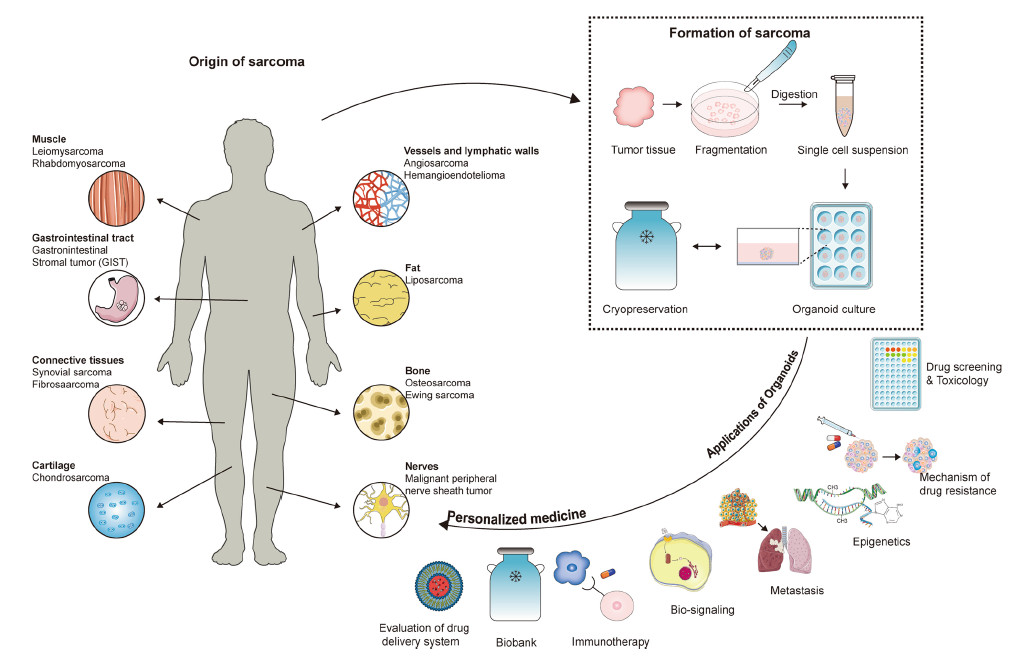
图2 肉瘤类器官的起源、形成和应用
研究结果
本综述认为,肉瘤类器官作为高度个体化、组织结构与分子特征保真的体外模型,具备以下优势:
(1)能模拟肿瘤异质性与患者差异性;
(2)有效补足2D和动物模型的局限;
(3)适用于药物敏感性筛选、机制探索、免疫反应模拟与表观遗传研究;
(4)可作为精准医学和转化研究桥梁模型。
同时也指出当前仍存在一些挑战,例如培养体系标准化不足、基因漂移控制难、建立效率受限等问题。未来,建立肉瘤类器官生物样本库(Organoid Biobank)、标准化建模流程和多中心共享机制将是推动该领域发展的关键方向。
表1 类器官在肉瘤中应用的简单总结
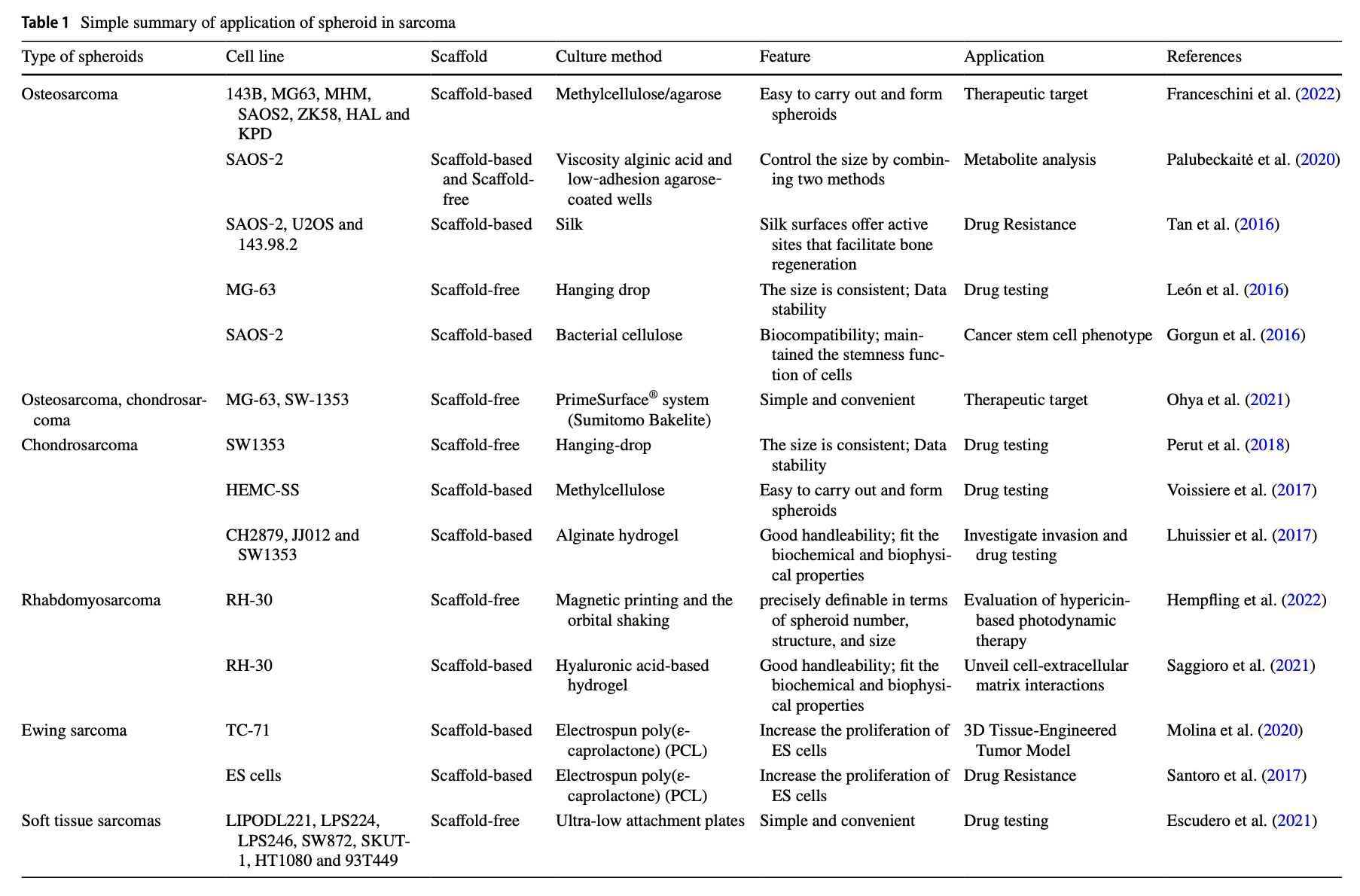
表2 类器官在肉瘤中应用的总结
Abstract
Sarcoma is a complex and heterogeneous cancer that has been difficult to study in vitro. While two-dimensional (2D) cell cultures and mouse models have been the dominant research tools, three-dimensional (3D) culture systems such as organoids have emerged as promising alternatives. In this review, we discuss recent developments in sarcoma organoid culture, with a focus on their potential as tools for drug screening and biobanking. We also highlight the ways in which sarcoma organoids have been used to investigate the mechanisms of gene regulation, drug resistance, metastasis, and immune interactions. Sarcoma organoids have shown to retain characteristics of in vivo biology within an in vitro system, making them a more representative model for sarcoma research. Our review suggests that sarcoma organoids offer a potential path forward for translational research in this field and may provide a platform for developing personalized therapies for sarcoma patients.
作者简介
通讯作者

黎志宏,中南大学党委常委、副校长。国家新药创制临床评价技术平台负责人,肿瘤模型与个体化诊治研究湖南省重点实验室主任;兼任中华医学会骨科学分会骨肿瘤学组委员、青年学组组长,中国医师协会骨科医师分会脊柱肿瘤学组副组长,湖南省骨科专业委员会侯任主委。研究方向:骨与软组织肿瘤, 骨与关节畸形,肿瘤模型。主持国家重点研发计划1项、国家科技重大专项课题新药临床评价技术平台1项,国家自然科学基金4项、省科技重大专项1项,重点研发计划3项。在Lancet Oncol、Lancet Infect Dis、Nat Commun、Cancer Lett、Adv Sci等权威国际SCI杂志发表SCI论文100余篇,授权发明专利7项,获得湖南省科技进步奖、全国青年岗位能手等荣誉。
通讯作者

任晓磊,现为中南大学湘雅二医院骨科助理研究员,硕士研究生导师。中国生物医学工程学会类器官和器官芯片分会委员。研究方向:骨相关疾病类器官、骨肉瘤铁死亡。在国际权威期刊Adv Sci、Cell Death Dis、BMC Musculoskel Dis、Cancer Cell Int 等以一作或或通讯发表SCI论文12篇,参编骨科相关专著5部,授权发明专利5项。主持国家自然科学基金青年基金1项、中国博士后科学基金面上项目1项。获得首届全国博士后创新创业大赛二等奖、湖南省优秀毕业生、中南大学升华博士后等荣誉。
第一作者

徐瑞菱,男,中南大学湘雅二医院2022级博士在读。
https://wap.sciencenet.cn/blog-3558836-1497109.html
上一篇:Phenomics | 中山大学贺雄雷教授团队发布表型空间编码规则
下一篇:Phenomics | 复旦大学附属中山医院范虹、姚光宇团队揭示视黄醇代谢在肺腺癌预后中的关键作用
全部作者的其他最新博文
- • Phenomics | 中山大学肿瘤防治中心曾木圣院士团队发表综述:肿瘤诊疗新靶点,整合素α6靶向技术引领精准医疗新时代
- • Phenomics | 上海交通大学医学院张孝勇教授团队开发磁共振成像降噪新方法,有潜力改善脑小血管病的诊断效能
- • Phenomics | 复旦大学倪挺教授团队揭示基因内含子多聚腺苷酸化调控细胞衰老新机制
- • Phenomics | 加拿大阿尔伯塔大学和复旦大学联合开发基于文本、音频和视频的多模态抑郁症检测与评估方法
- • Phenomics | 翟振国/蒋太交/张鹏团队合作开发自适应多基因风险评估模型提升汉族人群静脉血栓栓塞症的风险预测能力
- • 祝贺 | 《表型组学(英文)》成功入选2025年“中国科技核心期刊”