博文
[转载]hLife | Lai Guan Ng 团队最新综述:中性粒细胞与代谢综合征——关键作用和发展前景
||
临床数据显示,我国代谢综合征(MetS)患病率达33.9%,MetS患者发生心脑血管疾病的风险较健康人群升高3倍。MetS以胰岛素抵抗、肥胖、高血压等代谢异常为主要特征,其核心发病机制与慢性低度炎症及免疫代谢失衡的相互作用密切相关。近期研究发现,中性粒细胞作为炎症反应的"先锋免疫细胞",在MetS发展过程中通过代谢重编程与功能重塑发挥关键作用。
近日,上海市免疫治疗创新研究院Lai Guan Ng 团队在hLife期刊发表了题为“Neutrophils: Key players in the metabolic syndrome puzzle”的综述文章(图1),系统梳理了代谢综合征诱导的全身性及脂肪组织特异性代谢改变对中性粒细胞本身及其功能的影响,并展示了通过靶向中性粒细胞来治疗代谢综合征的前景。

图1 论文标题及作者信息
中性粒细胞的基本特性及其代谢机制
中性粒细胞作为血液中数量最丰富的白细胞,其免疫功能呈现独特的双向调控特性。传统理论将其迁移过程视为由血液至组织的“单程旅行”,但近年研究揭示其具备反向跨内皮重返血液循环的能力,这种动态迁移模式与其功能异质性密切相关。不同表型的中性粒细胞既可通过释放细胞因子构建免疫防御网络,又可能因表型极化导致远端器官损伤或全身免疫抑制,这种可塑性使其在急性炎症中发挥核心作用,同时,其在慢性炎症中的具体作用机制也成为研究热点。代谢可塑性是中性粒细胞适应复杂生理病理环境的关键特征。传统观点认为其仅依赖糖酵解供能,但多组学研究证实其能量代谢网络具有显著适应性:葡萄糖通过糖酵解和磷酸戊糖途径同时满足能量需求与效应分子合成,而脂肪酸氧化则作为应激状态下的能量补充。这种代谢灵活性受局部微环境调控,肿瘤微环境甚至能诱导其功能重编程,表明其与慢性炎症疾病及肿瘤免疫逃逸的深层关联。
中性粒细胞的发育多样性与功能复杂性不断革新传统认知。从骨髓粒-单核祖细胞分化而来的中性粒细胞,在发育过程中形成表型功能各异的亚群,其效应特征既受局部刺激信号塑造,也与特定亚群招募机制相关。NLRP3炎症小体作为先天免疫压力感受器,不仅调控促炎细胞因子分泌,更通过介导细胞焦亡影响免疫应答走向。这种从发育到功能的动态调控网络,为理解中性粒细胞在免疫稳态维持与疾病发生发展中的作用机制提供了全新维度。
中性粒细胞在代谢综合征中的病理机制与功能重塑
中性粒细胞在MetS病理进程中扮演核心角色,其数量及功能异常与疾病特征密切相关。作为代谢性炎症的首要响应者,MetS患者血液循环中的中性粒细胞计数显著升高,这种增加不仅与高血糖诱导的髓系造血亢进有关,更与血浆葡萄糖、甘油三酯等代谢指标呈正相关,其作为炎症标志物的敏感性甚至优于传统中性粒细胞-淋巴细胞比值。值得注意的是,高脂饮食可通过先天髓系细胞重编程促进粒细胞祖细胞扩增,同时经CXCR4/CXCR2轴驱动衰老中性粒细胞肝浸润,进而通过重塑内脏脂肪免疫微环境加剧胰岛素抵抗和肥胖。高血糖环境通过多重机制驱动中性粒细胞病理活化:糖基化终末产物(AGEs)蓄积引发氧化应激,S100A8蛋白分泌刺激骨髓造血因子释放形成恶性循环,最终导致中性粒细胞过度生成。代谢层面,高血糖迫使中性粒细胞代谢模式发生适应性转变——未成熟阶段依赖线粒体氧化磷酸化,成熟后转向糖酵解为主,而病理条件下磷酸戊糖途径(PPP)异常激活为NETosis提供能量,过度释放的胞外诱捕网(NETs)反而加剧组织损伤。而高脂血症患者中性粒细胞CD11b表达上调进一步放大炎症效应,这种代谢-免疫交互异常最终导致2型糖尿病及心血管并发症的发生。中性粒细胞功能可塑性在代谢紊乱中呈现双向调控特征:一方面,糖尿病患者中性粒细胞吞噬功能及活性氧(ROS)生成能力因糖酵解酶胰岛素调节异常而受损;另一方面,胰岛素替代治疗可直接逆转这些功能缺陷,凸显代谢干预对免疫细胞的调控作用。最新证据表明,中性粒细胞在静息状态下即可通过感知局部微环境调整功能状态,这种组织特异性适应机制提示MetS的营养过剩可能通过多维度重塑中性粒细胞内在代谢网络,进而影响其免疫效应输出,为理解代谢-免疫互作提供了新视角(图2)。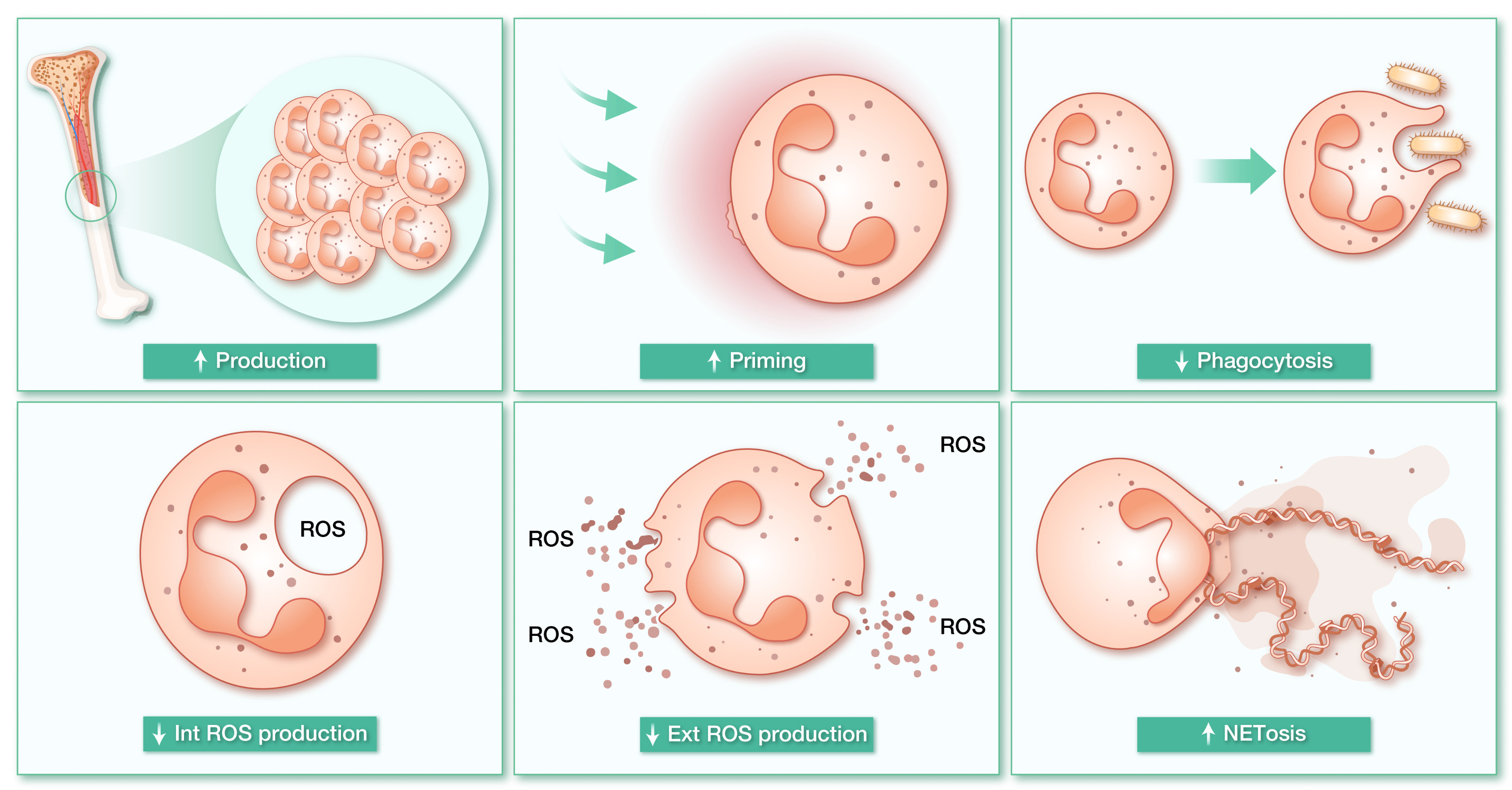 图2 代谢综合征对中性粒细胞效应功能的调控机制
图2 代谢综合征对中性粒细胞效应功能的调控机制中性粒细胞与脂肪组织互作机制及代谢调控
肥胖作为由能量过剩引发的代谢紊乱,其病理核心在于脂肪组织(AT)异常扩张及功能失调。内脏脂肪因解剖位置邻近代谢调控枢纽器官,其过度蓄积可通过内分泌功能异常加剧全身代谢紊乱:肥胖个体AT中促炎因子如肿瘤坏死因子-α(TNF-α)和白介素-6(IL-6)分泌增加,而具有胰岛素增敏作用的脂联素水平下降,这种脂肪因子失衡直接参与造成了葡萄糖耐受不良和胰岛素抵抗。与此同时,AT为应对营养过剩会通过脂肪细胞肥大与增生进行适应性脂质储存,但快速扩张常伴随血管生成滞后,导致组织缺氧、细胞死亡及促炎因子瀑布式释放,形成慢性低度炎症微环境(图3)。中性粒细胞在此病理过程中发挥关键介导作用,其与脂肪细胞的交互作用构成肥胖相关的代谢紊乱的恶性循环。早期阶段,中性粒细胞被招募至AT后通过释放弹性蛋白酶破坏胰岛素信号通路关键分子,同时促进巨噬细胞浸润加剧炎症;脂肪细胞脂解产生的游离脂肪酸则通过白三烯B4依赖性机制强化中性粒细胞-巨噬细胞串扰。值得注意的是,中性粒细胞介导的AT炎症存在物种特异性差异:小鼠模型显示非NLRP3依赖性IL-1β上调,而人类研究证实NLRP3炎症小体活化直接参与AT纤维化进程。这种代谢——免疫交互网络的复杂性说明,靶向中性粒细胞代谢重编程或成为改善肥胖相关代谢综合征的新策略。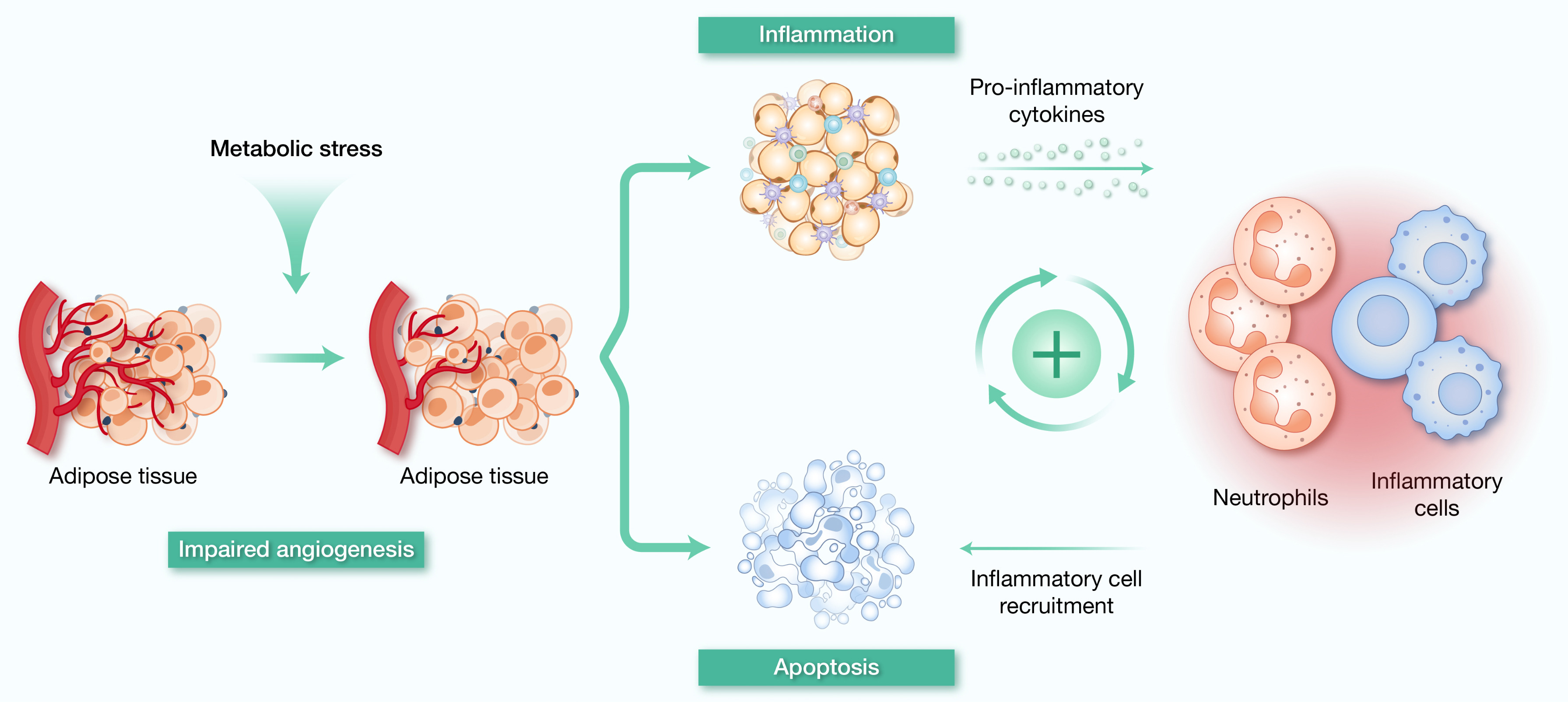 图3 代谢综合征中脂肪组织炎症与免疫细胞募集的病理机制
图3 代谢综合征中脂肪组织炎症与免疫细胞募集的病理机制代谢综合征免疫代谢紊乱的病理效应
作为代谢综合征的核心并发症,2型糖尿病(T2DM)与心血管疾病(CVD)的病理机制与中性粒细胞功能异常密切相关。高血糖环境通过多元醇/己糖胺途径耗竭糖酵解依赖的活性氧(ROS),同时高渗应激抑制线粒体ATP合成,双重打击导致中性粒细胞吞噬功能受损及代谢稳态失衡。尽管线粒体功能障碍已被证实参与胰岛素抵抗形成,但其在中性粒细胞介导的T2DM血管病变中的直接作用机制仍需深入解析。值得注意的是,血管内皮屏障在高血糖诱导的糖基化终末产物(AGEs)刺激下发生炎症浸润,而中性粒细胞表面受体异常表达形成的中性粒细胞胞外诱捕网(NETs),通过肽基精氨酸脱亚胺酶4(PAD4)依赖性机制激活NLRP3炎症小体,形成正反馈循环加剧血管斑块不稳定性和血栓前状态。当前研究面临动物模型与人类机制差异、临床样本异质性两大瓶颈,但转化医学领域已取得关键进展。针对NETosis核心酶PAD4的抑制剂进入II期临床试验,线粒体靶向抗氧化剂展现出调控NLRP3炎症小体的治疗潜力,而钙信号调节剂则通过恢复中性粒细胞吞噬功能改善代谢-免疫轴紊乱。这些突破为破解中性粒细胞在代谢综合征相关疾病中的"双刃剑"效应提供了新工具。未来研究需实现三大跨越:通过单细胞测序技术解析中性粒细胞亚群异质性,结合血管类器官模型精准模拟病理微环境;构建人工智能驱动的多组学整合平台,建立疾病进展的动态预测模型;突破人源化动物模型技术壁垒,系统解析中性粒细胞线粒体调控网络在代谢-免疫-血管交互轴中的核心地位。这些创新将推动临床干预策略从单靶点向多维度调控转型,为代谢综合征并发症防治开辟精准医学新路径。总结与展望
代谢综合征作为2型糖尿病(T2DM)和心血管疾病(CVD)的核心病理基础,其防治面临长期健康损害与经济负担的双重挑战。研究证实,脂肪组织(AT)慢性炎症是代谢综合征的关键早期驱动因素,常先于肥胖和T2DM发生。中性粒细胞作为炎症网络的核心调控节点,在人类及动物模型中均被证实深度参与代谢疾病进程:其既可通过释放炎症因子直接破坏代谢稳态,又能通过表型转换调控免疫-代谢轴平衡。然而,当前研究对中性粒细胞转录可塑性及亚群异质性的认知仍存在显著缺口,尤其在生理-病理状态转换过程中,线粒体代谢重编程与炎症小体激活的动态互作机制仍有待深入揭示(图4)。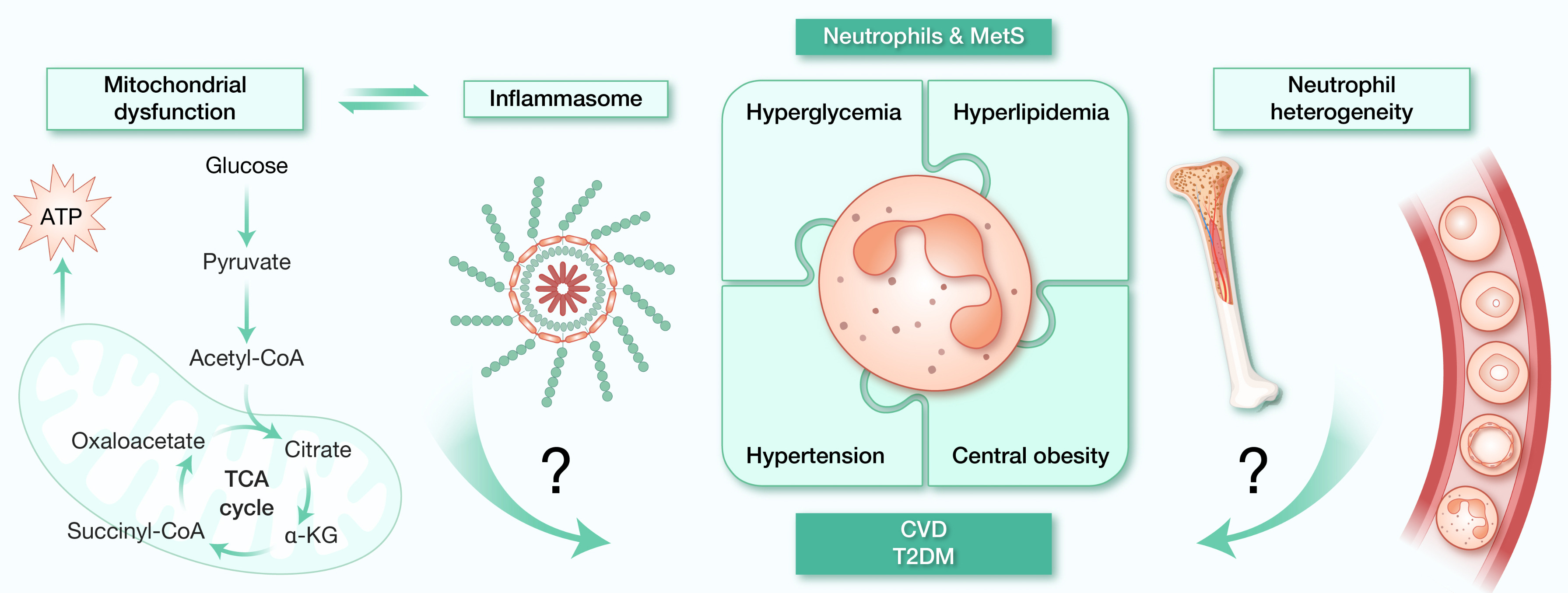 图4 中性粒细胞异质性-炎症小体-线粒体:代谢综合征调控轴未来研究有望突破传统单维度分析框架,借助多组学整合技术构建中性粒细胞功能图谱,揭示其在线粒体-炎症小体轴调控下的异质性特征。这不仅有助于解析代谢综合征的异质性疾病谱,更可能筛选出具有诊断价值的生物标志物,为T2DM、CVD等代谢性疾病的精准预防与个体化治疗提供新靶点。例如,针对中性粒细胞代谢重编程关键节点的干预策略,或可重塑代谢-免疫交互网络,从根源上阻断代谢综合征的病理级联反应。*此微信稿为翻译稿,如有歧义请以英文原文为准。
图4 中性粒细胞异质性-炎症小体-线粒体:代谢综合征调控轴未来研究有望突破传统单维度分析框架,借助多组学整合技术构建中性粒细胞功能图谱,揭示其在线粒体-炎症小体轴调控下的异质性特征。这不仅有助于解析代谢综合征的异质性疾病谱,更可能筛选出具有诊断价值的生物标志物,为T2DM、CVD等代谢性疾病的精准预防与个体化治疗提供新靶点。例如,针对中性粒细胞代谢重编程关键节点的干预策略,或可重塑代谢-免疫交互网络,从根源上阻断代谢综合征的病理级联反应。*此微信稿为翻译稿,如有歧义请以英文原文为准。作者简介
Hui Ping Yaw 博士后
第一作者
机构:上海市免疫治疗创新研究院
研究方向:中性粒细胞在健康与疾病中的异质性探究
Lai Guan Ng 资深研究员
通讯作者
机构:上海市免疫治疗创新研究院
研究方向:固有免疫,包括髓系细胞在稳态下和病理状态下的功能和机制
引用格式:Yaw HP, Devi S, Ng LG. Neutrophils: Key players in the metabolic syndrome puzzle. hLife 2025; 3: 121–131.
期刊简介
hLife 由高福院士、董晨院士和Jules A. Hoffmann教授(2011诺奖获得者)领衔,是中国科学院微生物研究所主办,中国生物工程学会,浙江大学陈廷骅大健康学院,西湖大学医学院,上海市免疫治疗创新研究院和广州霍夫曼免疫研究所联合支持,与国际出版商爱思唯尔合作的健康科学领域综合性英文期刊。
hLife 聚焦健康科学领域的前沿进展,旨在促进基础研究与临床应用的融合发展。期刊发表与医学相关各研究领域最新成果,学科领域包括(但不限于)病原生物学、流行病学、生理学、免疫学、结构生物学、疾病监测、肿瘤、药物、疫苗和健康政策等。
hLife是一本金色开放获取期刊,月刊出版;2022年成功入选“中国科技期刊卓越行动计划高起点新刊”;2023年11月正式创刊;2024年5月被DOAJ收录;2024年8月被Scopus收录。
2026年前hLife接收的稿件免收文章处理费(APC)。
期刊网址:
https://www.sciencedirect.com/journal/hlife
https://wap.sciencenet.cn/blog-3552961-1492323.html
上一篇:[转载]hLife |菌群、慢性炎症与健康:炎症组学开启精准医疗新时代
下一篇:[转载]hLife 2025年第五期正式出版