博文
[转载]hLife | 清华大学程功/朱毅斌研究团队揭秘哺乳动物宿主和蚊虫媒介对蚊媒病毒先天免疫反应的差异
||
在全球气候变化和人口流动加剧的背景下,蚊媒病毒性传染病的传播范围持续扩大,防控形势日益严峻。在应对这些疾病的过程中,深入理解宿主先天免疫系统的防御机制对于制定有效的抗病毒策略至关重要。
近日,清华大学程功/朱毅斌研究团队在 hLife 期刊发表了题为 "Comparison of innate immune responses against arboviruses in mammalian hosts and mosquito vectors" 的综述文章(图1)。该研究系统比较了哺乳动物与媒介蚊虫在应对蚊媒病毒感染时的先天免疫策略,揭示了生命进化过程中形成的复杂免疫防御网络,也为新型抗病毒疗法和病媒控制技术的开发提供了新的研究思路。
哺乳动物的三重防御体系
蚊媒病毒突破皮肤屏障进入哺乳动物体内后,哺乳动物的先天免疫系统迅速启动多层次防御机制。其中,补体系统作为机体抵御蚊媒病毒感染的第一道防线,主要通过经典途径、凝集素途径和替代途径介导免疫应答。经典途径通常由C1q识别并结合抗原-抗体复合物而启动,在登革病毒(DENV)、西尼罗病毒(WNV)、黄热病毒(YFV)和寨卡病毒(ZIKV)感染过程中,该途径可通过抗体介导的病毒清除降低病毒滴度。凝集素途径则不依赖抗体,其关键分子甘露糖结合凝集素(MBL)能够识别DENV和WNV表面的糖蛋白,进而激活补体相关蛋白酶,增强病毒吞噬作用。替代途径则通过持续水解C3产生C3b,与病毒结合并介导清除。该途径的关键因子缺陷可导致WNV在宿主体内扩散增强。此外,C3缺陷小鼠在委内瑞拉马脑炎病毒(VEEV)和辛德毕斯病毒(SINV)感染后,病毒清除延迟,增加其侵入中枢神经系统的风险。
补体系统的作用是机体免疫防御的初步反应,随后的免疫应答则依赖细胞内的模式识别受体(PRRs)。当病毒侵入细胞时,胞内PRRs迅速识别并启动防御机制。RIG-I和MDA5识别细胞质中的病毒RNA,并通过MAVS激活下游信号通路。Toll样受体(TLR)3和7分别识别内体中的病毒双链RNA和单链RNA,通过TRIF和MyD88衔接蛋白传导信号。这些信号最终汇聚于干扰素调节因子IRF3和IRF7,进而驱动干扰素(IFN)的表达。值得注意的是,cGAS-STING通路通过识别病毒复制过程中释放的线粒体DNA,在DENV等RNA病毒感染中发挥了独特的预警功能(图2A)。IFN的释放以及伴随而来的炎症反应标志着免疫防御的进一步加强。分泌的IFN通过与受体结合,激活JAK-STAT信号通路,诱导数百种干扰素刺激基因(ISGs)的表达。这些ISGs通过多种机制抑制病毒感染,包括抑制病毒翻译、降解病毒RNA和蛋白质、阻止病毒进入和复制、调节免疫信号通路以及诱导细胞死亡等(图2B)。此外,蚊媒病毒感染还通过激活NLR介导的炎症小体和NF-κB信号通路,驱动促炎细胞因子的产生、免疫细胞的招募以及抗病毒防御。NLR途径通过NOD1、NOD2等受体的激活,促使NF-κB介导促炎细胞因子的转录,例如在基孔肯雅病毒(CHIKV)和ZIKV感染中,NLRP3炎症小体被激活,促进IL-1β的释放并诱导细胞死亡。此外,NF-κB信号通路通过PRRs的激活引发信号级联反应,诱导促炎细胞因子和趋化因子的表达,进而招募免疫细胞来应对蚊媒病毒感染(图2C)。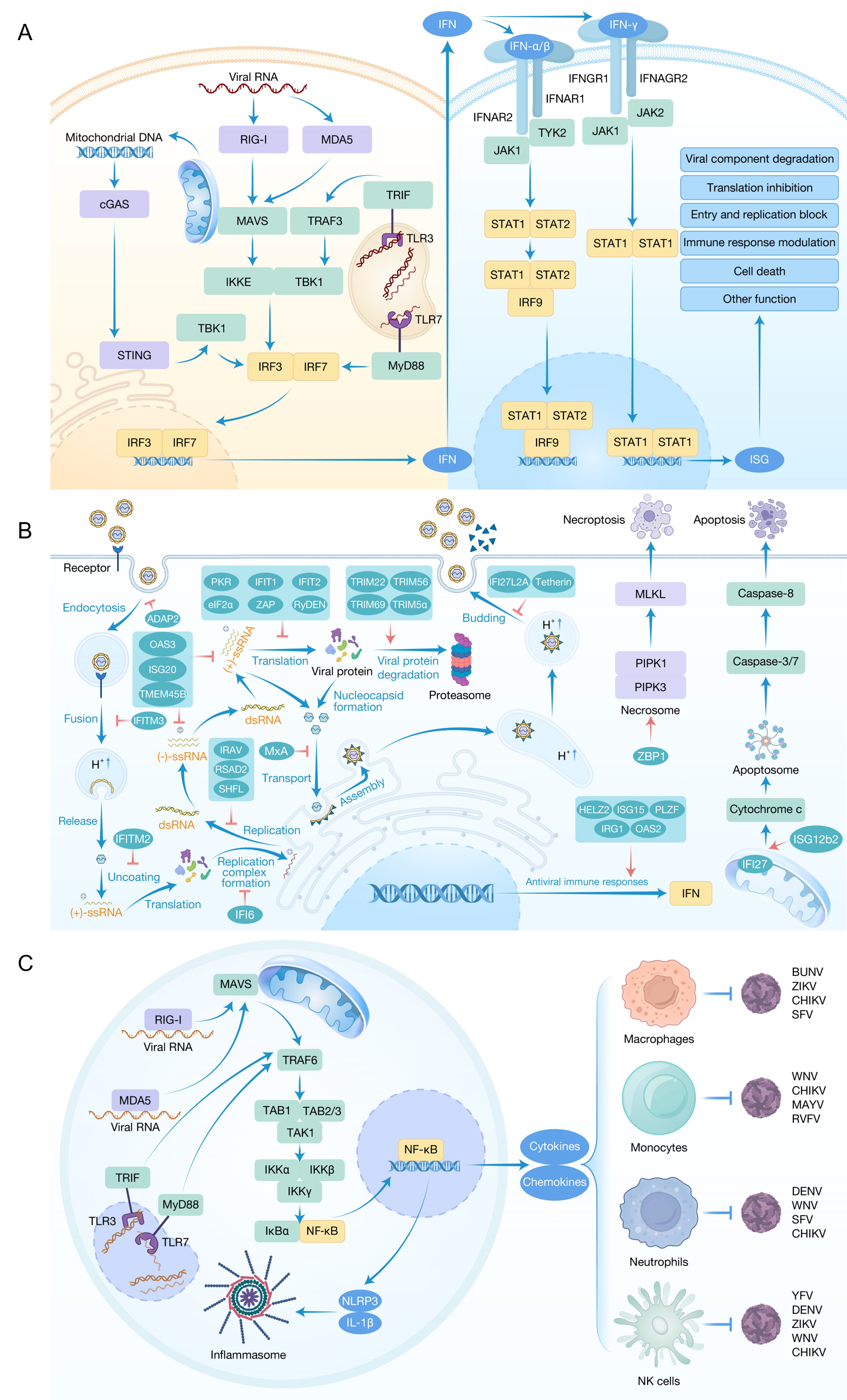
图2 哺乳动物的抗蚊媒病毒免疫策略
蚊虫的免疫防御策略
相比于哺乳动物依赖干扰素应答和强烈炎症反应的抗病毒策略,蚊虫进化出以RNA干扰(RNAi)为核心的抗病毒体系,以实现对病毒复制的精准抑制。
当病毒RNA进入蚊虫体内,Dicer2酶能够迅速识别并将其剪切为21-23 nt的小干扰RNA(siRNA)。这些siRNA与Argonaute 2(Ago2)蛋白形成RNA诱导沉默复合体(RISC),对病毒基因组进行特异性降解,从而有效抑制病毒扩增。此外,研究发现蚊虫可将病毒RNA反向转录形成环状病毒DNA,并存储于基因组中,作为一种“免疫记忆”传递给后代,使子代蚊虫在早期阶段具备一定的抗病毒能力。
除了RNAi机制,蚊虫还保留了三条保守的先天免疫通路:Toll、IMD和JAK-STAT通路。尽管这些通路的激活模式存在差异,但最终均可诱导抗菌肽(AMPs)的表达,从而发挥一定的抗病毒作用(图3)。在细胞免疫层面,蚊虫的血细胞在病毒防御中发挥重要作用。其中,粒细胞通过吞噬作用清除病毒颗粒,而绛色细胞则通过酚氧化酶级联反应产生毒性醌类化合物,以限制病毒复制。研究表明,当实验性抑制蚊虫血细胞功能(如使用乳胶微球)后,DENV和ZIKV在蚊虫体内的感染水平显著上升,进一步凸显血细胞在蚊虫抗病毒免疫中的关键作用。
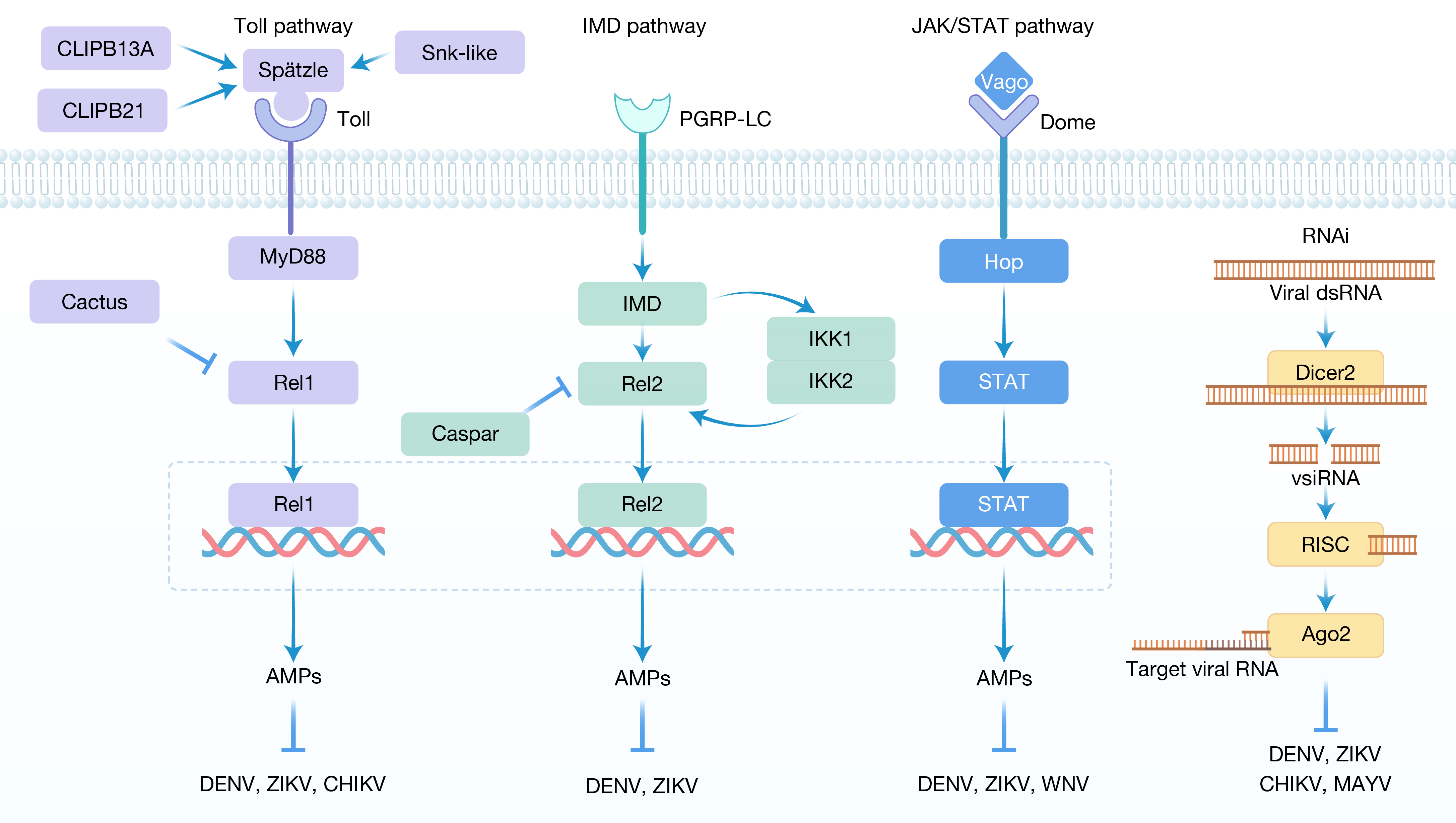
图3 蚊虫的抗蚊媒病毒免疫策略
跨物种比较:免疫策略的进化博弈
哺乳动物与蚊虫的先天免疫系统在进化过程中展现出一定的保守性。二者均依赖PRRs识别病毒相关分子模式(PAMPs),并通过激活Toll和JAK-STAT等保守信号通路,诱导免疫效应分子发挥抗病毒作用。此外,二者均利用细胞吞噬机制介导抗病毒反应,表明先天免疫的核心元件在进化过程中高度保守。
尽管哺乳动物与蚊虫的先天免疫系统源自共同祖先,但其进化路径呈现出明显的差异。哺乳动物的免疫策略侧重于快速清除病毒,通过补体系统介导初始防御,随后依赖干扰素信号放大免疫应答,并最终通过炎症调控恢复稳态。这种强效但高能耗的防御机制虽然能够有效消除病毒,但也可能引发细胞因子风暴等免疫病理损伤。相比之下,蚊虫作为病毒传播的媒介,其进化策略倾向于控制病毒载量而非彻底清除。RNAi机制允许病毒在低水平下持续感染,从而避免免疫系统的过度激活,同时维持宿主生存与病毒传播之间的动态平衡。
总结和展望
哺乳动物与蚊虫的先天免疫系统在感染控制方面展现出一定的保守性,均依赖核心免疫机制限制病毒复制。然而,二者在长期进化过程中形成了独特的抗病毒策略,以适应各自的生理特性和生态需求。
尽管近年来蚊虫免疫研究取得了重要进展,但仍存在诸多未解之谜,诸如关键免疫分子的功能、信号通路的调控机制,以及不同先天免疫系统之间的相互作用仍有待深入解析。系统性探索哺乳动物与媒介蚊虫的免疫特征,不仅有助于揭示虫媒病毒传播的内在机制,也为开发针对性防控策略提供了新的思路和潜在干预靶点。
✦ +
+
作者简介

张礼铭 博士后
第一作者
机构:清华大学基础医学院
研究方向:肠道菌群、蚊媒病毒和媒介蚊虫相互作用关系

朱毅斌 副研究员
第一作者
通讯作者
机构:清华大学基础医学院
研究方向:蚊媒病毒、宿主与媒介蚊虫的互作机制

程功 教授
通讯作者
机构: 清华大学基础医学院
研究方向:蚊媒病毒感染传播机制与抗病毒免疫研究
引用格式:Zhang L, Zhu Y, Cheng G, et al. Comparison of innate immune responses against arboviruses in mammalian hosts and mosquito vectors. hLife 2025; https://doi.org/10.1016/j.hlife.2025.02.007.
期刊简介
hLife由高福院士、董晨院士和Jules A. Hoffmann教授(2011诺奖获得者)领衔,是中国科学院微生物研究所主办,中国生物工程学会,浙江大学陈廷骅大健康学院,西湖大学医学院,上海市免疫治疗创新研究院和广州霍夫曼免疫研究所联合支持,与国际出版商爱思唯尔合作的健康科学领域综合性英文期刊。
hLife聚焦健康科学领域的前沿进展,旨在促进基础研究与临床应用的融合发展。期刊发表与医学相关各研究领域最新成果,学科领域包括(但不限于)病原生物学、流行病学、生理学、免疫学、结构生物学、疾病监测、肿瘤、药物、疫苗和健康政策等。
hLife是一本金色开放获取期刊,月刊出版;2022年成功入选“中国科技期刊卓越行动计划高起点新刊”;2023年11月正式创刊; 2024年5月被DOAJ收录;2024年8月被Scopus收录。
2026年前hLife接收的稿件免收文章处理费(APC)。
期刊网址:
https://www.sciencedirect.com/journ
https://wap.sciencenet.cn/blog-3552961-1481227.html
上一篇:[转载]hLife | 胡必杰与乐率等研究团队合作发现对抗超级细菌的利器!首例超级细菌胆道感染的噬菌体治疗案例!
下一篇:[转载]hLife | 广州医科大学李锋/唐小平研究团队成功建立猴痘病毒IIb分支I和II型干扰素通路双缺陷小鼠感染致病模型
