博文
CIMB:北京林业大学马玉超副教授团队——修饰葡萄糖代谢途径促进P. putida合成mcl-PHA
||
研究背景和内容
中链长聚羟基烷酸酯 (mcl-PHA) 是一种熔点低、断裂伸长率高的半结晶弹性体,在民用、农业、工业以及医疗等领域有着广泛的应用。通过代谢工程增强Pseudomonas putida合成mcl-PHA是一种很有前景的商业化策略,但很少有人尝试提高葡萄糖在合成mcl-PHA中的利用率。来自北京林业大学生物科学与技术学院的马玉超副教授及其团队对一株P. putida (Pseudomonas putida KT2440衍生株P. putida QSRZ6) 进行了多途径修饰研究,以提高底物葡萄糖的利用率和PHA的合成能力,并将这一成果发表在Current Issues in Molecular Biology (CIMB) 期刊上。
研究人员为促进葡萄糖代谢更多流向mcl-PHA的重要前体乙酰-CoA,共进行了3方面的研究:(1) 截断了葡萄糖外周通路和减弱了TCA循环;(2) 敲除葡萄糖代谢负调节因子hexR,进一步改善mcl-PHA的合成;(3) 过表达编码糖代谢双组分正控调节系统GltR/GltS的转录激活蛋白gltB,获得目前最优突变株QSRZ609。后续研究人员还进行了PHA合成途径的研究,即过表达编码PHA合成途径的正控调节因子phaD基因。随后研究人员在摇瓶中进行分批补料发酵优化,优化后QSRZ609的mcl-PHA含量为59.1%,效价为6.8 g/L。该研究证明,通过多基因修饰从葡萄糖到乙酰-CoA的调控是促进mcl-PHA合成的有效策略,所获得的突变体可以作为进一步提高mcl-PHA产量的底盘菌株 (图1)。

图1. 多基因联合修饰提高P. putida QRSZ6生产mcl-PHA的策略
文章亮点
分支途径截断、强化正调控因子表达和敲除负调控的多途径耦合修饰是提高葡萄糖利用率和增强PHA合成的有效途径。
研究结果
1. 葡萄糖代谢中竞争分支通路的阻断
分别敲除进入外围途径和TCA循环的第一个基因编码葡萄糖脱氢酶的gcd基因和编码柠檬酸合成酶的gltA基因,获得单基因敲除突变体QSRZ601和QSRZ602,其细胞生长速率和葡萄糖消耗速率与亲本菌株QSRZ6相似。双基因失活组合突变株QSRZ603的结果略有下降。突变体显示PHA合成能力增强 (图2B),mcl-PHA含量分别达到33.0%、32.6和37.6% wt%。与QSRZ6 (27.3 wt%) 相比,前者分别增强了21.0%、19.5%和38.0%。这两条分支通路被截断或弱化的结果,明显支持了碳源代谢和mcl-PHA生物合成的重新定向。
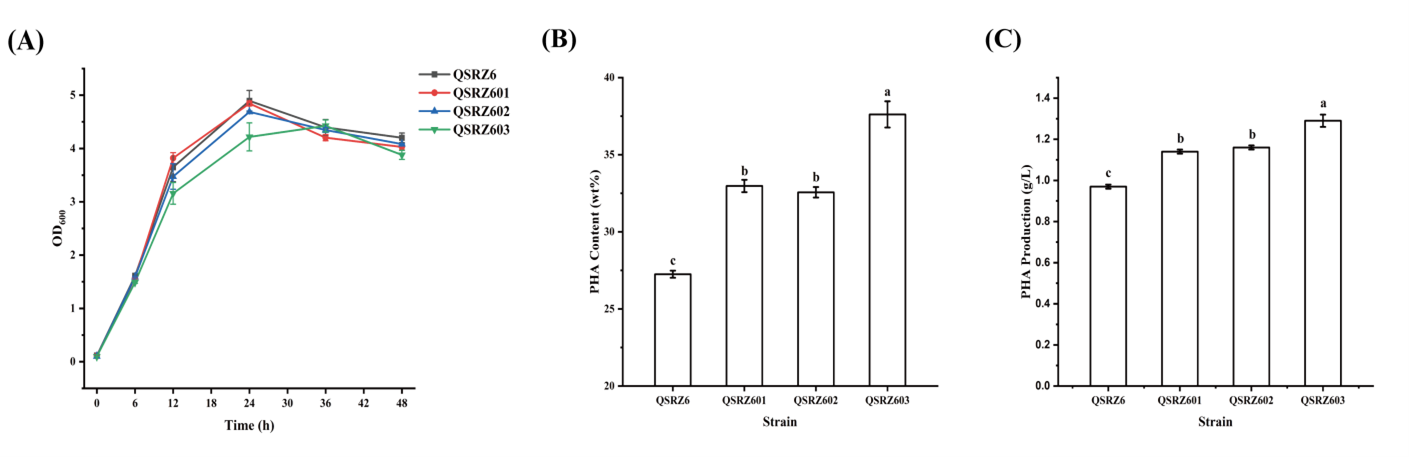
图2. gcd和gltA基因敲除突变体数据
2. 葡萄糖代谢中转录负调控因子的失活
研究解除HexR的糖代谢抑制作用对提高PHA合成的影响,分别在亲本菌株QSRZ6、QRZ601、QRZ602和QRZ603的基础上构建HexR失活突变体QSRZ604 (ΔhexR)、QSRZ605 (ΔhexRΔgcd)、QSRZ606 (∆hexR∆gltA) 和QSRZ607 (∆hexR∆gcd∆gltA)。经摇瓶发酵,mcl-PHA含量 (图3B) 分别达到37.4 wt%、47.4 wt%、39.5 wt%和49.1 wt%,与QSRZ6相比,分别增加37.4%、74.0%、45.0%和80.2%。mcl-PHA滴度 (图3C) 分别为1.4 g/L、2.0 g/L、1.4 g/L和2.1 g/L,与QSRZ6相比,分别高出45.5%、104.7%、48.3%和117.5%。结果显示,hexR失活对mcl-PHA合成十分重要,特别是与gcd和gltA敲除结合效果更加显著。考虑到QSRZ605和QSRZ607具有相似的最终mcl-PHA滴度,我们选择生长速度和葡萄糖利用率更快的QSRZ605进行进一步的基因改造。

图3. hexR基因敲除突变体数据
3. 葡萄糖代谢中转录正调节因子的增强
为利用GtrS-GltR信号级联系统来提高葡萄糖分解代谢的效率,利用张等所报道的P. putida KT2440核糖体小亚基蛋白S1和核糖体调节因子的强启动子 (P17和P33) 进行gltB基因过表达来激活GtrS-GltR系统,分别获得突变体QSRZ608 (QSRZ605::P17-gltB) 和QSRZ609 (QSRZ605::P33-gltB),经摇瓶发酵,突变体QSRZ609的mcl-PHA含量和效价分别达到57.3% wt%和2.5 g/L,分别比亲本菌株提高了21.0%和27.3%;与QSRZ6相比,分别增加了110.4%和159.9% (图4B、C)。结果表明P33更适合gltB过表达,以此利用GtrS-GltR信号级联增强mcl-PHA合成。

图4. gltB基因过表达突变体数据
4. P. putida KT2440 PHA合成途径的修饰
为增强mcl-PHA合成的表达,将启动子P33和P17控制的phaD基因插入到hexR基因中,分别以QSRZ605和QSRZ609为亲本构建突变体QSRZ610 (QSRZ605::P33-phaD) 和QSRZ611 (QSRZ609::P33-phaD)。在qRT-PCR检测中,phaD基因在QSRZ610和QSRZ611中的相对表达量明显高于对应亲本菌株 (图5A)。然而,结果显示最终的细胞干重、mcl-PHA含量和滴度都低于各自的亲本菌株 (图5A,B)。与亲本菌株QSRZ605相比,QSRZ610的mcl-PHA含量和终效价分别降低了33.7%和48.0%。与亲本菌株QSRZ609相比,QSRZ611的PHA含量和终效价分别降低29.7%和32.5% (图5C、D)。而且令人惊讶地是,QSRZ611的葡萄糖消耗速率并不比QSRZ609快,但QSRZ610的葡萄糖消耗速率恢复到与QSRZ6相似的水平,并且快于QSRZ605 (图S1D)。造成这一结果的原因可能为PhaD可能调控其他未知的碳代谢途径,有待进一步研究。
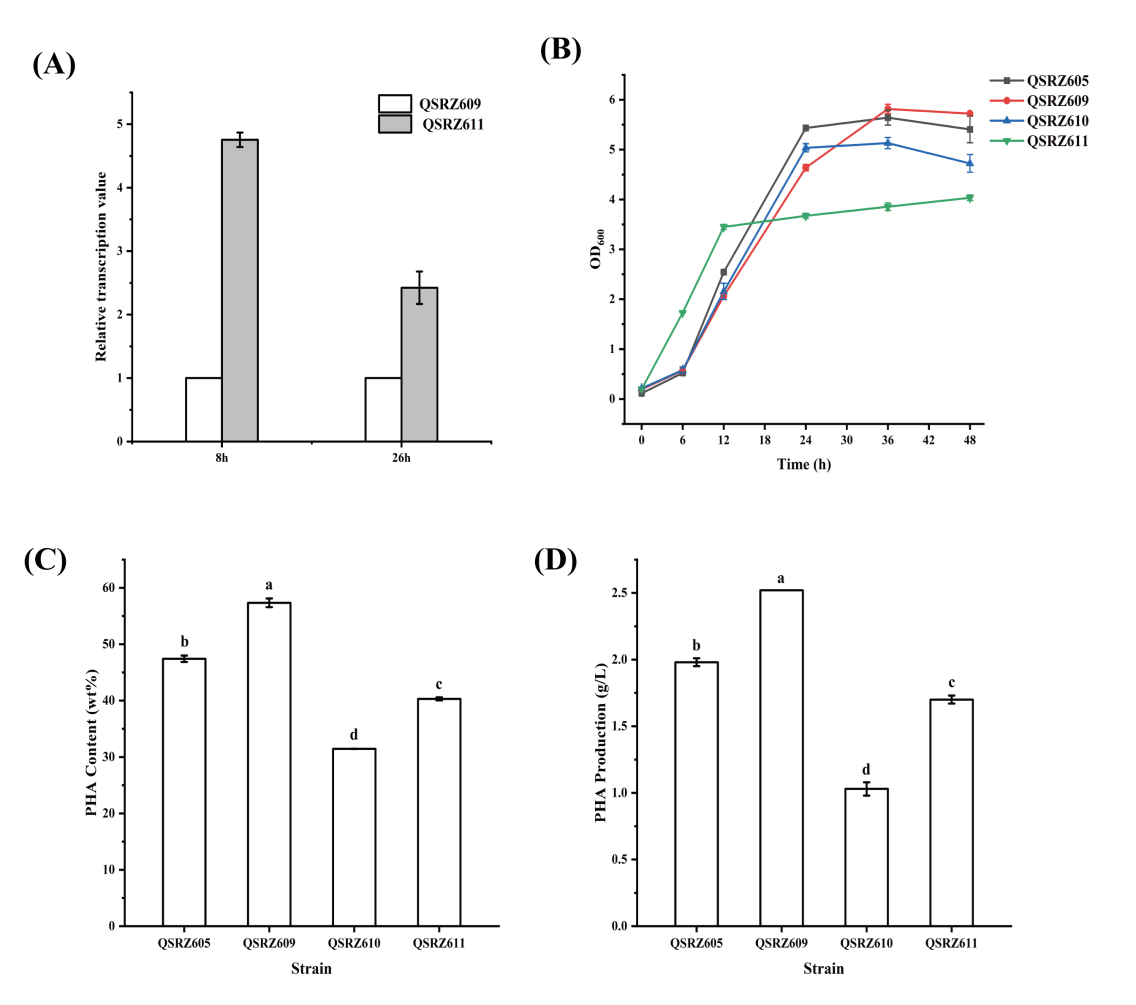
图5. phaD基因过表达突变体数据

图S1. 突变体的葡萄糖消耗数据
5. PHA结构分析
在以前的报道中,P. putida KT2440合成的mcl-PHA主要单体是C10 (3HD),其次是C8 (3HO)、C12 (3HDD) 和C14 (3HTD),而C6 (3HHx) 的含量极低,葡萄糖是无关的碳源。通过GC/MS对QSRZ6的PHA单体进行检测,发现各单体的比例与之前报道的相似。PHA单体类型通过脂肪酸的从头合成途径和PHA合酶在以葡萄糖为底物的PHA生物合成中的作用来决定。正如预期,本研究中仅修饰葡萄糖代谢途径突变体的PHA单体的类型和比例与起始菌株QSRZ6一致 (表1)。
表1. 突变体中PHA的结构组成

6. 发酵条件的优化
为更准确的评估菌株产mcl-PHA的能力,进行培养条件优化。采用两阶段发酵法,首先,在细胞生长阶段,经培养基和碳氮组分优化后,LBG被认为是最适合细胞生长的培养基 (图6A),在避免碳源浪费的情况下,初始葡萄糖添加20 g/L为最适细胞生长糖浓度 (图6B,图S2A),并且研究发现细胞生长曲线不受pH调节的影响 (图S2B)。其次,在mcl-PHA积累阶段,筛选一次性补料和小规模多次进料2种进料策略。在2种补料效果无明显差异的情况下,考虑到成本问题,最终选择单次进料更为合适。
最后,利用优化后的条件对QSRZ605、QSRZ607和QSRZ609这3个优秀突变体进行补料发酵,进一步检测各菌株CDW和mcl-PHAa的产量水平 (图6C、D)。在补料发酵中,mcl-PHA含量最高为59.1% wt% (QSRZ609),其次为58.4% wt% (QSRZ607) 和53.1% wt% (QSRZ605)。mcl-PHA滴度最高的是6.8 g/L (QSRZ609),其次是6.3 g/L (QSRZ607) 和5.8 g/L (QSRZ605),产量分别比QSRZ6提高了92.6%、78.4%和63.9%。综上所述,QSRZ609是一个优良的突变菌株,mcl-PHA产率为0.2 g/g葡萄糖。

图6. 发酵条件优化数据

图S2. 发酵条件优化补充数据
原文出自CIMB 期刊:https://www.mdpi.com/1467-3045/46/11/761
期刊主页:https://www.mdpi.com/journal/cimb
CIMB 期刊介绍
主编:Madhav Bhatia, University of Otago, New Zealand
期刊主题涵盖生物化学、分子和细胞生物学、分子生物物理学、分子医学, 以及化学分子研究的各个方面。
2023 Impact Factor:2.8
2023 CiteScore:2.9
Time to First Decision:15.8 Days
Acceptance to Publication:2.6 Days


https://wap.sciencenet.cn/blog-3516770-1471953.html
上一篇:对话 Pathogens 期刊新任栏目主编:刘玮研究员
下一篇:Applied Sciences 论文选题灵感:电气电子及通讯工程研究方向