最近,《科学》杂志发表的一篇文章(Design of high-specificity binders for peptide–MHC-I complexes. Science 24 July 2025), 通过生成式人工智能(Generative AI,如:RFdiffusion、ProteinMPNN、AlphaFold2/3)成功设计了具有高特异性结合pMHC-I能力的微型结合蛋白(binders),在T细胞免疫治疗领域,展开“智能导航”的新突破。
研究背景:免疫系统的 “精准识别困境”
人体细胞通过表面的 “肽 - MHC-I 复合物(pMHC-I)” 展示内部蛋白质片段(肽段),作为 “状态报告”:正常细胞展示自身肽段,而癌细胞或病毒感染细胞会呈现异常肽段(如肿瘤抗原、病毒蛋白片段)。免疫系统中的 T 细胞依靠 “T 细胞受体(TCR)” 识别这些异常信号并启动攻击,但传统识别工具存在三大局限:
特异性不足:异常肽段与正常肽段常仅差 1-2 个氨基酸,传统 TCR 或改造抗体易 “认错”,导致误伤正常细胞;
适配性有限:不同人因 “HLA 等位基因多样性”,MHC-I结构差异显著,一种识别工具难以通用;
开发低效:依赖从患者体内筛选 TCR 或改造天然蛋白,成本高、周期长、成功率低。
为此,研究团队借助生成式人工智能(Generative AI)设计全新 “分子识别器(binders)”,旨在突破上述局限,实现对病变细胞的精准靶向。
核心突破:AI 设计的 “超级识别器(binders)”
这些 binders 是完全人工设计的全新蛋白质,无天然原型,其设计逻辑和技术路线具有颠覆性:
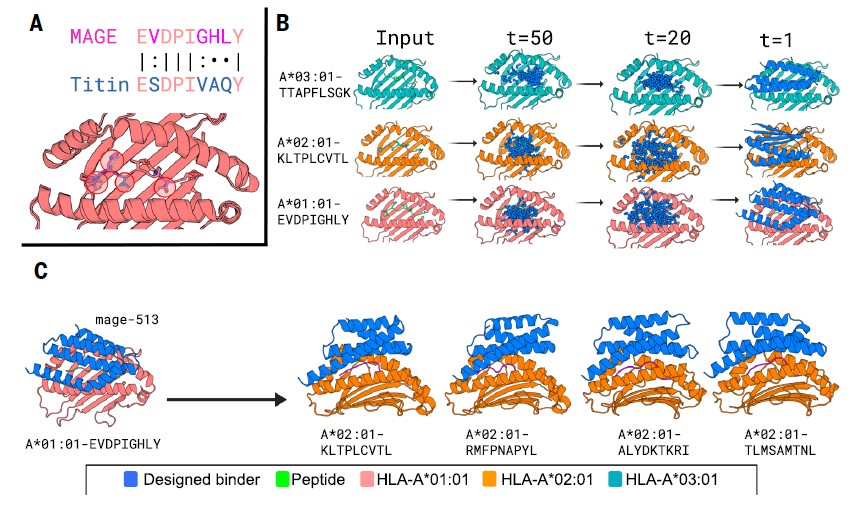
设计原型与核心逻辑不依赖天然免疫分子(如 TCR、抗体)模板,通过 AI 从头构建:利用 RFdiffusion 生成 “弧形骨架”,精准覆盖 MHC-I 的肽结合槽,优先与异常肽段的外向残基结合,同时刻意减少与 MHC-I 分子本身的接触 —— 这一设计确保其仅 “紧盯” 病变信号(异常肽段),而非 “展示板”(MHC-I),从结构上规避脱靶风险。
核心AI工具与设计流程三大 AI 工具协同形成 “计算闭环”:
RFdiffusion:从随机原子坐标出发,通过 “去噪” 生成能特异性结合 pMHC-I 的蛋白骨架;
ProteinMPNN:优化骨架的氨基酸序列,确保其稳定折叠并增强与靶肽的结合力;
AlphaFold2/3:预测设计的 binders 与 pMHC-I 的结合构象,筛选对靶肽结合置信度显著高于正常肽段的候选。

实验验证:从设计到功能的全面突破
目标覆盖:针对 11 个结构多样的 pMHC-I 复合物,包括 3 种病毒肽(如 SARS-CoV1、HIV)、4 种肿瘤相关抗原肽(如 WT1、MAGE-A3)及新抗原肽(如 CTNNb1 S5F 突变体),涉及 HLA-A01:01、A02:01 等 4 种常见等位基因。
特异性与亲和力
结构准确性mart1-3 与 MART-1 pMHC-I 的2.2Å 晶体结构显示,其与设计模型的骨架偏差(Cα RMSD)仅0.4Å,界面侧链偏差亦为0.4Å,证实AI设计的原子级精度。
功能验证:CAR-T 的精准激活与杀伤
关键发现:拓展设计边界与机制解析
快速适配新靶点:通过“部分扩散”技术,基于一个成功骨架(如 ALHGGWTTK/A*03:01结合剂),局部改造即可靶向 MAGE-A3、gp100 等新靶点,将开发周期缩短至数周。
无需实验结构亦可设计:针对无高分辨率结构的 pMHC-I(如 PRAME),基于 AlphaFold3 预测结构设计的 prame-9等binders,仍具高特异性(SPR亲和力35-96 nM),并能激活T细胞。
特异性机制:binders 通过多重相互作用锁定靶肽,如 mage-513 的 L37/L86 与 MAGE-A3 肽的 L8 形成疏水作用,D29作为“守门员” 通过空间位阻排除相似正常肽段,进一步降低脱靶风险。
应用前景:开启精准免疫治疗新时代
该技术为 pMHC-I 靶向疗法提供了 “通用设计工具”:
支持规模化生成临床级 binders,覆盖多样 HLA 等位基因和疾病靶点,推动个性化 CAR-T、双特异性抗体(BiTEs)等疗法发展;
实现 “数字先行” 策略,虚拟筛选数千种设计后再进入实验,大幅降低开发成本与周期;
为癌症、病毒感染等疾病的精准治疗奠定基础,有望解决传统免疫疗法的脱靶毒性与适配性难题。
转载本文请联系原作者获取授权,同时请注明本文来自阎影科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3302154-1497404.html?mobile=1
收藏
分享



