过继细胞疗法需要在体外培养经过工程改造的T细胞,这个过程主要是利用超生理浓度的代谢物(比如葡萄糖)来扩大细胞数量。但《细胞代谢》杂志上发表的数据显示,这种培养体系培养出的 T 细胞并不是杀伤肿瘤的最佳状态。
在使用T细胞治疗癌症时,需要先在体外大量培养T细胞。但以前的培养条件有个问题:这些T细胞太依赖 “有氧糖酵解”,也就是吃进去的葡萄糖没被好好利用,大多变成了乳酸,导致T细胞“体质”变差,到了体内后存活时间短、抗肿瘤能力弱,尤其是对付实体瘤效果不好。
T 细胞过度依赖有氧糖酵解(而非高效利用有氧代谢),并非有氧代谢本身有问题,而是这种代谢方式会导致T细胞功能受损。首先,有氧糖酵解会使T细胞产生大量乳酸,且葡萄糖未被充分用于线粒体的能量代谢,导致线粒体功能减弱,能量生成效率低下。这会让T细胞处于一种“代谢不健康”的状态,削弱其长期存活和增殖能力。
其次,过度依赖有氧糖酵解会使T细胞的代谢灵活性下降,难以适应体内复杂的营养环境(如肿瘤微环境中的低葡萄糖状态),导致其在体内的植入(engraftment)能力和持久性降低。
此外,这种代谢方式还会影响T细胞的表观遗传状态,抑制与干细胞特性和长寿相关基因的表达,使 T 细胞更倾向于短期效应功能,而缺乏长期抗肿瘤所需的自我更新和记忆能力,最终降低免疫治疗的效果。总之,问题不在于有氧代谢本身,而在于T细胞过度依赖低效的有氧糖酵解,牺牲了线粒体功能和代谢适应性,从而影响其治疗潜力。
试验发现,用一种叫“二氯乙酸(Dichloroacetate,DCA)”的化合物处理体外培养的T细胞,能帮它们重新规划葡萄糖的代谢流向,让葡萄糖更多地进入细胞的“能量工厂”线粒体里代谢,而不是浪费成乳酸。这样一来,T细胞的线粒体功能变强了,更像在体内自然激活的健康T细胞,保存了T细胞的“干细胞性”(Stemness),也能更好地利用体内的营养,如:乳酸、丙酮酸这些血液里常见的物质。
研究比较了OT-I T 细胞在体外和体内的扩增情况,发现它们的细胞代谢谱存在差异。最明显的区别是,在体外扩增的T细胞糖酵解活性高得多。为了让体外培养的T细胞更接近体内扩增的T细胞,研究人员在扩增阶段抑制了糖酵解酶丙酮酸脱氢酶激酶 1(pyruvate dehydrogenase kinase 1,PDHK1),这限制了乳酸的产生,改善了线粒体功能。
用DCA处理过的T细胞,在治疗小鼠黑色素瘤和其它实体瘤时,能更有效地清除肿瘤,小鼠存活率大幅提高,甚至能形成“免疫记忆”,防止肿瘤复发。对人类的CAR-T细胞做同样处理,也有类似的好效果。
背景原因:DCA不仅改了T细胞的代谢,还调整了它们的“基因开关”(表观遗传) 让一些和长寿、抗疲劳相关的基因更活跃,比如通过增加组蛋白乙酰化,让这些基因更好地表达。简单说,就是找到了一种给体外培养的T细胞“强身健体”的方法,让它们到了体内更能战斗,提升了癌症免疫治疗的效果。
PDHK1在T细胞激活时会被激活,而它会抑制丙酮酸脱氢酶(PDH)的活性,PDH的作用是将丙酮酸转化为乙酰辅酶A并送入线粒体进一步代谢。当PDHK1活跃时,丙酮酸难以进入线粒体,更多地被转化为乳酸,导致T细胞依赖有氧糖酵解。DCA能抑制PDHK1的活性,解除其对PDH的抑制,使得丙酮酸能更顺利地进入线粒体,参与三羧酸循环等过程,从而让葡萄糖更多地进入线粒体进行代谢。这一过程改变了T细胞的代谢方式,提升了线粒体功能,进而改善了T细胞的性能。
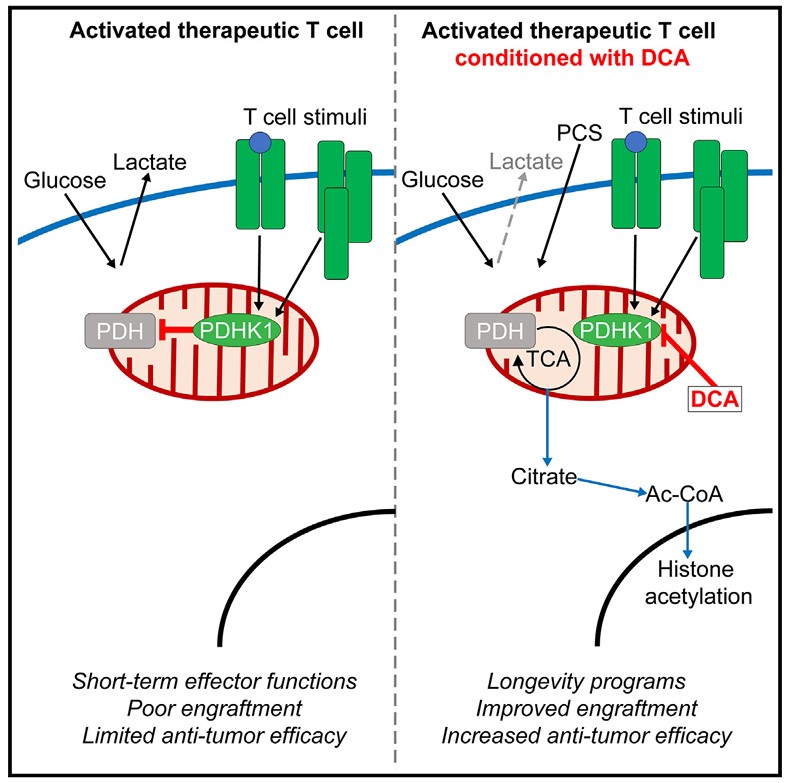
癌症的T细胞治疗目前依赖于高代谢条件下的体外扩增。体外培养的T细胞可以进行广泛的有氧糖酵解。使用DCA调节将葡萄糖通量转向线粒体可通过其代谢和表观遗传谱改善T细胞代谢及其治疗效果。
Redirecting glucose flux during in vitro expansion generates epigenetically and metabolically superior T cells for cancer immunotherapy.
2025, Cell Metabolism 37, 870–885
转载本文请联系原作者获取授权,同时请注明本文来自阎影科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3302154-1497295.html?mobile=1
收藏

