癌症新抗原是肿瘤细胞表达的一种蛋白质,它能引发身体的免疫反应,从而消灭肿瘤。对于实体瘤(特别是胰腺癌)的免疫治疗,有个很大的难题:就是大多数肿瘤细胞表达的那些能引发免疫反应的、癌症特有的蛋白质和肽非常少(也就是新抗原),这就限制了免疫疗法的效果。
麻省理工学院(MIT)的Dr. Ely等人做了一项关于人类胰腺癌的免疫肽组学的研究。发现了很多从基因组里本来不编码蛋白质的区域产生的独特肽。这些肽里有一些能引发免疫反应,这就有可能通过T细胞产生的免疫反应、杀死胰腺癌细胞。研究还发现,有一部分从癌症细胞里分离出来的肽在不同的患者身上都有存在(换言之:是共有的,shared),而且在正常的胰腺细胞里找不到。就是说这部分肽是肿瘤特有的,这意味着我们有可能开发出通用的“现成”免疫疗法,不用像以前那样专门为每个患者定制个性化免疫治疗,毕竟个性化疗法实施起来有更大的难度。
癌细胞能把一些原本认为不编码蛋白质的遗传物质,变成可以被人类白细胞抗原-I (HLA - I)呈递的特殊肽段,而这些特殊肽段比较隐蔽,故此被称为隐秘肽(或非经典肽)(cryptic (noncanonical) peptides)。不过,在大多数实体肿瘤里,这些隐秘肽到底是什么还不太清楚。由于免疫疗法对这些实体肿瘤的治疗效果常常并不太好,要是能更清楚地了解隐秘肽是怎么呈递出来的,以及它们能不能引发抗肿瘤免疫反应,就有可能会给像胰腺癌这样的实体肿瘤找到新的一条治疗途径。
科学家在这项研究里,探讨和研究了胰腺癌中与 HLA - I 结合的隐秘肽,还建立了一个系统,用来研究能识别这些隐秘肽的 T 细胞受体(TCR),看看这些隐秘肽有没有可能引发抗肿瘤的特异性免疫反应。在对胰腺癌患者的类器官和肿瘤组织的高深度免疫肽组学分析中,发现用类器官来研究,能更准确地找到那些和癌症相关的肽段,类器官方法显著提高了对癌症来源的特异性肽段的识别。原来以为通过分析基因变化能找到很多由突变产生的肽段,为此,研究为每位患者构建了个性化的蛋白质基因组搜索检测空间,但研究发现,使用这种免疫肽组学的途径,只能找到少数由突变产生的肽。相反,通过TCR和类器官的实验发现了一千多种由HLA - I呈递的隐秘肽。这些隐秘肽的来源很多,比如长链非编码RNAs(long noncoding RNAs,lncRNA)、基因两端不翻译蛋白质区域(5′or 3′untranslated regions,UTRs),还有一些特殊的阅读框架(alternative reading frames,intORFs)。
研究也查看了很多正常组织,包括健康的胸腺,以便找出那些可能只在癌症里才会产生的隐秘肽。结果发现,在胰腺癌里找到的隐秘肽,差不多有30%在其他健康组织里都找不到,这些只在癌组织中存在的肽,被称之为癌症限制性隐秘肽(cancer-restricted cryptic peptides)。而且很多这种癌症限制性隐秘肽是不同患者个体身上是共有的。
随后,利用建立的体外T细胞启动(priming)和扩增平台,进一步评估隐蔽肽免疫原性的潜力。研究发现癌症特异性隐蔽肽表现出强大的免疫原性,与那些由基因突变产生的新抗原具有的免疫原性不分上下。通过基于条形码的抗原图谱分析,以单细胞分辨率分离出针对隐蔽肽的特异性T细胞受体(TCR)。研究还重构了其中一部分 TCR,以确认隐蔽肽的抗原特异性、与TCR的亲和力,并评估可能存在的交叉反应。利用基于 CRISPR 的 TCR 重定向技术(CRISPR-based TCR redirection,TCR-T, 注:利用 CRISPR 基因编辑工具对TCR进行精准编辑,赋予需要的肿瘤抗原识别能力,目的在于识别肿瘤特异性抗原,也能增强免疫系统对癌细胞的攻击能力),研究证明T细胞能够识别肿瘤细胞上内源性水平的隐蔽抗原。此外,携带针对癌症限制性隐蔽抗原的TCR - T细胞,能够在体外和体内对患者来源的胰腺癌类器官发挥强大的杀伤作用。
这项解决了癌症抗原肽研究中的两个主要空白:即非经典肽的癌症特异性和免疫原性。研究结果表明,胰腺癌里一些不正常的翻译过程会产生能被T细胞识别的隐秘抗原。研究数据支持一部分隐蔽肽具有癌症特异性、免疫原性,并且可直接靶向人类胰腺癌细胞表面,使得它们成为值得进一步研究的潜在治疗靶点。
Pancreatic cancer–restricted cryptic antigens are targets for T cell recognition. SCIENCE 8 May 2025 Vol 388, Issue 6747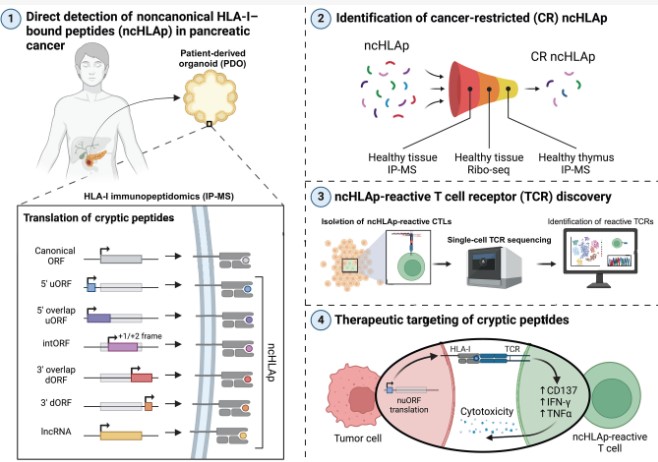
转载本文请联系原作者获取授权,同时请注明本文来自阎影科学网博客。
链接地址:https://wap.sciencenet.cn/blog-3302154-1485227.html?mobile=1
收藏

