博文
Cell Biomaterials----可植入可3D打印的生物水凝胶电池
||
Cell Biomaterials----可植入可3D打印的生物水凝胶电池
【背景】下一代生物电子设备对电源的需求,不仅在于能量供给,更在于与生命系统的深度协同。然而,传统电池虽然在工程性能上已接近极限,却因刚性结构、潜在毒性和持久残留等问题,难以适应人体柔性且动态的微环境。当前的核心挑战在于如何实现体内稳定电流输出的同时兼具生物降解性与功能持久性。
为此,EFL团队提出了一种新型电池构建策略:生物水凝胶电池 (Bio Hydrogel Battery, BHB),该电池由具备优异生物相容性的水凝胶与金属纳米颗粒协同组装而成,其力学性能与软组织高度匹配,可在组织再生过程中提供0.001–1 mA的微电流,并在心脏起搏等高负荷应用中稳定输出1–6 mA的大电流。通过灵活的调控设计,BHB展现出对生理需求的动态响应性与高精确性。这一体系巧妙地将可降解性与功能稳定性统一, BHB为柔性植入式智能设备开辟了全新路径。
相关工作以“A biohydrogel battery”为题,发表于Cell子刊《Cell Biomaterials》。浙江大学贺永教授,吴梦婕教授和尹俊研究员为通讯作者,浙江大学机械工程学院孔维程博士生、原禧敏博后,浙江大学医学院陈宏裕博士生、傅涛博士后为共同一作。
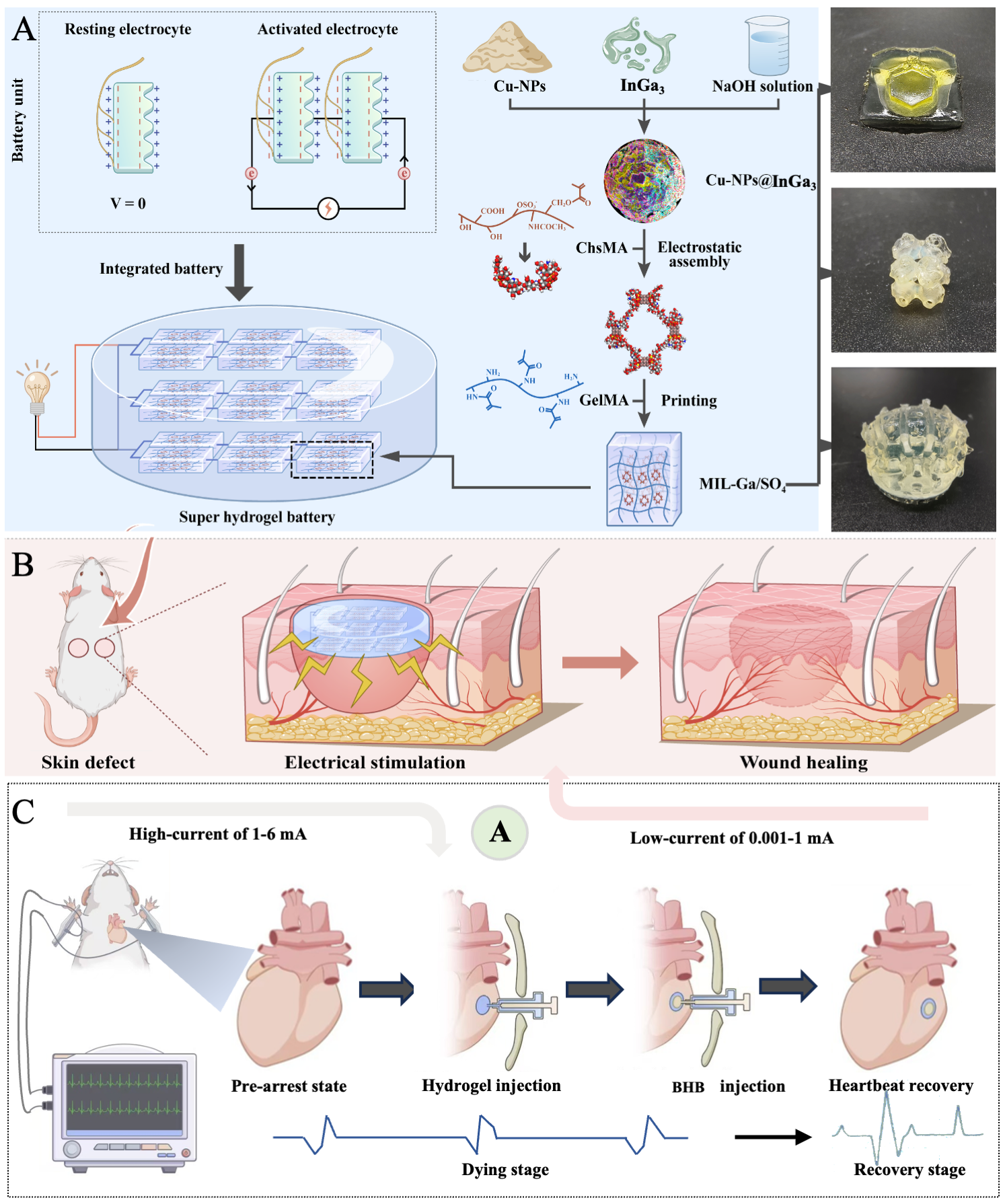
1 BHB的设计与制造
该研究设计并制备了一种新型生物水凝胶电池(BHB)。其核心结构由液态金属(LM)电极与水凝胶电解质构成,LM电极在水凝胶中均匀分散,形成稳定的电极–电解质界面,并通过串并联结构实现电压放大与电流增强。LM电极通过在NaOH溶液中对Cu纳米颗粒与InGa₃进行超声烧结获得,所得带正电的InGa₃–Cu–NPs与带负电的ChsMA–GelMA共聚物自组装,并经光聚合固定在水凝胶网络中,形成具备结构完整性的电源单元。进一步结合光固化–3D打印技术,可实现25 μm精度的复杂构型,如肝组织单元、TPMS结构及软骨–骨界面构建。该BHB具备双模式电流输出:微电流(0.001–1 mA)用于促进皮肤组织再生,高电流(1–6 mA)可驱动心脏起搏,展现出在先进生物电子学中的广阔应用潜力。
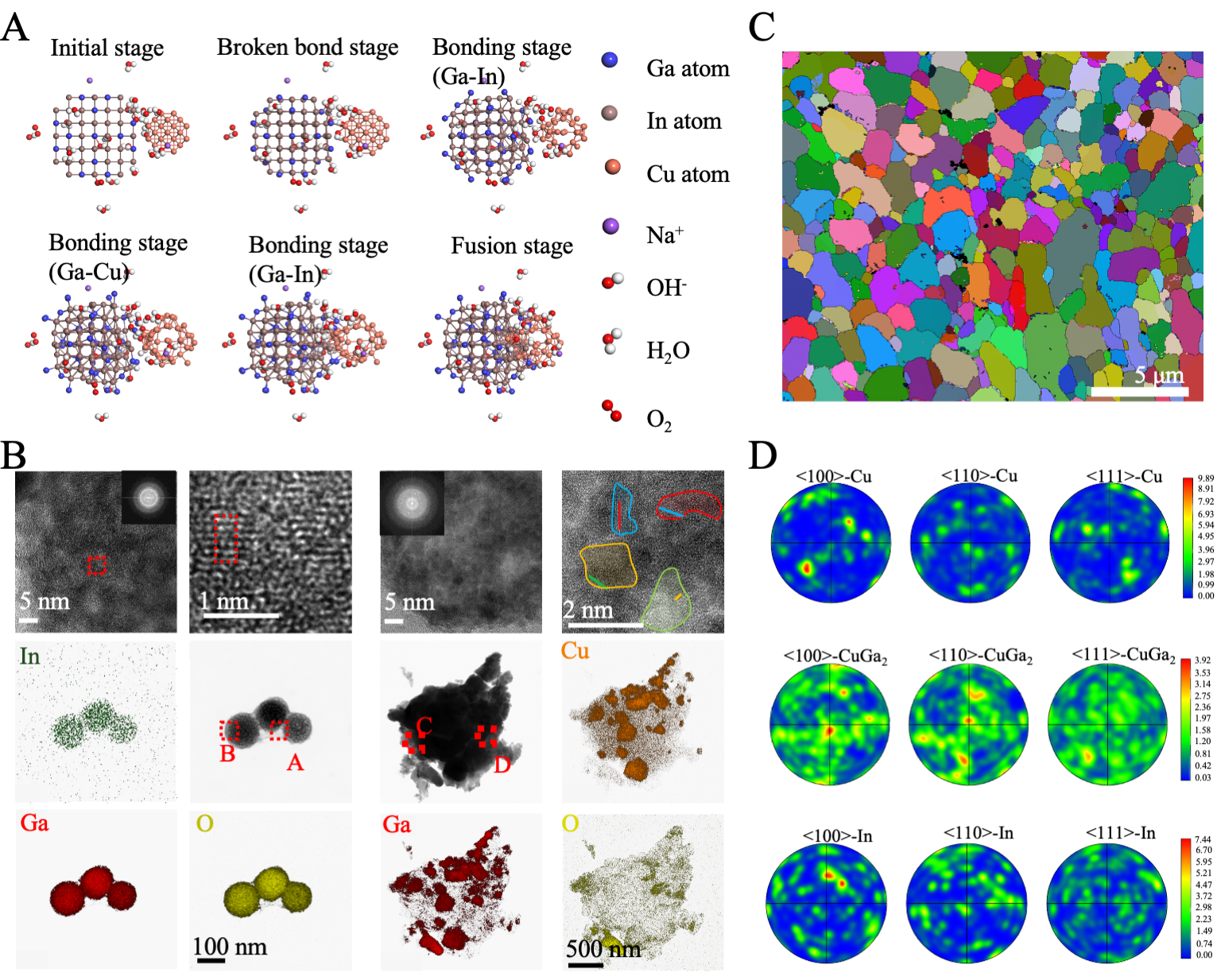
2 BHB的纳米结构
在BHB中,Cu纳米颗粒与InGa3在NaOH溶液中发生化学蚀刻与键合反应,经历了从Ga–In键断裂、Ga–Cu键形成到最终融合的六阶段过程,形成了InGa3与Ga2Cu的纳米嵌入结构。TEM及EDS表征显示,纯InGa3表面形成氧化膜,而InGa3–Cu–NPs则表现出Ga、In、Cu富集区域,对应InxGay和GaxCuy新相的生成。其典型结构为InGa3核与Ga2O3壳的核–壳形貌,壳层呈致密陶瓷状,具优异力学性能。高分辨TEM揭示了GaxCuy具有良好的FCC晶体结构,而InxGay为BCC结构,晶体质量略低。XPS映射和光谱证实Cu的引入提高了元素分布的均匀性和材料密度。XRD与EBSD进一步表明,在蚀刻作用下形成了晶粒细化的CuGa2相,缺陷更少,结构更稳定,为电化学性能的提升奠定了基础。
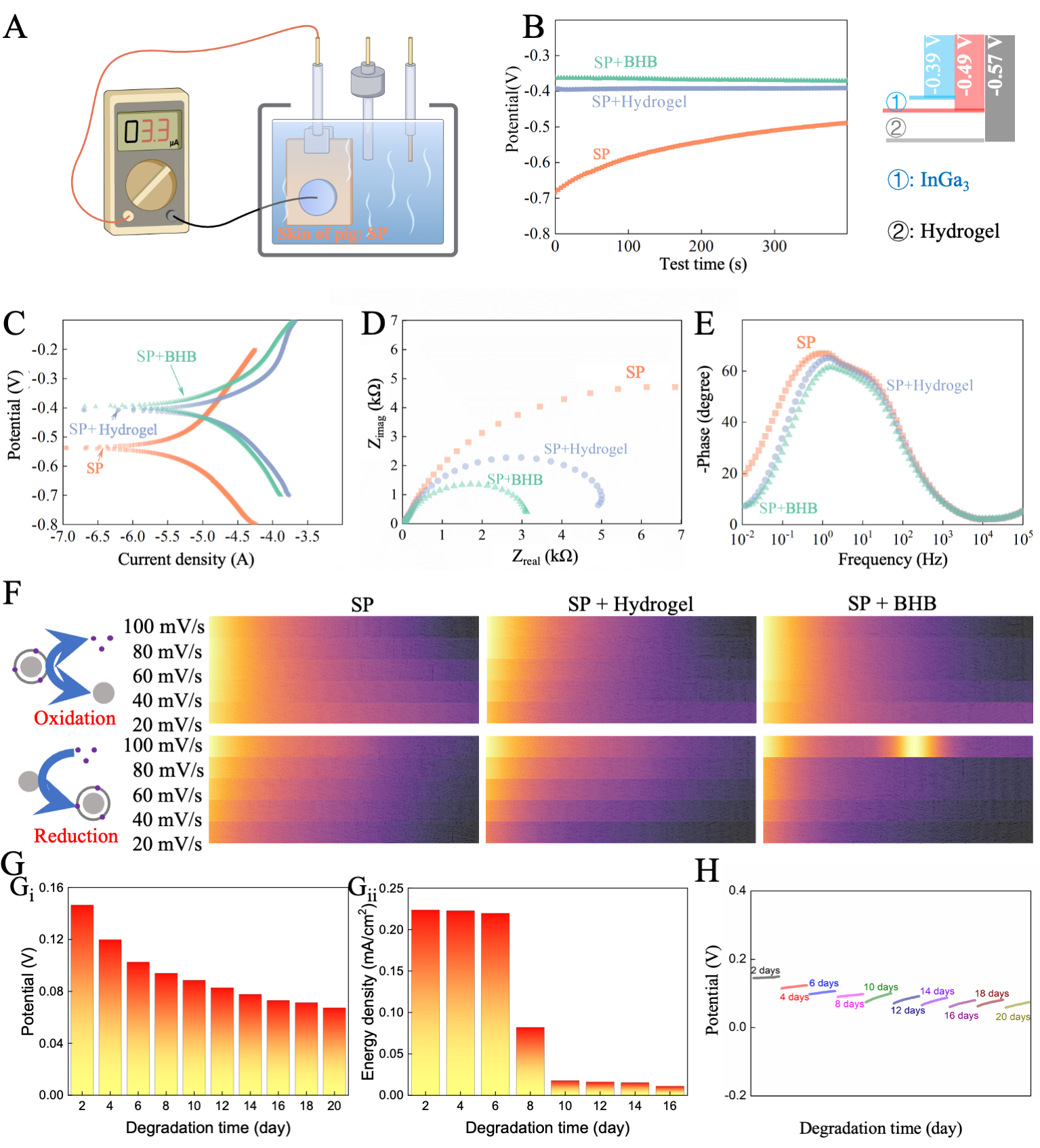
3 BHB的电化学性能
电化学性能测试表明,光固化打印制备的BHB可在组织表面释放微弱电流(0.0033 mA),并在猪皮肤模型中实现稳定电输出。开路电位(OCP)和极化曲线分析显示,BHB较水凝胶具有更低的电荷转移阻抗(Rct),体现出更优的离子扩散与电荷传输能力。循环伏安(CV)结果揭示,InGa₃–Cu–NPs赋予BHB更强的氧化还原活性与电流响应。随体外降解进行,BHB在前10天可维持336 mA·h的容量,能量密度在第10天前保持基本稳定,20天后因水凝胶完全降解而电流骤降。长期电化学阻抗谱(EIS)进一步确认,BHB在降解过程中依然保持较好的电化学稳定性。整体结果表明,BHB兼具稳定供电能力与可降解特性,为组织修复与植入电子提供了可靠电源。
4 BHB的组织再生性能
通过大鼠全层皮肤缺损模型验证了BHB的组织再生性能。结果显示,BHB贴片能显著加速创面闭合,3天和7天时创口面积明显小于对照组与单纯水凝胶组,14天后几乎完全愈合。组织学染色进一步证实,BHB组在早期表现出更多肉芽组织和更高胶原沉积,促进了更快的伤口收缩。对照的“BHB(绝缘线)”组仅表现轻微提升,说明加速修复的关键因素是电刺激而非单纯的结构支撑。体外与体内降解实验表明,BHB在16天内完全降解,释放的Cu、Ga、In离子浓度在10天后显著下降,无明显毒性残留。对主要脏器切片分析亦未发现金属离子沉积,证明其良好的生物安全性和可降解性。综上,BHB在伤口修复中兼具电刺激加速愈合与安全降解优势,具有潜力成为组织工程支架与植入电源。
5 BHB心脏治疗
研究进一步探索了BHB在急性心脏骤停中的应用潜力。BHB贴片可在高电流模式下驱动心脏起搏,通过ECG监测发现,其在大鼠模型中能在20秒内恢复部分心脏电活动,有效避免心脏完全停搏。为实现精准治疗,设计了双通道注射器,将BHB与水凝胶同步注入并光固化于心脏表面,保证与心肌组织的紧密结合。结果显示,BHB能够提供稳定电流,支持起搏器感知模块运行,部分恢复心肌去极化,但未能完全恢复窦性心律,心电波形仍存在不规则。相比商业起搏器,BHB在短期复苏中具有一定优势。其可降解特性适用于术后短期植入监测、心脏急救及可降解药物递送等场景。然而,受限于能量密度和电流分布不均,其在完全心律同步和长期治疗中的应用仍需优化。
5 结论
本研究提出的BHB具有良好的生物相容性与可降解性,单位面积功率达0.224 mW/cm2,且在体内外约20天内可完全降解。其在组织再生和心脏起搏领域展现出显著应用潜力,不仅能有效促进组织修复,还可部分恢复心脏电活动。然而,BHB在完全恢复正常窦性心律方面仍需进一步优化电学性能,并结合其他治疗手段。未来研究将聚焦于在更复杂模型中的性能提升,评估其长期疗效与临床可行性。
https://wap.sciencenet.cn/blog-2159320-1500921.html
上一篇:Cell Biomat:AI赋能生物电子加速感染性创伤愈合
下一篇:AM:3D打印通过电化学分子锁构建用于组织再生的梯度仿生支架