博文
Cell Biomat:AI赋能生物电子加速感染性创伤愈合
||
Cell Biomat:AI赋能生物电子加速感染性创伤愈合
2025年9月1日,浙江大学贺永教授团队与浙大医学院附属口腔医院俞梦飞研究员团队联合在Cell子刊Cell Biomaterials上发表了题为“AI feedback bioelectronics promote infectious wound healing”的最新研究。他们提出"AI融合的再生修复智能闭环系统"这一理念,首次将人工智能、生物电子与组织再生进行有机融合,实现创面修复过程的监测-分析-干预的全闭环管理。该系统通过AI监控并诊断组织再生状态,动态优化生物电子敷料的电刺激参数,从而达成创伤的"修复-调控-再修复"闭环体系。未来的组织再生过程也能像自动驾驶的汽车一样,实时根据创伤状态智能调整治疗方案。
文章亮点:
(1)首次实现AI与再生型生物电子的深度融合,AI作为组织再生与修复过程的反馈调控核心,提升治疗的智能化水平;
(2)通过对生物电子的智能调控,构建从抗菌防御到组织修复的全程精准干预系统,开创高效、精准的创面治疗新策略;
(3)显著优化创面治疗流程,提升治疗效率,同时降低传统治疗的操作复杂性,实现治疗过程的标准化与智能化。
文章简介
从治疗策略层面看,复杂和难愈性创面的修复依赖于对创面微环境的精准干预与持续管理。创面微环境是一个动态且高度复杂的体系,涉及炎症反应、细胞迁移及组织再生等多种过程,其时空变化直接决定了修复效果。一个重要的科学问题是如何实现对这一复杂微环境的实时监测与系统性调控?然而,传统治疗手段缺乏动态监测能力,且在微环境的多因素调控上存在明显不足,导致疗效受限,难以满足复杂创面管理的需求。
浙江大学贺永教授带领的 EFL 团队多年来一直致力于组织工程领域的研究工作。团队重点关注通过构建仿生结构和智能调控细胞微环境来推动组织修复与再生。在相关研究中,他们提出并验证了多项具有代表性的成果,例如:提出器官尺度打印生物墨水体系设计方法(Nat Proc. 2025);利用仿生气管样结构提升兔气管缺损模型的存活率 (Sci Transl Med. 2023;15(714));通过微针贴片增强组织表面黏附并实现主动药物递送 (Sci Adv. 2023;9(25));开发可用于原位修复的“生物混凝土”型组织工程支架 (Nat Commun. 2022;13(1));以及基于可降解支架实现的微创软组织修复 (Nat Commun. 2024;15(1))。此外,团队也在探索面向生命科学研究与临床应用的多样化细胞微环境构建策略,包括基于高分辨率投影的复杂微环境调控 (Nat Rev Bioeng. 2024)、高细胞比例液体支架体系 (Adv. Mater. 2024)、以及无需去除支架、基于多细胞悬浮液的三维微环境构建 (Adv. Mater. 2024)。这些研究成果不仅推动了组织工程的理论发展,也为临床转化提供了切实可行的新路径。
在本研究中,浙江大学贺永教授团队与浙大医学院附属口腔医院俞梦飞研究员团队提出了一种将再生生物电子与人工智能(AI)相融合的创新策略。在该体系中,AI 作为组织再生信号的反馈模块,兼具促进组织修复与智能响应的双重功能。在感染早期,生物电子装置通过高电流刺激触发液态金属释放高剂量镓离子,从而实现快速且高效的广谱抗菌作用;在愈合后期,AI 技术使装置能够根据创面状态自适应调控镓离子释放,显著加速组织再生与修复。该闭环治疗平台实现了对复杂创面的全程管理,不仅显著提升了现有创面护理的疗效,还开创了智能化愈合的新范式,标志着人工智能与再生生物电子及组织工程深度融合的重要突破(图1)。
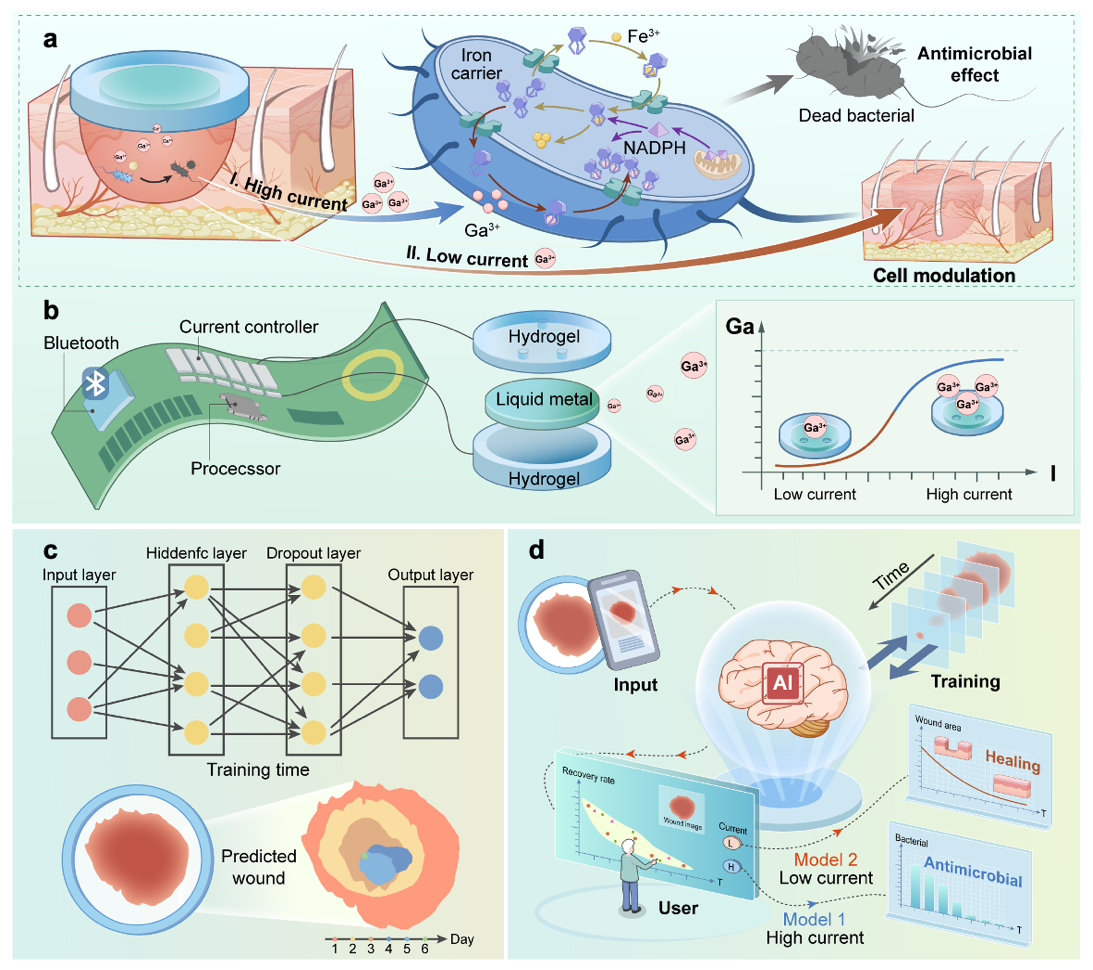
图 1. AI再生型生物电子设计
本团队在材料研究方面引入单宁酸(TA)优化复合水凝胶性能。结果表明,TA 的加入可降低孔隙率、增强力学强度与黏附性,并赋予材料优异的形状适应性。机理研究显示,TA 提升了水凝胶的黏弹性和分子间作用力,从而显著提高了其结构稳定性与应用潜力(图2)。体外实验表明,柔性生物电子贴片在 4 mA 电流刺激下可显著杀灭金黄色葡萄球菌和大肠杆菌,并抑制生物膜形成。低含量 TA 或低电流下无明显抗菌效果,SEM 与 Ga³⁺释放曲线一致,说明贴片在电流驱动下具有优异的抗菌性能(图3)。液态金属通过电刺激释放 Ga³⁺,在细菌体内与铁载体蛋白形成(-C-O)-Ga 配位结构,阻碍 NADPH 蛋白分解,使细菌无法获取必需的铁元素,最终导致细胞死亡。TEM 与 HRTEM 观察显示,Ga³⁺在细菌内形成掺杂颗粒,并与铁载体蛋白协同作用增强结晶性。量子力学计算进一步验证了(-C-O)-Ga 对 NADPH 蛋白的抗还原能力,揭示了液态金属的核心抗菌机制(图4)。柔性贴片在低电流刺激下对人角质形成细胞(HACAT)和人静脉内皮细胞(HUVEC)表现出良好的生物相容性,并显著促进细胞迁移,有利于伤口愈合。与此同时,低电流条件还能调控巨噬细胞炎症反应,抑制促炎基因表达并提升抗炎基因水平。通过阶段性调控电流强度,贴片兼具抗菌与组织修复功能,展现出广阔的临床应用潜力(图5)。在小鼠感染性创伤模型中,Hydrogel+EGaInE贴片显著加速创面愈合,14天闭合率达95.8%,高于其他对照组。组织学分析显示,该组创口免疫细胞浸润减少、胶原纤维密度增加,且CD31染色表明血管新生明显增强。与此同时,贴片有效调控炎症反应,降低促炎因子水平并提升抗炎因子表达,促进组织再生与创面修复(图6)。

图 2. 水凝胶的机械性能。
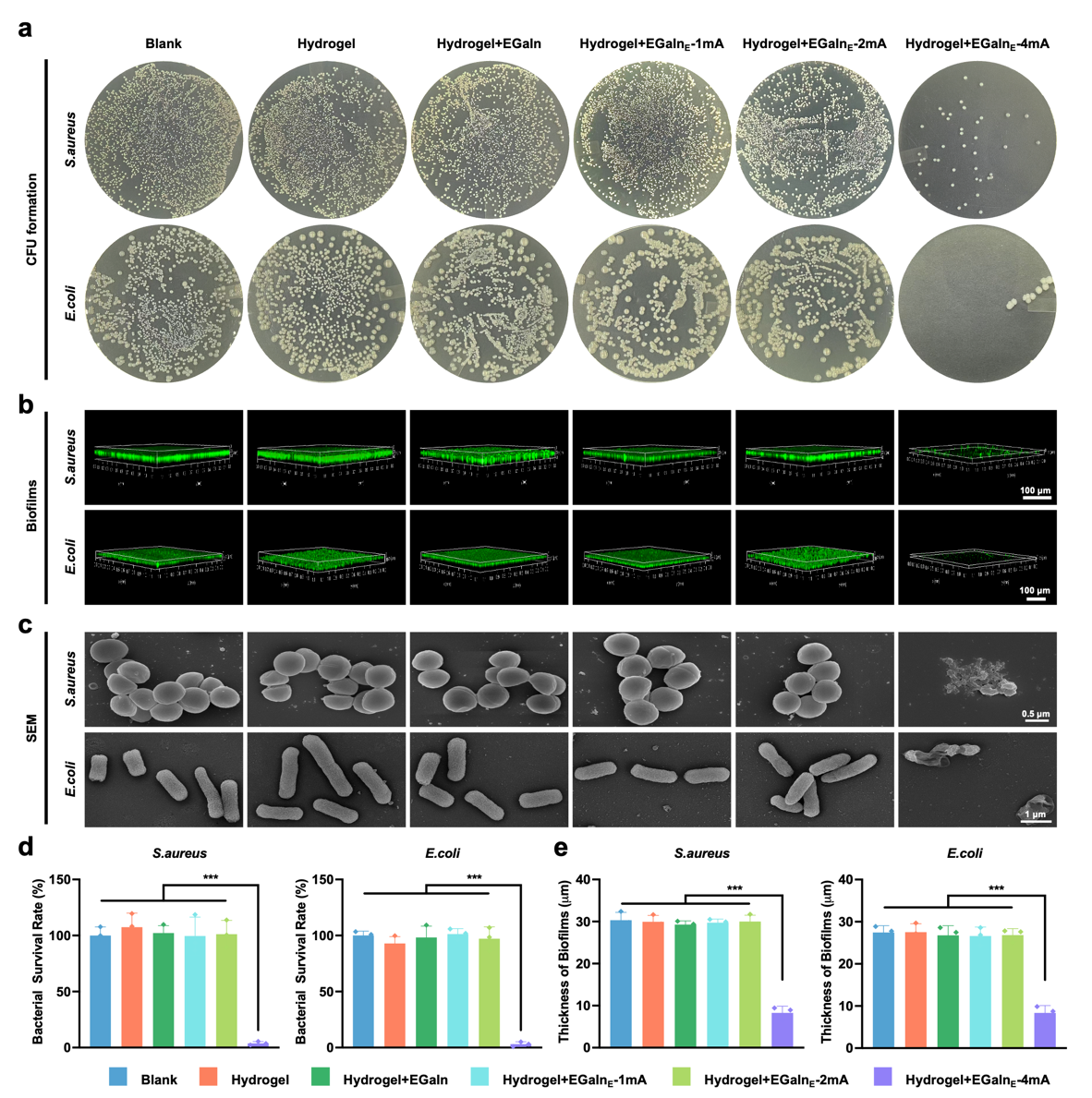
图 3. 柔性贴片的抗菌性能。
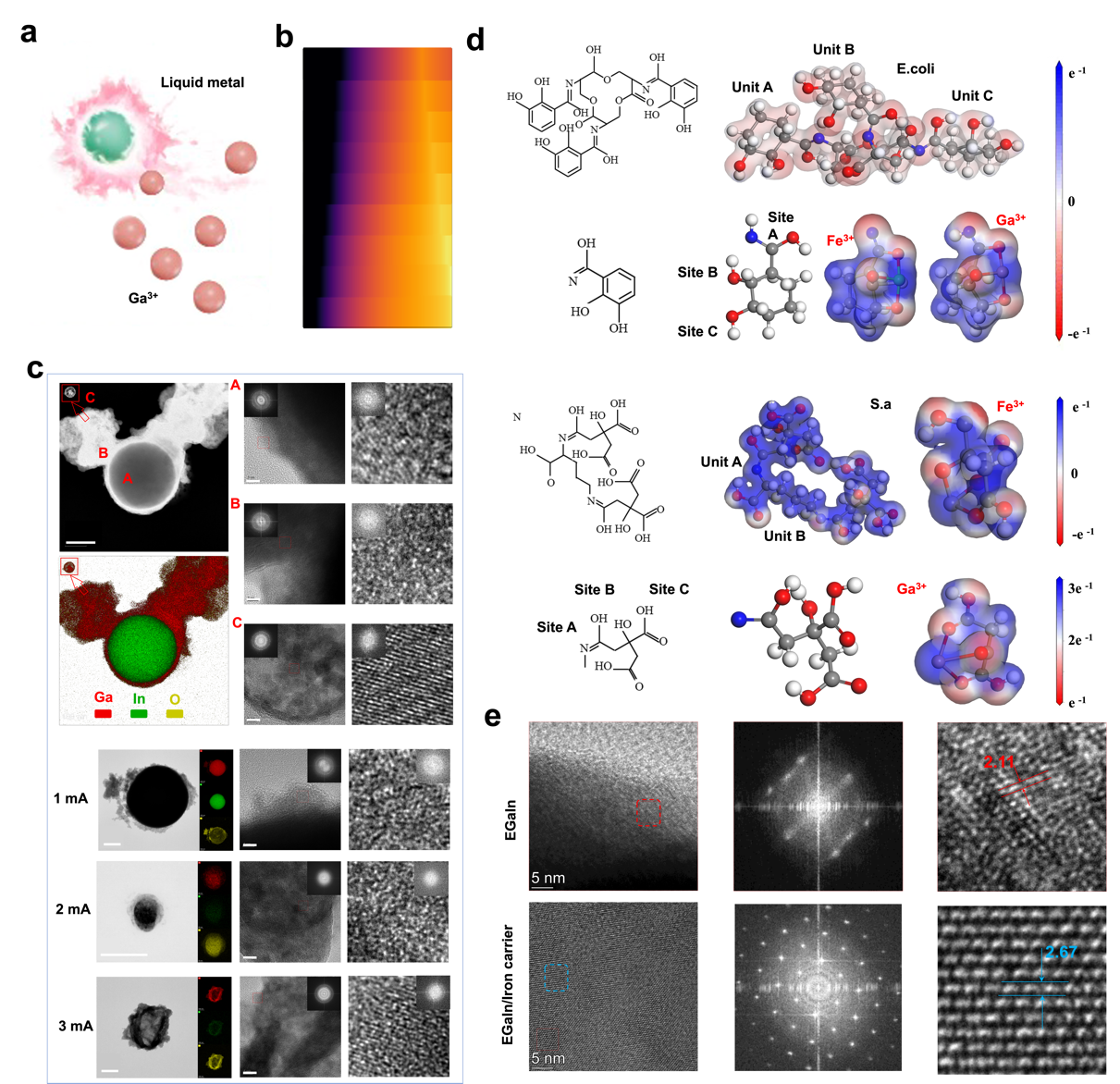
图 4. 抗菌机理。
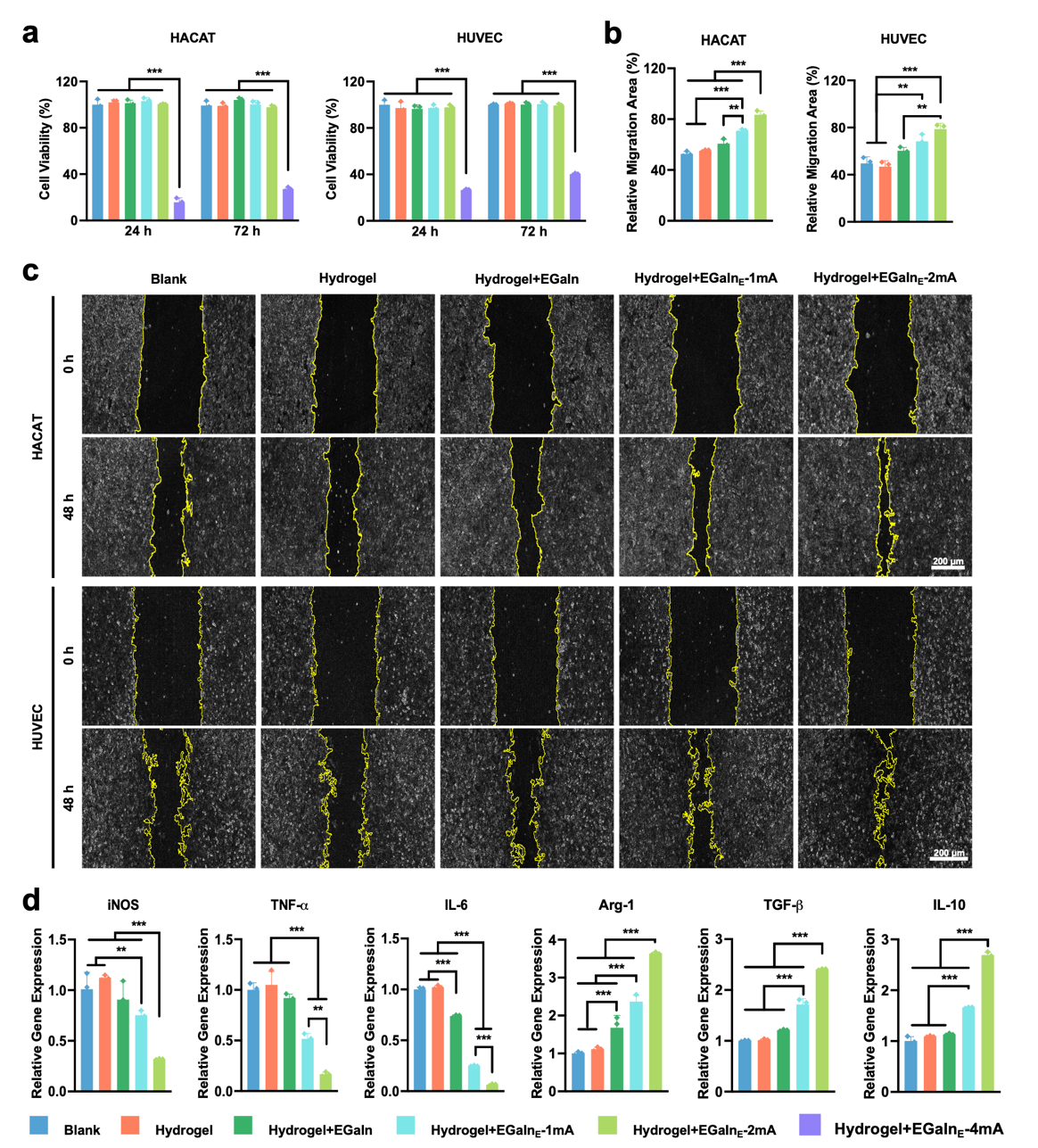
图5. 细胞迁移影响。

图 6.体内创面愈合性能。
总体而言,通过对创伤愈合过程的14天跟踪结果可见,给予柔性贴片可控电刺激的治疗手段在促进伤口愈合方面显著优于其他对照组。这种治疗效果可归因于以下几个协同机制:(1) 水凝胶可吸收多余的渗出液和血清,促进皮肤呼吸,有助于创伤修复;(2)在高电流刺激下,产生较高浓度的Ga³⁺。尽管高浓度Ga³⁺在体外会抑制正常细胞活性,但感染部位的细菌增殖速度远快于正常细胞,因而更快更大量地吸收并利用Ga³⁺。Ga³⁺被细菌误识为Fe³⁺从而被摄入,导致代谢错误并引发细菌死亡;(3)在低电流刺激下,产生较低浓度的Ga³⁺,此时能够促进细胞迁移、抑制炎症,最终加速创伤愈合进程。
本研究展示了人工智能在伤口愈合监测与管理中的应用,整合了深度学习、多尺度注意力模块(MSA)及动态监测与干预功能(图7)。系统通过摄像设备获取高分辨伤口图像,卷积网络提取局部与全局特征,MSA模块关注关键区域并生成预测性的愈合特征图,直观展示面积变化和愈合分布。结合卷积与上采样操作,网络捕捉伤口长期和大尺度变化,为个性化治疗提供精准数据支持。通过追踪愈合曲线并建立标准化愈合模型,系统可识别异常愈合并触发干预策略,实现伤口愈合的实时监测与优化。训练过程中,模型性能指标稳步提升并趋于稳定,表明其具备良好的稳健性与泛化能力。
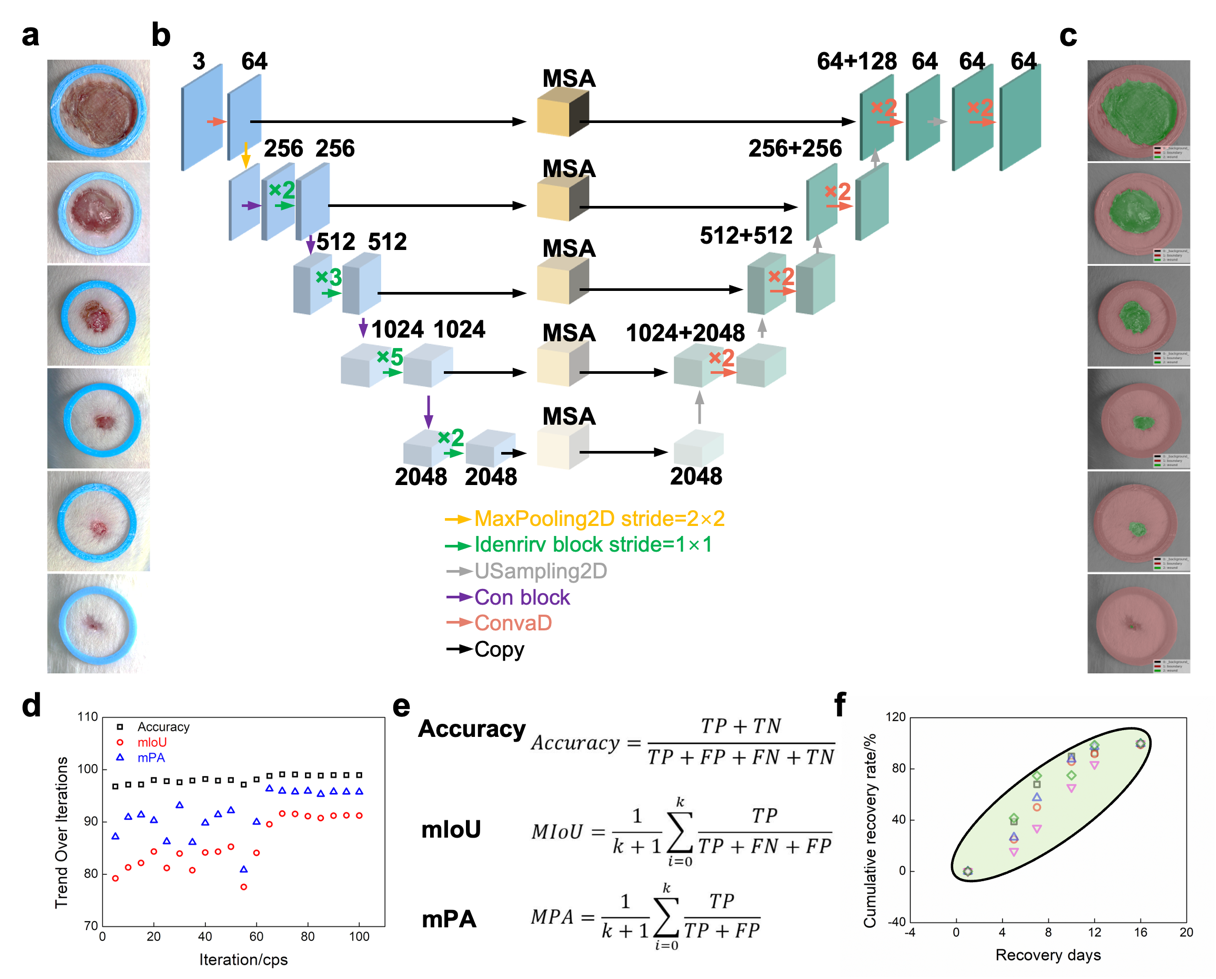
图 7. AI系统。
目前伤口管理研究虽广泛,但多数缺乏实际应用且未实现商业化。本研究制备的智能柔性贴片制备简单、易于规模化生产,利用光固化3D打印实现水凝胶基底的批量打印,添加液态金属后即可组装使用(图8)。压缩测试表明器件在10,000次最大应变50%的循环中具有优异抗疲劳性能。通过AI反馈控制,系统在感染伤口模型中实现个性化精准治疗,有效促进愈合,同时对主要器官的组织学分析显示良好的生物安全性。
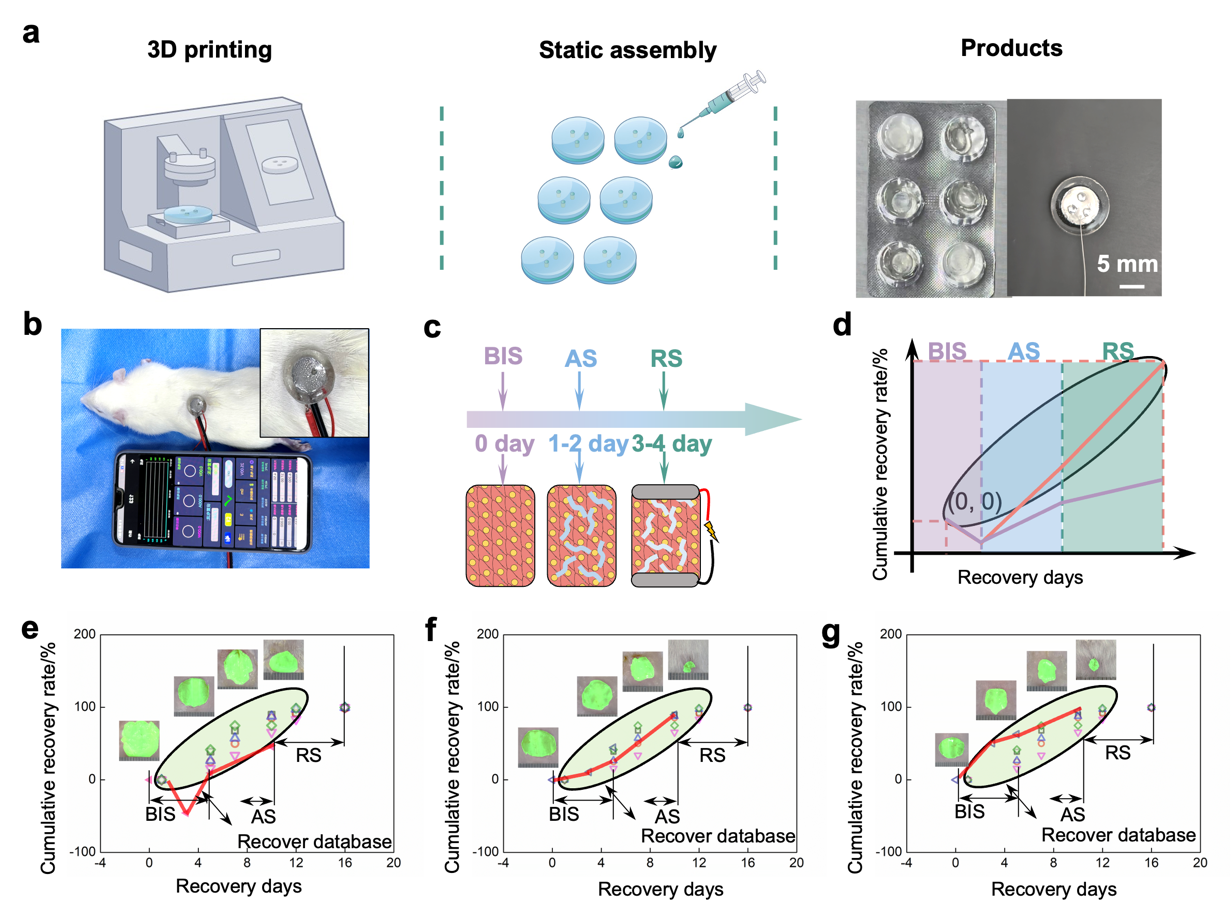
图 8. 应用展示
https://wap.sciencenet.cn/blog-2159320-1500248.html
上一篇:Nature Protocols:器官尺度打印生物墨水体系设计
下一篇:Cell Biomaterials----可植入可3D打印的生物水凝胶电池