博文
[转载]铁:人体与微生物的“平衡大师”——揭秘铁在健康与疾病中的双重角色
||
铁是地球上几乎所有生命形式包括人体与微生物不可或缺的微量元素。它不仅支撑着人类的呼吸、免疫和能量代谢,更是肠道微生物争夺的“战略资源”。铁稳态的破坏与肠道菌群失调和多种疾病的发展密切相关。
然而科学家发现,铁在人体与微生物之间也是一把双刃剑:它既能维持生命,也可能通过氧化应激引发DNA损伤和疾病。过量的铁主要通过芬顿反应产生有害的氧化应激,导致DNA、蛋白质和脂质等大分子损伤。因此,人体细胞和微生物系统的铁水平受到复杂机制的严格管控,以维持体内平衡。铁失调可以作为多种人类疾病的原因和结果。更微妙的是,人体与肠道微生物之间围绕铁的“争夺战”,直接决定了我们的健康与疾病状态。
肠道菌群是铁稳态和宿主健康的关键参与者,肠道中未吸收的膳食铁会影响肠道微生物群的组成。铁稳态的破坏可以引发肠道微生态的失调,从而影响宿主的的生理和免疫系统。
近年来,《自然·微生物学》等顶级期刊的研究揭示,铁的动态平衡不仅影响贫血或感染,还与炎症性肠病、癌症等慢性病密切相关。肠道微生物群的组成和功能,甚至药物疗效,都可能被铁的波动彻底改变。本文将从铁的核心作用出发,解析宿主、微生物与铁之间的复杂博弈,并探讨如何通过精准调控铁代谢实现个性化健康管理。
铁的基础生物学——为何所有生命都需要它?1. 铁的生理功能
铁是血红蛋白和肌红蛋白的核心成分,负责氧气的运输与储存;它也是细胞色素和铁硫簇蛋白的辅因子,参与能量代谢(ATP生成)和DNA合成。人体每天需要约20-25毫克铁,但仅1-2毫克通过肠道吸收,其余来自红细胞回收。
膳食铁分为两类:血红素铁和非血红素铁。
一般来说,血红素铁的生物利用度高于非血红素铁。这是因为,非血红素铁与各种饮食成分复合摄入,抑制其在十二指肠的吸收。虽然铁的还原亚铁形式(Fe2+)是可溶性的能被人类吸收和利用,但亚铁在生理pH值和有氧条件下被氧化为不溶性的三价铁形式(Fe3+)。因此,最常见改善机制是降低环境pH值为酸性条件或通过微生物代谢产物,来改善非血红素铁的溶解度和生物利用率。
2. 铁的毒性风险
游离铁通过芬顿反应(Fenton Reaction)产生活性氧(ROS),攻击脂质、蛋白质和DNA。有研究表明,活性氧水平升高可导致衰老加速,呼吸道和心血管疾病、IBD和癌症的风险增加。总之,这一临床证据突出了维持铁稳态对整体健康的关键作用。
注:芬顿反应是一种基于亚铁离子(Fe²⁺)催化过氧化氢(H₂O₂)产生羟基自由基(•OH)的高级氧化过程,具有极强的氧化能力,广泛应用于环境治理、有机污染物降解等领域。
3. 铁的调控系统
为了维持铁稳态,人体进化出严密的铁调控系统:
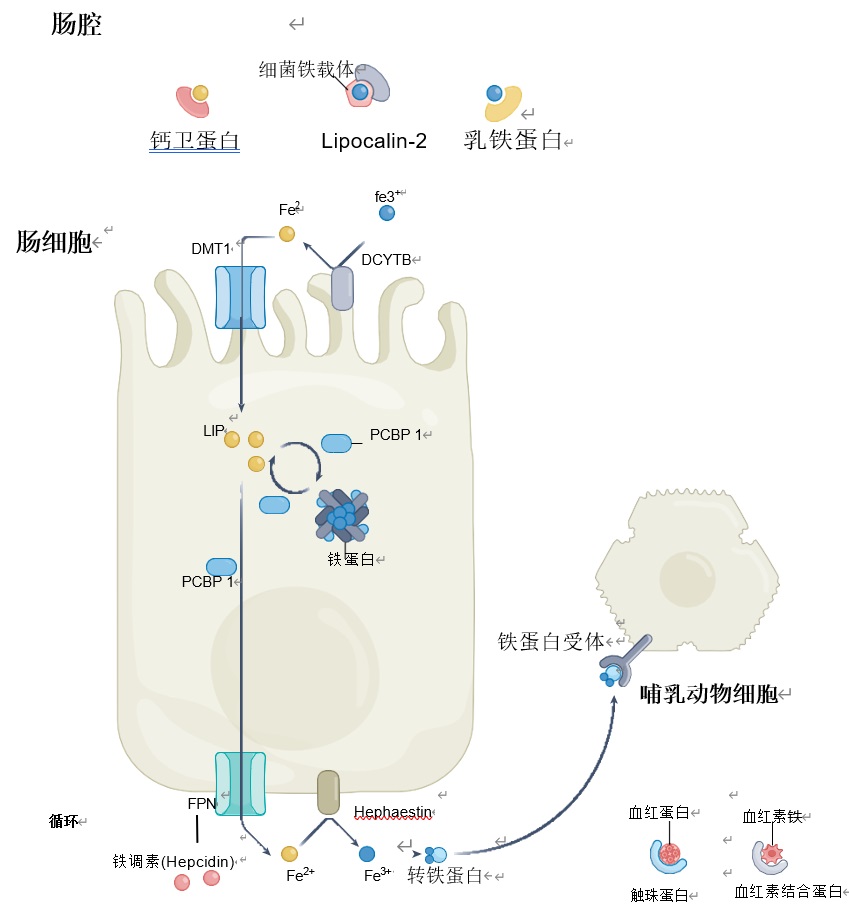
铁吸收:人类通过饮食获得铁,主要在十二指肠吸收。十二指肠细胞通过DMT1蛋白(Divalent Metal Transporter 1)吸收非血红素铁(图1),而血红素铁的摄入机制目前尚未有完全明确研究报道。
铁运输:铁转运蛋白Fpn(Ferroportin)将铁输出到血液,循环铁与转铁蛋白Fpn相结合,然后铁-转铁蛋白复合物可以在需要时被宿主细胞运往全身。
铁储存:多余的铁被封存在铁蛋白(Ferritin)中供以后使用。
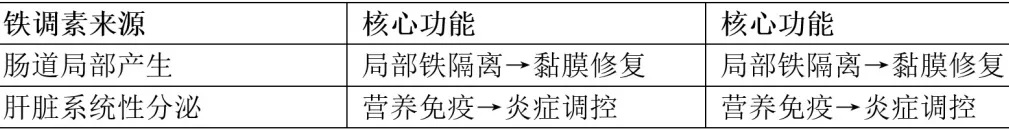
铁调控:人体全身铁稳态由Fpn抑制剂“铁调素”(Hepcidin)动态调节,hepcidin主要由肝细胞合成。当体内铁过量时,它会锁住铁转运蛋白,阻止铁吸收和释放。事实上,慢性铁调素过表达导致铁限制宿主红细胞生成,称为炎症性贫血;而慢性铁调素缺乏导致病理性铁超载。
图1人类的铁调节
doi.org/10.1038/s41564-025-02001-y
宿主与微生物的铁争夺战
1.宿主的防御策略:营养免疫(Nutritional Immunity)
在急性感染期间,病原体急需铁在宿主内增殖。因此,严格的监管机制,以限制铁的可用性有助于防止感染性疾病的发展。这种宿主防御策略通过调节铁转运蛋白和铁螯合蛋白来执行,被称为“营养免疫”。
铁调素:铁调素是营养免疫的关键,当感染引发炎症因子IL-6,刺激肝脏分泌铁调素,抑制肠道铁吸收和巨噬细胞铁释放,降低血液铁浓度。
铁螯合蛋白:除了铁调素能调节铁的吸收和隔离外,上皮细胞和免疫细胞在感染过程中也会诱导分泌铁螯合蛋白质,如钙卫蛋白(Calprotectin)、脂质运载蛋白-2(Lipocalin-2)、血凝素(haemopexin)和触珠蛋白(haptoglobin)等通过结合游离铁或病原体的铁载体(Siderophore),阻断微生物的铁摄取。
案例:
脂质运载蛋白-2能捕获大肠杆菌的肠菌素(Enterobactin),但沙门氏菌通过分泌“隐形铁载体”沙门菌素(Salmochelin)逃逸这一机制,凸显了攻防的进化博弈。
2. 微生物的反击策略
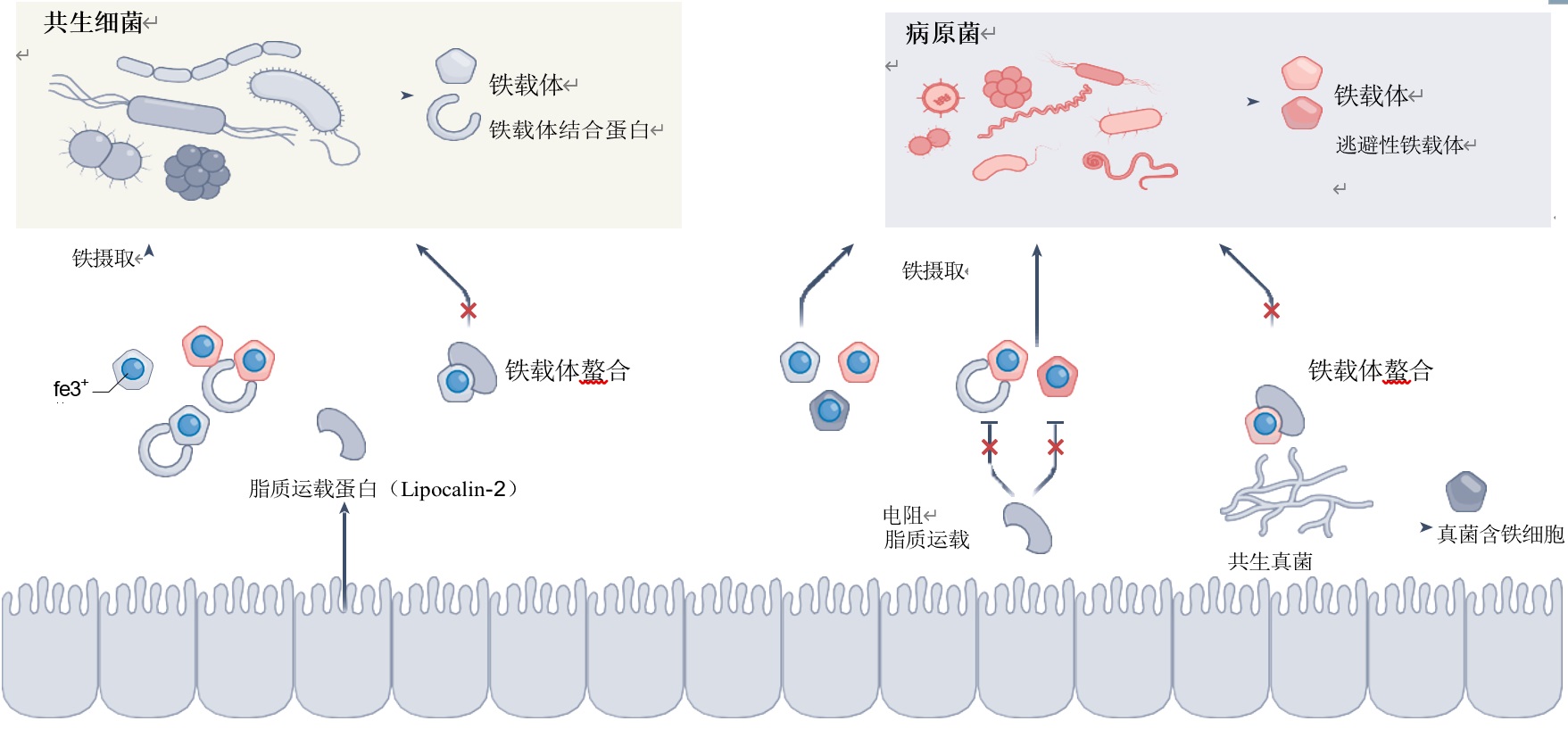
为了克服宿主组织内严重的铁缺乏,病原体已经演化出了各种铁获取机制。最突出的策略就是分泌小的铁螯合分子(铁载体):
铁载体(Siderophore):铁载体如肠杆菌素(enterobactin)、耶尔森氏杆菌素(yersiniabactin)和弧菌杆菌素(vibriobactin)可以从宿主铁结合分子中吸收铁,并且它们的同源受体内化铁结合成铁载体(图2)。
铁载体共享(Xenosiderophore Utilization):研究发现,人体肠道共生菌中存在一个庞大的铁载体相互作用网络。一项针对儿童的纵向分析表明:在个体肠道环境中,能够生产铁载体的细菌通常仅有少数几种;而吸收铁载体的系统在整个肠道菌群的微生物中普遍存在。这一现象揭示:肠道微生物间普遍存在着尚未被充分认知的社会性互动模式——微生物共同参与铁载体-铁复合物的吸收过程。其中,"盗铁者"会表达特异性受体,直接摄取其他菌群合成的铁结合载体(称为异源铁载体利用或铁载体盗取)。典型案例:致病性霍乱弧菌可利用共生大肠杆菌产生的肠杆菌素;沙门氏菌和耶尔森菌能捕获其自身无法合成的铁载体——铁氧胺(ferrioxamine); 沙门氏菌甚至可获取源自饮食或肠道共生真菌的真菌铁载体,显著增强其在肠道的致病定植能力。
肠道共生菌的铁获取机制:非致病性共生菌的铁获取系统在细菌存活和营养免疫调节中扮演关键角色。例如肠道共生菌多形拟杆菌(Bacteroides thetaiotaomicron)通过一种特殊蛋白XusB直接捕获异源铁载体获取铁元素,而无需自身合成铁载体。这种高效策略使其能在肠道炎症引发的铁匮乏环境中持续生存。XusB蛋白既能保护铁载体免受宿主免疫蛋白脂质运载蛋白-2(lipocalin-2)的捕获,却又可能被沙门氏菌二次劫持,形成复杂的铁元素争夺链。
铁竞争机制:共生菌与病原体对铁资源的直接竞争,是影响感染性疾病发展的关键因素。大肠杆菌Nissle 1917通过分泌抗脂质运载蛋白-2的铁载体,在铁竞争中压制鼠伤寒沙门氏菌,显著降低其定植能力,从而发挥益生特性。在铁受限环境中,该菌分泌的微球菌素可有效抑制肠杆菌科(包含竞争性共生菌、条件致病菌和病原体)的扩张。
"特洛伊木马"机制:在微生物世界中,铁元素是生死攸关的战略资源。除了简单的合作与竞争,某些细菌甚至进化出了"特洛伊木马"机制——肠病原体假结核耶尔森菌(Yersinia pseudotuberculosis)便是个中高手。它分泌一种名为TepC的双功能蛋白,既是VI型分泌系统的效应蛋白,又能同时充当蛋白质铁载体和DNA毒素。TepC的杀伤逻辑堪称精妙:当"作弊者"细菌(那些盗用TepC受体却不生产解毒抗毒素的菌株)试图窃取铁资源时,TepC便会激活其DNA毒素功能,精准剿灭这些投机者。这种机制赋予病原体显著的竞争优势,可广泛抑制铁载体作弊菌的增殖。
非铁载体途径:除铁载体外,微生物还有两大夺铁"黑科技":细菌和真菌病原体可直接摄取宿主血红素中的铁(如艰难梭菌)。或利用FeoB蛋白摄取二价铁,广泛存在于放线菌、厚壁菌、拟杆菌等关键微生物群中。
图2 细菌在肠道中获取铁的策略
doi.org/10.1038/s41564-025-02001-y
肠道微生物——铁代谢的隐形调控者
1. 微生物代谢物如何影响铁吸收
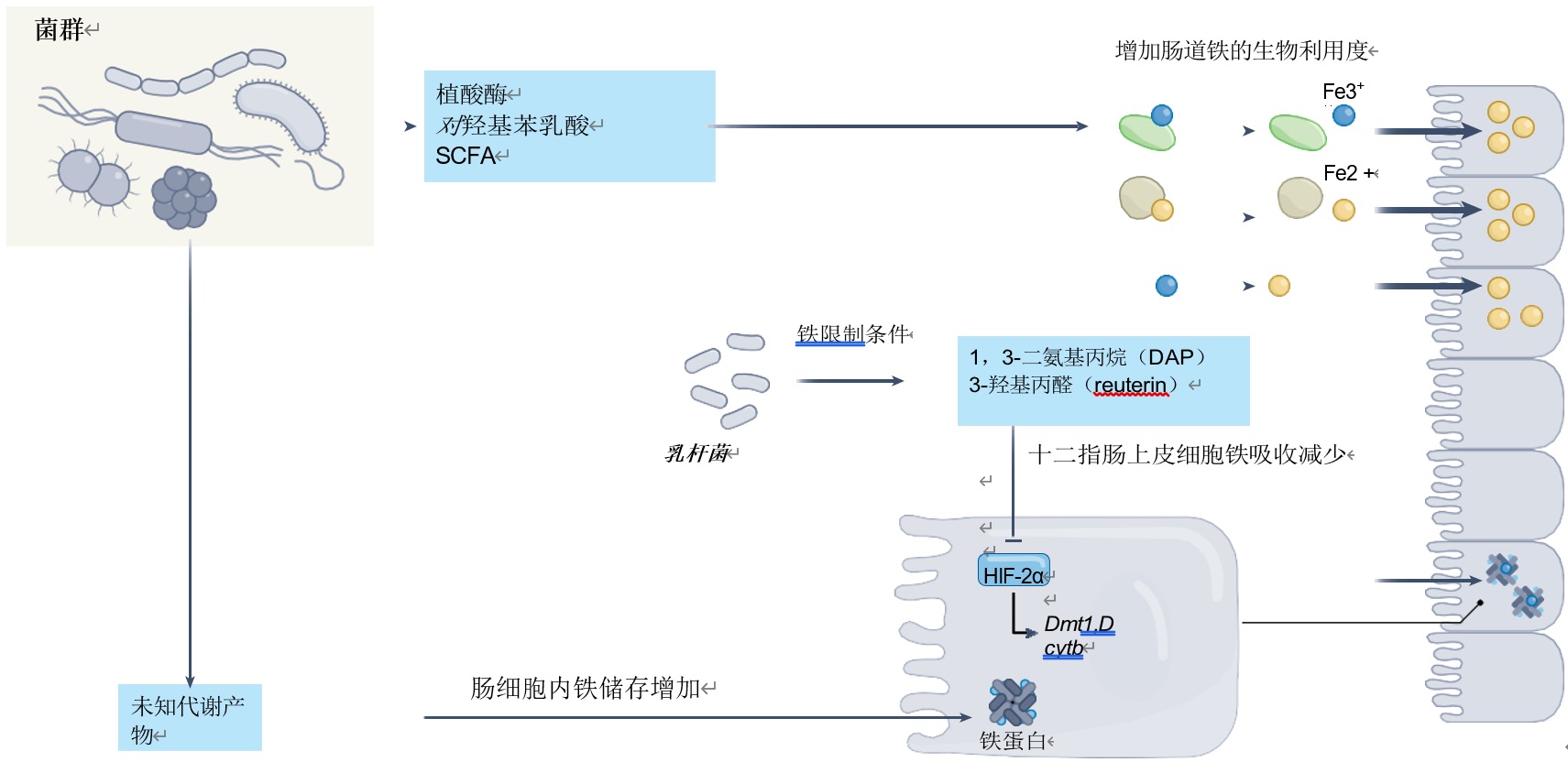
肠道微生物通过分泌一系列酶和代谢副产物,这些酶和代谢副产物可以提高或限制膳食铁的利用率,从而影响铁的吸收。
促进吸收:一些共生细菌,如大肠杆菌等分泌植酸酶,分解铁螯合剂植酸盐,释放非血红素铁(图3);发酵乳杆菌产生 p-羟基苯基乳酸,将三价铁(Fe³⁺)还原为更易吸收的二价铁(Fe²⁺);短链脂肪酸(SCFAs)降低肠道pH值,提升铁溶解度。高纤维饮食通过增加丁酸、戊酸等SCFAs提高铁吸收率。
抑制吸收:嗜热双歧杆菌在细胞膜结合游离铁,降低铁生物利用度;乳酸菌产生的1,3-二氨基丙烷(DAP)和3-羟基丙醛(Reuterin)抑制低氧诱导因子HIF-2α,减少肠道铁吸收基因(如DMT1)的表达。
临床意义:高纤维饮食通过增加SCFA改善缺铁性贫血,而长期使用质子泵抑制剂(PPI)因抑制胃酸,可能加剧铁缺乏和肠道菌群失调。
图3 微生物衍生代谢物调节宿主铁吸收
doi.org/10.1038/s41564-025-02001-y
2. 微生物群落结构的铁依赖性
缺铁环境:乳杆菌、双歧杆菌等有益菌能在低铁条件下存活,而大肠杆菌、沙门氏菌等病原菌因依赖铁载体而受抑制。铁水平通过调节菌群竞争格局直接影响微生态平衡(图4)。
高铁环境:口服铁剂作为缺铁性贫血的首选疗法,却在动物、人类研究中显现副作用:变形菌门(Proteobacteria)激增、双歧杆菌锐减、肠道炎症易感性升高。
虽然缺铁和铁过量都有风险的记录,但重度缺铁会不可逆地降低微生物的多样性和丰富度,削减宿主健康所需的代谢物(如短链脂肪酸SCFA)。
典型表现为:产SCFA菌(厚壁菌门、罗氏菌属/直肠真杆菌)比例下降;SCFA合成相关基因表达受抑,由于SCFA具备抗炎特性,菌群代谢衰减可能放大缺铁引发的炎症。
图4 铁失调和微生物群失调相关的人类疾病
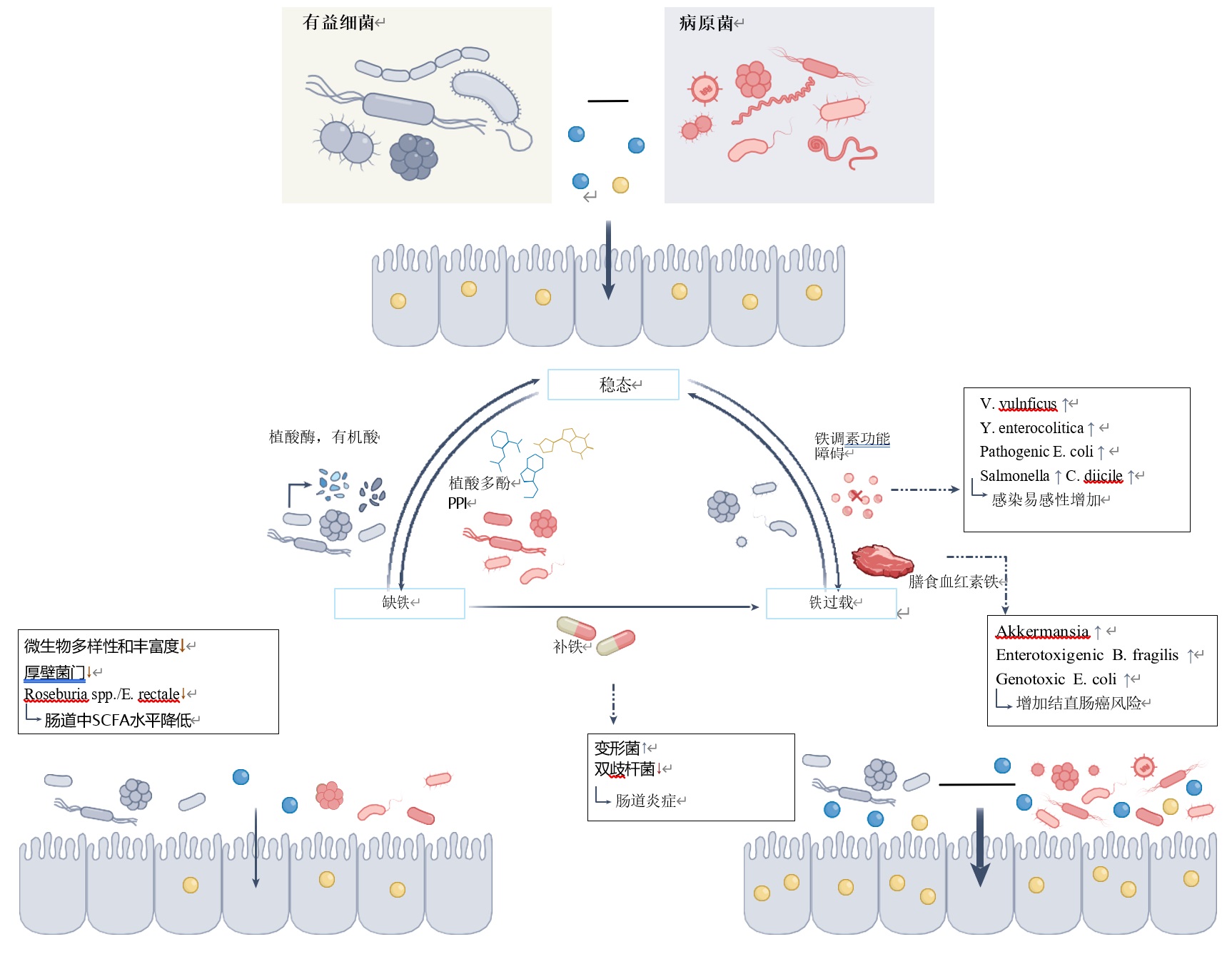
doi.org/10.1038/s41564-025-02001-y
铁调素失调与疾病关联最新的研究表明,膳食铁是微生物群构成的关键变量,铁-宿主-微生物群的交互作用可显著影响炎症性肠病(IBD)及癌症的病程发展。
1. 炎症性肠病(IBD)
铁代谢失调与感染IBD之间复杂的关联性:
铁调素缺失:病理性铁调素缺乏会直接导致细胞外铁水平升高、肠道炎症和感染风险激增。例如:小鼠缺乏铁调素时,创伤弧菌感染的死亡率大幅上升;铁调素可有效对抗嗜铁性病原体(如小肠结肠炎耶尔森菌O9株),但对非嗜铁菌株(如小肠结肠炎耶尔森菌O8株和金黄色葡萄球菌)保护作用有限。但临床常见的大肠杆菌(非嗜铁病原体)感染中,铁调素仍能显著降低脓毒症风险和死亡率。这表明铁调素抗菌机制具有广谱性。在肺炎、皮肤感染等场景中,铁调素介导的低铁血症能有效阻断细菌扩散,并增强免疫应答。人类铁调素缺失者则因组织铁过载而面临高感染风险。
铁调素的双重防御机制:肝脏铁调素缺失模型会导致血清和组织铁过载;菌群失调;结肠炎易感性增加。在结肠炎模型中,常规树突细胞分泌的铁调素通过局部截留铁元素,限制共生微生物的铁利用,从而促进黏膜愈合。这表明:
2. 癌症
除了感染和免疫,失衡的铁代谢(尤其是红肉中过量的血红素铁)也是结直肠癌的重要推手。它破坏肠道屏障、喂养有害菌、并直接“喂养”癌细胞。癌细胞还会“劫持”铁调节系统囤积铁,而限制铁供应或调控铁代谢,可能成为抗癌新思路。
研究表明,过量摄入红肉中的血红素铁,会损害肠道黏液保护屏障。更关键的是,它会促进一种能分解肠道黏液的细菌——艾克曼菌(Akkermansia) 的生长,从而刺激肠道上皮细胞过度增殖,为癌变埋下隐患。
长期食用红肉和高脂肪饮食,还与两种有害细菌的滋生密切相关:产肠毒素脆弱拟杆菌(Bacteroides fragilis)和具有基因毒性的特定大肠杆菌(E. coli)。这两种细菌分别产生脆弱拟杆菌毒素(BFT)和大肠杆菌素(colibactin),这些毒素已被证实与结肠癌的发生有直接关联。
不过,有趣的是,高浓度的铁环境本身又会抑制大肠杆菌素(colibactin)的产生。这提示我们,饮食中的铁、肠道致病菌(pathobionts)与结直肠癌发病率之间的具体联系非常复杂,仍需更多研究来阐明。
癌细胞是“铁瘾患者”与铁调控的“劫持者”
癌细胞疯狂生长,对铁元素的需求量巨大。与正常的结肠上皮细胞相比,结直肠癌细胞装备了高效的“铁输入系统”:它们会过量表达铁输入蛋白DMT1(二价金属离子转运蛋白1),导致肿瘤内部铁大量积聚,加速肿瘤生长。
同时,癌细胞还非常“狡猾”。它们会在局部分泌一种名为铁调素(hepcidin)的激素。铁调素的作用是抑制铁输出蛋白膜铁转运蛋白(Ferroportin, Fpn)的功能。这样一来,癌细胞就能成功地将铁囤积在自己内部,进一步促进其生长。实验证据支持这一点:缺乏铁调素能降低肿瘤负担,因为肿瘤细胞内的铁水平下降,进而抑制了其赖以生存的线粒体呼吸作用和合成DNA所需的核苷酸生物合成。
肿瘤微环境中的铁:巨噬细胞角色与治疗潜力
除了癌细胞自身,肿瘤微环境中的其他细胞,特别是肿瘤相关巨噬细胞(TAMs),在调控铁分布和影响癌症进程中可能扮演关键角色。例如,一项转录组研究发现,膜铁转运蛋白(Fpn)的表达水平不仅是肝癌中特定巨噬细胞亚群的标志,还是一个不良预后的指标。
更令人鼓舞的是,另一项研究发现,共生益生菌
植物乳植杆菌(Lactiplantibacillus plantarum)能够促进肿瘤内巨噬细胞表达铁螯合蛋白脂质运载蛋白-2(lipocalin-2),从而增强抗肿瘤免疫力。
这些发现都指向一个极具前景的研究方向:限制肿瘤对铁的获取,或调控铁在肿瘤微环境中的分布,可能具有显著的抗癌治疗潜力。当然,这需要未来更多的研究来深入探索和验证。
3. 感染性疾病
铁过载:血色素沉着症患者因铁调素缺陷,血清铁升高,易感染嗜铁病原体(如创伤弧菌)。
铁缺乏:慢性肾病患者的铁缺乏会削弱中性粒细胞杀菌功能,增加感染风险。
宿主、肠道微生物与铁元素之间复杂的相互作用,给制定人群层面的膳食铁摄入标准和口服铁剂补充方案带来了巨大挑战。早期研究曾指出补铁可能导致菌群失调并增加疾病风险,但后续针对不同地区人群的试验却发现:肠道微生物的初始构成决定了补铁是否引发菌群失调。
饮食结构和微生物组的个体差异,是当前微生物疗法效果不稳定的关键原因。这种差异性要求我们采取个性化医疗策略——根据患者具体情况搭配营养干预和微生物疗法。
过去30年,癌症治疗已实现从“无差别放化疗”到“靶向基因突变”的精准医疗跨越。同样,如果我们能锁定调控铁代谢的核心通路、以及影响铁稳态的特定微生物(如导致感染、炎症性肠病和癌症的菌株),便有望开发出新一代精准疗法。
1. 个性化补铁策略
检测先行:通过血清铁、铁蛋白、铁调素等指标评估铁状态,避免盲目补铁。
剂型选择:血红素铁(动物来源)吸收率高,但可能促进致病菌;非血红素铁(植物来源)需搭配维生素C提高吸收。
微生物干预:特定益生菌(如乳酸菌)可调节铁吸收,未来或开发“补铁益生菌”。
2. 饮食与药物的协同管理
促铁吸收:维生素C、柠檬酸、发酵食品(如酸奶)。
抑铁吸收:茶、咖啡(含单宁)、全谷物(含植酸)。
药物影响:长期使用PPI、抗生素可能干扰铁代谢,需监测和调整。
3. 未来方向:微生物组精准编辑
通过基因工程改造益生菌,使其分泌铁载体拮抗剂或免疫调节分子,或开发“铁载体-药物偶联物”,靶向递送抗生素至病原体。若鉴定出有益菌(如罗伊氏乳杆菌),可开发对应益生菌疗法;对有害菌则可用噬菌体或抑制剂精准清除。
微生物的“双面剑”特性
尽管传统研究聚焦病原体,但共生微生物的作用也同样引发关注。多形拟杆菌、阿克曼菌等“益生菌”在特定环境下可能会助推感染和癌症风险。关键在于解析环境因素(如铁浓度、菌群互作)如何影响微生物行为。
未来研究需突破两大方向:
① 揭示健康/疾病状态下,共生菌、条件致病菌与病原体的互动机制;
② 追踪铁元素如何通过改变微生物代谢通路影响宿主健康。
铁的平衡艺术——迈向精准健康时代
铁不仅是生命的基石,更是宿主与微生物、健康与疾病的交汇点。
微生物组在补铁过程中的“保护 vs 致病”双重角色,解释了为何相同的疗法对不同患者效果迥异。
随着微生物组学、代谢组学和基因编辑技术的进步,我们有望像定制癌症治疗方案一样,为每个人设计铁代谢的个性化蓝图。从饮食调整到微生物干预,科学的铁管理将成为预防和治疗慢性病的核心策略之一。
主要参考文献:
Choi, G., Bessman, N.J. Iron at the crossroads of host–microbiome interactions in health and disease. Nat Microbiol 10, 1282–1293 (2025).
本文转自:谷禾健康
https://wap.sciencenet.cn/blog-2040048-1493424.html
上一篇:[转载]从“菌”入手,助力睡眠:灵芝、茯苓、酸枣仁等的助眠之道
下一篇:[转载]如何利用益生元和肠道菌群更好地改善2型糖尿病?