博文
[转载]解密“肠-脑轴”如何操控你的食欲
||

为什么在劳累一天后,我们的大脑会疯狂渴望一块巧克力蛋糕,而不是一盘清爽的西兰花?为什么明知奶茶不健康,那种甜腻的口感却能带来无与伦比的慰藉?
过去,我们总把这归结为“压力大”、“嘴馋”或是“意志力薄弱”。但科学的聚光灯正照向一个我们长期忽略的角落——我们的肠道。
你可能不知道,你的每一次口腹之欲,背后都可能是一场发生在肠道里的“生物战争”。你体内的微生物菌群,这些数量比我们自身细胞还多的微小生命体,它们有着自己的“生存法则”和“饮食偏好”。
你吃的每一口食物,都在“投票”:你选择高纤维的蔬菜,就是在为你体内的“有益菌”投票,它们会回报你稳定的情绪和清晰的饱腹感信号。而你选择高度加工的甜食,则是在为那些渴望糖分的“捣蛋菌”投票,它们会分泌出让你更加渴求垃圾食品的化学物质。
这不仅仅是关于消化:这些菌群产生的代谢产物,如短链脂肪酸、胆汁酸甚至神经递质,能像信使一样,顺着“肠-脑轴”这条信息高速公路直达大脑,直接影响你的心情、味觉乃至成瘾行为。
高度加工食品的特点是脂肪和糖含量升高、纤维含量降低,同时含有大量盐和食品添加剂,维生素等微量营养素减少。而饮食中膳食底物(纤维、糖、脂肪和蛋白质等)比例的改变会扰乱微生物组-肠道-大脑轴。
越来越多的证据表明,微生物群在调节饮食相关行为及代谢紊乱的行为合并症方面发挥至关重要作用。了解肠道微生物群影响宿主食欲和新陈代谢的机制,将有助于更好地理解肥胖等饮食失调和代谢失调情况,从而开发新的生物治疗策略。
本文将为你揭示,现代工业化饮食是如何通过扰乱我们体内的“微生态平衡”,来悄无声息地影响我们的行为的。理解了这场“肠脑对话”,你将找到一把全新的钥匙,去解锁困扰已久的饮食难题,并最终学会如何“喂养”出一个更健康、更快乐的自己。
01现代的饮食行为及影响机制现代化进程推动了人类生活方式的变革,饮食行为作为基本生存需求也随之发生复杂多样的演变。工业革命的食品加工技术、信息时代的个性化营养、全球化的饮食文化融合、城市化的快节奏生活、科技进步的精准营养指导,以及社交媒体对饮食观念的重塑,这些现代化力量共同催生了当代社会中数量庞大、类型繁多的饮食行为模式。
这些饮食行为呈现出鲜明的双重性特征:既有科学化营养管理、个性化健康需求满足等积极趋势,也存在高糖高脂成瘾性消费、不规律进食习惯、过度依赖加工食品等不健康倾向。深入理解这些饮食行为的成因、特征及健康影响,对构建科学合理可持续的现代饮食体系具有重要意义。
Part 01
不健康的饮食行为
以下列举了一些在当代社会中普遍存在的不健康饮食行为模式,这些行为可能正在悄悄影响着我们的身体健康,快来看看自己是否存在这些问题。
高糖高脂类
高脂肪高糖饮食:现代食品的发展使得高糖高脂食品变得极其便利和诱人。这类饮食方式不仅包括传统的高脂肪高糖饮食如奶茶、甜品、油炸食品和快餐组合,还延伸出了更加隐蔽的形式。
精制糖依赖:已成为现代人普遍面临的健康威胁。从早晨的含糖咖啡开始,到下午的甜点小憩,再到深夜的糖分慰藉,精制糖以各种形式渗透到日常生活的每一个角落。含糖饮料、糖果、精制糕点的过量摄入不仅导致血糖波动,还可能引发类似药物依赖的生理和心理反应。
反式脂肪摄入:人造奶油、酥饼、部分快餐食品中含有的反式脂肪酸,以其独特的口感和保存特性被广泛使用,但其对心血管健康的危害已被科学研究充分证实。
高盐高钠类
重口味饮食:现代人对味觉刺激的追求催生了重口味饮食的盛行。这种饮食方式表现为过度依赖调味料、腌制食品、咸菜等高钠食物,以及对麻辣、酸辣等强烈味觉刺激的偏好。
加工食品依赖:火腿肠、方便面、罐头等便利食品为了延长保质期和增强口感,往往含有超出日常所需的钠含量。这些"隐形盐"的大量摄入与高血压、心血管疾病的发生密切相关。
不规律进食类
现代生活节奏的加快导致了饮食时间的严重失调。这种失调不仅体现在进食时间的不规律,更表现为进食量和频率的极端化。
暴饮暴食:在工作压力、社交焦虑、情感困扰的驱动下,许多人选择通过短时间内大量进食来获得心理慰藉,这种压力性进食行为已成为现代都市生活的普遍现象。
过度节食:在追求"完美身材"的社会压力下,极端限制热量摄入、长期营养不均衡的节食行为不仅损害身体健康,还可能导致进食障碍等严重心理问题。
夜宵文化:深夜大量进食高热量食物不仅干扰正常的生物钟,还会增加消化系统负担,影响睡眠质量。
跳餐习惯:不吃早餐的现象在年轻人中非常普遍。这种习惯不仅影响一天的能量供应和代谢稳定,还可能导致午餐和晚餐的过度补偿性进食。
营养结构单一化饮食
碳水化合物过量:表现为主要以米面等精制谷物为主食,缺乏粗粮、杂粮的摄入。这种饮食模式不仅导致B族维生素和纤维素摄入不足,还可能引发血糖波动和胰岛素抵抗。
蛋白质缺乏:在一些盲目追求素食的人群中尤为明显。长期素食但营养搭配不当,特别是缺乏对植物蛋白互补性的理解,可能导致必需氨基酸摄入不足。
维生素矿物质不足:主要源于新鲜蔬果摄入不足。现代人对加工食品、外卖食品的依赖,使得天然维生素和矿物质的摄入量远低于推荐标准。
Part 02
较健康的饮食行为
与上述不健康的饮食行为形成鲜明对比的是,在现代社会中同时也涌现出了一些相对更加科学合理、对身体健康更为有益的健康饮食方式和饮食理念。
均衡营养类
地中海饮食:地中海饮食作为被广泛认可的健康饮食模式,以橄榄油、鱼类、坚果、全谷物、蔬果为主要构成,其对心血管健康的保护作用已被大量科学研究证实。
DASH饮食:通过低钠高钾的营养配比,强调蔬果、全谷物、瘦肉蛋白的摄入,不仅有助于控制血压,还能改善整体代谢健康。
彩虹饮食:鼓励人们每天摄入多种颜色的蔬果,通过颜色的多样性确保植物化学物质和营养素的全面摄入。
全食物饮食:强调选择未加工或轻加工的天然食物,避免过度加工食品中的添加剂和人工成分,回归食物的天然营养价值。
一些饮食对肠道微生物群和免疫的影响
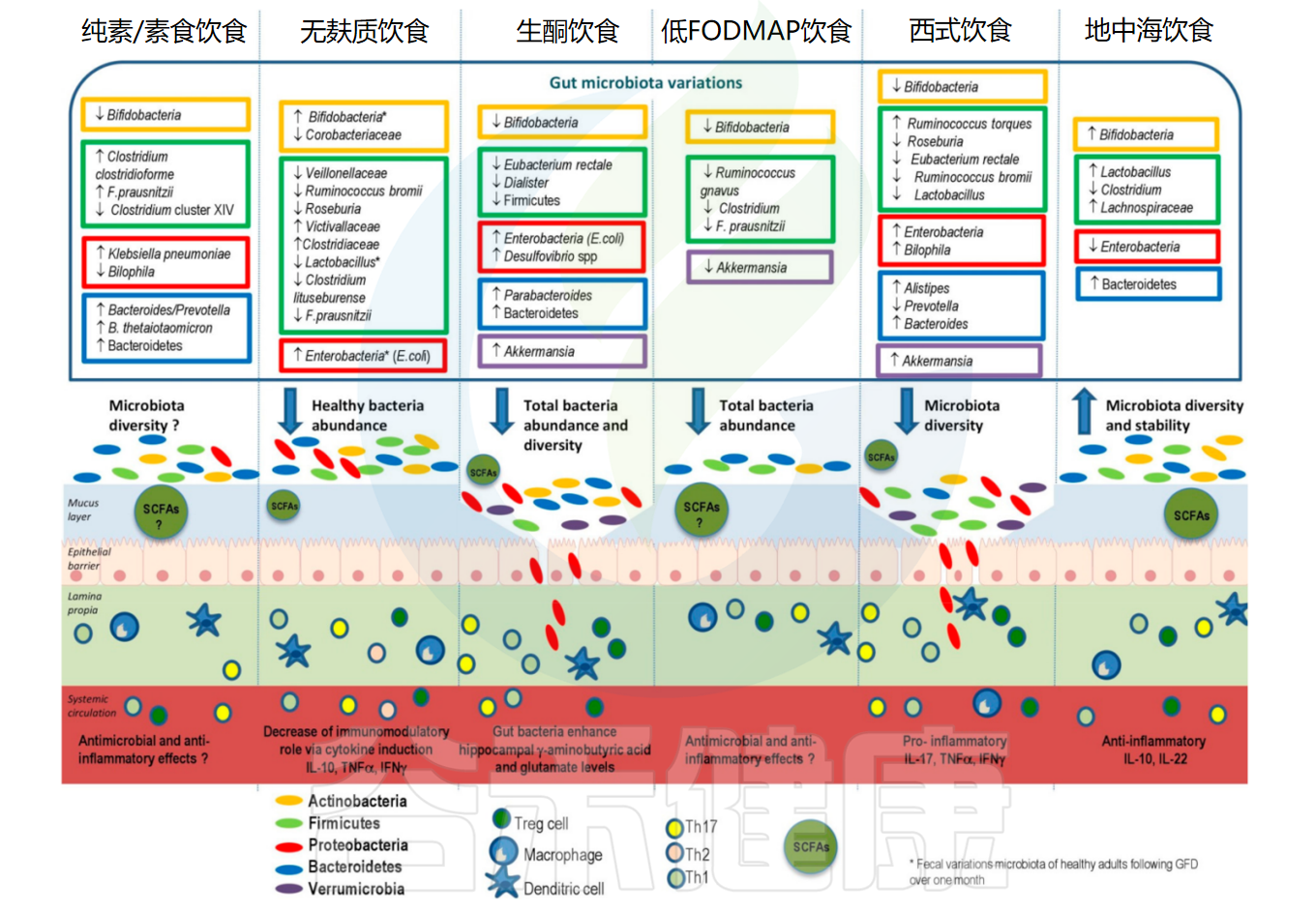
doi: 10.3390/nu11102393.
植物性饮食类
素食主义:现代素食主义已经从单纯的不摄入动物产品,发展为注重营养搭配、科学规划的健康生活方式。
弹性素食:以植物性食物为主,适量摄入动物产品的饮食模式,既满足了营养需求,又减少了环境负担。
轻食主义:以低热量、低脂肪、高纤维的食物为主,追求营养均衡而非饱腹感。典型食物包括沙拉、轻汤、蒸煮食品等,强调"吃得少而精"。
功能性饮食类
抗炎饮食:通过富含抗氧化剂的食物,如浆果、绿叶蔬菜、深海鱼类等,帮助人体对抗慢性炎症,预防相关疾病。
益生菌饮食:强调发酵食品、酸奶、泡菜等有益菌群的摄入,促进肠道健康,这与现代医学对肠道微生物群重要性的认识高度一致。
低升糖指数饮食:通过选择血糖反应较低的食物,帮助维持血糖稳定,对糖尿病防治具有重要意义。
▸ 膳食成分影响微生物代谢和饮食行为
√ 膳食成分和加工程度会影响微生物和代谢
膳食成分组成而非热量负荷本身是微生物组结构和功能的主要驱动因素。人类队列和动物模型研究一致表明,不同的营养素特征会引起特定的微生物和代谢反应。
对照喂养研究显示,营养素比例相同但纤维含量和加工程度不同的等热量饮食会产生截然不同的微生物特征、发酵活性和宿主能量利用效率。工业化饮食减少了可发酵化合物的可用性,而这些化合物对维持多样化和有弹性的微生物群落至关重要。
由于肠道微生物组影响免疫、代谢、神经传递和内分泌等多种宿主过程,饮食的重大变化可能改变肠道微生物组的代谢输出,对宿主生理和行为产生重要影响。
√ 肠道微生物可以通过肠脑轴反向影响饮食行为
肠-脑轴对摄入的营养物质(纤维、糖、脂肪和蛋白质)进行差异感知,并将有关营养、能量和饱腹感的信息传递到大脑,以协调摄食行为。这些行为包括饥饿时觅食和饱腹时停止摄入。该系统通过专门的感觉途径整合来自胃肠道的化学和物理影响,从而维持能量稳态。
肠道微生物组作为对饮食敏感且高度可塑的微生物群落,在结肠中密度最高,通过将膳食底物代谢成生物活性化合物在宿主营养中发挥关键作用。由于肠道微生物组对饮食的反应和代谢能力远超人体自身,它能够显著影响肠脑信号传导和摄食行为。然而,这种饮食敏感性可能是双刃剑:在进化的低能量环境中发挥优势的机制,在现代工业化产生的高能量密集且易消化食物环境中可能带来危害。
饮食驱动的微生物组-肠-脑轴调节摄食行为
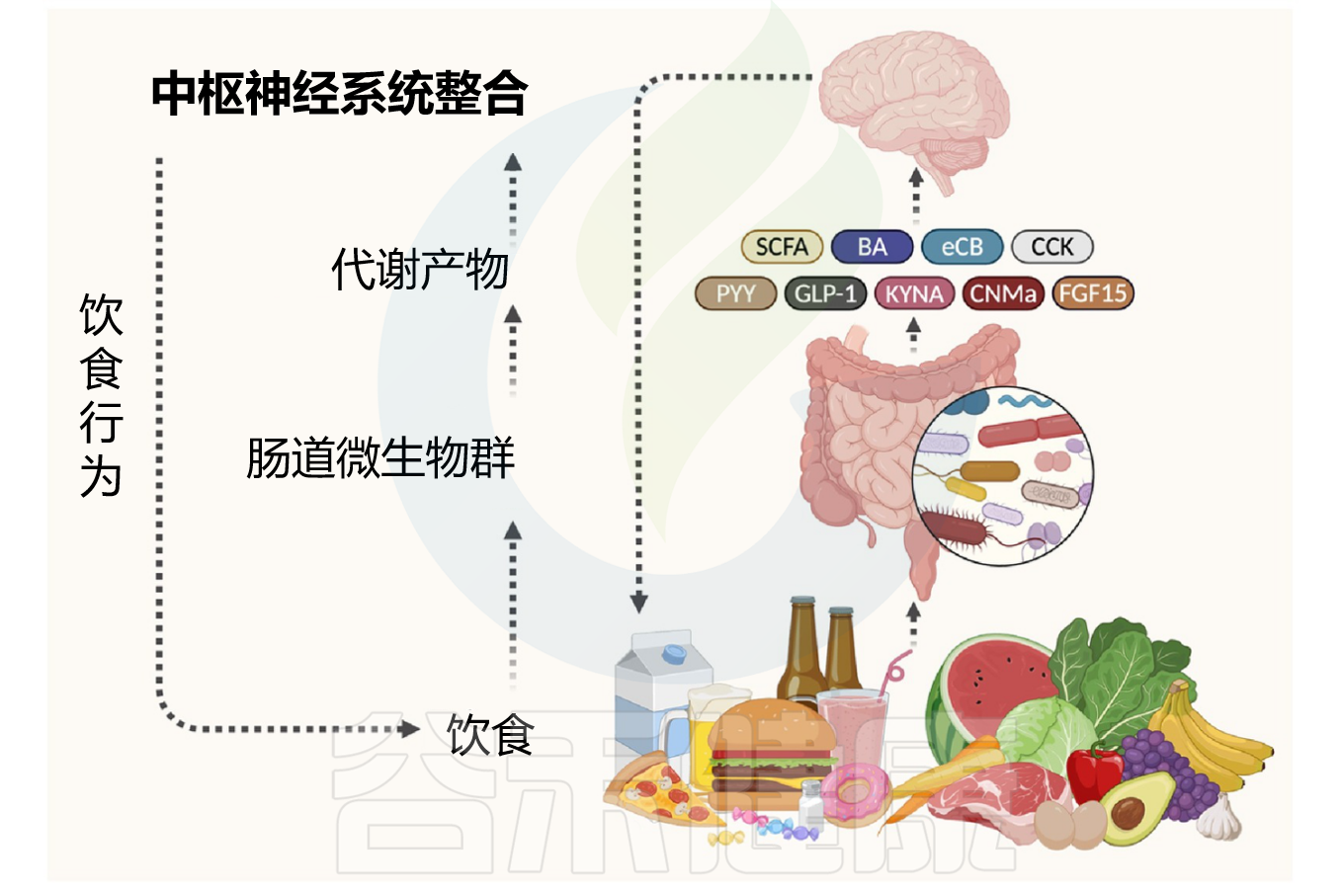
Liow YJ,et al.Trends Endocrinol Metab.2025
√ 现代饮食的大量加工会导致饮食行为改变
现代饮食改变了纤维、糖、脂肪和蛋白质的比例,并通过大量加工提高小肠营养物质消化率。这些变化增加了工业化饮食破坏微生物介导营养传感网络的可能性,导致饮食行为改变和能量失衡。这些饮食-微生物组相互作用可能为工业化生活方式相关的流行病(包括饮食失调和代谢疾病)提供了现有模型中基本未解释的隐藏信号层。
▸ 膳食常量营养素的化学感觉编码
√ 葡萄糖信号传感
葡萄糖传感发生在门静脉肠系膜系统内,代谢信号通过迷走神经和脊髓传入神经编码。门静脉葡萄糖代谢的迷走神经元通过结节神经节将信号传递至孤立道核,并通过调节纹状体多巴胺释放增强糖偏好。平行的门静脉-脊髓轴确保强大的营养信号编码,凸显了糖检测在摄食调节中的重要性。
然而,葡萄糖缺乏检测涉及非迷走神经机制。孤立道核后区是感知葡萄糖缺乏的中心枢纽,迷走神经切断术不能消除葡萄糖缺乏引起的摄食反应,而损伤该回路则能消除此反应,表明葡萄糖缺乏检测可能依赖中枢糖感受器或脊髓传入神经。此外,葡萄糖通过非迷走神经途径抑制刺鼠相关肽(AgRP)神经元,支持其他内感受机制的参与。
注:刺鼠基因相关蛋白——一种与食欲控制密切相关的神经肽。
√ 脂质信号传感
相比之下,脂质传感显示出对迷走神经传入神经的严格依赖。迷走神经切断术消除脂质摄食反应,表明脂质代谢信息必须通过肠-脑信号传导而非中枢直接检测传达。十二指肠脂肪需要迷走神经输入抑制AgRP神经元,强化了迷走神经信号的重要性。关键介质是油酰乙醇酰胺,这是近端肠道合成的脂质衍生分子,与PPARα受体结合并调节纹状体多巴胺信号,可能通过投射至孤立道核后区的迷走神经传入发挥作用。
长期高脂肪饮食会破坏油酰乙醇酰胺信号,削弱肠脑通讯和脂肪衍生的多巴胺释放,这种适应不良反应可能导致代偿性暴食。糖和脂肪信号参与重叠但不同的回路,同时出现时会放大多巴胺释放,促进超出热量需求的过度消耗。
√ 蛋白质信号传感
蛋白质衍生的信号参与迷走神经和非迷走神经途径,具体取决于蛋白质形式和生理环境。蛋白胨等水解蛋白激活肠道化学感受器并触发胆囊收缩素(CCK)释放,刺激迷走神经传入并激活食欲调节的肠脑信号。
迷走神经切断术或CCK1受体阻断可消除此效应,证实迷走神经依赖性。相反,完整蛋白质通过非迷走神经反馈调节摄食,可能通过血浆氨基酸传感或肝脏传入神经实现。肝门传感器以剂量依赖方式检测循环氨基酸,在氨基酸缺乏时迷走神经传感器敏感性增加约100倍,放大代偿驱动。这种肝脏中心机制能根据营养可用性动态调节蛋白质摄入。
▸ 胃胀的机械感觉编码
机械感觉提供独立于营养成分的肠脑信号传导层,传达胃扩张和进食量信息。表达催产素受体的迷走神经感觉神经元作为机械传感器,对胃和十二指肠牵拉做出反应,将机械信号传递至孤立道核。
√ 机械敏感传入神经影响饱腹感和能量平衡
这些机械敏感传入神经影响饱腹感和能量平衡控制回路,激活时抑制食物摄入并诱导昏睡样状态,表现为能量消耗减少和下丘脑-垂体-肾上腺轴活动增加。除迷走神经通路外,脊髓传入神经也传递机械感觉信号,背根神经节介导的通路将GLP-1介导的胃松弛信号传递至下丘脑外侧。
然而,机械感觉通路并非孤立运作,而是与肠内分泌细胞的化学感觉输入相互作用。产生5-羟色胺的肠嗜铬细胞既对管腔刺激物反应,也促进肠道蠕动并加速肠道转运以助毒素清除。此外,胰高血糖素样肽-1(GLP-1)和CCK释放细胞可减缓胃排空,可能与迷走神经机械传感器协同延长饱腹感。
√ 营养信号和机械信号共同调节进食行为
营养信号和机械信号间的相互作用精细调节进食行为,促进对不同膳食成分的适应性反应。
通过整合来自营养成分的化学感觉输入和编码胃扩张的机械感觉信号,肠脑轴传入分支确保摄食行为根据摄入食物的代谢和物理特性动态调节。脑干迷走神经和脊髓传入通路的汇聚实现对食欲和能量平衡的精细调节。肠内分泌细胞作为综合枢纽,将管腔营养信号转化为激素和神经输出,塑造肠道蠕动和摄食行为,进一步完善能量稳态的内感受控制。
02饮食中微生物衍生的代谢物影响宿主饮食行为饮食对肠道微生物组组成和功能的影响远超遗传因素。比较植物性与动物性饮食、地中海与西方饮食、非洲农村高纤维与欧洲城市饮食以及熟食与生食的研究中,均可观察到饮食对肠道微生物组的显著影响。
√ 肠道微生物组有助于评估生活方式的健康性
肠道微生物组对饮食的敏感性使其成为评估现代生活方式健康影响的重要标志和靶点。特别是向工业化饮食的转变可能对与饮食行为相关的肠道微生物组产生显著的组成和功能变化。
与传统饮食相比,工业化饮食的特征是纤维含量急剧减少,糖、脂肪和蛋白质含量增加。肠道微生物组代谢部分抵抗小肠消化的营养物质,产生多种生物活性小分子代谢物,使工业化饮食与其他饮食产生区别。在动物模型和人类研究中,饮食成为肠道微生物生态学的核心决定因素,不仅重塑群落组成,还重塑介导微生物-宿主相互作用的基因组、转录组和代谢组学程序。
√ 微生物代谢影响食欲和摄食行为
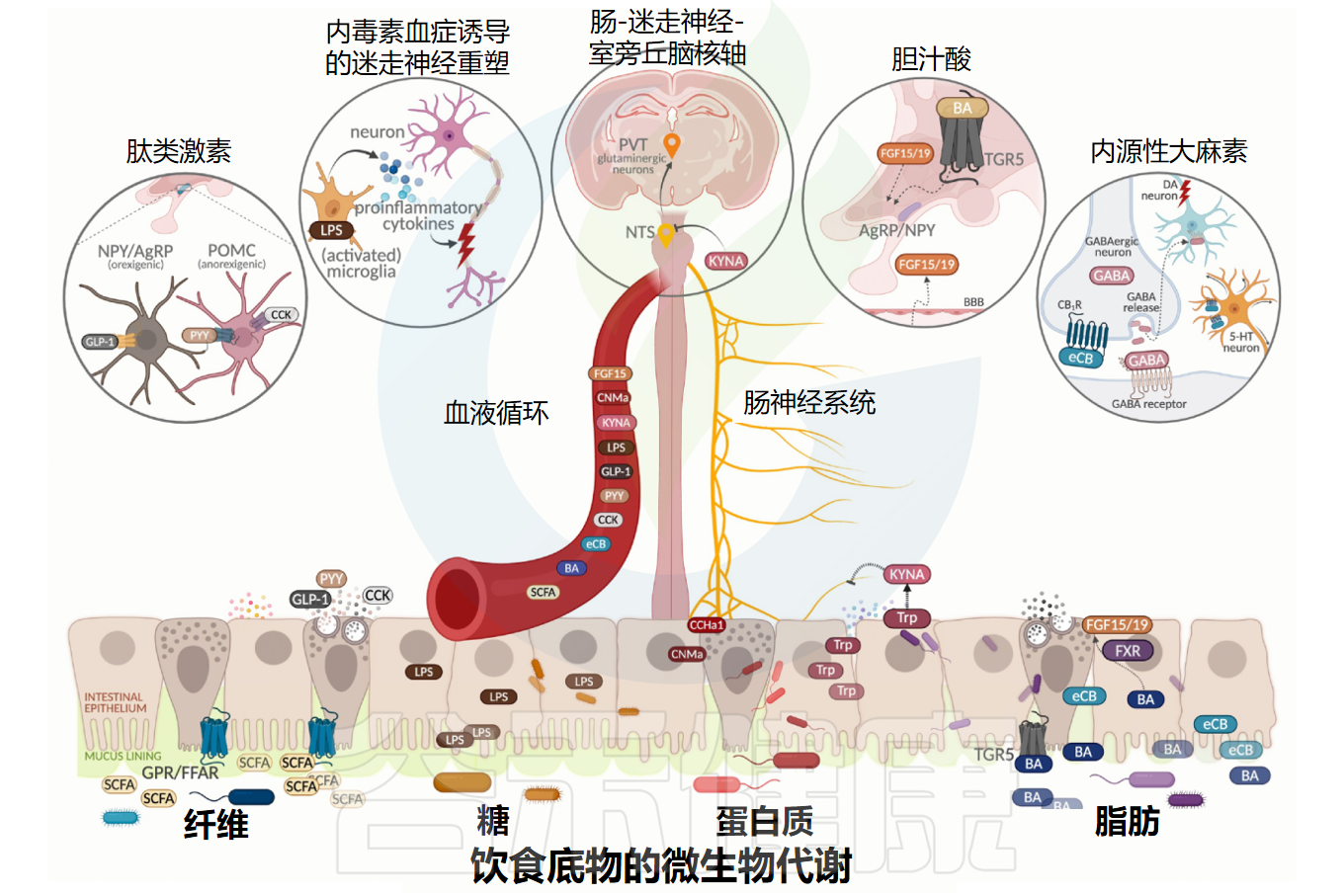
肠道微生物组在接触膳食底物时产生的代谢物包括短链脂肪酸(SCFA)、氨基酸代谢物、次级胆汁酸和神经递质,其产生取决于管腔中常量营养素的可用性。这些代谢物改变局部肠道环境、粪便和血浆代谢组特征以及全身能量调节,并对宿主生理学产生其他影响。
重要的是,这些代谢物与外周和中枢神经元相互作用,影响宿主进食行为。下图表概述了膳食底物的肠道微生物代谢如何产生影响食欲调节和摄食行为神经回路的生物活性代谢物。接下来我们将介绍微生物与各主要膳食成分的相互作用。
微生物代谢膳食底物及对宿主进食行为的影响


Liow YJ,et al.Trends Endocrinol Metab.2025
1
膳食纤维
工业化饮食的特征是纤维含量相对较低,精制碳水化合物含量较高。这种膳食底物模式促进了支持炎症和奖励敏感代谢途径的微生物环境,而抑制了促进饱腹感和代谢平衡的途径。
√ 能否发酵会影响宿主的饮食选择
膳食纤维对肠道微生物组的塑造程度取决于其可发酵性:可发酵纤维(如菊粉)更强烈地调节微生物组成和活性,而不可发酵纤维(如纤维素)代谢最少,对宿主能量贡献很小。
纤维素虽能诱导肠扩张,但代谢惰性相对较高,虽然它可激活迷走神经信号,但与脂肪和糖等代谢活性营养素相比作用较弱。有趣的是,微生物发酵能力可能影响宿主食物偏好:最近研究发现,小鼠更偏好其常驻微生物无法发酵的膳食纤维,而非可发酵纤维。因此,发酵性不仅控制微生物和代谢结果,还控制对膳食纤维的行为反应。
富含纤维的食物会诱导肠道蠕动、胃排空和肠内分泌信号传导的急性变化。在短期内,纤维消耗通过胃胀气和延迟营养吸收来增加饱腹感,从而减少膳食量。在数天至数周内,持续摄入纤维会重新配置微生物组组成和代谢信号通路,增强肠内分泌激素分泌,并导致食欲调节和能量稳态的持续改变。长期以来,高纤维饮食与较低的能量摄入和体重调节有关。
√ 膳食纤维代谢产生的短链脂肪酸是肠脑通讯的重要信号分子
膳食纤维发酵是短链脂肪酸(主要是丁酸盐、乙酸盐和丙酸盐)的主要来源。短链脂肪酸已成为肠脑通讯的重要调节剂。丁酸盐通过激活迷走神经传入神经元、降低孤立束核和背侧迷走神经复合体活性以及抑制下丘脑神经肽Y(NPY)表达的食欲神经元来抑制食物摄入。这种食欲抑制作用需要迷走神经完整性。
乙酸盐和丙酸盐腹腔注射也具有显著厌食作用。在禁食小鼠中,全身注射短链脂肪酸导致食物摄入量剂量依赖性减少,丁酸盐效果最强,其次是丙酸盐和乙酸盐。这种短链脂肪酸诱导的食欲抑制由迷走神经传入神经元介导,迷走神经传入神经元表达游离脂肪酸受体(FFAR2、FFAR3),为微生物代谢物提供了独立于经典肠内分泌信号通路调节宿主摄食行为的途径。
√ 短链脂肪酸影响肠内分泌激素进而影响饮食行为
短链脂肪酸不仅直接作用于迷走神经传入神经,还刺激肠内分泌细胞通过激活肠内分泌L细胞上的FFAR2释放激素,调节摄食行为和能量稳态。其中,CCK、GLP-1和PYY是肠脑信号传导和饱腹感的关键调节因子。
短链脂肪酸及其对宿主食欲和新陈代谢的影响
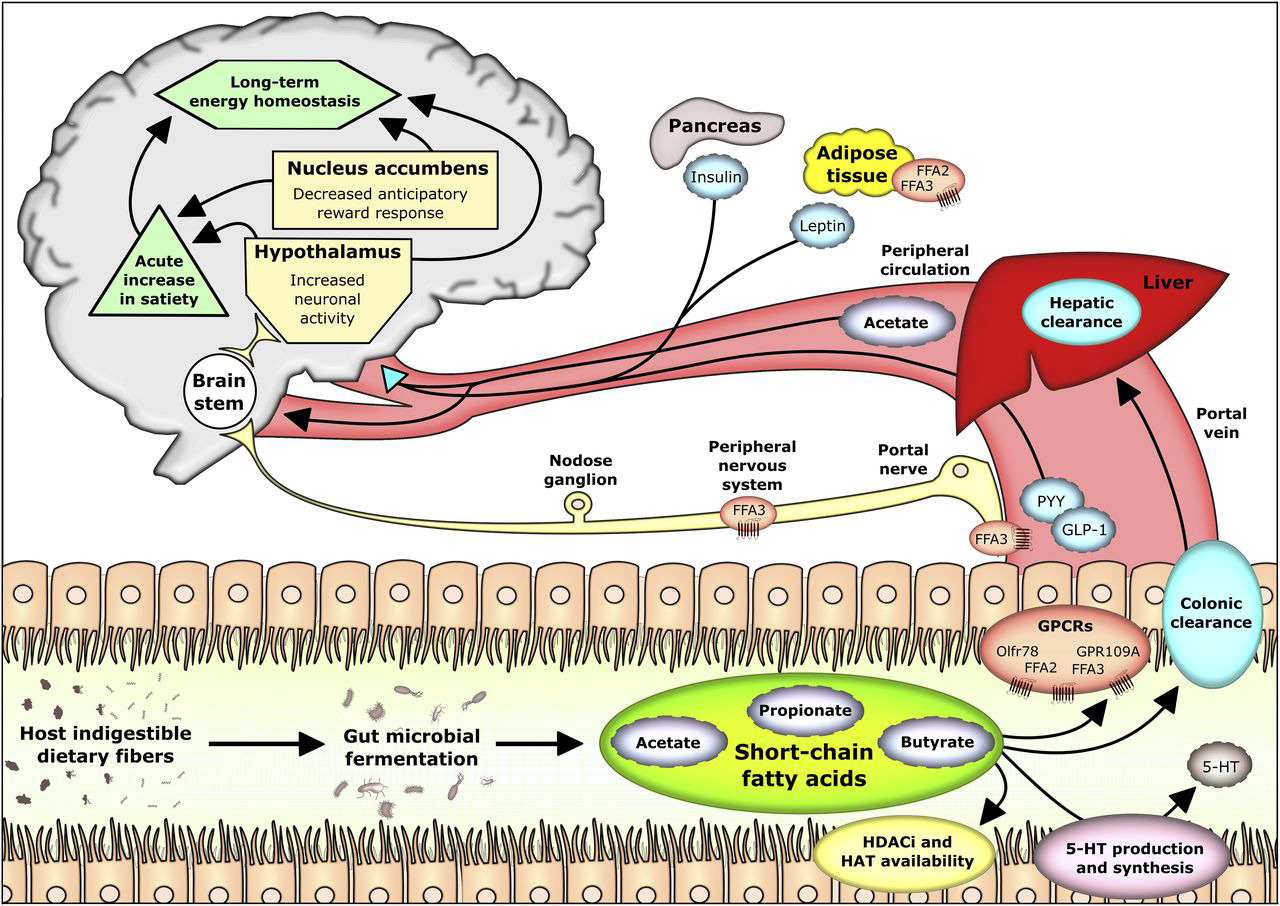
doi: 10.3945/jn.116.240481.
CCK通过迷走神经元影响摄食行为,迷走神经切开术消除其厌食作用。微生物来源的丙酸盐通过直接上调肠内分泌细胞中的Cck mRNA和肽水平刺激回肠和盲肠中CCK表达。CCK塑造营养特异性偏好,包括脂肪偏好发展。阻断CCK信号传导消除对糖、脂肪和氨基酸的迷走神经反应,表明CCK对营养驱动的食欲行为至关重要。膳食纤维摄入促进微生物发酵并促进CCK释放,通过微生物活动将膳食纤维与肠脑信号传导联系起来。
GLP-1是食欲和血糖控制的关键调节因子,通过表达GLP-1受体的迷走神经传入神经发挥作用。这些神经元密集支配胃肠道并投射到孤立道核,介导GLP-1的厌食和代谢作用。内源性GLP-1还通过替代的肠交感神经回路发挥作用。GLP-1和PYY都受微生物来源短链脂肪酸调节,后者通过结肠L细胞上的FFAR2急性刺激其分泌。长期暴露时,短链脂肪酸还通过FFAR2/PAX4依赖性分化扩大L细胞群来增强PYY输出。PYY3-36通过与迷走神经传入神经上的Y2受体结合发挥厌食作用。
√ 特定微生物代谢膳食纤维改变宿主的食物偏好
尽管微生物短链脂肪酸和肠内分泌激素相互作用影响饱腹感和能量稳态,但膳食纤维的微生物代谢也可能通过替代途径影响宿主食物偏好。菊粉补充剂研究表明其将食物偏好转向脂肪而非糖,这种变化与特定微生物特征相关。受控研究显示,用特定拟杆菌定植的小鼠选择性发酵果聚糖,使宿主偏好从可发酵果聚糖转向不可发酵果聚糖,当微生物代谢中断时这种效应消失。
人体研究提供初步证据表明肠道微生物对纤维的发酵影响食物相关线索的神经处理。超重成人补充菊粉型益生元纤维改变大脑对高热量食物刺激的激活模式,减少奖励评估相关脑区激活。尽管这些神经变化未直接转化为食物摄入或偏好改变,但提示微生物代谢物可能影响大脑对营养丰富食物的评估。
综上所述,低纤维的工业化饮食减少短链脂肪酸的微生物产生,通过迷走神经传入神经减弱饱腹感信号传导并减少CCK、GLP-1和PYY等饱腹感激素分泌,从而破坏肠脑通讯。因此,膳食纤维缺失可能导致饱腹感下降,促进过度摄入并损害能量平衡。
膳食底物的微生物代谢控制宿主的进食行为
Liow YJ,et al.Trends Endocrinol Metab.2025
2
膳食糖
膳食糖在现代工业化饮食体系中占据了相当大的比例,现代食品中,有相当多的食品类别都含有大量的糖分成分。
因为糖在小肠中易被消化,大大减少了到达结肠肠道微生物群的糖量。然而,在糖摄入过量的情况下——如某些工业化饮食所预期的,未吸收的糖会溢出到达结肠,引发微生物组、免疫和神经生理学变化的级联反应,间接影响宿主摄食行为。这些机制包括短链脂肪酸产生改变、免疫-微生物组相互作用和迷走神经重塑。
√ 过量的糖到达结肠可能会抑制拟杆菌等纤维降解菌
葡萄糖通常几乎完全在小肠中被吸收,而果糖代谢变化更大。当果糖到达结肠肠道微生物群落时,通过抑制编码关键定植因子的roc基因来抑制关键的纤维降解细菌,如多形拟杆菌(Bacteroides thetaiotaomicron)。
这种转变破坏微生物群落稳定性,可能导致短链脂肪酸产生减少。鉴于短链脂肪酸作为代谢信号分子,通过迷走神经通路和神经递质调节参与肠脑轴,其可用性降低会扰乱摄食行为和代谢稳态。
√ 膳食糖影响辅助性T17细胞进而影响饮食行为
与直接促进微生物代谢产生生物活性代谢物的膳食纤维不同,膳食糖对微生物组与免疫相互作用产生更间接影响。其中一种机制是通过消耗辅助性T17(Th17)细胞,这种免疫细胞群对肠道稳态至关重要。高糖饮食有利于适应糖的微生物扩张,而牺牲Th17诱导的共生体,导致肠黏膜中Th17细胞丢失。
Th17细胞破坏减少IL-17产生,这种细胞因子直接作用于下丘脑神经元,通过增加POMC表达和激活厌食信号通路抑制食物摄入,从而通过抑制这种免疫来源的饱腹感信号改变摄食行为。同时,Th17细胞通过IL-17调节肠道脂质吸收,并下调CD36(关键脂质转运蛋白)。这种免疫调节功能丧失增加脂质吸收,表明微生物组介导的糖摄入代谢后果与免疫抑制和微生物破坏交织。
这些发现共同强调了膳食糖塑造饮食行为的独特但未被充分认识的途径——不是通过作为微生物底物,而是通过以驱动代谢和神经生理学效应的方式重新编程宿主-微生物相互作用。
尽管膳食糖与微生物组结构变化、免疫调节和迷走神经重塑相关,但证明这些变化如何转化为摄食行为改变的直接实验证据仍然有限。然而,这一途径对现代饮食具有重要意义,因为长期摄入糖可能通过持续的微生物组-肠-脑改变强化失调的摄食行为。
3
膳食蛋白质
蛋白质杠杆理论假设生物体优先考虑蛋白质摄入而非总能量摄入,当膳食蛋白质被稀释时,会导致脂肪和碳水化合物的代偿性过度消耗。这种现象在包括人类在内的各物种中均可观察到,强调蛋白质食欲是摄食行为的重要驱动因素。尽管研究主要集中在宿主机制上,如氨基酸感觉检测、激素反馈回路和控制蛋白质食欲的中枢神经通路,但肠道微生物组在塑造蛋白质驱动摄食行为中的作用在很大程度上仍未探索。
√ 微生物氨基酸合成可抑制宿主代偿性摄食
越来越多证据表明肠脑信号传导在蛋白质稳态中起核心作用,新发现暗示微生物对这一调节网络的贡献。肠道微生物通过调节氨基酸可用性缓冲宿主对抗膳食蛋白质稀缺:用产生必需氨基酸的细菌Acetobacter pomorum定植的果蝇表现出减少的蛋白质寻找行为,表明微生物氨基酸合成可抑制宿主代偿性摄食。
相比之下,乳酸杆菌缺乏必需支链氨基酸(亮氨酸、异亮氨酸、缬氨酸)的生物合成途径,在必需氨基酸剥夺时不会抑制蛋白质食欲,这与该食欲调节作用需要必需氨基酸微生物生物合成的假设一致。这表明微生物对代偿性摄食反应的抑制取决于特定的生物合成能力。
√ 不同饮食下的微生物群落会影响宿主的摄食偏好
微生物组驱动的与必需氨基酸相互作用也可能影响更广泛的常量营养素偏好。在草食性供体肠道微生物中定植的小鼠表现出血浆色氨酸升高和对蛋白质的更大偏好,而在杂食性或肉食性供体肠道微生物中定植的小鼠消耗更多碳水化合物。其他一些研究已将犬尿氨酸途径与微生物组驱动的色氨酸代谢对摄食行为的影响联系起来。
色氨酸向犬尿酸的微生物代谢通过涉及迷走神经传入和中枢食欲通路的肠脑回路调节摄食行为。慢性压力和节食史改变肠道微生物组成并降低管腔犬尿酸水平。这种消耗抑制迷走神经末梢,通过孤束核和室旁核过度激活导致食物摄入量增加。通过补充益生菌或直接给药犬尿酸恢复其水平,使摄食行为正常化,证实犬尿氨酸途径是强迫性暴饮暴食的微生物代谢调节剂。
√ 肠脑轴信号和微生物代谢共同调节蛋白质摄入
蛋白质稳态依赖于肠道来源神经肽,这些神经肽参与肠道和中枢回路调整摄食行为以响应氨基酸可用性,肠道微生物组通过促进营养平衡进一步塑造这一过程。微生物合成必需氨基酸时,其生物合成抑制宿主因蛋白质稀缺而产生的代偿性摄食。这些机制共同证明宿主驱动的肠脑信号传导和微生物代谢都调节蛋白质摄入。
√ 不同蛋白质对肠道微生物群的影响存在差异
蛋白质对肠道微生物群组成的影响因类型而异。食用动物蛋白(特别是红肉和奶制品中的蛋白质)可能导致耐胆汁厌氧菌(如拟杆菌门、Alistipes和嗜胆菌门)丰度增加。这些肠道微生物群改变诱导氧化三甲胺(TMAO)增加。
TMAO是一种具有促动脉粥样硬化潜力的化合物,在心血管疾病中发挥重要作用。
另一项研究表明,硫酸盐还原菌从膳食中的无机硫和硫酸化氨基酸(即蛋氨酸、半胱氨酸、胱氨酸和牛磺酸)中产生硫化氢,可能增加炎症性肠病风险。此外,动物蛋白发酵降低了双歧杆菌丰度和短链脂肪酸产生,可能进一步增加炎症性肠病风险。
而食用植物蛋白(如豌豆蛋白)会增加肠道共生双歧杆菌和乳酸杆菌,并减少致病性脆弱拟杆菌和产气荚膜梭菌。在小鼠模型中,西式饮食3周后补充大豆浓缩蛋白导致双歧杆菌科、梭状芽胞杆菌科和递叶杆菌科丰度显著增加,拟杆菌门水平降低。植物蛋白的发酵与双歧杆菌和乳酸杆菌丰度增加相关,从而刺激短链脂肪酸产生。
√ 优化饮食中纤维和蛋白质的比例可能有助于改善代谢和微生物群
膳食纤维和蛋白质对肠道微生物组组成和微生物衍生代谢物的影响有据可查,突显它们对宿主饮食行为的重要性。尽管不可消化碳水化合物是微生物介导短链脂肪酸产生的主要底物,但结肠中未消化的膳食蛋白质和氨基酸也可作为短链脂肪酸合成前体。
纤维和蛋白质衍生代谢物间的相互作用可能抵消与西方饮食相关的一些不良代谢影响,西方饮食通常纤维含量低,脂肪和蛋白质含量高。饮食的代谢和微生物结果不仅取决于单个常量营养素存在,还取决于它们的相对比例和相互作用。
将可发酵纤维与优质蛋白质来源共同给药,可通过增加微生物对可发酵底物暴露来减少直接能量吸收并调节肠道微生物组组成。同时,降低高脂肪饮食中蛋白质与纤维比例可改善血糖控制和血脂状况,同时有利于产生短链脂肪酸的细菌类群扩张。
确定优化纤维与蛋白质比例是否可将微生物代谢转向增加短链脂肪酸产生和减少蛋白水解副产物,可能揭示抵消与纤维缺乏西方饮食相关饮食失调和代谢功能障碍的策略。
4
膳食脂肪
膳食脂肪通过热量负荷或感觉奖励以外的机制影响宿主摄食行为,新证据表明肠道来源代谢信号与脂肪偏好和饱腹感调节有关。工业化饮食的高脂肪和低纤维含量迅速使肠道微生物群落转向胆汁耐受生物,同时减少纤维发酵物种,导致包括胆汁酸代谢改变在内的功能变化。
√ 膳食脂肪改变微生物胆汁酸代谢影响脂肪感应
胆汁酸是微生物组衍生的关键代谢产物,将饮食与宿主代谢和摄食神经控制相结合。胆汁酸传统上因其在脂质乳化和吸收中的作用而受到认可,现在被认为是参与肠道激素通路、迷走神经传入神经元和中枢食欲回路的生物活性信号分子。
饮食、肠道微生物组组成、胆汁酸组成和摄食行为间的相互关系表明存在动态调节系统,其中膳食脂肪改变微生物胆汁酸代谢和胆汁酸组成,进而调节脂肪感应、饱腹感和食物摄入量。
高脂肪饮食通过重塑肠道微生物组和胆汁酸库破坏这种调节平衡,对肠脑信号传导产生下游影响。这些转变部分由微生物解偶联和初级胆汁酸脱羟基化为二级形式驱动,改变肠道和肝脏中的受体信号传导。例如,暴露于西方饮食的小鼠表现出胆汁酸组成变化,降低参与代谢调节的关键受体激活,包括法尼醇X受体和G蛋白偶联受体5,导致肠道激素分泌受损和代谢功能障碍。在人类中,不受控制的进食行为与扭链瘤胃球菌(Ruminococcus torques)和双歧杆菌属(Bifidobacterium spp)富集以及参与胆汁酸代谢和神经递质产生的基因表达减少有关。
高脂肪饮食对肠道微生物群和粘液屏障的影响
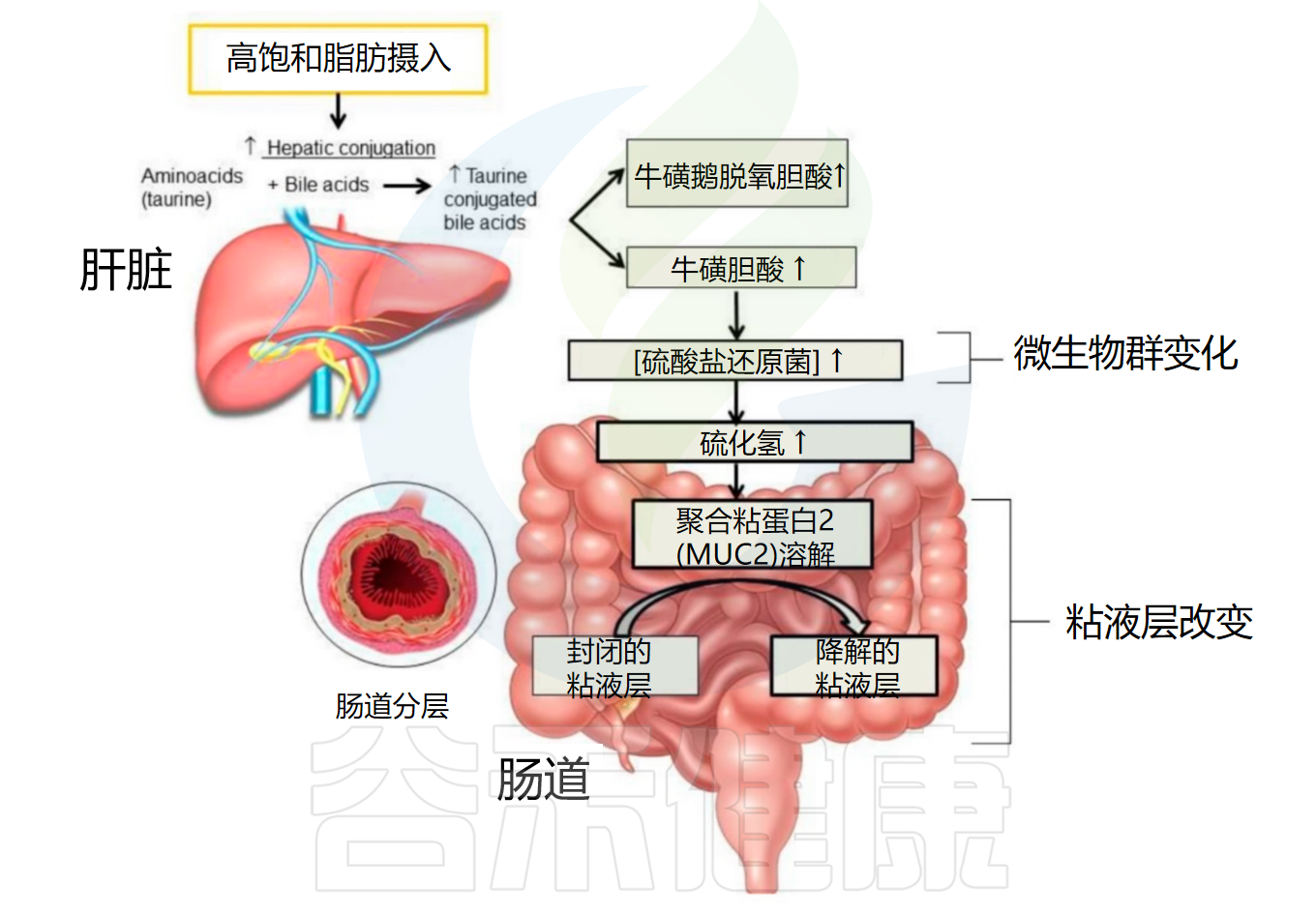
doi: 10.3390/nu11102393.
√ 胆汁酸可以充当肠道信号影响饱腹感和摄食行为
胆汁酸组成对摄食行为的影响是动态的,因为胆汁酸还影响膳食脂肪的感知和代谢方式。由关键胆汁酸产生酶CYP8B1破坏引起的小鼠12α-羟基化胆汁酸丢失会改变肠道脂质感应。这种变化增强GPR119介导的肠道激素分泌,从而增加饱腹感并减少高脂肪饮食消耗。
虽然胆汁酸主要通过肠道激素信号传导和迷走神经激活调节脂肪消化和饱腹感,但内源性大麻素通过直接参与奖励途径加强脂肪偏好来扩展这种调节功能。内源性大麻素系统通过CB1受体介导的抑制和兴奋性输入微调多巴胺和血清素信号传导,抑制奖励相关区域的多巴胺释放,同时以特定区域方式调节血清素传递——这些机制共同塑造包括摄食和强化学习在内的动机行为。
√ 肠道微生物群通过调节内源性大麻素水平诱导脂肪摄入
饮食引起的肠道微生物组组成变化通过调节生物活性内源性大麻素的合成和降解影响这些过程,导致回肠和血浆内源性大麻素水平平行变化。因此,限制和间歇性暴露于高脂肪饮食会改变大脑内源性大麻素信号传导并诱导暴饮暴食样行为。
内源性大麻素信号传导对膳食脂肪摄入的选择性反应。在受控喂养模型中,肠道内安非他命和2-花生四烯酰甘油水平对脂肪有反应但对碳水化合物或蛋白质无反应,迅速升高。直接给药这些内源性大麻素足以诱导脂肪偏好,迷走神经切断术消除了它们在空肠中脂肪诱导的积累和行为反应,加强了肠脑轴作为脂肪驱动奖励信号传导渠道的作用。
一个关键问题是肠道微生物组本身是否合成影响宿主食物摄入的生物活性脂质介质。肠道细菌可将膳食中的ω-3多不饱和脂肪酸转化为内源性大麻素样分子,表明微生物代谢可能至少扩展了宿主脂质信号传导的范围。
5
盐
世界卫生组织推荐盐的最大摄入量为5g/天。高盐饮食是高血压、肾损伤和心血管疾病发展的主要危险因素之一。高盐饮食还通过直接损害胃粘膜导致上皮增生,与胃癌风险增加相关。此外,考虑到幽门螺杆菌CagA阳性菌株是胃癌风险的标志物,当暴露于高盐饮食时,胃幽门螺杆菌通过诱导CagA表达来改变其毒力。
√ 高盐饮食会减少乳杆菌等有益菌并促进炎症
几项小鼠模型研究表明,高盐饮食与乳酸菌属、Oscillibacter、Pseudoflavonifractor、Clostridium XIVa、Johnsonella和Rothia的丰度降低相关,同时Parasutterella、Erwinia、Christensenellaceae、Corynebacteriaceae和瘤胃球菌属的丰度增加。
特别是,与高盐饮食相关的乳酸菌属减少会增加Th17细胞,这是许多炎症性疾病的促炎标志。进一步研究表明,高盐饮食诱导的小鼠结肠炎恶化与乳酸菌属减少有关,导致保护性短链脂肪酸产生改变,这些变化改变了肠道免疫稳态,增加了对炎症损伤的易感性。高盐饮食可能导致肠道菌群组成改变,厚壁菌门/拟杆菌门比率增加,从而改变与肠道通透性和免疫稳态变化相关的短链脂肪酸产生。
6
微量营养素
微量营养素在塑造肠道微生物群中起着重要作用,而肠道微生物群又是介导其保护性健康影响的有效参与者。
√ 许多拟杆菌和梭菌都能合成B族维生素
肠道微生物群可以合成多种维生素,包括硫胺素(VB1)、核黄素(VB2)、烟酸(VB3)、生物素(VB7)、泛酸(VB5)、叶酸(VB9)等B族维生素以及维生素K。拟杆菌门、梭菌门和变形菌门的细菌许多具备核黄素和生物素生物合成途径,大部分梭菌门都能产生维生素B12,而拟杆菌门是B族维生素的主要产生者。
√ 维生素会影响肠道菌群组成并可能对免疫和炎症性肠病有益
另一方面,研究表明维生素D等维生素会影响肠道微生物群组成。维生素D通过调节肠道微生物组和增加有益细菌菌株丰度,对炎症性肠病患者产生积极影响。在3-6个月大婴儿的研究中,维生素D与Lachnobacterium增加和乳球菌减少相关,这些变化可能对免疫系统调节和哮喘/过敏性疾病发病率产生长期影响。
其他抗氧化维生素,如负责许多水果和蔬菜黄色、橙色和红色的类胡萝卜素,也可能影响肠道微生物群组成。最近一项人类植物疗法研究确定叶黄素是黑醋栗提取物粉末的成分,并证明叶黄素显著促进双歧杆菌和乳酸杆菌生长,同时减少拟杆菌属和梭状芽胞杆菌属等其他细菌种群。
另一方面,血清类胡萝卜素水平可能受肠道微生物群组成影响。研究肠道宏基因组改变与动脉粥样硬化的关联,提出健康对照血清中高水平β-胡萝卜素可能由于肠道微生物群产生这种抗氧化剂。该研究表明β-胡萝卜素的抗炎作用由肠道微生物群介导。
7
食品添加剂
随着加工食品发展,食品添加剂(如非营养性甜味剂和乳化剂)数量飙升。人造甜味剂几乎被添加到所有加工食品中,通常有助于提高稳定性和保质期,并改善味道和质地。
√ 人造甜味剂可能改变肠道菌群并诱导不良反应
食用人造甜味剂会改变肠道菌群,并在宿主中诱导微生物群介导的不良反应(如葡萄糖耐受不良)。无热量人工甜味剂改变了微生物代谢途径,并将这些变化与宿主对代谢疾病的易感性联系起来。
几项研究证实,人工甜味剂摄入增加了拟杆菌属和一些梭菌属丰度,降低了梭状芽胞杆菌属、双歧杆菌属和乳酸菌属丰度,同时空腹血糖水平升高和胰岛素反应受损。
√ 膳食乳化剂可能促进全身炎症和菌群失调
除人造甜味剂外,膳食乳化剂(如卵磷脂、脂肪酸的甘油单酯和甘油二酯)可在体外增加细菌跨上皮细胞易位,促进全身炎症,改变微生物群定位和组成。乳化剂摄入降低了肠道微生物多样性和拟杆菌门丰度,增加了阿克曼菌(Akkermansia muciniphila)等粘液降解细菌的丰度。这些微生物群改变易导致菌群失调和慢性肠道炎症,促进结肠炎和代谢综合征发生。
03肠道微生物群在味觉和饮食行为中的作用感知和品尝营养物质的能力在维持营养平衡、食用有益食物以及识别变质食物方面起着至关重要的作用。动物模型已证明,特定信号机制会影响不同口味(甜、苦、咸、酸和鲜)的反应性。因此,肠道微生物对这些信号传导机制的调节可影响宿主摄取特定营养物质,从而增加它们的食物底物和存活率。
√ 饮食失调会导致对应的味觉反应改变
患有饮食失调的个体具有与其表型相对应的味觉反应性改变。事实上,肥胖与对甜味和脂肪味的反应性降低有关,导致人们转向偏好这些味道浓度较高的食物。此外,神经性厌食症患者的味觉受损,这已被证明会随着体重增加而改善。
舌头上的味觉受体细胞检测传递味觉的信号,随后通过孤立束传递到丘脑,向其他大脑区域发出信号。这些味觉受体细胞还表达厌食激素如GLP-1、PYY和胆囊收缩素,表明存在通过胃肠道激素分泌导致食欲下降的外周信号通路。
注:PYY敲除小鼠对脂肪和苦味化合物的行为反应降低。在这些小鼠中重建唾液PYY浓度会改善它们对脂肪的反应,但不会改善苦味反应。此外,在味觉反应性增加的个体中检测到较高浓度的循环TNF-α、胰岛素样生长因子1和瘦素,表明这些特定循环激素可能在味觉感知中发挥作用。
▸ 肠道微生物影响味觉
很少有研究调查肠道微生物群在宿主营养和味觉感应中的作用。最近的研究表明,使用选择性培育的西方低糖精和高糖精消耗大鼠模型,天生更易摄入糖精的大鼠具有与不易摄入糖精的大鼠不同的肠道微生物群组成。
√ 肠道微生物群通过影响味觉受体影响饮食偏好
此外,对无菌小鼠的研究表明,肠道微生物群能够影响味觉受体,从而影响味觉。例如,据报道小鼠中肠道甜味受体增加,蔗糖偏好增加。此外,小鼠对舌FA转位酶的口服偏好和表达增加,但FA受体的肠道表达降低,表明脂肪信号转导减少。
关于肠道微生物群对营养和味觉感应以及味觉功能影响的知识表明,这些影响可通过免疫系统调节分化味觉受体细胞的持续供应来实现。这些细胞在味觉化合物检测中必不可少,并通过味蕾细胞直接或间接传递后续信号,从而产生口腔味觉感知。
√ 肠道微生物可能通过调节免疫功能影响味觉
分化味觉受体细胞的持续供应对正常味觉功能至关重要,而这种供应的中断可能对味觉信号传导有害。免疫系统激活导致舌头上味觉受体和味蕾细胞的细胞更新和寿命缩短,这可能通过哺乳动物toll样受体以及I型和II型IFN受体介导,因为它们位于味觉细胞中。几项研究进一步指出免疫系统功能与味觉相关。例如,IL-10敲除小鼠的味蕾和味觉受体细胞数量减少,并且对脂多糖诱导的炎症反应增加。此外,TNF敲除小鼠对各种苦味化合物的反应降低,但对其他口味的反应也降低。
细菌衍生毒素脂多糖会导致舌头炎症反应,同时味觉细胞寿命缩短和味觉偏好降低。此外,小鼠长期口服脂多糖会导致甜味受体表达降低和对蔗糖的反应降低。
值得注意的是,脂多糖给药还会导致包括快感缺乏和焦虑成分的疾病行为,因此在研究体内行为时可能是混杂因素。然而,脂多糖给药降低了舌味上皮中c-Fos的表达,表明存在局部抑制的细胞活性。此外,将脂多糖皮下注射到舌腹表面会导致白细胞募集,并通过主要感觉传入神经鼓索抑制钠诱导的味觉信号传导。
综合来看,这些结果表明肠道微生物群可通过免疫系统调节影响宿主的营养和味觉信号传导,从而影响味觉功能,而脂多糖是其中的潜在介质。
▸ 肠道微生物影响其他饮食相关行为
除了味觉功能外,其他与饮食相关的行为很可能受到肠道微生物群及其代谢物的影响。尽管尚未广泛研究与肠道微生物群的直接联系,但嗅觉功能、与食物相关的认知加工、与食物相关的冲动和强迫性以及食物摄入的社会方面很可能容易受到微生物组调节。
√ 肠道微生物可能在食物成瘾中起关键作用
最近有假设肠道微生物群在成瘾中起关键作用,这可能与有争议的食物成瘾概念特别相关。肠道微生物群已经与小鼠的可卡因使用和人类的酒精依赖有关。同样地,大麻的主要精神活性成分Δ9-四氢大麻酚的给药缓解了高脂肪饮食诱导的与肠道微生物群改变相关的脂肪量和体重增加。
关于肠道微生物群在食物成瘾中的作用,特别是其他与饮食相关的行为,仍有很多未知数,因此需要进行更多研究,以更全面地了解肠道微生物群在饮食相关行为中的作用。
√ 微生物可能影响饮食紊乱导致焦虑和抑郁
饮食和代谢紊乱通常与焦虑和抑郁等其他行为合并症相关,因此这些行为可能存在很强的双向相互作用。影响这些食物相关行为的微生物或微生物衍生代谢物也有可能会改变宿主的食欲和新陈代谢。
微生物群-肠-脑轴的影响在焦虑和抑郁等行为中也越来越受到认可。因此,关于焦虑、压力、抑郁、社交和其他行为的发现对于全面了解饮食和代谢紊乱至关重要。
最近的一项研究表明,住院时神经性厌食症患者的肠道微生物群组成和多样性与抑郁、焦虑和饮食失调精神病理学水平相关。此外,许多与微生物群-肠-脑轴相关的食物相关行为发现通常通过肠道微生物群与宿主代谢和食欲相互作用的途径介导,包括免疫系统调节、迷走神经信号传导和神经化学物质产生。
▸ 工业化饮食塑造的不良饮食行为
工业化社会中饮食失调的患病率不断上升,反映出饮食行为与调节饱腹感的内部信号脱节。超加工食品作为工业化饮食的标志,可以通过增强奖励敏感性和鼓励超越生理饱腹感信号的摄入来发挥作用。
√ 超加工食品导致微生物多样性减少和氧化应激
微生物代谢被视为连接工业化饮食与适应不良饮食行为的潜在因素。工业化饮食通过提供高度加工的饮食底物,改变肠腔中的资源及其对宿主健康的广泛影响,从而塑造肠道微生物组及其代谢输出。
肠道微生物代谢物的下游变化既是饮食行为改变的潜在驱动因素,也是其强化因素,特别是通过对奖励途径和炎症过程的影响。由饮食和生活方式塑造的工业化微生物组表现出微生物多样性减少和氧化应激相关途径丰富,反映了生态脆弱和促炎状态。
通过这些级联效应,工业化饮食与微生物组-肠-脑轴之间的相互作用有可能形成一个生化反馈循环,从而促进食物成瘾和其他病态饮食行为。
√ 当代高糖低纤维的饮食改变了微生物组成及其代谢物
尽管在工业化和非工业化环境中人类饮食差异很大,但工业化饮食通常含有较少的纤维、较多的糖、蛋白质和脂肪,以及较高的总体热量。常量营养素平衡的这些变化预计将改变与宿主信号通路相互作用的微生物组衍生代谢物。
例如,膳食纤维减少会减少短链脂肪酸的微生物产生,而短链脂肪酸是饱腹感和代谢调节的关键信号。因此,短链脂肪酸信号传导受损可能会削弱控制饱腹感的肠脑通路,从而促进暴饮暴食和热量过剩。
膳食糖的增加驱动了适应糖的微生物丰度增加,牺牲了纤维发酵微生物,并通过短链脂肪酸的丢失直接损害了食欲调节。升高的膳食蛋白质驱动微生物代谢产生神经活性氨基酸代谢物,如犬尿酸和酪胺,这些代谢物能够破坏宿主营养感知并加强寻求蛋白质的摄食行为。
同样,高膳食脂肪摄入量会增加参与胆汁酸代谢的胆汁耐受生物的丰度,这些变化有可能激活奖励途径并促进针对脂肪食物的强迫性饮食行为。
04肠道微生物群及其代谢物作为代谢和食欲控制的治疗靶点随着全球肥胖症和代谢性疾病的流行,传统治疗方法面临疗效有限和副作用明显的挑战。近年来,肠道微生物群作为人体"第二基因组"的重要作用日益受到关注,在调节宿主代谢和食欲控制方面展现出巨大治疗潜力。
研究表明,肠道微生物群不仅参与食物消化和营养吸收,更通过产生短链脂肪酸、胆汁酸代谢产物和神经递质前体等生物活性代谢物,直接影响宿主的能量平衡、糖脂代谢和摄食行为。这些发现使肠道微生物群及其代谢物成为代谢和食欲控制领域极具前景的治疗靶点。
肠道微生物代谢物影响宿主食欲和新陈代谢
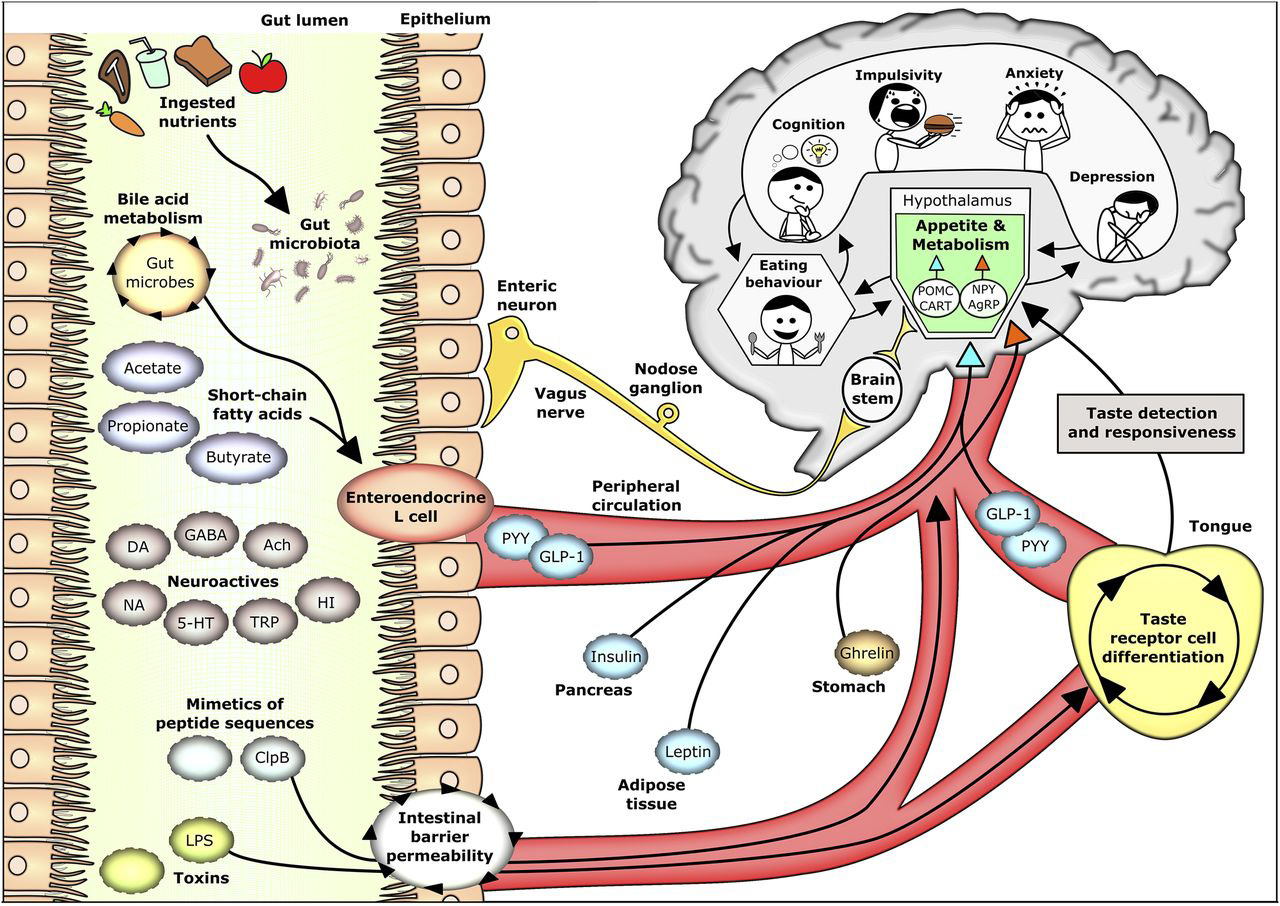
doi: 10.3945/jn.116.240481.
√ 益生元能增加饱腹感并降低餐后血糖水平
益生菌和益生元已被证明是显著改善超重和肥胖个体新陈代谢的有效策略。啮齿动物研究表明,补充益生菌可以促进饥饿的恢复,特定细菌菌株会影响体重或超重肥胖相关症状。
宿主难以消化的膳食纤维等益生元会增加饱腹感并影响餐后葡萄糖和胰岛素浓度。据报道,它们还与能量摄入、体重、胰岛素分泌、循环脂质和炎症标志物的减少相关。
√ 肠道菌群代谢物影响宿主代谢及食欲和摄入
微生物代谢物通过多种途径影响宿主代谢,包括与胃肠道和外周组织的直接相互作用。这些相互作用包括:通过表观遗传机制影响宿主基因表达、影响肠道神经系统并直接诱导迷走神经信号传导、改变胆汁酸信号传导,以及影响整合宿主能量状态的中枢食欲通路。
肠道微生物代谢物调节宿主食欲和新陈代谢控制。摄入的营养物质被肠道微生物利用,导致微生物群组成和功能改变。这些肠道微生物影响胆汁酸代谢,并产生各种代谢物,包括短链脂肪酸、神经活性物质、小蛋白序列和毒素。
部分肠道微生物代谢物通过与肠道中肠内分泌L细胞或迷走神经上的受体直接相互作用,或通过肠上皮转位到外周循环中发挥作用。胆汁酸或短链脂肪酸刺激L细胞导致厌食激素PYY和GLP-1的释放,并可增加胰岛素、瘦素和生长素释放肽等外周激素浓度。这些激素介导的信号转导受免疫球蛋白影响,而免疫球蛋白又可受到刺激或与肠道微生物衍生的小蛋白序列(如ClpB)相互作用。这种蛋白质序列以及肠道微生物衍生毒素(如LPS)的影响受肠道屏障完整性高度影响。
脂多糖还能够诱发免疫反应,可能导致味觉受体细胞分化减少和味觉检测降低。这些通路累积影响食欲和新陈代谢,受下丘脑中促阿片黑皮质素和可卡因苯丙胺调节转录物以及含有神经肽Y和刺豚鼠调节肽的神经元高度调控,最终影响进食行为、饮食相关行为(如认知和冲动)以及与食欲和代谢障碍相关的行为合并症功能失调(如焦虑和抑郁)。
▸ 作用机制
①微生物群-肠-脑轴的核心作用
肠道微生物群通过微生物群-肠-脑轴影响宿主代谢和食欲控制,主要通过以下途径:
-神经途径:通过迷走神经和肠神经系统直接信号传导;
-激素途径:调节GLP-1、PYY、瘦素、胰岛素等代谢激素分泌;
-免疫途径:调节慢性低度炎症和免疫反应;
-表观遗传机制:通过表观遗传修饰影响宿主基因表达。
②关键代谢物及其功能
-短链脂肪酸(SCFA)是最重要的微生物代谢物:
乙酸盐、丙酸盐、丁酸盐由纤维发酵产生,刺激肠内分泌L细胞释放厌食激素(PYY、GLP-1),可穿越血脑屏障直接调节下丘脑食欲中枢,激活迷走神经传入信号,抑制食物摄入。
-胆汁酸代谢产物:调节脂质代谢和能量平衡。
-GABA(γ-氨基丁酸)作为肠道微生物产生的多种神经活性物质之一,与以下物质共同调节宿主代谢和食欲:
组胺:影响食欲和代谢;
乙酰胆碱:调节胃肠道功能;
色胺:参与情绪和食欲调节;
儿茶酚胺(去甲肾上腺素、多巴胺):调节奖励机制和食欲;
血清素:调节情绪、饱腹感和胃肠道蠕动。
-小蛋白序列:如ClpB,影响激素信号传导。
√ 工业化饮食通过破坏微生物群-肠-脑轴造成了以下负面影响:
促进菌群失调:有益菌减少,有害菌增加;
损害饱腹感信号:影响GLP-1和PYY分泌;
增强奖励反应:激活大脑奖励回路,促进过度进食;
诱发慢性炎症:破坏肠道屏障,引起全身炎症;
形成恶性循环:代谢物谱改变强化不良饮食行为。
▸ 应对措施
针对现代高度加工食品对人体健康和肠道微生物群带来的各种负面影响,目前研究和临床实践中主要采用两大类应对策略:一类是通过益生菌、益生元等方式进行的直接微生物调节方法,另一类是通过调整膳食结构和营养成分的饮食干预策略。
√ 直接微生物调节方法
调节肠道菌群的主要方法有四种:
1)施用活的有益细菌菌株(益生菌);
2)施用宿主难消化的膳食纤维,这些纤维经细菌发酵后刺激特定细菌生长(益生元);
3)施用靶向抗生素;
4)粪便微生物群移植。
益生菌治疗:给予特定有益菌株(如Akkermansia muciniphila、Lactobacillus等);
分泌菌株特异性代谢物,改善代谢内毒素血症;
需要持续补充以维持效果。
益生元补充:提供宿主难消化的膳食纤维(如菊粉、低聚糖)选择性促进有益菌生长;
增加SCFA产生,改善饱腹感信号。
靶向抗生素:选择性清除有害菌群;
需要精准识别病原菌;
避免影响有益菌群。
粪菌移植:从健康供体移植微生物群;
适用于严重菌群失调病例;
需要严格的安全性评估。
√ 饮食干预策略
"去工业化"饮食模式
高纤维摄入:每日至少25-35g膳食纤维;
最小化加工:选择全谷物、新鲜蔬果;
低能量密度:减少高糖高脂食品;
植物为主:增加植物性食物比例。
增加发酵食品摄入(酸奶、发酵蔬菜等);
多样化膳食纤维来源(不同类型蔬果、谷物);
控制精制糖和加工食品摄入;
规律饮食,避免暴饮暴食。
05结语想象一下,未来的减肥和健康管理将是什么样子?不再是千篇一律的节食食谱,也不是痛苦的意志力考验。你的医生或营养师可能会给你开一份特殊的“处方”:一份为你量身定制的“菌群优化”饮食方案。
·早餐:可能不再是简单的牛奶鸡蛋,而是一杯富含特定益生元的营养奶昔,专门用来唤醒你肠道中负责传递饱腹感信号的菌群。
·午餐:你的外卖软件可能会根据你上周的菌群报告,为你优先推荐富含短链脂肪酸前体的菜品。
·零食:你甚至可以享用专门设计的“益生菌软糖”,它不仅能解馋,还能精准地为你的肠道“盟友”补充能量。
通过精准调控肠道这个“第二大脑”,我们不仅能从根源上解决肥胖、糖尿病等代谢难题,更能彻底重塑我们与食物的关系——让吃饭回归健康与愉悦的本质。
现代饮食“高糖高脂低纤维”的组合拳,不仅喂饱了我们,更喂养出了一支会“胁迫”大脑、破坏代谢平衡的“叛逆”菌群。喂养你的“好菌”:别再只喂饱你自己,更要喂饱你体内的有益菌。多吃富含膳食纤维的食物,比如燕麦、豆类、全谷物和五颜六色的蔬菜水果。它们是益生菌最爱的“口粮”,能帮你产生更多有益的代谢物,向大脑发送“我饱了”的信号。
好消息是,我们已经找到了扭转战局的钥匙。未来的医学,将不再仅仅关注疾病本身,而是会深入到肠道以及肠道的亿万微生物,这意味着,我们有望从根本上告别“管不住嘴”的困扰,让身体自然而然地渴望健康食物。这一前沿领域不仅为攻克肥胖和代谢综合征带来了曙光,更将引领一场全民性的饮食观念升级:善待你的肠道菌群,就是善待你自己。
主要参考文献
Liow YJ, Sarkar A, Carmody RN. Industrialized diets modulate host eating behavior via the microbiome-gut-brain axis. Trends Endocrinol Metab. 2025 Jul 17:S1043-2760(25)00125-0.
Samulėnaitė S, García-Blanco A, Mayneris-Perxachs J, Domingo-Rodríguez L, Cabana-Domínguez J, Fernàndez-Castillo N, Gago-García E, Pineda-Cirera L, Burokas A, Espinosa-Carrasco J, Arboleya S, Latorre J, Stanton C, Hosomi K, Kunisawa J, Cormand B, Fernández-Real JM, Maldonado R, Martín-García E. Gut microbiota signatures of vulnerability to food addiction in mice and humans. Gut. 2024 Oct 7;73(11):1799-1815.
van de Wouw M, Schellekens H, Dinan TG, Cryan JF. Microbiota-Gut-Brain Axis: Modulator of Host Metabolism and Appetite. J Nutr. 2017 May;147(5):727-745.
Rinninella E, Cintoni M, Raoul P, Lopetuso LR, Scaldaferri F, Pulcini G, Miggiano GAD, Gasbarrini A, Mele MC. Food Components and Dietary Habits: Keys for a Healthy Gut Microbiota Composition. Nutrients. 2019 Oct 7;11(10):2393.
Medawar E, Haange SB, Rolle-Kampczyk U, Engelmann B, Dietrich A, Thieleking R, Wiegank C, Fries C, Horstmann A, Villringer A, von Bergen M, Fenske W, Veronica Witte A. Gut microbiota link dietary fiber intake and short-chain fatty acid metabolism with eating behavior. Transl Psychiatry. 2021 Oct 1;11(1):500.
McDougle M, de Araujo A, Singh A, Yang M, Braga I, Paille V, Mendez-Hernandez R, Vergara M, Woodie LN, Gour A, Sharma A, Urs N, Warren B, de Lartigue G. Separate gut-brain circuits for fat and sugar reinforcement combine to promote overeating. Cell Metab. 2024 Feb 6;36(2):393-407.e7.
Li M, Tan HE, Lu Z, Tsang KS, Chung AJ, Zuker CS. Gut-brain circuits for fat preference. Nature. 2022 Oct;610(7933):722-730.
Tan HE, Sisti AC, Jin H, Vignovich M, Villavicencio M, Tsang KS, Goffer Y, Zuker CS. The gut-brain axis mediates sugar preference. Nature. 2020 Apr;580(7804):511-516.
本文转自:谷禾健康
https://wap.sciencenet.cn/blog-2040048-1500000.html
上一篇:[转载]猫慢性肾病全面科普
下一篇:[转载]肠道炎症的原因,影响和改善措施