博文
[转载]肠道炎症的原因,影响和改善措施
||

清晨被肠绞痛惊醒,聚餐后腹胀如鼓,皮肤莫名冒出红疹...这些现代人熟悉的困扰,根源可能都指向同一个问题——肠道炎症。外卖高油盐饮食、熬夜加班压力、抗生素滥用,正让我们的肠道炎症悄悄出现。
肠道炎症不仅是消化系统问题,更是影响全身健康。肠道是人体最大的免疫器官(70%免疫细胞位于肠道),肠道炎症的严重性远不止于表面症状,当它持续存在时可能导致炎症性肠病、糖尿病、关节炎、抑郁焦虑等神经系统疾病、免疫相关疾病(如过敏)等非常多慢性疾病。研究表明,慢性肠道炎症患者的结直肠癌风险提高,自身免疫疾病患者的肠道通透性标志物连蛋白(Zonulin)水平显著高于健康人群。
正因为它如此重要,肠道炎症已经成为现代医学关注的重要问题。现代医学通过多维度指标评估肠道炎症水平,例如,直接生化标志物,肠道屏障功能等。在谷禾肠道菌群检测报告中,也有“肠道炎症”这项指标。
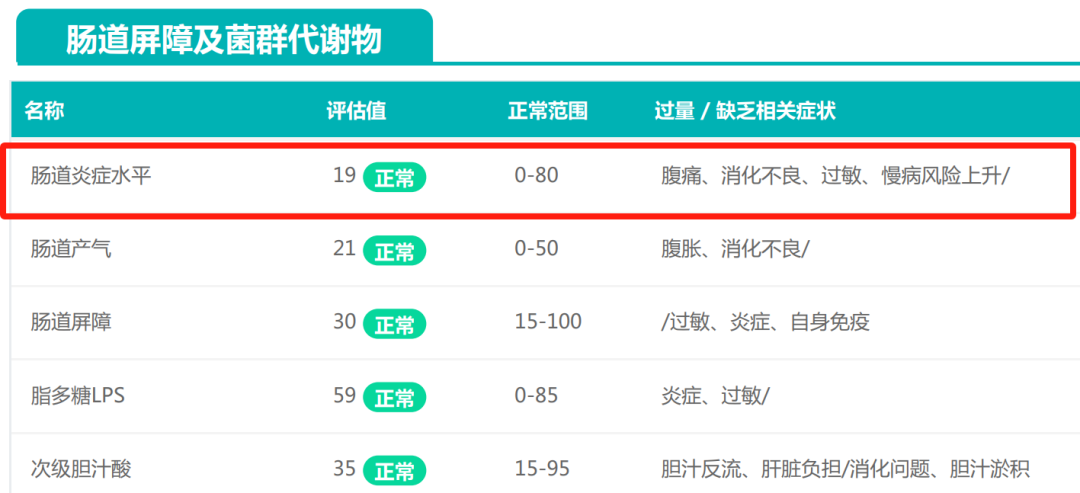
<来源:谷禾肠道菌群检测数据库>
本文深入解析肠道炎症的成因链条——从麸质敏感、工业种子油到慢性压力的触发机制;揭示其如何通过"肠-脑轴"、"肠-皮肤轴"等方式引发全身性疾病;并提供相关干预方案,涵盖屏障修复、菌群重建及创新生物制剂应用等。
01什么是“肠道炎症”?▸ 炎症:是什么?如何作用?
炎症是机体对有害刺激(如病原体、有毒化合物或受损细胞)的反应。它通过清除有害因子并启动修复过程发挥保护作用。
▸ 炎症的四个阶段
炎症过程包含四个不同阶段:
1.静息期,受损细胞释放介质启动炎症反应;
2.血管期,出现血管扩张和血浆外渗;
3.细胞期,中性粒细胞、单核细胞和巨噬细胞浸润,随后激活适应性免疫;
4.消退期,修复组织并清除碎片和炎症细胞。
因此,炎症本质上是一个具有明确起始、发展和结束阶段的生理过程。
慢性肠道炎症的各个阶段
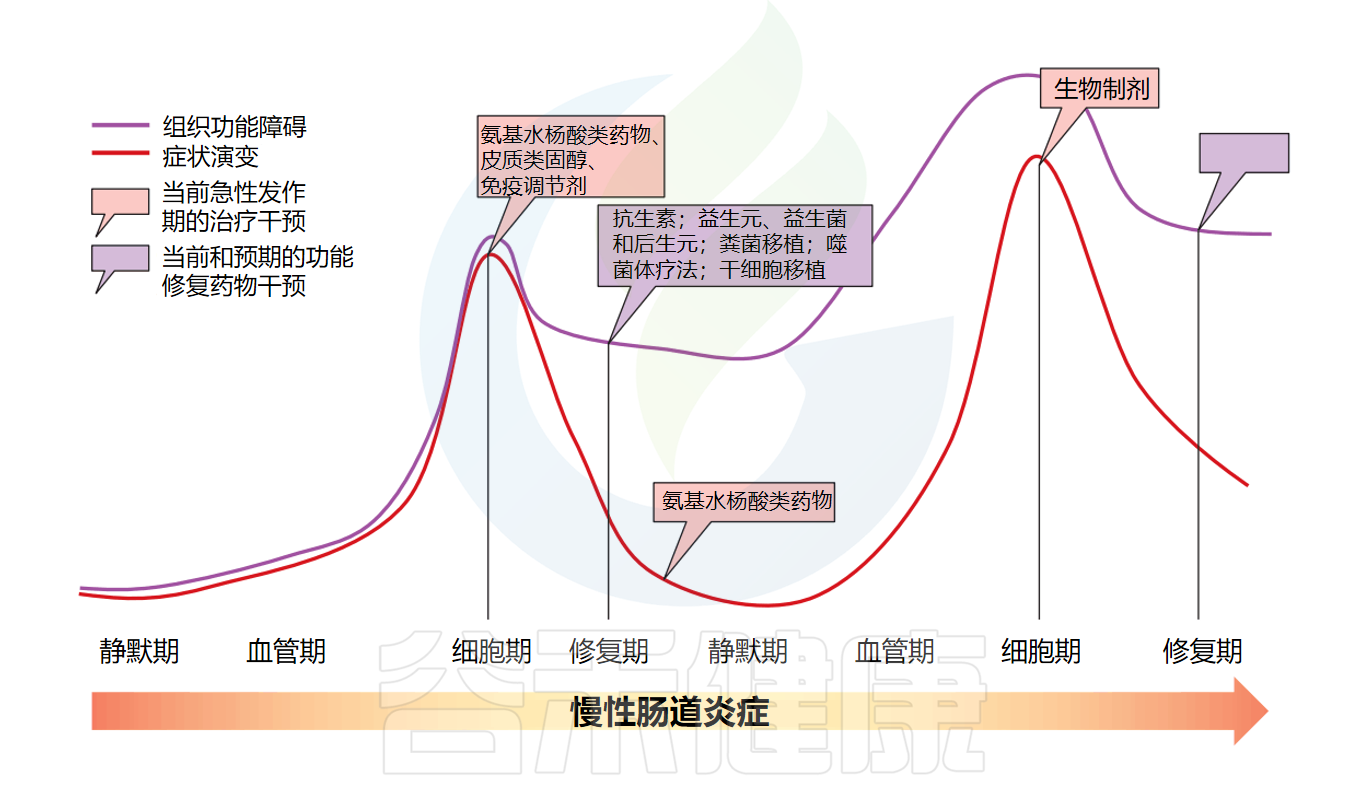
Deraison C,et al.Annu Rev Pharmacol Toxicol.2025
急性炎症可能会发展成慢性炎症
然而,部分患者短期的炎症可能会发展为慢性炎症性疾病,炎症症状持续数月至数年。慢性炎症通常由于未能消除急性炎症的致病因子所致。这可能发生在病原体(如细菌、真菌、寄生虫)感染中,这些病原体能够抵抗宿主防御机制,或当刺激物持续存在且无法被内源性机制(如酶、炎症细胞吞噬作用)降解时。
自身免疫性疾病中也会出现慢性炎症,此时免疫系统错误地将自身蛋白质识别为外来抗原并引起组织破坏,如乳糜泻。正常情况下标志炎症过程结束的消退机制失调同样可导致慢性炎症。在肠道等黏膜表面,负责"处理"外来抗原和调节黏膜组织对微生物暴露反应的机制发生故障也可引起慢性炎症性疾病。这些故障机制包括屏障功能的各个层面——物理屏障(黏液)、细胞屏障(上皮细胞)和免疫屏障(常驻炎症细胞)。
▸ 与肠道炎症相关的疾病
急性回肠炎或结肠炎的发作通常与感染(病毒、细菌、真菌或寄生虫)相关。然而,在某些情况下,急性回肠炎或结肠炎可能是慢性炎症性疾病的最初表现,这些肠道慢性炎症性疾病包括炎症性肠病(IBD)、乳糜泻和肠易激综合征(IBS)。
▸ 炎症性肠病
炎症性肠病(IBD)是一种慢性肠道炎症性疾病,包括克罗恩病(CD)和溃疡性结肠炎(UC)两个主要亚型,通常表现为腹痛、腹泻和血便。
IBD的病程特点是急性炎症发作(活动期)与缓解期和复发期交替出现。在病因方面,普遍认为IBD是遗传易感性和环境因素共同作用的结果,两者协同导致肠道微生物群落改变和免疫反应失控。
▸ 乳糜泻
乳糜泻是一种遗传性免疫疾病。遗传易感个体摄入含麸质食物后,会发生小肠黏膜炎症和绒毛萎缩。小麦面筋蛋白和麦胶蛋白富含谷氨酰胺和脯氨酸,使其对蛋白酶降解具有抗性,在小肠内形成免疫原性大肽。然而,这些肽的存在并不足以引发疾病;患者还必须携带位于DQ位点的特定HLA II类基因。这种遗传易感性使肠道组织更易受到食物诱发的炎症因子影响。
▸ 肠易激综合征
肠易激综合征是一种伴有排便习惯改变的慢性腹痛综合征,尚未发现明确的结构异常或炎症细胞浸润。多项研究探讨了炎症征象与该综合征的关联性。部分研究显示抗炎治疗(如美沙拉嗪)未能缓解肠易激综合征症状,提示炎症可能并非症状成因。
然而,大多数肠易激综合征患者存在免疫细胞激活增强的证据。这些免疫细胞包括在患者结肠组织中发生脱颗粒的肥大细胞,以及在结肠活检中上调的多种促炎介质(组胺、多不饱和脂肪酸代谢物、蛋白酶)。因此,充分证据表明肠易激综合征可视为一种低度慢性肠道炎症性疾病,虽然炎症细胞浸润并非显著特征,但可能存在组织功能紊乱和黏膜稳态改变。
▸ 肠道炎症涉及的分子机制
肠道黏膜炎症状态的共同特征包括微生物群生物膜失调、上皮功能障碍、先天免疫细胞浸润和适应性免疫激活。
肠道炎症患者存在微生物群失调
虽然IBD、乳糜泻或IBS中的微生物群失调可能呈现不同的分类特征,难以识别共同的微生物分子机制,但所有炎症状态均表现出微生物物种多样性和丰富性的减少。
紧密连接分子降解和黏液产生减少
屏障功能改变是另一共同特征。肠道上皮细胞紧密连接分子(如Zonulin和occludin)的降解以及杯状细胞黏液产生减少均与肠道炎症相关。潘氏细胞和肠上皮细胞表达分泌的抗菌肽是肠道屏障功能的重要组成部分,在炎症时功能下降。
α-和β-防御素、溶菌酶以及elafin和分泌型白细胞蛋白酶抑制剂等抗菌肽蛋白酶抑制剂在炎症组织中表达下调。因此,促进紧密连接分子、黏液蛋白和抗菌肽的表达和功能有助于增强肠道屏障功能,被视为治疗炎症的有效方法。
微生物群失调和屏障功能改变共同促进肠道慢性炎症
微生物群失调与屏障功能改变导致微生物对组织的异常暴露增加,引起先天免疫细胞深度激活。活化的巨噬细胞吞噬微生物成分,通过Toll样受体9、磷酸二酯酶4和Janus激酶(JAK)等信号机制释放肿瘤坏死因子α(TNF-α)、白细胞介素(IL)-6、IL-12和IL-23,这些炎症介质和信号通路均被视为治疗慢性炎症的重要分子靶标。
组织损伤或侵袭激活后,肥大细胞、巨噬细胞和中性粒细胞共同释放储存在颗粒中的分子,包括炎症脂质介质(如前列腺素和白三烯)、活性氧(ROS)和蛋白酶,这些均构成炎症治疗的分子靶标。肠上皮细胞同样促进炎症性肠黏膜释放这些介质。
与慢性肠道炎症相关的机制
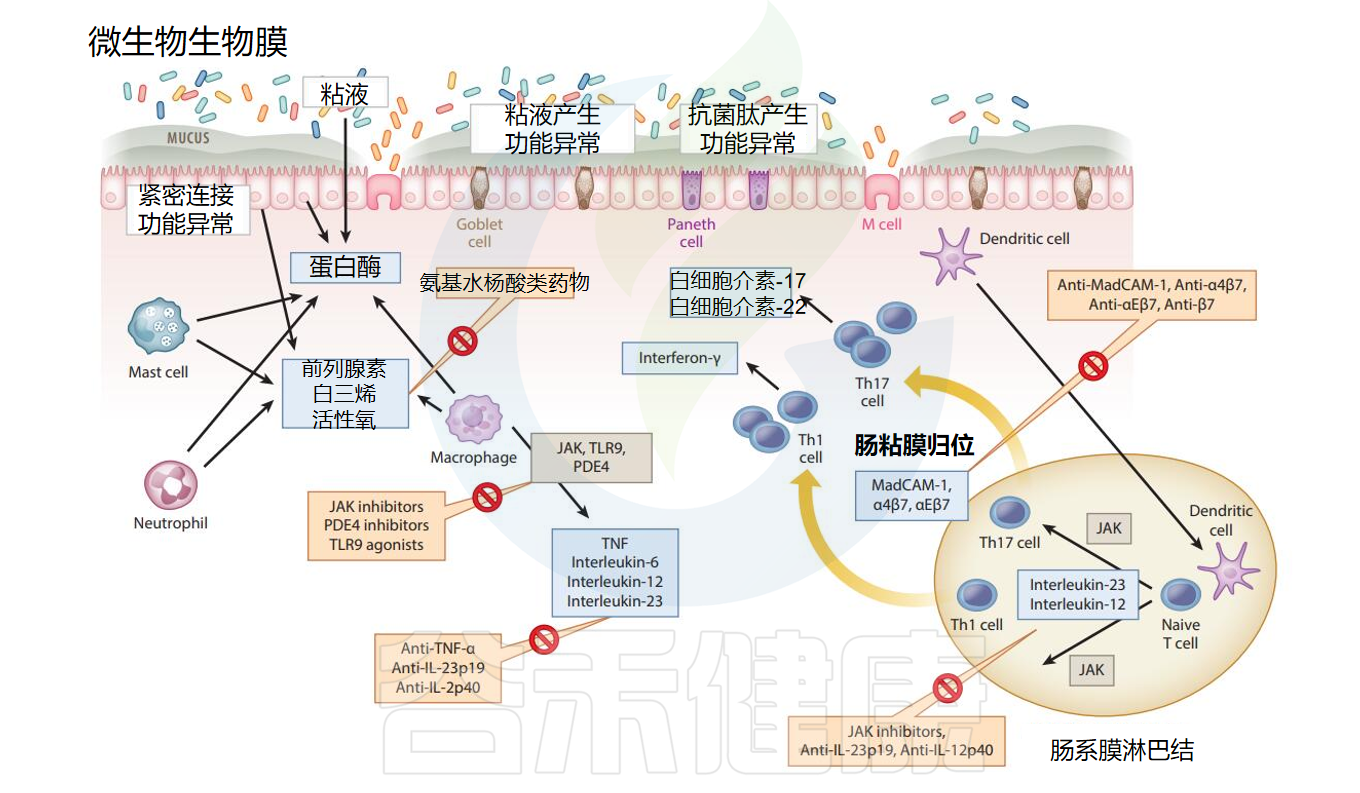
Deraison C,et al.Annu Rev Pharmacol Toxicol.2025
02可能导致肠道炎症的12种饮食和生活方式1
麸质——乳糜泻或麸质敏感人群的炎症
麸质蛋白是小麦、大麦、黑麦和燕麦的主要储能蛋白,位于谷物胚乳中,由麦谷蛋白和醇溶谷蛋白以1:1比例构成。
麸质会引起乳糜泻和麸质敏感患者炎症
麸质会导致乳糜泻和非乳糜泻麸质敏感性(NCGS)患者的炎症。乳糜泻是一种麸质自身免疫反应,表现为肠组织结构破坏、胃肠道不适及肠外症状(如皮疹和贫血)。
人群筛查显示乳糜泻为最常见的慢性胃肠道疾病之一,但因临床表现多样且模糊,绝大多数患者仍未被识别。虽然吸收不良和胃肠道症状较为人知,但多数患者实际表现为肠外症状,可累及神经系统、肝脏、皮肤、生殖和肌肉骨骼系统等全身器官,且可在不同年龄出现,更难确定诊断。
麸质会激活肠道肥大细胞并释放促炎分子
麸质与肠道CXCR3受体结合促进zonulin释放,引发易感个体肠道炎症。Zonulin分解上皮细胞间紧密连接蛋白,增加肠通透性和炎症。麸质还激活肠道肥大细胞释放组胺和类胰蛋白酶等促炎分子,使炎症持续存在。

需要注意的是,麸质并非对所有人都引起炎症。无乳糜泻或无非乳糜泻麸质敏感性(NCGS)的人通常能耐受饮食中的麸质。
注:多数晚期肠外表现可通过乳糜泻早期诊断预防。提高诊断率的方法是筛查高危人群,但无麸质饮食维持困难、社会限制且昂贵,可能降低生活质量,特别是症状轻微的患者。然而,证据表明即使无症状成年人也可能已有晚期组织学病变并从饮食治疗中获益,且诊断延迟会增加临床反应不良风险。
2
工业种子油
从大豆、玉米、油菜籽、棉籽和红花籽提取的高度加工工业籽油在标准饮食中占主要份额。这些油不到两个世纪前才引入人类饮食,与一些人体进化不匹配,会促进肠道炎症。
工业种子油烹饪会产生促炎产物
工业种子油富含ω-6脂肪酸,易受光和热损害。用其加工烹饪产生氧化炎症副产品,食用后引起肠道炎症。研究发现,富含工业种子油的饮食不仅会引起肠道炎症,还促进肠道病原体生长。
脂质饮食对肠道微生物群多样性的影响
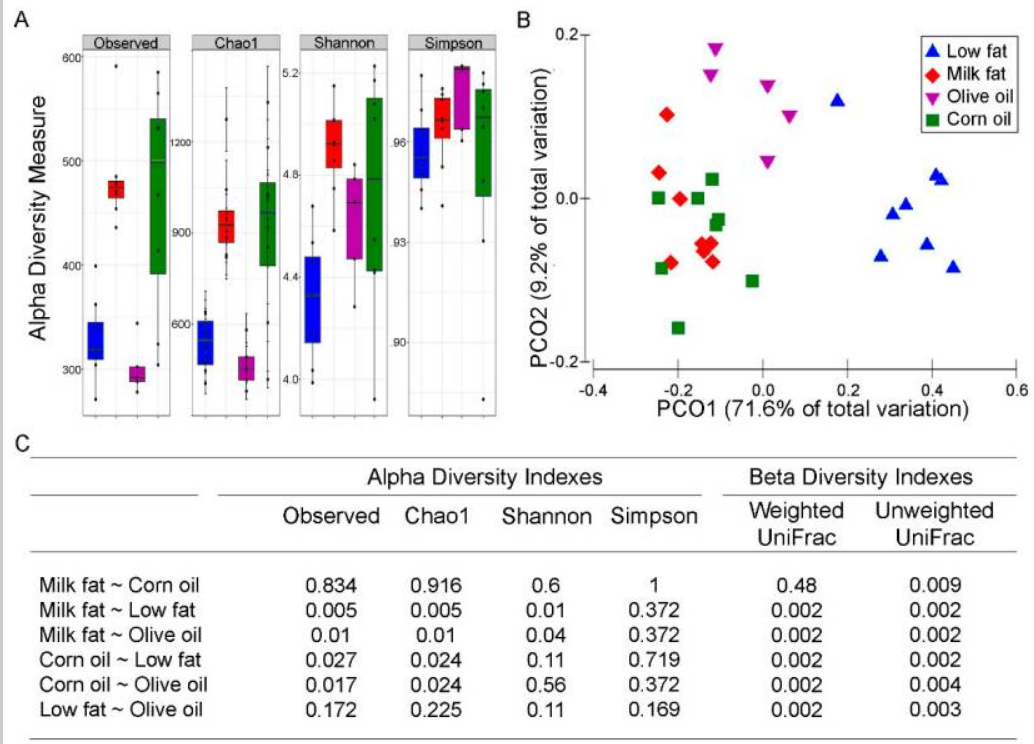
doi: 10.3390/nu11020418.
脂质是哺乳动物正常发育和生存必需品,其化学性质细微差别影响生理和炎症反应。
不同的膳食脂质会影响肠道微生物群,可能促炎
研究显示饮食脂质对肠道微生物的影响:乳脂和玉米油饮食增加微生物多样性,橄榄油效果与低脂饮食相似;饮食脂质解释80.8%的微生物变异,形成三个不同聚类群;不同脂质类型特异性塑造肠道微生物群落。
总的来说,单不饱和脂肪酸消费与健康益处相关,包括降低消化系统癌症、2型糖尿病和炎症性肠病(IBD)发病率,橄榄油饮食可有效预防小鼠结肠炎。相比之下,虽然北美膳食指南推荐植物籽油中的ω-6多不饱和脂肪酸,但过量摄入是人类IBD风险因素,研究证实其加剧鼠结肠炎。
对于存在于乳制品和椰子油中的饱和脂肪酸,虽然数十年来被批评对健康不利,但欧洲前瞻性队列研究发现牛奶消费与IBD风险降低相关。然而,饲喂饱和脂肪酸通过与胆汁酸结合促进沃氏嗜胆菌(Bilophila wadsworthii)生长,增加IL-10-/-小鼠自发性结肠炎。但动物脂肪成分如丁酸具有抑制炎症、防止DSS-结肠炎和刺激结肠修复的作用。
3
非细胞碳水化合物
非细胞碳水化合物是指缺乏细胞壁的高碳水化合物密度食物,如面粉和糖,在饮食中大量存在并促进炎症性肠道微生物群。相比之下,细胞碳水化合物是含完整细胞的碳水化合物食物,如红薯和整个水果,通过促进抗炎肠道细菌生长来促进肠道健康。
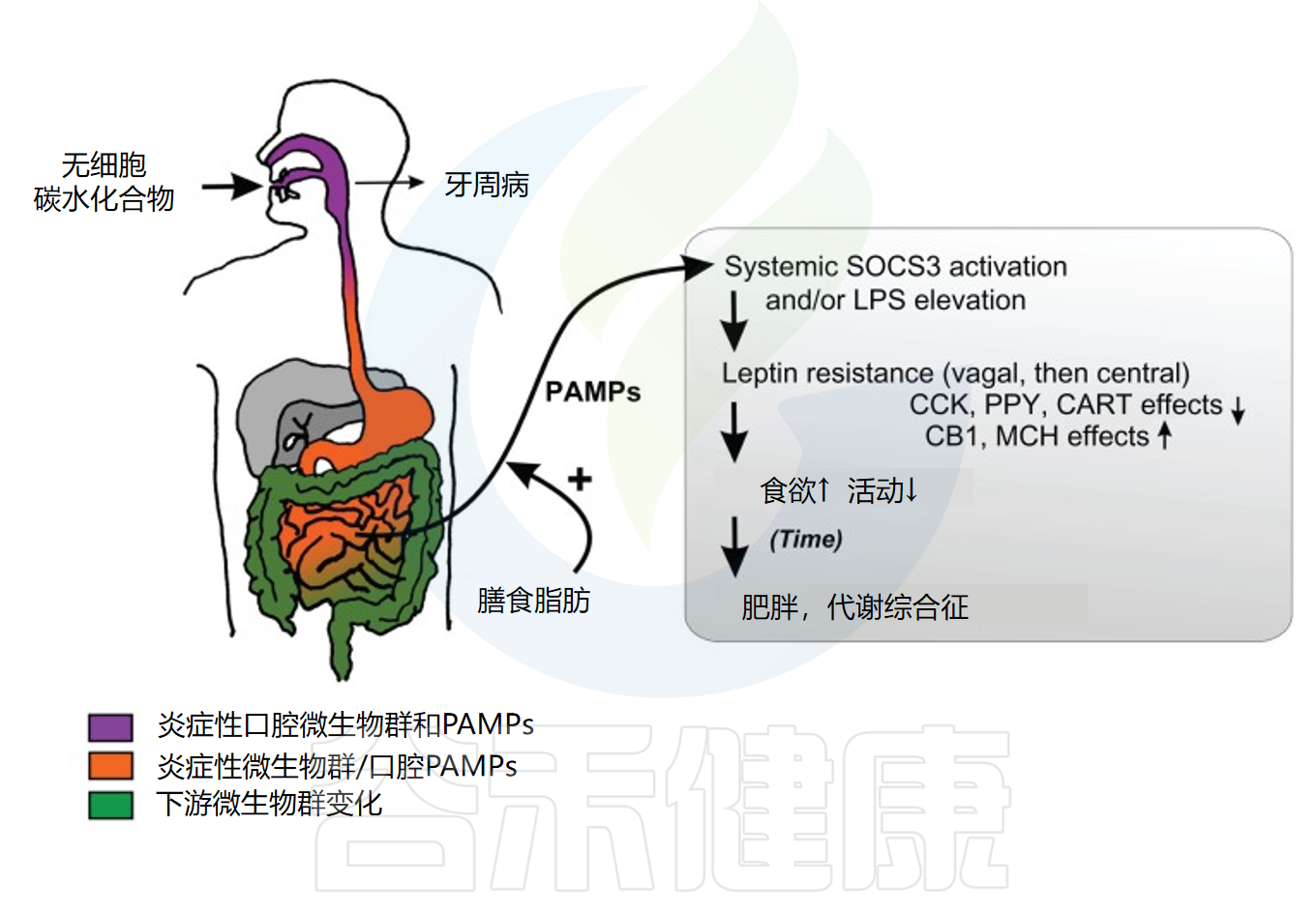
doi: 10.2147/DMSO.S33473. Epub 2012 Jul 6.
现代食品中的无细胞致密碳水化合物从口腔开始产生炎症微生物群,最初引起牙周病。小肠暴露于口腔微生物群的脂多糖和其他病原体相关分子模式,并通过无细胞碳水化合物调节自身小细菌群的促炎性。膳食脂肪增强全身吸收后,炎症细菌化合物诱导瘦素抵抗和过度进食。
4
食品添加剂
超加工食品日益增多且含有大量食品添加剂。大多数添加剂缺乏长期安全性研究,而越来越多证据表明其对肠道炎症有害。
食品添加剂促进促炎细菌生长并增加肠道通透性
人造甜味剂三氯蔗糖刺激炎症肠道细菌的生长。海藻多糖角叉菜胶因其增稠和乳化特性被使用,但会加剧炎症性肠病。常见食品乳化剂羧甲基纤维素和聚山梨酯-80增加肠道通透性。增白剂二氧化钛在肠道引起炎症细胞因子反应。为防止肠道炎症,避免或减少这些普遍存在的食品添加剂应是首要任务。
5
剖腹产和配方奶喂养
剖腹产和奶粉喂养婴儿更易患肠道炎症
剖腹产深刻改变发育中婴儿肠道,用环境微生物而非母亲阴道有益微生物接种微生物组。剖腹产婴儿还通过胎盘循环暴露于预防术后感染的抗生素。这种早期抗生素暴露进一步扭曲婴儿肠道微生物群发育,使孩子易患肠道炎症和哮喘、肥胖等慢性炎症性疾病。
配方奶粉喂养对脆弱婴儿肠道同样可能有害。配方奶喂养的婴儿具有较高水平的促炎细菌类γ-变形菌门,增加肠道通透性和总细菌负荷。相反,母乳喂养增加婴儿肠道抗炎乳酸杆菌和双歧杆菌定植,降低肠道炎症和慢性炎症性疾病风险。
6
肠道感染
细菌、病毒、真菌和寄生虫等各类病原体引起的肠道感染会显著改变肠道微生物群的正常组成结构,从而创造出一个促进炎症反应的肠道内环境。
细菌和病原体感染会变相增加一些促炎细菌丰度
例如,甲型流感病毒感染过程中会通过多种机制减少具有保护作用的肠道有益细菌数量,这种保护性细菌的减少会瞬时性地增加机体对沙门氏菌属等致病菌的易感性,使患者更容易发生继发性细菌感染。
与此同时,幽门螺杆菌这种常见的胃部致病菌在感染过程中不仅会直接损害胃黏膜,还会通过复杂的相互作用机制增强普雷沃氏菌这种典型促炎细菌在肠道中的生长和繁殖能力。
食物中毒也会促进肠道炎症反应
此外,急性食物中毒事件除了造成胃肠道症状外,还可能通过刺激肠道免疫系统产生针对自身组织的炎症性自身抗体,这些异常的免疫反应不仅会引发持续性的肠道炎症状态,还可能进一步发展为肠易激综合征等功能性肠道疾病。
7
压力
人类的肠道对慢性压力非常敏感。糖皮质激素水平的长期升高驱动肠神经胶质细胞的炎症亚群的产生,通过集落刺激因子-1(CSF-1)促进单核细胞和TNF介导的炎症。此外,糖皮质激素通过TGF-β2引起肠神经元的转录不成熟、乙酰胆碱缺乏和运动障碍。
压力促使脂多糖进入血液导致炎症
慢性心理压力还会增加肠道通透性,并允许脂多糖(LPS),一种炎症细菌的副产物,进入血液循环;这会导致局部和全身炎症反应。应激还消耗保护性肠道粘膜层,并增加细菌粘附和渗透到肠上皮细胞中,引起肠道炎症。
不同居住条件下心理压力对肠道炎症的加剧作用
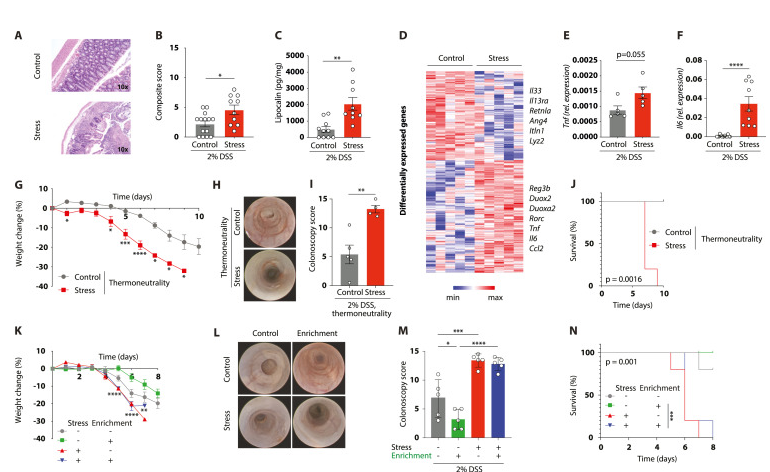
DOI: 10.1016/j.cell.2023.05.001
糖皮质激素治疗结肠炎的效果与心理压力相关
压力会导致炎症性疾病,而心理压力的典型全身介质——儿茶酚胺和糖皮质激素通常被认为具有抗炎作用。由于糖皮质激素受体激动剂泼尼松用于治疗IBD患者结肠炎,糖皮质激素信号传导诱导炎性肠神经胶质细胞和结肠炎恶化尤其令人困惑。
例如,长期压力或地塞米松治疗可能因负反馈抑制下丘脑-垂体-肾上腺轴而导致肾上腺皮质酮生产不足。然而,急性糖皮质激素受体抑制的有益作用与"肾上腺抑制"不符。或者,糖皮质激素抗炎和促炎作用间的平衡可能是暂时现象。
虽然急性糖皮质激素治疗改善DSS诱导的结肠炎,研究团队还发现持续升高的皮质酮水平有助于eGAPS的出现和产生TNF的单核细胞的积累。同样,临床观察已经证明,只有短期类固醇治疗才能在IBD中产生有益的结果。所以还是要强调了在炎症性疾病的临床管理中考虑患者心理健康的重要性,治疗效果可能因受影响个体的心理状态而异。
因此,心理状态的评估,结合减少压力,焦虑和抑郁的策略,可能是一个强大的和未充分利用的工具,以提高治疗的成功。
8
久坐不动的生活方式和过度训练
适量运动有助于促进抗炎细菌的生长
适度的运动可以促进有益的肠道细菌,包括产生抗炎性短链脂肪酸(SCFA)的细菌,如梭状芽孢杆菌属、罗氏菌属、毛螺菌属等,从而抑制肠道炎症。相反,久坐不动的生活方式与炎症分子向肠道的渗透增加有关。

然而,运动也并非越多越好。过度的体力活动会增加肠道通透性,对肠道微生物群产生负面影响。如果您患有慢性炎症性疾病或承受严重心理压力,应避免剧烈运动,专注于散步、瑜伽或游泳等温和活动。
9
昼夜节律紊乱和睡眠不足
昼夜节律是以约24小时为周期的内部生化过程,调节包括肠道健康和炎症在内的多项生理功能。当夜间蓝光照射和不规律睡眠等因素干扰昼夜节律时,会促进炎性肠道细菌生长,减少有益微生物,并增加肠道通透性和脂多糖向体循环的转运。
睡眠不足与昼夜节律紊乱促进炎性细菌增长
睡眠不足与昼夜节律紊乱密切相关,对肠道健康同样有害。仅两个晚上的部分睡眠剥夺就能改变肠道微生物群,增加促炎细菌种类,并加剧IBD的肠道炎症。因此,维持正常昼夜节律和充足睡眠对减少肠道炎症至关重要。
10
滥用抗生素
临床医生频繁开处抗生素会给患者带来虚假安全感,轻易就开抗生素已成为社会常态,但其对肠道健康的影响往往被低估。大量研究表明,抗生素可能对肠道微生物群产生长期有害影响,并诱导肠道炎症。
抗生素减少肠道菌群的多样性并导致肠道功能紊乱
抗生素会减少肠道共生细菌的多样性和丰度,使埃希氏菌和念珠菌等条件性致病菌过度生长,抗生素还增加了拟杆菌门/厚壁菌门的比率。抗生素对厌氧菌具有特异性,厌氧菌在人体肠道微生物群中占主导地位并发挥重要作用。克林霉素就是一个例子,这是一种相对广谱的抗生素,主要针对厌氧菌。克林霉素对肠道微生物群有很大的负面影响,表现为对病原体定植的抵抗力降低,导致艰难梭菌过度生长导致伪膜性结肠炎的高风险。克林霉素对肠道菌群的其他影响是胃炎和腹泻。正常肠道功能紊乱可导致腹胀和肠痛等症状。
抗生素可能导致长期的生态失调和肠道免疫下降
抗生素处理的微生物组释放岩藻糖和唾液酸等粘膜碳水化合物。这些物质水平的增加有利于机会性病原体鼠伤寒沙门氏菌和艰难梭菌在肠道内的扩张。肠出血性大肠埃希菌也被证明可以获取肠道微生物群从粘蛋白中释放的岩藻糖或唾液酸。
兵器抗生素导致的微生物的变化可以在停止使用抗生素后持续数月或数年。它们的不良影响在婴儿和幼儿中最为明显,他们正在经历肠道微生物群发育的关键时间窗口。
更令人担忧的是,耐药细菌在接触抗生素后会变得更具炎症性。抗生素还会增加肠道通透性,降低肠道天然免疫防御,从而间接促进肠道炎症。
11
非抗生素药物
除了抗生素会影响肠道微生态外,越来越多的证据表明普通常见药物也会对人体肠道健康产生影响。
胃肠道药物和抗抑郁药物对肠道微生态的影响尤为显著
质子泵抑制剂(PPI)用于治疗胃食管反流病和胃酸反流,通过减少胃酸产生来发挥作用。正常情况下,充足的胃酸能限制环境细菌进入肠道。PPI抑制胃酸产生后,更多细菌得以进入消化道并在小肠中增殖,导致细菌过度生长和肠道炎症,同时竞争资源减少产生抗炎短链脂肪酸的有益细菌生长。
选择性5-羟色胺再摄取抑制剂(SSRIs)除了引起便秘和食欲变化外,也会干扰正常的肠道微生物群结构。临床前研究表明氟西汀(百忧解)会抑制乳酸杆菌生长,同时显著增加Alistipes、各种Lachnospiraceae OTU、Lachnoclostridium和Anaerotruncus等菌属的丰度,从而加剧肠道菌群失调。

口服避孕药也会引发肠道炎症。事实上,它们的使用与克罗恩病(IBD的一种亚型)的风险增加有关。
12
环境毒素
工业界每年开发数千种新化学品,但现有环境化学品已造成的一系列健康危害。
环境毒素也会导致有害细菌增加并引发肠道炎症
肠道炎症是环境毒素暴露的最常见后果之一。双酚A(BPA)广泛存在于塑料水瓶、食品容器、儿童玩具和收银机收据中,通过增加有害肠道细菌和肠道通透性来促进肠道炎症。不含BPA产品中的替代增塑剂同样有害,甚至危害更大。
三氯生是洗手液和个人护理产品中使用的合成抗菌剂,也会加重肠道炎症。草甘膦作为农达除草剂的主要成分,能减少乳酸杆菌并促进耐除草剂大肠杆菌生长,表明其在肠道微生物组中发挥抗生素作用。
03肠道炎症的后果——慢性疾病发炎的肠道会显著增加患多种慢性疾病的风险,包括炎症性肠病(IBD)和结肠癌等消化系统疾病,以及自闭症和阿尔茨海默病等神经系统疾病。肠道炎症作为一个关键的病理过程,与这些严重健康问题的发生和发展密切相关。
因此,积极阻止肠道炎症的发生和进展,对于有效预防这些慢性疾病的出现以及成功管理已有慢性疾病的症状和进程都具有至关重要的意义。通过控制肠道炎症,我们能够从根本上降低患病风险,改善整体健康状况。
1
过敏
促炎细胞因子会刺激诱导过敏性炎症
肠道炎症可能导致季节性过敏。有益和有害肠道微生物失衡会增加肠道促炎细胞因子的释放,这些细胞因子刺激肥大细胞、嗜碱性粒细胞和嗜酸性粒细胞活性,诱导过敏性炎症。生态失调相关的肠道炎症还与特应性皮炎和食物过敏密切相关。
相反,健康的肠道通过释放抗炎短链脂肪酸和调节性T细胞来抑制过敏性致敏,维持免疫平衡。
肠道微生物群与免疫系统之间的相互作用
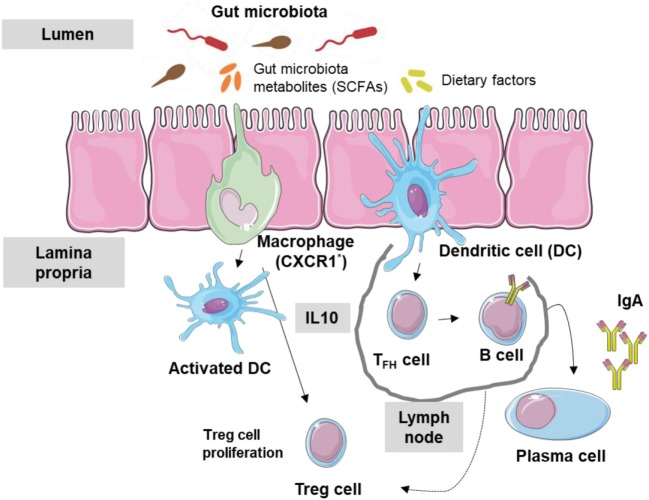
doi: 10.3389/fimmu.2018.01584.
2
自身免疫性疾病
肠道屏障受损在免疫性疾病中发挥重要作用
肠道炎症是自身免疫性疾病发展的先导因素。1型糖尿病患者的循环脂多糖水平更高。Zonulin是肠道屏障受损时释放的蛋白质,自身免疫性疾病患者的Zonulin水平明显高于健康对照组,表明肠漏在自身免疫性疾病中发挥重要作用。
麸质敏感性和慢性应激是肠道炎症的两个主要触发因素,通常在自身免疫疾病发生之前出现。
3
关节炎
口腔和肠道微生物群发生炎症性改变时,会对关节炎的发生和进展产生重要影响。这些微生物群的改变主要表现为致龋细菌牙龈卟啉单胞菌的异常过度生长,同时伴随着有益细菌数量的显著减少,这种微生物失衡状态与关节炎病情的恶化和进展密切相关。
生态失调引起促炎细胞因子释放,导致关节和肌肉病理性改变
当肠道出现生态失调和肠道屏障功能受损导致肠道渗漏时,会在体内诱导广泛的全身性炎症反应。这种炎症反应会触发多种促炎细胞因子的大量释放,这些细胞因子进入循环系统后会直接作用于肌肉骨骼系统,最终导致关节、肌肉和骨骼组织的退化性改变。
有益的抗炎细菌和短链脂肪酸有助于减轻关节炎
然而,与此形成鲜明对比的是,当肠道中存在充足的抗炎细菌和短链脂肪酸时,这些有益成分已被科学研究证实能够有效减轻关节炎症状的严重程度,并且具有预防和阻止骨质流失的保护作用。
4
胃肠道疾病
炎症性肠病(IBD)
肠道炎症是炎症性肠病(IBD)的一个关键特征,包括溃疡性结肠炎和克罗恩病。一系列有害的肠道变化,包括生态失调和肠道通透性增加,会促进IBD的进展。
肠易激综合征(IBS)
科学研究已经深入阐明了肥大细胞在肠易激综合征(IBS)发病机制中发挥的关键作用。肥大细胞作为一类重要的免疫细胞,能够释放多种刺激性化合物,其中组胺是最主要的介质之一。这些刺激性化合物的释放会引起肠道组织的炎症反应,而持续存在的低度炎症状态在IBS的病理过程中扮演着至关重要的角色,直接影响着疾病的发生和发展进程。
在临床表现为腹泻为主的IBS或者混合型IBS的患者群体中,自身免疫机制同样可能在肠道炎症的产生和维持过程中发挥重要作用。特别是在这些特定类型的IBS病例中,患者既往经历的食物中毒事件可能会成为一个重要的触发因素。这些食物中毒事件会刺激机体的免疫系统产生异常的免疫反应,最终导致机体产生能够直接损害和攻击胃肠道组织的自身抗体,从而加重肠道的炎症状态和功能紊乱。
长期的肠道炎症会增加结直肠癌风险
结直肠癌是一种严重威胁人类健康的恶性肿瘤,其发病率和死亡率都相当高。大量的科学研究证据清楚地表明,预先存在的胃肠道炎症状态往往在结直肠癌的发生和发展过程中起到先导作用,也就是说肠道炎症通常会在结直肠癌实际形成之前就已经出现。
通过深入的研究分析,科学家们已经成功确定了多种能够引发结直肠癌发生的炎症触发因素。包括各种有害的肠道病原体感染,肠道内负责产生丁酸盐的有益细菌数量处于异常低下的水平,以及长期摄入高度加工和精制的典型西方饮食模式,这些因素都会通过不同的机制促进肠道炎症的发生,进而增加结直肠癌的患病风险。
肠道炎症还会引发憩室炎
憩室炎是一种肠壁刺激,由肠道炎症引发。其特征在于结肠中的生态失调和粪便钙卫蛋白升高,这是当胃肠道中存在活动性炎症时由白细胞释放的蛋白质。
5
心血管疾病
心血管疾病(CVD)是全球死亡的主要原因,药物和手术是传统医疗的基石。然而,越来越多的证据表明肠道和心脏健康之间存在重要联系,肠道靶向治疗可能是未来CVD的治疗方法。
生态失调会促进斑块形成和高血压
肠道内多种炎症过程影响心血管疾病的病程。生态失调通过释放脂多糖和肽聚糖等革兰氏阴性和阳性细菌的炎性细胞壁成分,促进动脉粥样硬化斑块形成和高血压,从而导致心血管疾病。菌群失调还会影响胆汁酸代谢,损害胆固醇和甘油三酯等血脂的排泄。
6
抑郁和焦虑
最新的科学研究表明,免疫系统在抑郁症和焦虑症的发生和发展过程中起着至关重要的作用。考虑到人类肠道系统拥有约70%的免疫细胞和免疫组织,集中了机体免疫系统的绝大部分功能,因此肠道内发生的炎症反应会对心理健康状态产生显著而深远的影响也就完全不足为奇了。
肠道炎症通过肠-脑轴诱导大脑产生神经炎症反应
肠-脑轴是连接肠道肠神经系统和中枢神经系统之间的一个复杂的双向信号传递网络系统,这个重要的生理网络在介导和调节肠道炎症状态与心理健康水平之间的密切关系方面发挥着关键作用。
当肠道内出现各种炎症刺激时,这些炎症信号会通过肠-脑轴这一重要通道向大脑传送相关信息,从而在大脑组织内诱导产生神经炎症反应,并且显著改变和影响各种神经递质的正常合成和分泌过程。这些深层次生化变化所带来的直接后果就是大脑神经活动模式发生异常改变,最终表现为抑郁症和焦虑症等精神心理疾病的临床症状。
抑郁症和焦虑症患者对抗肠道炎症的能力减弱
这种具有炎症特征的肠-脑轴信号传导异常主要是由肠道微生物群的生态失调状态和肠道屏障功能的严重障碍所触发和维持的,而这两种病理状态在患有抑郁症和焦虑症的患者群体中表现得极为常见和普遍。同时,患有抑郁症和焦虑症的人群还表现出对抗肠道炎症能力的明显降低和减弱,这种抗炎能力的下降主要是由于肠道内具有抗炎作用的短链脂肪酸水平显著降低所导致的。
7
神经系统疾病
肠道炎症可能是神经退行性疾病的“驱动器”
肠-脑轴在神经退行性疾病中发挥关键作用。肠道炎症被认为是帕金森病的"沉默驱动器",可在症状出现前持续长达二十年。研究还发现,肠源性炎症反应促进淀粉样蛋白-β斑块沉积,导致阿尔茨海默病中的神经元变性和认知功能障碍。
自闭症、多动症患者菌群多样性减少,存在肠道炎症
神经发育障碍在全球患病率急剧上升;自闭症患病率已达到每59名儿童中有1名,截至2016年,11%的儿童和青少年被诊断为注意力缺陷/多动障碍(ADHD)。小儿急性发作性神经精神综合征(PANS)和链球菌感染相关的小儿自身免疫性神经精神障碍(PANDAS)是以抽搐和强迫症突然发作为特征的新兴神经发育障碍。
研究表明,生态失调和肠道炎症是这些疾病的共同致病因素。ADHD儿童表现出肠道微生物α多样性降低,即肠道细菌种类减少;而较高的多样性通常与更好的健康结果相关。自闭症谱系儿童和PANS/PANDAS儿童同样表现出生态失调。这些炎症变化改变了肠-脑信号传导,最终导致神经行为缺陷。
8
骨质疏松
肠道炎症会影响维生素D、钙的吸收
几条证据表明肠道炎症通过破坏骨生成和骨吸收细胞之间的平衡,导致骨量净损失,从而促进骨质疏松症。肠道炎症也会减少对关键的骨骼构建营养素的吸收,包括维生素D,钙和镁。
9
皮肤健康
肠道及其微生物通过肠-皮肤轴影响皮肤健康
我们已经写了许多关于肠道和皮肤健康之间联系的文章,由肠道-皮肤轴介导。就像肠-脑轴一样,肠-皮肤轴是一个连接肠道及其微生物与皮肤的信号分子网络。
肠道的炎症变化,包括生态失调和肠道通透性增加,与一系列皮肤病有关,包括痤疮、牛皮癣、红斑痤疮和湿疹。
10
代谢性疾病
肠道炎症和代谢失调之间存在双向加剧作用
代谢综合征、2型糖尿病(T2D)、肥胖症和肠道炎症之间形成了一个复杂而有害的恶性循环机制:血糖调节失调状态和体内过量脂肪组织的积累会显著促进肠道内炎症反应的发生和发展,而肠道炎症状态反过来又会进一步加剧和恶化机体的代谢功能障碍,从而形成一个持续恶化的病理生理过程。
肠道微生态失调会促进胰岛素抵抗和瘦素抵抗
肠道微生物生态系统的失调状态以及循环系统中脂多糖水平的升高共同诱导和促进胰岛素抵抗和瘦素抵抗的发生,而这两种激素抵抗现象正是代谢综合征、2型糖尿病和肥胖症发病机制中的关键病理特征和核心环节。
日常饮食中摄入的非纤维性碳水化合物以及环境中存在的各种致肥胖环境毒素暴露(包括双酚A和多种邻苯二甲酸盐化合物)都会对肠道微生物群落的组成和结构产生显著的改变和影响。这些肠道微生物群落的变化和改变会直接引起肠道组织内炎症反应的激活和维持,并且对代谢功能障碍疾病的发生、发展和进展过程产生重要的推动和影响作用。
肠道菌群受损时会驱动非酒精性脂肪性肝病
非酒精性脂肪性肝病(NAFLD)是一种特定的肝脏疾病状态,主要是指在很少饮酒或完全不饮酒的个体中,肝脏组织内出现多余脂肪物质的异常积聚和沉积现象,这种疾病状态与代谢综合征、2型糖尿病(T2D)以及肥胖症等代谢性疾病之间存在着非常密切和重要的关联性。
当肠道微生物群落结构和功能受到损害和破坏时,这种受损的肠道微生物生态系统似乎会成为驱动和促进NAFLD相关炎症反应发生和发展的重要因素和机制。与此相对应的是,各种有益的、针对肠道环境的靶向治疗方法和干预措施,例如通过补充益生菌等方式来调节和改善肠道微生物群落,能够有效地缓解和减轻肝脏组织内的炎症反应以及由此导致的肝脏功能障碍和损害。
04针对肠道炎症的治疗方法肠道炎症作为多种慢性疾病的核心病理机制,其有效治疗需要采用多元化、个体化的综合干预策略。当前的治疗方法主要围绕恢复肠道微生物平衡、修复肠道屏障功能、调节免疫反应以及减少促炎因子等核心目标展开。
这些治疗手段包括但不限于营养干预、益生菌和益生元补充、抗炎药物应用、生活方式调整以及新兴的微生物移植疗法等。通过系统性地结合这些不同的治疗模式,能够从多个层面同时作用于肠道炎症的发病机制,从而实现更加全面和持久的治疗效果,最终改善患者的整体健康状况和生活质量。
1
药物治疗
目前用于治疗慢性肠道炎症的大多数药物要么针对在炎症反应早期阶段(即静息期和血管期)释放的炎症介质,要么针对炎症细胞的招募。
①氨基水杨酸类药物
氨基水杨酸类药物(包括柳氮磺吡啶和5-氨基水杨酸)通过作用于花生四烯酸代谢,抑制前列腺素和白三烯等脂质炎症介质的释放。然而,该类药物还具有其他作用机制,包括清除活性氧、抑制白细胞产生细胞因子、通过芳香烃受体依赖途径诱导调节性T细胞招募,以及与过氧化物酶体增殖物激活受体γ结合。
5-氨基水杨酸用于治疗溃疡性结肠炎,有助于维持病情缓解,但在克罗恩病患者中的应用仍存争议。一项研究显示,5-氨基水杨酸能有效减少乳糜泻患者组织器官型培养中的氧化爆发和炎症,但尚无减少组织炎症的报道。在肠易激综合征患者的研究中,5-氨基水杨酸治疗未能改善症状。
②皮质类固醇
20世纪50年代,皮质类固醇成为治疗IBD的首个药理方法,至今仍能使许多患者获得有效缓解,但其维持缓解的效果尚未得到证实。因此,皮质类固醇用于终止炎症发作和诱导缓解,但不推荐长期使用。
皮质类固醇对所有炎症相关途径的多效性作用解释了其疗效。然而,尽管努力开发更安全、耐受性更好的皮质类固醇,但其使用可能产生显著副作用,包括机会性感染、糖尿病、高血压、静脉血栓栓塞和骨质疏松症。此外,部分患者对皮质类固醇治疗存在抵抗性,必须考虑其他免疫调节方法。
③免疫调节剂
用于治疗肠道炎症的免疫调节剂包括硫唑嘌呤、甲氨蝶呤、钙调磷酸酶抑制剂和Janus激酶抑制剂,所有这些药物都旨在降低T淋巴细胞的活化或增殖,并且在减少炎症发作方面非常有效。然而,它们也引起许多不良反应,包括肝损伤、骨髓抑制和传染病。
④生物制剂
许多治疗肠道炎症(特别是IBD)的生物制剂针对细胞因子或整合素。由于TNF-α、IL-12和IL-23在IBD发病机制中的重要作用,抗TNF-α和抗IL-12/23抗体是治疗IBD的主要生物制剂。
抗TNF-α抗体可抑制炎症反应和组织损伤,用于治疗对皮质类固醇无反应的中重度UC或CD患者。通过剂量递增可实现抗TNF-α抗体的长期缓解。然而,高达40%的患者对TNF-α抑制剂无反应,且在开始治疗后仅1年就有20%-45%的患者出现继发性疗效丧失。因此,抗IL-12和抗IL-23在生物制剂初治和既往治疗患者中均有效,常作为二线治疗使用。
整合素通过与组织特异性细胞黏附分子结合介导白细胞归巢,在炎症细胞向炎症组织招募和滞留中起关键作用。抗整合素治疗通过阻断整合素与白细胞内皮细胞黏附分子或上皮细胞表达的E-钙黏蛋白结合发挥作用。抗整合素生物制剂针对黏附分子的α4或β7整合素亚单位。
所有生物制剂对应答者的缓解诱导效果均很好。然而,尽管具有选择性高、特异性强等优点,仍有相当一部分IBD患者出现原发性无应答、继发性应答丧失和治疗不耐受,因此需要其他治疗选择。
2
微生物群靶向治疗
微生物群失调既是炎症相关肠道病变的常见特征,也是导致长期炎症的早期事件。因此,针对微生物群的治疗是治疗肠道炎症的有前景选择。
微生物干预能够有效改善肠道炎症
基于微生物组的疗法包括饮食干预、益生元补充、单一或多菌株益生菌制剂、噬菌体疗法、粪便微生物群移植(FMT)和微生物组模拟物。多项证据表明针对微生物组的疗法对炎症性肠病、肠易激综合征以及一定程度上的乳糜泻有益。微生物组治疗的作用模式可能是多模态的,涉及直接影响生物膜组成和代谢、控制屏障功能以及影响黏膜免疫。
①微生物群相关修复
多项研究显示益生菌、益生元和后益生元在IBD和IBS患者中的潜在作用。它们安全且耐受性良好,尽管效果有时相当有限。在CD患者中,大多数研究表明益生菌无显著效果,而在UC患者或IBS患者中,对临床症状和缓解有益。
粪菌移植治疗IBD的潜力正被积极研究。在UC患者中,FMT在实现临床缓解方面优于安慰剂,一项关于FMT在IBD患者中疗效的荟萃分析显示,无论CD还是UC,临床缓解率均显著。
②干细胞移植
干细胞作为所有细胞类型的起源,包括上皮细胞,因此用于修复受损肠道组织并恢复功能具有理论依据。在重度难治性克罗恩病患者中,自体造血干细胞移植或同种异体骨髓间充质干细胞治疗均显示出积极效果,约半数患者实现临床缓解。
尽管大多数接受自体造血干细胞移植的患者在术后5年内复发,但80%复发者在再次移植后可重新达到缓解。因此,干细胞移植对CD患者的黏膜修复具有潜力,但其临床应用尚未获批。此外,干细胞移植还可利用自体肠道干细胞,经体外培养和检测后移植,该方法已在动物模型中成功应用,但在人类中的临床条件尚未确定。
③加强屏障功能
屏障功能障碍与肠道炎症密切相关,这种障碍在炎症性肠病、乳糜泻和肠易激综合征患者中均有发现。研究表明,即使炎症消退,屏障功能在之后数周内仍可能受损。清除急性炎症后,屏障功能的恢复是组织修复的关键,涉及黏膜微生物生物膜、黏液层、上皮单层、黏膜免疫系统和神经支配。因此,屏障功能可通过多种方式恢复。一些IBD治疗手段部分通过改善上皮屏障起效,如抗TNF-α治疗对克罗恩病有效。
肠道粘膜表面的解决和修复参与者及介质
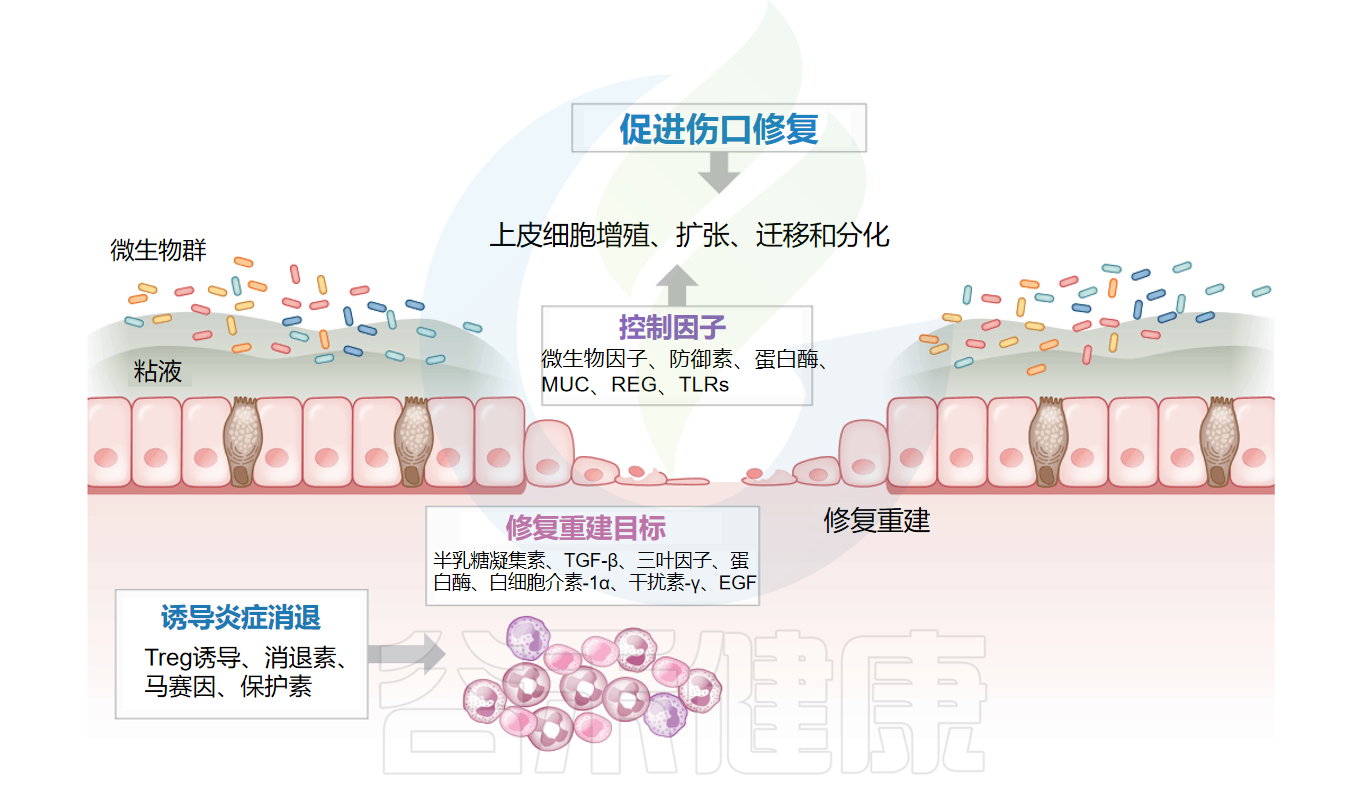
Deraison C,et al.Annu Rev Pharmacol Toxicol.2025
临床上,恢复肠道屏障功能主要依赖饮食干预,包括免疫调节营养物、益生菌和微生物代谢产物。局部应用丁酸可改善难治性溃疡性结肠炎患者的屏障功能。新的理论认为,具有细胞功能失常遗传背景者更易发生自身免疫反应,此类细胞对炎症触发因素更为敏感。肠腔内容物常为炎症的主要触发因素,难以完全避免。因此,针对遗传性功能障碍的干预为新型治疗途径。
3
生活方式改善
①吃营养丰富的未经加工的饮食
营养丰富、未经加工的饮食提供了底物(即,可发酵纤维,多酚和其他营养素),你的肠道细菌需要茁壮成长,创造一个抗炎的肠道生态系统。特别关注益生元食物可以提高你的抗炎SCFA产生细菌的水平。避免非细胞碳水化合物,包括精制面粉产品和工业种子油。
对于患有严重肠道炎症的人,如IBD,自身免疫方案饮食可以提供显著的缓解。
②管理压力
慢性压力确实会损害肠道健康,因此压力管理对于减轻肠道炎症至关重要。冥想有助于调节压力反应,维持肠道屏障功能和炎症平衡。规律锻炼和良好睡眠同样有助于管理压力并支持肠道健康。
③控制合理使用药物
为减少肠道炎症,应谨慎使用抗生素和其他药物。目前对非抗生素药物对肠道健康影响的了解有限,但已有初步担忧。相比之下,抗生素对肠道的负面影响证据充分。如果您正在使用PPI,请谨慎使用,并了解如何通过饮食和生活方式调整来减少或停用抑酸药物。
④尽量限制接触毒素
环境毒素无处不在,但通过以下简单措施可以降低暴露并预防肠道炎症:
-购物时避免使用收据,减少接触。
-选择不锈钢或玻璃水瓶和食物容器,避免塑料制品。
-避免在家中和院子里使用杀虫剂。
这些措施有助于减少环境毒素的累积暴露,促进肠道和整体健康。
05结语肠道掌控着全身的健康。从消化吸收到免疫防线,从情绪调节到慢性病预防,你的身体几乎所有系统,都绕不开它的“号令”。一旦肠道炎症悄然来袭,打破屏障和菌群的平衡,导致各种慢性疾病,比如炎症性肠病、结肠癌、糖尿病、哮喘,甚至影响大脑、皮肤和骨骼健康。
不健康饮食(精制碳水、工业油、食品添加剂),还有滥用抗生素、环境毒素、过度压力、久坐、睡眠紊乱、剖腹产及配方喂养、反复肠道感染、甚至是某些常见药物等都会影响肠道炎症。
总之,肠道健康是你和慢病拉开距离的“第一道防线”。面对日常的饮食、作息和环境时,不妨从肠道微生物组学的角度审视:这些是否有利于维持肠道菌群的多样性与稳态?
从丰富多样、天然未加工的饮食入手,善用益生菌和益生元,科学运动,重视深度睡眠,减少压力,限用药物,远离环境毒素,肠道就会回馈你健康的身体和愉悦的心情。而现代医学的营养干预、生物制剂、微生态移植和干细胞等创新治疗,也在不断拓宽肠道炎症的管理边界。
肠道炎症,正走向现代医学的中心,未来,肠道炎症指标将如同血压、血糖一样成为常规监测项目,在疾病症状出现前数年就能识别风险并及时干预。谷禾肠道菌群检测为这一转变提供了强有力的技术支撑,通过分析肠道微生物组成和功能,基于大样本量数据库及最新的算法模型,评估肠道炎症水平。健康管理也正从症状出现后治疗向风险早期识别的根本转变。通过持续的肠道健康监测和精准干预,我们能够预防很多慢性疾病。
面对肠道炎症的复杂病理机制,未来的医疗模式将迎来跨学科融合,整合营养学、微生物学和免疫学等多学科知识,基于个体化检测结果制定多维度干预策略,为患者提供系统化解决方案。
主要参考文献
Pelaseyed T, Bergström JH, Gustafsson JK, Ermund A, Birchenough GM, Schütte A, van der Post S, Svensson F, Rodríguez-Piñeiro AM, Nyström EE, Wising C, Johansson ME, Hansson GC. The mucus and mucins of the goblet cells and enterocytes provide the first defense line of the gastrointestinal tract and interact with the immune system. Immunol Rev. 2014 Jul;260(1):8-20.
Ohno H. Intestinal M cells. J Biochem. 2016 Feb;159(2):151-60.
Gassler N. Paneth cells in intestinal physiology and pathophysiology. World J Gastrointest Pathophysiol. 2017 Nov 15;8(4):150-160.
Bäckhed F, Ley RE, Sonnenburg JL, Peterson DA, Gordon JI. Host-bacterial mutualism in the human intestine. Science. 2005 Mar 25;307(5717):1915-20.
Gill SR, Pop M, Deboy RT, Eckburg PB, Turnbaugh PJ, Samuel BS, Gordon JI, Relman DA, Fraser-Liggett CM, Nelson KE. Metagenomic analysis of the human distal gut microbiome. Science. 2006 Jun 2;312(5778):1355-9.
Qin J, Li R, Raes J, Arumugam M, Burgdorf KS, Manichanh C, Nielsen T, Pons N, Levenez F, Yamada T, Mende DR, Li J, Xu J, Li S, Li D, Cao J, Wang B, Liang H, Zheng H, Xie Y, Tap J, Lepage P, Bertalan M, Batto JM, Hansen T, Le Paslier D, Linneberg A, Nielsen HB, Pelletier E, Renault P, Sicheritz-Ponten T, Turner K, Zhu H, Yu C, Li S, Jian M, Zhou Y, Li Y, Zhang X, Li S, Qin N, Yang H, Wang J, Brunak S, Doré J, Guarner F, Kristiansen K, Pedersen O, Parkhill J, Weissenbach J; MetaHIT Consortium; Bork P, Ehrlich SD, Wang J. A human gut microbial gene catalogue established by metagenomic sequencing. Nature. 2010 Mar 4;464(7285):59-65.
Laurikka P, Nurminen S, Kivelä L, Kurppa K. Extraintestinal Manifestations of Celiac Disease: Early Detection for Better Long-Term Outcomes. Nutrients. 2018 Aug 3;10(8):1015.
Sturgeon C, Fasano A. Zonulin, a regulator of epithelial and endothelial barrier functions, and its involvement in chronic inflammatory diseases. Tissue Barriers. 2016 Oct 21;4(4):e1251384.
Frossi B, De Carli M, Calabrò A. Coeliac Disease and Mast Cells. Int J Mol Sci. 2019 Jul 11;20(14):3400.
Losurdo G, Piscitelli D, Pezzuto F, Fortarezza F, Covelli C, Marra A, Iannone A, Amoruso A, Principi M, Ierardi E, Di Leo A. T Helper Lymphocyte and Mast Cell Immunohistochemical Pattern in Nonceliac Gluten Sensitivity. Gastroenterol Res Pract. 2017;2017:5023680.
Abulizi N, Quin C, Brown K, Chan YK, Gill SK, Gibson DL. Gut Mucosal Proteins and Bacteriome Are Shaped by the Saturation Index of Dietary Lipids. Nutrients. 2019 Feb 16;11(2):418.
Spreadbury I. Comparison with ancestral diets suggests dense acellular carbohydrates promote an inflammatory microbiota, and may be the primary dietary cause of leptin resistance and obesity. Diabetes Metab Syndr Obes. 2012;5:175-89.
Martínez Steele E, Baraldi LG, Louzada ML, Moubarac JC, Mozaffarian D, Monteiro CA. Ultra-processed foods and added sugars in the US diet: evidence from a nationally representative cross-sectional study. BMJ Open. 2016 Mar 9;6(3):e009892.
Nickerson KP, McDonald C. Crohn's disease-associated adherent-invasive Escherichia coli adhesion is enhanced by exposure to the ubiquitous dietary polysaccharide maltodextrin. PLoS One. 2012;7(12):e52132.
Rodriguez-Palacios A, Harding A, Menghini P, Himmelman C, Retuerto M, Nickerson KP, Lam M, Croniger CM, McLean MH, Durum SK, Pizarro TT, Ghannoum MA, Ilic S, McDonald C, Cominelli F. The Artificial Sweetener Splenda Promotes Gut Proteobacteria, Dysbiosis, and Myeloperoxidase Reactivity in Crohn's Disease-Like Ileitis. Inflamm Bowel Dis. 2018 Apr 23;24(5):1005-1020.
Braniste V, Jouault A, Gaultier E, Polizzi A, Buisson-Brenac C, Leveque M, Martin PG, Theodorou V, Fioramonti J, Houdeau E. Impact of oral bisphenol A at reference doses on intestinal barrier function and sex differences after perinatal exposure in rats. Proc Natl Acad Sci U S A. 2010
JPascal M, Perez-Gordo M, Caballero T, Escribese MM, Lopez Longo MN, Luengo O, Manso L, Matheu V, Seoane E, Zamorano M, Labrador M, Mayorga C. Microbiome and Allergic Diseases. Front Immunol. 2018 Jul 17;9:1584. an 5;107(1):448-53.
Mao, Q., Manservisi, F., Panzacchi, S. et al. The Ramazzini Institute 13-week pilot study on glyphosate and Roundup administered at human-equivalent dose to Sprague Dawley rats: effects on the microbiome. Environ Health 17, 50 (2018).
Han H, Li Y, Fang J, Liu G, Yin J, Li T, Yin Y. Gut Microbiota and Type 1 Diabetes. Int J Mol Sci. 2018 Mar 27;19(4):995.
Chen, J., Chia, N., Kalari, K. et al. Multiple sclerosis patients have a distinct gut microbiota compared to healthy controls. Sci Rep 6, 28484 (2016).
本文转自:谷禾健康
https://wap.sciencenet.cn/blog-2040048-1500004.html
上一篇:[转载]解密“肠-脑轴”如何操控你的食欲
下一篇:[转载]常见水果对肠道菌群、肠道蠕动和便秘的影响