博文
[转载]如何利用益生元和肠道菌群更好地改善2型糖尿病?
||

肠道微生物群是居住在人类胃肠道中的复杂生态系统,由数万亿微生物(包括细菌、病毒、真菌和其他微生物)组成。通过代谢活动和与宿主相互作用,肠道微生物群在影响正常生理过程、代谢稳态和疾病易感性方面发挥重要作用,并影响健康的各个方面。
研究表明,肠道菌群失调或改变可通过影响葡萄糖代谢、胰岛素敏感性和炎症来促进2型糖尿病发展。此外,肠道菌群通过葡萄糖耐量受损和胰岛素抵抗增加等机制与2型糖尿病、肥胖、代谢综合征等疾病发作相关。
2型糖尿病患者通常表现出产丁酸盐的有益细菌(如罗氏菌属和普拉梭菌)减少,而有害细菌(如埃希菌属和扭链瘤胃球菌属)增加。

而平衡的肠道微生物群与葡萄糖代谢和胰岛素敏感性改善相关,有可能降低糖尿病相关并发症风险。最近的荟萃分析表明,微生物群衍生的干预措施可显著改善血清空腹胰岛素和糖化血红蛋白水平,这两者都是2型糖尿病患者疾病进展的关键标志物。调节肠道微生物群的策略包括使用益生菌、益生元和合生元。益生菌是摄入后对健康有益的活微生物,益生元是刺激有益肠道细菌生长的不可消化化合物,合生元是益生菌和益生元的组合,协同作用以增强肠道健康。
尽管关于益生菌在2型糖尿病中作用的研究正在迅速扩大,强调它们对血糖控制和代谢参数的积极影响,然而益生元作为细菌营养基质的重要作用经常被忽视。不同类型的益生元可直接影响血糖水平,并通过支持有益细菌生长间接影响糖尿病。菊粉、低聚果糖、低聚半乳糖、抗性淀粉、果胶低聚糖、多酚、β-葡聚糖和铁皮石斛等益生元已被证明可改善肠道微生物组成并支持2型糖尿病患者血糖控制。
本文将详细描述不同的益生元、它们建议的每日剂量、含有它们的食物、它们对2型糖尿病的直接影响,以及由此产生的肠道微生物群的变化。益生元还通过不同机制改善血糖指数,包括对短链脂肪酸的影响、抗炎作用、肠促胰岛素分泌优化、血脂水平改善和抗氧化特性。深入地了解如何利用益生元以及个性化饮食干预有望作为优化糖尿病管理和改善整体健康的治疗策略。
012型糖尿病的危害和成因2型糖尿病(T2DM)是一种由胰岛素抵抗或分泌不足等导致血糖水平升高的慢性代谢性疾病,典型症状被称为"三多一少":即多饮、多尿、多食和体重减轻。
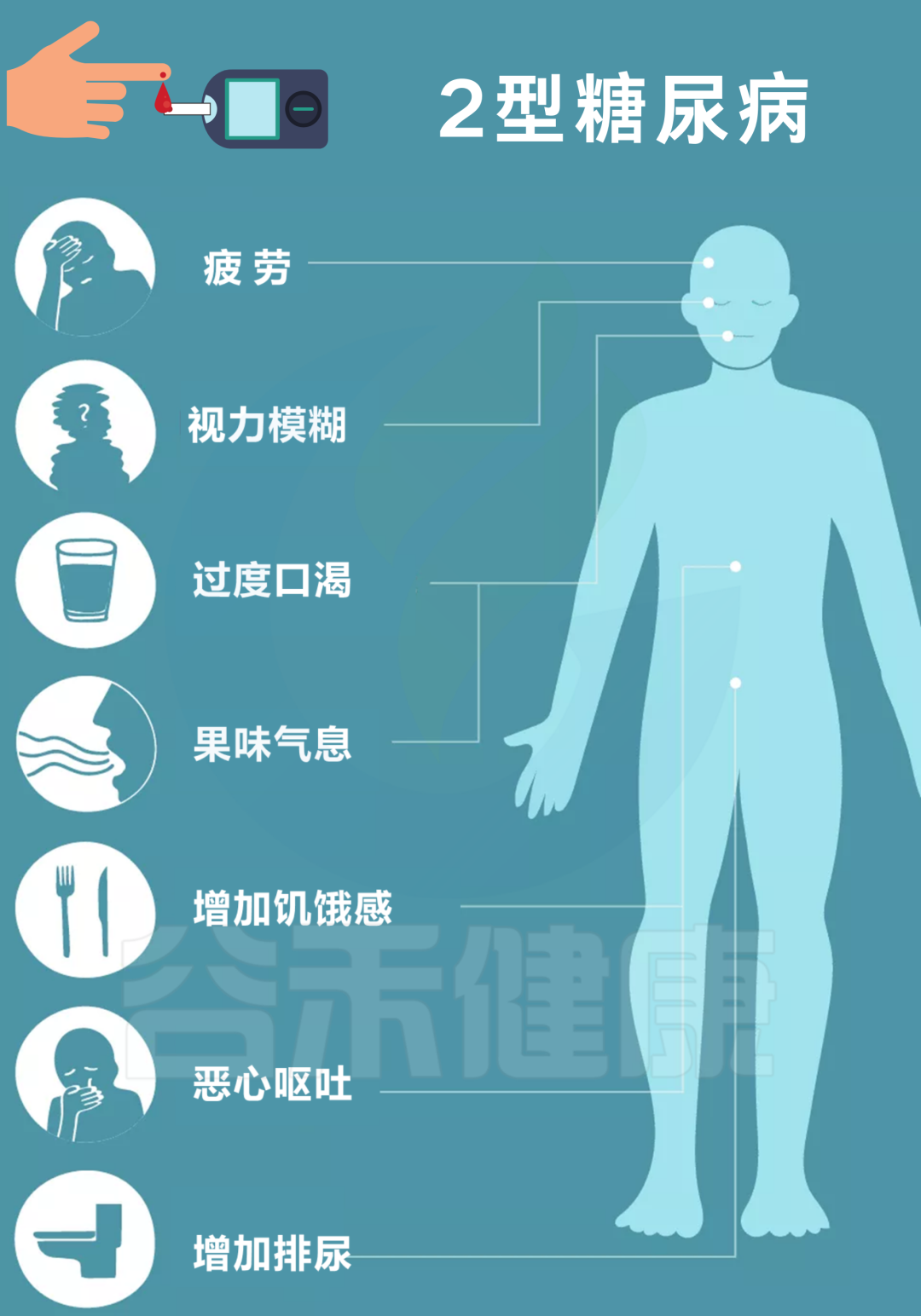
2型糖尿病已成为21世纪最严重的全球性健康危机之一。据国际糖尿病联盟数据,全球糖尿病患者从2000年的1.51亿激增至2021年的5.37亿,预计2045年将达7.83亿,其中90-95%为2型糖尿病。并且在全球20-79岁成年患者中,中国占1.41亿人,超过总数的四分之一。
2型糖尿病的危害
这一"现代流行病"不仅以惊人的速度蔓延,更以其广泛而深远的健康危害威胁着人类生存质量:它是导致失明、肾衰竭、糖尿病截肢的主要原因,还会使心血管疾病风险增加2-4倍,每年夺走超过400万人的生命。
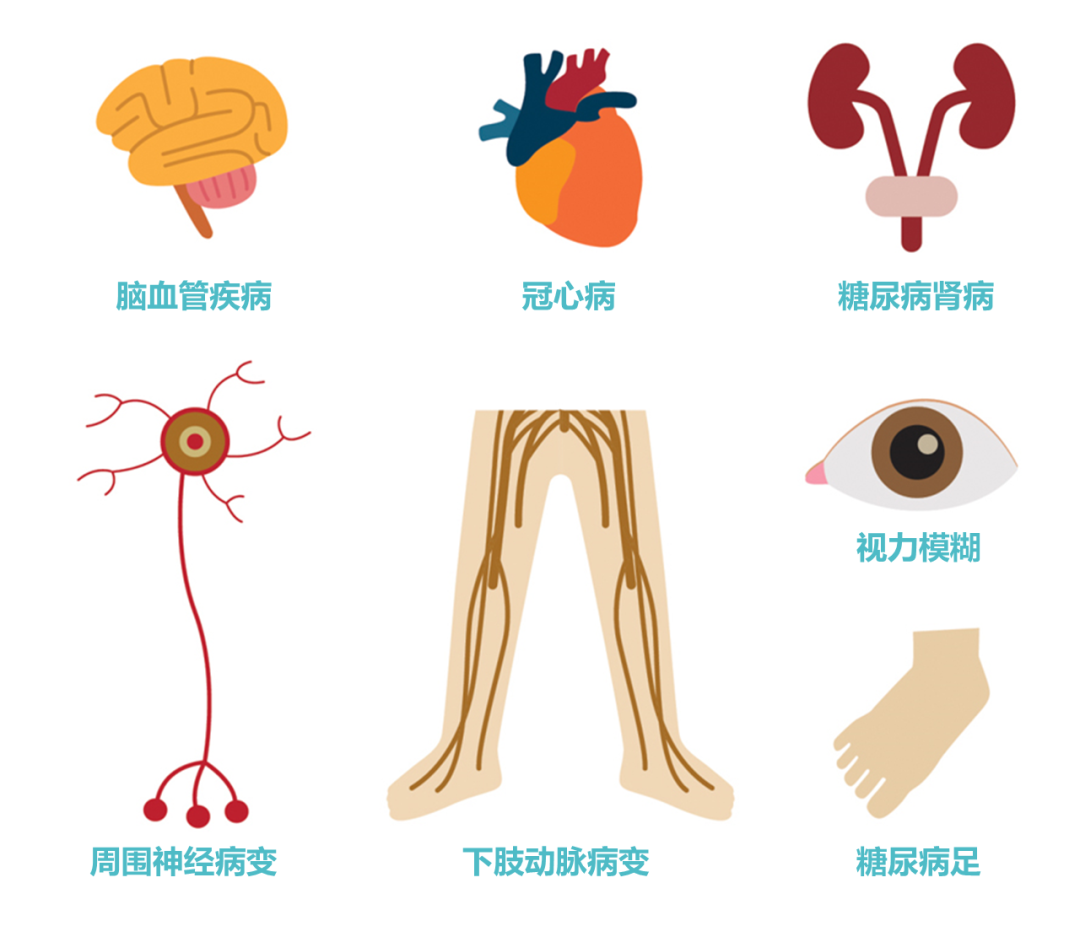
2型糖尿病的危害包括以下几方面:
▸ 急性并发症
①糖尿病酮症酸中毒 (DKA)
发生率:2型糖尿病患者中约5-25%;
病理机制:胰岛素严重不足,脂肪分解增加,酮体生成过多;
临床表现:恶心、呕吐、腹痛、意识障碍;
死亡率:未治疗情况下可达5-10%。
②高血糖高渗状态 (HHS)
血糖通常>33.3 mmol/L,血浆渗透压>320 mOsm/kg;
脱水严重,可达体重的20-25%;
死亡率:10-50%。
③严重低血糖
血糖<2.8 mmol/L且伴有症状;
可导致认知功能损害、昏迷、死亡;
老年患者风险更高。
▸ 慢性微血管并发症
①糖尿病肾病
病理改变:肾小球基底膜增厚、系膜扩张、结节性硬化;
分子机制:高血糖激活蛋白激酶C,促进细胞外基质合成;
糖基化终末产物 (AGEs) 激活炎症反应;
肾素-血管紧张素系统激活;
患病率:30-40%的糖尿病患者发生肾病,是导致终末期肾病的主要原因。
②糖尿病视网膜病变
病理机制:视网膜毛细血管基底膜增厚;
周细胞丢失,血管通透性增加;
视网膜缺血,血管内皮生长因子 (VEGF) 释放;
新生血管形成,纤维增殖;
患病率:病程20年后约60%患者发生;
致盲率:糖尿病是工作年龄人群致盲的主要原因。
③糖尿病神经病变
远端对称性多发神经病变:
病理:轴突变性、脱髓鞘、神经纤维丢失;
症状:疼痛、麻木、感觉异常;
患病率:50-90%。
自主神经病变:
心血管自主神经病变:心率变异性降低,体位性低血压;
胃肠道自主神经病变:胃轻瘫,腹泻或便秘;
泌尿生殖系统病变:膀胱功能障碍,勃起功能障碍。
▸ 慢性大血管并发症
①冠心病
发病机制:动脉粥样硬化加速形成;
内皮功能障碍,一氧化氮生成减少;
血小板聚集性增加,凝血功能异常;
炎症反应激活,C反应蛋白升高;
发病风险:比非糖尿病患者高2-4倍;
预后:糖尿病患者心肌梗死后死亡率更高。
②脑血管病
缺血性脑卒中风险:增加2-3倍;
病理机制:大动脉粥样硬化、小血管病变、心源性栓塞;
认知障碍:血管性痴呆风险显著增加。
③外周动脉疾病
下肢动脉疾病:患病率15-20%。
糖尿病足:
发病机制:神经病变+血管病变+感染;
溃疡年发生率:2-10%;
截肢率:比非糖尿病患者高10-20倍。
▸ 代谢和内分泌影响
①脂代谢紊乱
糖尿病性血脂异常:甘油三酯升高(>1.7 mmol/L);
高密度脂蛋白胆固醇降低(<1.0 mmol/L男性,<1.3 mmol/L女性);
小而密的低密度脂蛋白增加。
非酒精性脂肪肝:患病率60-70%。
②电解质和酸碱平衡紊乱
高钾血症:肾功能不全时常见;
低钠血症:高血糖导致的稀释性低钠;
代谢性酸中毒:晚期肾病或酮症时。
▸ 免疫功能损害
①感染易感性增加
机制:中性粒细胞趋化性和吞噬功能下降;
细胞免疫功能减退;
组织愈合能力降低。
常见感染:
泌尿系统感染
皮肤软组织感染
肺部感染
真菌感染(如念珠菌病)
②疫苗应答减弱
流感疫苗、肺炎疫苗效果降低;
需要加强免疫策略。
▸ 心理和认知影响
①认知功能损害
2型糖尿病引起的脑血管病变、慢性炎症、胰岛素信号异常、高血糖毒性可能损害认知功能;
表现:执行功能、记忆力、注意力下降;
痴呆风险:增加1.5-2倍。
②心理健康问题
抑郁症:患病率25-30%,是一般人群的2倍;
焦虑障碍:患病率15-20%;
糖尿病痛苦:疾病管理负担导致的心理压力。
2型糖尿病是如何形成的?
葡萄糖通过食物和饮料进入人体,此时胰腺会分泌胰岛素激素帮助血液中的葡萄糖进入肌肉、脂肪和肝脏以提供能量。
▸ 胰岛素有助于控制正常血糖水平
胰岛素通过血液循环进入不同组织。组织大多数细胞表面有一种结构,叫胰岛素受体。当胰岛素流过时,会附着在胰岛素受体上,就像“钥匙打开锁”一样,糖可以进入细胞内,细胞获得能量维持正常运作,血液中糖分就会回落到正常水平。
在2型糖尿病患者身上,细胞对胰岛素没有反应,这种情况就叫胰岛素抵抗。胰岛素没有了“钥匙”的作用,不能有效开启细胞上的“锁”,或者“锁”的数量也减少了,由此,糖分就不能进入细胞有效利用,被挡在了细胞外面,只好在血液中积累,血糖就升高了。
初期,胰腺会代偿性地分泌更多胰岛素来克服胰岛素抵抗。随着时间推移,胰腺功能逐渐衰竭,无法产生足够的胰岛素,2型糖尿病由此发生。
▸ 胰岛素抵抗的发生机制
细胞水平机制
胰岛素受体缺陷:受体数量减少或亲和力下降;
胰岛素受体底物-1 (IRS-1) 功能障碍:磷酸化异常,信号传导受阻;
PI3K-Akt通路受损:葡萄糖转运蛋白4 (GLUT4) 转位障碍;
线粒体功能异常:氧化磷酸化效率降低,ATP生成受限。
分子机制
蛋白激酶C (PKC) 激活:由二酰甘油 (DAG) 激活,抑制胰岛素信号;
c-Jun氨基末端激酶 (JNK) 激活:促进IRS-1丝氨酸磷酸化;
核因子κB (NF-κB) 激活:促进炎症因子释放;
过氧化物酶体增殖物激活受体γ (PPARγ) 功能减退。
▸ β细胞功能衰竭
早期阶段
β细胞代偿性增生:胰岛β细胞质量增加20-50%;
胰岛素分泌相位改变:第一相分泌减少,第二相延迟;
淀粉样蛋白沉积:胰岛淀粉样多肽 (IAPP) 在胰岛内沉积。
进展阶段
β细胞凋亡:氧化应激、内质网应激诱导细胞死亡;
β细胞去分化:失去成熟β细胞特征,分泌功能丧失;
胰岛纤维化:细胞外基质沉积,胰岛结构破坏。
▸ 遗传易感性
主要易感基因
TCF7L2:最强的2型糖尿病易感基因,影响胰岛素分泌;
PPARG:调节脂肪细胞分化和胰岛素敏感性;
KCNJ11和ABCC8:编码胰岛β细胞ATP敏感性钾通道;
IGF2BP2、CDKN2A/B、CDKAL1:影响β细胞功能。
遗传风险
一级亲属患病风险增加2-6倍;
同卵双胞胎一致性达90%;
不同种族遗传易感性存在差异。
▸ 环境和生活方式等因素
肥胖会增加患2型糖尿病的风险
内脏脂肪堆积:释放游离脂肪酸,诱发胰岛素抵抗;
脂肪因子异常:脂联素减少,瘦素抵抗,抵抗素增加;
慢性低度炎症:TNF-α、IL-6等促炎因子升高;
异位脂质沉积:肝脏、肌肉、胰腺脂肪浸润。
其他环境因素
久坐行为:肌肉胰岛素敏感性下降;
睡眠障碍:皮质醇分泌异常,葡萄糖稳态破坏;
慢性应激:下丘脑-垂体-肾上腺轴激活;
肠道菌群失调:短链脂肪酸减少,肠道屏障功能受损。(肠道菌群与2型糖尿病的关系将在后续章节详细描述,通过益生元和改善肠道微生物群可能成为治疗2型糖尿病的一种新方法)
022型糖尿病患者肠道菌群的变化研究表明,肠道菌群失调可通过影响葡萄糖代谢、胰岛素敏感性和炎症反应促进2型糖尿病(T2DM)的发生发展。
此外,肠道菌群还通过葡萄糖耐量受损和胰岛素抵抗等机制与肥胖、代谢综合征和2型糖尿病相关。最新荟萃分析显示,微生物群干预可显著改善空腹胰岛素和糖化血红蛋白水平,这两项均为2型糖尿病进展的关键指标。
2型糖尿病患者的肠道微生物群组成显示出明显的改变,提供了微生物分类群和相关代谢物之间的重要相关性,这些代谢物要么增加了对2型糖尿病发展的敏感性,要么防止了2型糖尿病的发展。
1
产丁酸盐细菌减少
具体而言,2型糖尿病(T2DM)患者表现出有益的产丁酸盐细菌减少,微生物多样性降低,包括普拉梭菌(Faecalibacterium prausnitzii)、罗氏菌属(Roseburia)和直肠真杆菌(Eubacterium rectale)。
丁酸盐是一种短链脂肪酸(SCFA),在调节食欲、体重和胰岛素抵抗方面起着关键作用。此外,在糖尿病患者中,另一种丁酸盐生产梭菌的减少已有记录。
• 与葡萄糖代谢相关的青春双歧杆菌等有益菌群减少
此外,2型糖尿病患者中另一种有益细菌Anaerostipes hadrus含量降低,这种减少与葡萄糖代谢受损和胰岛素抵抗增加有关。研究还显示,直肠真杆菌水平下降与加重胰岛素抵抗的菌群失调有关。
瘤胃球菌(Ruminococcus bromii)对葡萄糖代谢至关重要,但在糖尿病患者(尤其是慢性胰腺炎患者)中含量较低。2型糖尿病患者的青春双歧杆菌(Bifidobacterium adolescentis)和克里斯滕斯菌科(Christensenellaceae)水平均降低,后者与糖化血红蛋白水平呈负相关。糖尿病前期个体的梭菌显著减少,其降低与血糖水平、胰岛素抵抗和炎症反应改善相关。
2
对血糖有积极影响的菌群减少
放线菌门中的双歧杆菌与较低的2型糖尿病风险相关,厌氧菌门对空腹血糖有积极影响。其他研究表明,2型糖尿病患者的肠道拟杆菌(Bacteroides intestinalis)、拟杆菌(Bacteroides)和普通拟杆菌(Bacteroides vulgatus)水平降低。
早期研究显示,2型糖尿病患者的梭状芽胞杆菌和厚壁菌门水平显著下降,新诊断患者中球囊梭菌(Clostridium coccoides)和柔嫩梭菌属(Clostridium leptum)水平尤其降低。
青春双歧杆菌(Bifidobacterium adolescentis)和Bifidobacterium angulatum有助于改善血糖控制,Oscillospiraceae水平升高与胰岛素抵抗改善相关。巨单胞菌高水平与正常葡萄糖耐量相关。
• 双歧杆菌减少
双歧杆菌属具有显著的健康益处,包括改善肠道通透性,从而降低内毒素的循环水平并减少全身炎症。这与改善宿主的糖耐量和葡萄糖诱导的胰岛素分泌,并减少炎症有关。
• Akkermansia菌减少
Akkermansia muciniphila和Faecali prausnitzii这两种菌为2型糖尿病的发展提供了保护。
Akkermansia菌在维持粘蛋白层完整性和减少炎症方面发挥关键作用。粘蛋白作为高度糖基化的大分子蛋白质参与胃肠道保护,减少细菌移位,改善脂肪储存、脂肪组织代谢和葡萄糖稳态。
• Faecali prausnitzii 减少
2型糖尿病的Faecali prausnitzii丰度降低,而糖尿病治疗可导致了Faecali prausnitzii丰度的增加、全身炎症的二次减少和胰岛素抵抗的改善。
3
与糖尿病风险增加相关的有害菌丰度升高
临床前和临床试验的系统评价显示,双歧杆菌、拟杆菌、粪杆菌、阿克曼氏菌和罗氏菌属与2型糖尿病发展呈负相关,有助于改善代谢和肠道健康。相反,瘤胃球菌属、梭杆菌属和经黏液真杆菌属(Blautia)与糖尿病风险增加相关。
• 扭链瘤胃球菌与胰岛素抵抗和高血糖相关
并且2型糖尿病患者中潜在有害细菌显著增加,例如埃希氏菌和普雷沃氏菌。还观察到糖尿病患者变形菌门的显著增加。在T2DM 患者中经常观察到更高水平的 Collinsella,尤其是 Collinsella aerofaciens。此外,扭链瘤胃球菌(Ruminococcus torques)与胰岛素抵抗和高血糖有关,在减重手术和糖尿病缓解后水平下降。
2型糖尿病患者中高丰度的特定菌属还包括:Blautia、Coprococcus、Sporobacter、Abiotrophia、Peptostreptococcus、Parasutterella、Collinsella。
4
平衡的肠道菌群对改善2型糖尿病有益
• 双歧杆菌可能有助于改善2型糖尿病
多种双歧杆菌,包括青春双歧杆菌、两歧双歧杆菌、假链双歧杆菌、长双歧杆菌和齿双歧杆菌,与2型糖尿病呈负相关,尤其是在接受二甲双胍治疗的患者中。
产丁酸细菌如柔嫩梭菌属(Clostridium leptum)与糖化血红蛋白和空腹血糖呈负相关。2型糖尿病患者厚壁菌门水平普遍升高,但在糖尿病模型中与空腹血糖呈负相关。
• 阴沟肠杆菌与葡萄糖耐量受损相关
在2型糖尿病中观察到Desulfovibrio和Odoribacter水平升高。肥胖和糖尿病患者丹毒丝菌科(Erysipelotrichaceae)丰度较高,阴沟肠杆菌与葡萄糖耐量受损相关。
同时糖尿病患者免疫功能受损增加肺炎克雷伯菌感染风险。代谢综合征患者Odoribacter水平升高,产气荚膜梭菌可致糖尿病患者肝脓肿,体现其机会致病特性。
• 平衡的肠道菌群益于葡萄糖代谢和降低并发症
另一方面,平衡的肠道微生物群(共生状态)与2型糖尿病患者葡萄糖代谢改善和胰岛素敏感性增加相关。此外,共生状态有助于预防与2型糖尿病(T2DM)相关的并发症,因为健康的肠道微生物群可以降低糖尿病并发症的风险,如视网膜病变、肾病和其他相关疾病。
益生元选择性地刺激有益细菌的生长,增强微生物多样性。它们不会促进有害细菌,但可以影响某些细菌种类的生长,有时可能与在糖尿病等疾病中观察到的微生物变化重叠。
03特定益生元对肠道微生物组成和2型糖尿病的影响如上所述,某些细菌类型在糖尿病患者中可能更丰富。而服用益生元为2型糖尿病提供了双重好处,促进共生,同时改善血糖指数。
要被归类为益生元,食品成分必须满足特定标准:它必须抵抗胃酸,避免被消化酶水解,并能被胃肠道菌群发酵代谢,并增加促进健康的肠道细菌的丰度。
益生元本质上是不可消化的食物基质,绕过人体消化,最终到达肠道,为肠道微生物群提供能量来源。这种关系是共生的,因为益生元促进有益肠道微生物群的生长,如乳酸杆菌、阿克曼菌、双歧杆菌、粪杆菌和罗氏菌属,这有助于缓解与2型糖尿病相关的代谢过程。
碳水化合物被认为是最有效的益生元,可按分子大小或聚合程度分类。不可消化碳水化合物、特定蛋白质肽段及某些脂质也被确定为潜在益生元成分。菊粉、低聚果糖、低聚半乳糖、抗性淀粉、果胶低聚糖、β-葡聚糖、多酚和石斛属等益生元已被证实可通过优化肠道微生物组成对2型糖尿病患者血糖控制产生治疗作用。下面将讲述这些益生元的功能特性及其对肠道微生物组成和血糖指数的影响。
1
菊粉
菊粉是一种水溶性储存多糖,存在于36000多种植物中,属于果聚糖类不可消化碳水化合物。作为分类益生元,菊粉天然存在于多种食物中,建议每日摄入量为2-12克。
建议每天摄入菊粉量和最丰富的食物来源

Iatcu OC,et al.Nutrients.2024
菊粉表现出显著的益生元特性,长链菊粉型果聚糖对发酵活性和细菌群落组成的影响更强。菊粉的药理特性使其成为各种食品类别的多功能成分。它作为一种低热量甜味剂和不易消化的纤维,有助于提高食品的粘度、形成凝胶并改善食品的感官特性。菊粉能开发出具有理想质地和感官品质的低脂肉类和家禽产品,其脂肪替代和质地改性特性适用于各种食品。
注:菊粉广泛用于肉制品、乳制品、酱汁和糖果的脂肪替代品,还作为食品添加剂应用于面包、烘焙产品、乳制品、糖果和婴儿食品中,在食品工业中发挥重要作用。
• 菊粉对治疗2型糖尿病具有益处
多项研究表明菊粉对2型糖尿病的潜在益处。一项涉及49名BMI为25-35 kg/m²的2型糖尿病女性研究显示,每日服用10g菊粉2个月可降低空腹血糖和糖化血红蛋白水平,同时增加总抗氧化能力。
另一项52名2型糖尿病女性患者研究表明,补充10g富含低聚果糖的菊粉8周同样可降低空腹血糖和糖化血红蛋白水平。
• 菊粉改善了糖尿病患者的胰岛素敏感性
双盲交叉研究发现,糖尿病前期患者每日服用30g菊粉2周可改善胰岛素敏感性。每日补充15g菊粉6个月可降低糖尿病前期患者空腹胰岛素水平并改善胰岛素抵抗。
然而,一项随机双盲试验报告每日摄入10g菊粉12周对2型糖尿病患者胆固醇、血糖或糖化血红蛋白无显著影响。尽管如此,大量证据支持菊粉作为2型糖尿病治疗选择的潜力。
• 菊粉增加抗炎细菌丰度,改善厚壁菌门/拟杆菌门比率
关于肠道微生物群影响,糖尿病前期患者每日服用15g菊粉6个月可增加放线菌、双歧杆菌、乳酸菌等相对丰度,同时降低另枝菌属(Alistipes)丰度。
健康成人每日服用5-7.5g龙舌兰菊粉21天后,放线菌门和双歧杆菌丰度增加,脱硫弧菌丰度降低。双歧杆菌作用与较高粪便短链脂肪酸浓度相关,可能对2型糖尿病产生有益影响。
小鼠模型显示菊粉补充剂通过调节肠道神经胶质细胞产生显著抗炎作用,改善厚壁菌门/拟杆菌门比率。丁酸盐水平升高可抑制NF-κB通路,降低促炎因子表达。人体研究证实菊粉的抗炎益处,60例糖尿病患者补充菊粉后TLR4、NF-κB和IL-1表达降低。
• 菊粉可改善胰岛素抵抗
菊粉还被证明可以改善胰岛素抵抗的标志物,包括特定基因和胰岛素受体底物的表达。在一项针对67例2型糖尿病患者的纵向研究中,每日补充10g菊粉2个月可降低INS基因甲基化。有趣的是,据报道,胰岛细胞的胰岛素启动子中含有 INS 基因甲基化,这进一步揭示了菊粉干预人类后表观遗传修饰的作用。
此外,在小鼠模型中,菊苣菊粉补充8周后,IRS-1和MAPK信号通路受到影响。该研究表明,IRS活性上调并抑制丝裂原活化蛋白激酶(MAPK)通路,该通路对T2DM发病机制和糖尿病肾病等并发症有重大影响。
最后,在一项针对60名2型糖尿病患者的研究中,补充菊粉与丁酸盐联合使用,改善了血糖标志物、血脂谱和GLP-1分泌。
总体而言,有大量证据支持菊粉在改善血糖指数、减轻2型糖尿病发病机制相关分子过程和增强肠道微生物组成方面具有作用。
2
抗性淀粉
抗性淀粉在碳水化合物中具有独特特性,能抵抗小肠内源性淀粉酶消化,到达大肠作为肠道细菌营养。这一特性使抗性淀粉被归类为膳食纤维,具有多种潜在健康益处。抗性淀粉分为五种类型,天然存在于全谷物、豆类、煮熟冷却的马铃薯、大米和未成熟香蕉等食物中。
抗性淀粉包括物理难接近淀粉(RS1)、酶抗性淀粉(RS2)、逆降解淀粉(RS3)和化学改性淀粉(RS4),对人体葡萄糖反应影响不同。
抗性淀粉可通过发酵、挤压和化学处理等加工技术生产和改性,增强其结构、发酵特性和抗消化性。建议每日摄入量为10-15克。由于热量低,抗性淀粉适合添加到纤维和膨化谷物、零食、意大利面和烘焙食品中,不会显著增加卡路里。此外,它还能改善食品质地、稠度和稳定性。
建议每天摄入抗性淀粉量和最丰富的食物来源

Iatcu OC,et al.Nutrients.2024
• 补充抗性淀粉有助于血糖水平下降
2023年荟萃分析显示,2型糖尿病或糖尿病前期患者补充1型和2型抗性淀粉后餐后血糖降低,RS2的餐后胰岛素反应减少。另一荟萃分析发现,健康个体和糖尿病患者补充抗性淀粉后空腹胰岛素、HOMA-B、糖化血红蛋白降低,HOMA-S增加,糖尿病患者空腹血糖水平下降。
2020年的荟萃分析也表明,补充抗性淀粉可降低空腹血糖,摄入量超过28g/d或干预超过8周时改善更显著。
• 抗性淀粉具有抗炎抗氧化特性从而改善血糖
抗性淀粉改善血糖控制的机制涉及其抗氧化和抗炎特性。一项meta分析纳入了16项试验和706例2型糖尿病患者,结果显示,总抗氧化能力增加,炎症标志物(如CRP、IL-6和TNF浓度)降低。
这些发现一致强调了抗性淀粉在控制T2DM患者血糖水平和减少炎症方面的好处。除了这些荟萃分析外,个别临床试验还提供了强有力的证据,支持将抗性淀粉纳入2型糖尿病患者的饮食中,从而更详细地了解与食用相关的代谢改善。
例如,在60例T2DM女性患者中,补充10g/天的RS2持续8周,导致HgbA1c降低,甘油三酯降低,促炎性TNF-α减少,同时血清HDL水平升高。在另一项针对T2DM患者的研究中,补充RS2显示出对餐后GLP-1的有益影响,从而改善餐后胰岛素反应。
• 抗性淀粉饮食增加了罗氏菌属、阿克曼菌等
关于肠道菌群影响,富含抗性淀粉的饮食增加厚壁菌门与拟杆菌门比例,胰岛素敏感性低的个体中普拉梭菌、普雷沃氏菌科、瘤胃球菌、直肠真杆菌、罗氏菌属和嗜粘蛋白阿克曼菌增加。
不同类型抗性淀粉会引起不同反应:RS4可能促进拟杆菌门,RS2有利于厚壁菌门。研究显示,食用含RS4饼干的参与者放线菌门和拟杆菌门增加,厚壁菌门减少;食用含RS2饼干的个体瘤胃球菌和直肠真杆菌增加。但两种类型的抗性淀粉都与梭菌状芽胞杆菌比例的增加有关。
3
低聚果糖
低聚果糖(FOS)广泛用于生产功能性和低热量食品,作为甜味剂和生物防腐剂,以益生元作用著称。建议每日摄入量为12.5-20g,天然存在于洋葱、菊苣、大蒜、香蕉和朝鲜蓟等植物中。
建议每天摄入低聚果糖量和最丰富的食物来源

Iatcu OC,et al.Nutrients.2024
• 补充低聚果糖增加了双歧杆菌丰度,但会因年龄而异
与其他益生元结合使用时,低聚果糖显示出更好的代谢控制。与多酚类配对时,联合益生元效应可改善胰腺β细胞功能,降低肝脏胰岛素抵抗和低密度脂蛋白胆固醇水平,肠道菌群也发生显著变化,双歧杆菌属增加4倍,真杆菌属增加2倍。
2022年荟萃分析显示,低聚果糖给药后双歧杆菌浓度增加(每日7.5-15g,持续4周以上),乳杆菌属或肠杆菌科无显著变化。低聚果糖对肠道菌群的影响因年龄而异,成人和老年人Odoribacter显著减少,所有年龄组嗜胆菌属和毛螺菌属减少,年轻人和成人颤螺菌属(Oscillospira)减少。
• 低聚果糖对GLP-1分泌的影响还未确定
分子水平上,低聚果糖在小鼠模型中对肠促胰岛素激素(如GLP-1)分泌有积极影响。在2型糖尿病模型中,低聚果糖减轻肠道L细胞凋亡,增强GLP-1分泌。含低聚果糖饼干可在体外增加GLP-1浓度并降低血糖。
然而,人类急性摄入低聚果糖未产生类似结果,肠道激素水平或饱腹感无显著变化。富含低聚果糖的糖浆也不会显著改变餐后生长素释放肽或GLP-1水平。
4
低聚半乳糖
低聚半乳糖是天然功能性低聚糖,也是牛奶中的关键活性成分和广泛使用的益生元。它存在于α-低聚半乳糖和β-低聚半乳糖两种亚型,通过特定半乳糖键区分。
低聚半乳糖因双重功能在食品生产中受到关注:既能改善加工食品的感官品质(如味道、质地和稳定性),又能通过选择性刺激双歧杆菌和乳酸杆菌生长促进肠道健康。建议每日摄入量为2-20克。
建议每天摄入低聚半乳糖量和最丰富的食物来源

Iatcu OC,et al.Nutrients.2024
• 低聚半乳糖可能影响空腹胰岛素和血糖水平
关于低聚半乳糖对空腹胰岛素和血糖水平的影响,研究结果不一致,类似于低聚果糖。一项超重个体研究显示,每日补充5.5g低聚半乳糖84天后空腹胰岛素显著降低,同时总胆固醇、甘油三酯和炎症标志物(如CRP)也降低。
相反,另一项针对2型糖尿病患者的相同剂量和持续时间研究未观察到空腹血糖、糖化血红蛋白或空腹胰岛素水平的显著变化。荷兰一项针对超重或肥胖个体每日摄入15g低聚半乳糖84天的研究也未报告空腹血糖、胰岛素、肠道激素或炎症标志物的显著变化。
• 补充低聚半乳糖后双歧杆菌等有益菌丰度增加
虽然空腹胰岛素和血糖结果不一致,但低聚半乳糖对肠道微生物群的影响显示出更一致的结果。小鼠研究表明补充低聚半乳糖后双歧杆菌水平增加。人类研究同样显示低聚半乳糖增加双歧杆菌科,12周研究发现粪便双歧杆菌增加5倍。最近一项涉及53名糖尿病前期个体的研究显示,补充低聚半乳糖和短双歧杆菌12周后,糖化血红蛋白和空腹血糖显著降低。
除了增加双歧杆菌外,低聚半乳糖补充剂还与肠道微生物组成的其他有益变化有关。例如,在一项针对溃疡性结肠炎患者的研究中,每天服用2.8g低聚半乳糖,双歧杆菌属和克里斯滕森氏菌的丰度增加。还报道了几种有益细菌种类的增加,包括长双歧杆菌、青春双歧杆菌、乳酸菌科和瘤胃球菌属,以及补充低聚半乳糖后梭状芽胞杆菌、丹毒丝菌科、Odoribacteraceae和颤螺菌科(Oscillospiraceae)的减少。
总体而言,虽然低聚半乳糖在改善2型糖尿病血糖指数方面的功效仍无定论,但其对肠道微生物群的积极影响已得到充分证明。数据表明,与益生菌或其他有益剂结合使用时,低聚半乳糖可能增强疗效,尽管单独补充可能不会显著改变血糖结果。
5
果胶低聚糖
果胶是高等植物细胞壁中的必需多糖,对维持植物组织刚性和结构至关重要。水果和蔬菜中果胶含量为0.1%-2.5%,建议每日摄入30克可减少餐后血糖反应、维持正常胆固醇水平和增加饱腹感,从而减少热量摄入。
注:果胶含量因来源而异:橄榄渣34.4%,柑橘废料30%,洋葱皮27-34%,苹果浆20.9%,甜菜浆16.2%。果胶也是果胶低聚糖(POS)的来源,建议每日摄入10-20克,提供益生元益处并支持肠道健康。
• 果胶通过提高胰岛素敏感性等机制抗糖尿病
多项研究证实果胶的抗糖尿病特性。红辣椒果实提取的果胶可显著提高胰岛素敏感性并降低血糖水平。在含106g碳水化合物的膳食中添加16g瓜尔豆和10g果胶可显著降低胰岛素依赖型和非胰岛素依赖型糖尿病患者的餐后血糖和胰岛素水平。
健康成年人在含碳水化合物膳食中摄入10g果胶也可降低餐后血糖。一项涉及43名2型糖尿病志愿者的研究显示,补充果胶后空腹血糖和糖化血红蛋白水平显著降低,HOMA-IR指数降低表明胰岛素抵抗改善。
果胶还可以在胃肠道形成凝胶,减缓胃排空并减少葡萄糖吸收,调节血糖水平并增加饱腹感;对脂质代谢有积极影响,降低胆固醇水平;具有抗炎作用,可能通过减少炎症标志物改善整体代谢健康。
• 果胶促进有益菌生长并产生短链脂肪酸
果胶调节肠道菌群的能力是另一个关键因素,因为它促进有益细菌的生长,从而改善代谢健康和胰岛素敏感性。果胶经过缓慢发酵,并通过产生短链脂肪酸(SCFA)表现出益生元作用。
果胶低聚糖(POS)已显示出促进双歧杆菌的潜力,并提供各种健康益处,包括抗肥胖、抗癌和抗氧化特性。POS代表了一类新的益生元,它通过肠道微生物群的发酵产生SCFA。一项研究表明,甜菜中的POS具有最高的双歧杆菌生成促进作用和最高的SCFA浓度,而柑橘皮中的 POS 增加了乳酸菌种群。
2型糖尿病中响应益生元的肠道微生物组成变化
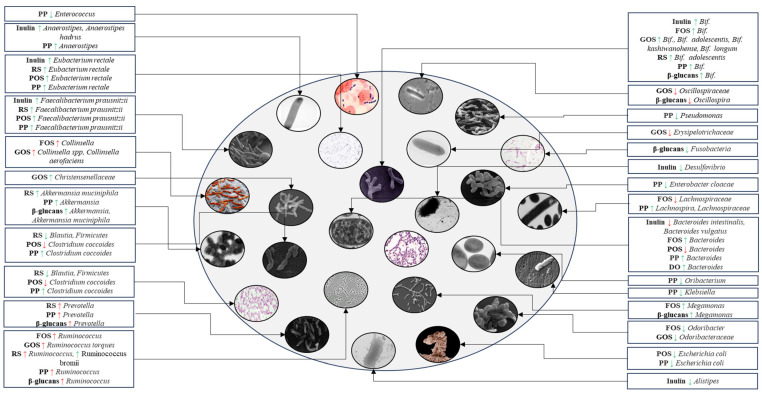
Iatcu OC,et al.Nutrients.2024
6
多酚类
酚类化合物是源自植物的具有生物活性的次生代谢产物,在蔬菜、水果、全谷物和其他植物来源中含量丰富。这些化合物因其抗炎、抗氧化和代谢调节特性而受到关注。每日定期摄入约1-2克多酚与预防慢性疾病相关,每日摄入超过650毫克可显著降低死亡风险。
• 酚类化合物具有控制糖尿病的潜力
膳食酚类化合物(如类黄酮、香豆素、醌、二苯乙烯和姜黄素类化合物)控制糖尿病的潜力受到关注。酚类已被证明能增强胰岛素分泌,调节血糖水平,并可能通过影响复杂分子过程帮助预防糖尿病相关并发症。
杨梅提取物通过增强肝细胞葡萄糖摄取和提高谷胱甘肽水平显示降糖活性。苹果多酚可刺激葡萄糖吸收,改善线粒体功能,减少氧化应激。牛至、黑莓提取物、白桑葚和发芽藜麦酸奶也显示出降血糖、抗氧化和抗炎作用。
• 2型糖尿病患者服用多酚后餐后血糖降低
临床试验进一步证实多酚的抗糖尿病潜力。一项涉及25名糖尿病风险男性的研究发现,早餐时食用250毫升芙蓉提取物可降低血糖、胰岛素、甘油三酯和C反应蛋白。
2型糖尿病患者每日两次补充160毫克纯化花青素24周后,低密度脂蛋白胆固醇、甘油三酯、空腹血糖和胰岛素抵抗降低,高密度脂蛋白胆固醇和抗氧化能力增加。对口服降糖药无反应的2型糖尿病患者每8小时补充350毫克越橘提取物2个月后,空腹血糖、餐后血糖和糖化血红蛋白显著降低,对肝肾功能无不良影响。
• 多酚可增加乳酸杆菌和双歧杆菌
生物活性酚类化合物,包括类黄酮和非类黄酮,在胃和小肠中部分吸收,其余部分到达大肠。在那里,它们要么被肠道微生物群利用以发挥益生元作用,要么转化为活性代谢物。大约90-95%的食用酚不会立即被吸收,而是到达大肠,在那里它们对人类健康起着保护作用。
各种研究表明,多酚可增加有益肠道细菌(如乳酸杆菌和双歧杆菌)的丰度,同时调节其他微生物群,包括拟杆菌、梭状芽胞杆菌和普拉梭菌。肠道微生物群的这些变化可能有助于酚类化合物的抗糖尿病、抗氧化和抗炎作用,进一步支持它们在代谢健康中的作用。
7
β-葡聚糖
β-葡聚糖是主要存在于燕麦和大麦中的可溶性膳食纤维,因其在糖尿病控制方面的健康益处而受到认可。这些化合物天然存在于植物细胞壁、谷物种子以及某些真菌、酵母、藻类和细菌中,高度集中在燕麦和大麦胚乳细胞壁中,占其含量的75%,在麸皮中占10.4%。
注:燕麦和大麦在谷物中β-葡聚糖浓度最高,燕麦每100克干重含3-8克(溶解度82%),大麦含2-20克(溶解度65%)。
• β-葡聚糖改善血糖控制,增加胰岛素敏感性
研究表明,β-葡聚糖可显著改善血糖控制,增加胰岛素敏感性,降低胆固醇水平。其主要作用机制是增加肠道粘度,减慢碳水化合物吸收,调节餐后血糖水平,防止血糖急剧飙升。
β-葡聚糖能在低浓度(1%)下形成高粘度溶液,在各种pH值下都具有稳定性,优于其他可溶性纤维。每日摄入约3克β-葡聚糖可显著改善2型糖尿病患者血糖控制,降低胰岛素抵抗,并与较低的糖化血红蛋白水平相关。
除改善血糖控制外,β-葡聚糖还对脂质代谢产生积极影响,有助于降低糖尿病患者心血管风险。它们通过与胆汁酸结合、促进胆汁排泄和减少肠道胆固醇吸收来降低总胆固醇和低密度脂蛋白胆固醇水平。这种降脂作用与其增加肠道粘度的能力相关,结合葡萄糖、胆汁酸和胆固醇,增强粪便排泄。β-葡聚糖通过肠道菌群发酵刺激短链脂肪酸产生,调节GLP-1和PYY等激素,增加胰岛素分泌并增强饱腹感。
• β-葡聚糖可增加肠道中阿克曼菌等产丁酸菌
β-葡聚糖发酵促进肠道菌群健康变化。糖尿病动物模型研究显示,酵母β-葡聚糖和面包酵母β-葡聚糖给药后阿克曼氏菌增加。燕麦β-葡聚糖增加梭菌和丁酸球菌,减少拟杆菌属、乳酸菌属、颤螺菌属和瘤胃球菌属。肥胖动物研究报道,大麦β-葡聚糖给药后双歧杆菌、拟杆菌属、乳酸菌属和Atopobium增加。
谷物β-葡聚糖对调节肠道微生物群的影响已得到广泛研究。有代谢综合征风险的患者食用富含β-葡聚糖的大麦粉面包后,双歧杆菌属和阿克曼菌属数量增加。动物研究表明,低分子量β-葡聚糖增加双歧杆菌和拟杆菌数量,促进短链脂肪酸(特别是乙酸盐和丁酸盐)产生。食用全麦大麦意大利面后,人罗氏菌属和瘤胃球菌属增加,梭菌门和厚壁菌门减少。
8
铁皮石斛
近年来,石斛属因其显著的益生元特性而受到关注,特别是在2型糖尿病动物模型中。它具有减少慢性炎症、防止胰腺β细胞功能障碍、刺激GLP-1分泌以及通过增强微生物多样性上调短链脂肪酸浓度等显著益处。这些作用改善多种代谢参数,包括葡萄糖耐量、胰岛素抵抗和血脂水平。
• 上调短链脂肪酸产生并改善胰岛素分泌
在糖尿病前期小鼠模型中,铁皮石斛通过调节炎症、修复胰岛损伤、增加肠促胰岛素释放和改善胰岛素分泌发挥作用,特别是通过减少脂多糖介导的TLR4激活。
补充铁皮石斛增加了Roseburia、Alloprevotella、拟杆菌、双歧杆菌和乳酸杆菌的相对丰度,同时上调短链脂肪酸产生和肠道GPR43表达。另一项研究发现类似的抗炎作用,铁皮石斛通过增加Allobaculum、双歧杆菌和乳酸杆菌丰度来增强代谢参数,通过下调LPS/TLR-4通路减少炎症,并加强肠道屏障。
• 铁皮石斛调节信号通路促进血糖控制
铁皮石斛多糖通过减少肝脏糖异生酶和调节AMP-PKA和Akt等信号通路促进血糖控制。在评估2型糖尿病小鼠模型脂质代谢的研究中,石斛补充剂通过激活PPAR信号通路改善肝功能,导致血脂水平降低和胰岛素敏感性提高。类似研究报道,石斛治疗4周后PPARγ激活导致炎症减轻。
尽管尚未在2型糖尿病患者中进行随机临床试验,但动物模型的有希望证据表明,石斛属的益生元作用可能需要进一步研究作为血糖控制的辅助治疗。
04益生元与肠道菌群共同改善血糖参数益生元和肠道菌群可以通过多种机制改善血糖参数,包括将食品发酵成生物活性短链脂肪酸 (SCFA)、减少炎症、增加降血糖激素水平、增强脂质代谢和提高抗氧化酶活性。
这些分子因素和途径的相互作用有助于2型糖尿病患者通过食用益生元改善健康状况。这些机制将在以下小节中具体讲述。
益生元对2型糖尿病患者血糖指数的影响




Iatcu OC,et al.Nutrients.2024
1
通过产生短链脂肪酸改善血糖指数
益生元主要由可溶性纤维组成,由肠道微生物群通过一系列反应发酵,产生短链脂肪酸(SCFA),即乙酸盐、丙酸盐和丁酸盐。
• 短链脂肪酸增强葡萄糖摄取,提高胰岛素敏感性
短链脂肪酸(特别是丁酸盐)作为结肠细胞关键能量来源,具有多种益处。研究表明,定期摄入纤维与人类短链脂肪酸浓度增加约4倍相关。各种益生元在微生物群组成和短链脂肪酸产生方面表现出相似反应。短链脂肪酸通过激活G蛋白偶联受体(GPR41/GPR43)和启动细胞能量稳态信号通路增强外周组织葡萄糖摄取,对提高胰岛素敏感性至关重要。
例如,小鼠模型中益生元纤维缺乏与GPR41和GPR43信号传导减少相关,导致心脏代谢健康状况下降。益生元补充剂通过增加产生短链脂肪酸的肠道微生物群,增强肝脏AMP活化蛋白激酶信号传导,从而降低胰岛素抵抗。AMPK激活通过促进葡萄糖和脂肪酸氧化、增强摄取、抑制脂肪合成和减少糖异生等能量消耗过程来提高胰岛素敏感性。丙酸盐通过GPR43/AMPK通路抑制肝脏糖异生,GPR43激活导致肝细胞钙依赖性AMPK激活,减少糖异生。
• 增加短链脂肪酸产生菌丰度并释放肠促胰素
此外,益生元通过增加短链脂肪酸产生和促进产生短链脂肪酸的细菌来增强抗炎作用、抗氧化特性、脂质代谢和肠促胰岛素激素释放。膳食纤维摄入通过增加短链脂肪酸产生改善2型糖尿病相关的各种参数,包括炎症、血脂水平和早期饱腹感。
2
抗炎作用改善血糖控制
2型糖尿病的特征是低度炎症,由脂肪组织释放促炎细胞因子、巨噬细胞浸润和有害肠道微生物及其代谢物驱动。这种炎症在临床上通常与C反应蛋白水平升高相关。
益生元干预措施的荟萃分析表明,2型糖尿病患者使用益生元后C反应蛋白水平显著降低,循环肿瘤坏死因子-α减少,抗氧化酶活性改善。另一项纳入27项研究的荟萃分析显示,抗性淀粉、抗性糊精和低聚果糖等益生元具有显著的降糖和抗炎益处。其中19项研究报告血糖指标改善,包括糖化血红蛋白、HOMA-IR评分和血糖,许多研究还显示抗炎作用增强。
• 益生元与肠道菌群通过抗炎作用改善2型糖尿病
脂多糖是革兰氏阴性菌外膜组成部分,通过与Toll样受体4结合,触发全身性促炎细胞因子释放,起到有效的炎症刺激作用。这些细胞因子(特别在脂肪组织和肝脏中)通过干扰胰岛素信号通路导致胰岛素抵抗。
白细胞介素-6和肿瘤坏死因子-α等细胞因子激活磷酸化胰岛素受体底物1的激酶,损害胰岛素信号传导。白细胞介素-6诱导细胞因子信号传导抑制因子3表达,降解胰岛素受体底物1,进一步恶化胰岛素抵抗。此外,白细胞介素激活核因子κβ,刺激细胞因子释放并产生反馈回路,加剧血糖失调。
肠道菌群和益生元通过发挥抗炎作用抵消这些炎症过程。多糖补充已被证明可减少2型糖尿病中脂多糖泄漏和代谢炎症。从机制上讲,益生元上调紧密连接蛋白,改善肠道屏障完整性,减轻脂多糖和核因子κβ介导的炎症损伤和氧化应激。
同时,有益的产生短链脂肪酸的双歧杆菌和乳酸杆菌种群增加两倍,有害的幽门螺杆菌种类受到抑制。研究表明,在脂多糖刺激的炎症细胞中进行短链脂肪酸治疗可降低血糖正常和控制不佳的2型糖尿病个体的肿瘤坏死因子-α和干扰素-γ。
注:异麦芽糖糊精是另一种潜在益生元,可抑制肿瘤坏死因子-α和白细胞介素-6,通过抑制脂肪组织中巨噬细胞浸润和恢复胰岛素受体底物1表达来调节免疫反应。它还提高拟杆菌-普雷沃氏菌浓度,改善微生物多样性,提高胰岛素敏感性。
总体而言,炎症是导致血糖控制不佳的重要因素,益生元和肠道菌群在减轻与2型糖尿病发作相关的炎症信号通路方面起着至关重要的作用。
3
影响激素水平从而调节血糖
肠促胰岛素激素(如胰高血糖素样肽1和胃抑制多肽)是众所周知的餐后胰岛素分泌增强剂,是目前流行的改善代谢健康的药物。
益生元摄入可通过改变肠道菌群组成及其代谢物自然刺激胰高血糖素样肽1、肽YY和胃抑制多肽的释放。例如,服用益生元2周与标准化膳食后血浆胰高血糖素样肽1和肽YY浓度升高及餐后血糖水平降低显著相关。
• 胰高血糖素样肽1和肽YY分泌增加
通过益生元增强胰高血糖素样肽1释放可部分归因于短链脂肪酸浓度增加。短链脂肪酸与分泌胰高血糖素样肽1的L细胞上的GPR41和GPR43受体结合,通过Gq信号传导促进胞质钙释放,刺激胰高血糖素样肽1分泌。低聚果糖和菊粉等益生元通过上调GPR43受体表达和增加结肠中分泌胰高血糖素样肽1的L细胞数量来促进这些作用。
例如康普茶作为富含多酚和益生元的茶,通过增加产生短链脂肪酸的细菌(如丁酸球菌、乳酸菌和毛螺菌科)水平来促进胰高血糖素样肽1和肽YY释放,对胰岛β细胞功能显示出有益作用。干预4周后,还观察到血糖控制的其他标志物改善,包括脂多糖水平降低、肠道屏障完整性改善,以及有害细菌属(如脱硫弧菌、大肠杆菌和志贺氏菌)减少。
总体而言,有强有力的证据支持益生元介导的肠促胰岛素激素释放增加,有助于改善血糖控制。
4
改善血脂水平进而增强血糖控制
益生元补充剂的另一个重要结果是改善血脂水平,从而直接或间接增强血糖控制。与其他有益机制类似,益生元通过促进产生短链脂肪酸的有益肠道微生物群生长来实现更好的脂质调节。
• 抑制肝脏胆固醇合成、减少异位脂肪沉积
丙酸盐通过下调参与胆固醇产生的关键酶(如乙酰辅酶A羧化酶和脂肪酸合酶)来抑制肝脏胆固醇合成,减少甘油三酯形成,降低极低密度脂蛋白分泌。
丁酸盐促进脂肪酸氧化,减少肝脏、肌肉和脂肪组织中的脂质积累。血糖控制改善主要由于异位脂肪沉积减少,因为无法抑制脂肪分解是导致2型糖尿病患者胰岛素抵抗的重要因素。
这些代谢益处通常同时发生,补充β-葡聚糖的益生元已被证明可减少胰岛素抵抗(AMPK信号传导)和脂肪酸储存(过氧化物酶体增殖物激活受体γ)的标志物。临床上,研究表明抵抗性糊精补充剂8周导致空腹血糖、糖化血红蛋白和低密度脂蛋白胆固醇水平降低,同时高密度脂蛋白浓度增加。
因此,益生元在控制脂质参数中的作用至关重要,因为脂质代谢与2型糖尿病的发生和发展有着密切关系。
5
益生元、抗氧化剂和血糖指数
氧化应激部分由有害微生物物种过度生长驱动,通过破坏胰岛素信号通路和促进胰腺β细胞功能障碍,在2型糖尿病发病机制和进展中起重要作用。
活性氧介导的通路触发胰岛细胞凋亡信号,导致细胞损伤和功能能力下降。在氧化应激状态下,胰岛素受体底物1磷酸化进一步损害胰岛素敏感性。
此外,促氧化剂损害内皮细胞,减少一氧化氮产生,而一氧化氮通过血管舒张作用将葡萄糖输送到细胞中是必不可少的。埃希菌属、梭状芽胞杆菌属和肠球菌属等细菌属,以及变形菌门和厚壁菌门与拟杆菌门比例增加,与2型糖尿病患者氧化应激增加相关。
• 减轻氧化应激、保护胰腺β细胞并改善葡萄糖稳态
益生元(特别是多酚)通过增加具有固有抗氧化能力的有益细菌相对丰度来减轻氧化应激,这些有益细菌可有效清除活性氧。多酚被肠道微生物群代谢产生酚酸,这是一种有效的抗氧化剂,已知可增强胰岛素信号传导、保护胰腺β细胞并改善葡萄糖稳态。
从机制上讲,酚酸通过下调NADPH氧化酶和上调核因子红细胞2相关因子2,后者是抗氧化酶的有效刺激剂。该研究还表明下游胰岛素信号传导增强,显著增加Akt磷酸化,表明胰岛素敏感性提高。
例如姜黄素是一种多酚,通过上调谷胱甘肽过氧化物酶和超氧化物歧化酶等抗氧化酶来促进胰岛细胞存活和功能,同时减少细胞凋亡。多酚已被证明可降低2型糖尿病患者脂质过氧化,通过降低低密度脂蛋白和增加高密度脂蛋白水平来优化血脂谱。这些改善与抗氧化防御机制增加相关,包括总谷胱甘肽水平升高,有助于防止糖尿病并发症进展。
因此,益生元的抗氧化特性在控制2型糖尿病氧化应激和控制血糖指数方面起着关键的治疗作用。
05总结基于肠道微生物群的精准营养干预正成为功能食品和营养保健品行业的重要发展方向。随着个性化医疗的兴起,针对不同肠道菌群特征和代谢表型的定制化益生元产品将具有巨大的市场潜力。
肠道微生物群失调是2型糖尿病发生发展的重要机制,患者普遍存在产丁酸盐有益细菌(如双歧杆菌、罗氏菌属、普拉梭菌)减少,而有害细菌增加的现象。
研究表明,益生元在肠道菌群在2型糖尿病管理中的重要作用,本文深入分析菊粉、抗性淀粉、低聚果糖、低聚半乳糖、果胶低聚糖、多酚、β-葡聚糖和铁皮石斛等八种主要益生元,揭示了它们通过多重机制改善2型糖尿病的分子基础:促进短链脂肪酸产生、发挥抗炎作用、优化肠促胰岛素激素分泌、改善血脂代谢以及增强抗氧化特性。这些机制协同作用,显著改善血糖控制、胰岛素敏感性和代谢健康状况。
未来,应关注益生元与现有药物的协同作用,发展"药物+营养"的综合治疗模式。根据个体肠道微生物群特征和代谢特征定制益生元干预措施是一种策略。同时,这种"检测-分析-干预-监测"的精准营养循环,不仅能够实现血糖控制的显著改善,更能从根本上修复代谢紊乱的生物学基础。有望实现更好的血糖控制和整体健康改善。

主要参考文献
Iatcu OC, Hamamah S, Covasa M. Harnessing Prebiotics to Improve Type 2 Diabetes Outcomes. Nutrients. 2024 Oct 11;16(20):3447.
Zhou M., Zhao J. A Review on the Health Effects of Pesticides Based on Host Gut Microbiome and Metabolomics. Front. Mol. Biosci. 2021;8:632955.
Keivanlou M.H., Amini-Salehi E., Sattari N., Hashemi M., Saberian P., Prabhu S.V., Javid M., Mirdamadi A., Heidarzad F., Bakhshi A., et al. Gut microbiota interventions in type 2 diabetes mellitus: An umbrella review of glycemic indices. Diabetes Metab. Syndr. 2024;18:103110.
Quigley E.M.M. Prebiotics and Probiotics in Digestive Health. Clin. Gastroenterol. Hepatol. 2019;17:333–344.
Hamamah S., Iatcu O.C., Covasa M. Nutrition at the Intersection between Gut Microbiota Eubiosis and Effective Management of Type 2 Diabetes. Nutrients. 2024;16:269.
Megur A., Daliri E.B., Baltriukiene D., Burokas A. Prebiotics as a Tool for the Prevention and Treatment of Obesity and Diabetes: Classification and Ability to Modulate the Gut Microbiota. Int. J. Mol. Sci. 2022;23:6097.
Wu J., Yang K., Fan H., Wei M., Xiong Q. Targeting the gut microbiota and its metabolites for type 2 diabetes mellitus. Front. Endocrinol. 2023;14:1114424.
Gargari B.P., Dehghan P., Aliasgharzadeh A., Jafar-Abadi M.A. Effects of high performance inulin supplementation on glycemic control and antioxidant status in women with type 2 diabetes. Diabetes Metab. J. 2013;37:140–148.
本文转自:谷禾健康
https://wap.sciencenet.cn/blog-2040048-1493430.html
上一篇:[转载]铁:人体与微生物的“平衡大师”——揭秘铁在健康与疾病中的双重角色
下一篇:[转载]你吃的食物正在悄悄让你抑郁,女性和年轻人最易受影响