博文
[转载]肠道神经免疫轴:神经元、免疫细胞和微生物之间的串扰
||

在自然界中,一些引人注目的共生现象出现在能够改变宿主行为的微生物与其宿主之间。
细菌沃尔巴克氏体(Wolbachia pipientis)如同生物基因木马,能够操控昆虫的生殖和神经系统;
狂犬病毒(Rabies lyssavirus)感染宿主中枢神经系统后,几乎以100%的死亡率展现其致命威力;
偏侧蛇虫草菌(Ophiocordyceps unilateralis,也称为僵尸蚂蚁),通过释放化学物质将蚂蚁变成自己的傀儡。
这些病原体的“精神控制”能力激发了许多末日小说作品,如HBO剧集《最后生还者》中令人毛骨悚然的真菌感染场景。
延展小知识关于细菌沃尔巴克氏体、狂犬病毒、偏侧蛇虫草菌Wolbachia pipientis 操控昆虫生殖及神经Wolbachia pipientis 被喻为生物基因“木马”,可以操控昆虫生殖。常见于节肢动物门和部分线虫体内,影响所寄生动物的生殖和发育。除了影响生殖外,当它们转移到一个新的物种时,会使新寄主产生各种严重的神经系统并发症。2009年开始,科学家发现Wolbachia pipientis阻止登革热病毒在蚊子体内复制增殖,从而阻隔登革热的传播。2019年,中山大学的研究人员利用利用Wolbachia pipientis感染的雄蚊使得雌蚊无法繁殖下一代几乎消灭了世界上最具侵入性的蚊子种类 - 亚洲虎蚊(白纹伊蚊,本地俗称花脚蚊)。狂犬病病毒 (Rabies virus)狂犬病病毒(Rabies virus,RABV) 感染宿主中枢神经系统的重要人兽共患病,一旦发病死亡率接近100%,每年造成全球几万人死亡。Ophiocordyceps unilateralis,僵尸蚂蚁Ophiocordyceps unilateralis ,也被称为偏侧蛇虫草菌,是一种拟寄真菌,偏侧蛇虫草菌在感染蚂蚁后,能够通过释放化学物质改变和控制蚂蚁的行为,让变成蚂蚁自己的傀儡,直到最终死亡。HBO新剧《最后生还者》(The Last of Us)第一季让大家领教了真菌的厉害。剧中的这种致命真菌就是偏侧蛇虫草(Ophiocordyceps unilateralis),它能够入侵昆虫的大脑,使其成为僵尸。
然而,改变行为的微生物并不仅限于这些极端的寄生生物。在自然界中,已有关于共栖和互利微生物驱动宿主行为操控的描述。这个观点在发现胃肠道内的细菌可以调节宿主中枢神经系统后,得到了广泛关注和逐步证实。
肠道微生物群——这一动态且多样化的微生物群落,被认为是肠-脑相互作用的关键调节器。与自然界中那些极端的"精神控制"案例不同,人体肠道微生物群以更加微妙和复杂的方式影响着我们的情绪、认知和行为。
各种证据表明,肠道细菌发出的信号可以循环到大脑,或影响肠-脑轴免疫和内分泌细胞的功能。一个庞大的神经网络——外周神经系统,不断且迅速地在肠道和大脑这两个远距离器官之间传递信息,使大脑能够协调胃肠功能,而肠道也能够影响情绪、认知和行为。
临床意义:当微生物失衡遇上疾病
肠道微生物结构的改变与这些生物系统的变化相关,并对人类代谢、神经精神和肠道健康产生重要影响。焦虑、抑郁、自闭症谱系障碍(ASD)和帕金森病等多种神经疾病都具有明确的胃肠疾病合并症。诸如肠易激综合征(IBS)和炎症性肠病等胃肠疾病常常表现为心理症状。关键是,这些临床相关性与失衡的微生物群和紊乱的肠—脑信号密切相关。
四条通路:微生物与大脑的对话方式
目前已经比较清晰的知道,连接肠道微生物群和大脑的四种主要通信方式。
在第一种途径(代谢物循环)中,微生物衍生的肠道代谢物进入循环,穿过血脑屏障并直接影响中枢神经系统(CNS) 。
在第二条途径中(免疫信号),肠道微生物向各种免疫细胞发出信号,包括驻留在肠道和大脑中的免疫细胞。肠道驻留免疫细胞可以将细胞因子分泌到循环中,也可以前往 CNS 发挥其作用。
在第三种途径(在激素循环)中,肠道内壁的肠内分泌细胞对微生物线索做出反应,并将激素释放到循环中,然后到达大脑。
在第四条通路中,支配肠道的外周传入神经将信号从肠道微生物群传递到 CNS。反过来,大脑通过下丘脑-垂体-肾上腺神经内分泌轴和支配肠道的外周传出神经调节肠道微生物群。
肠道微生物群-脑轴
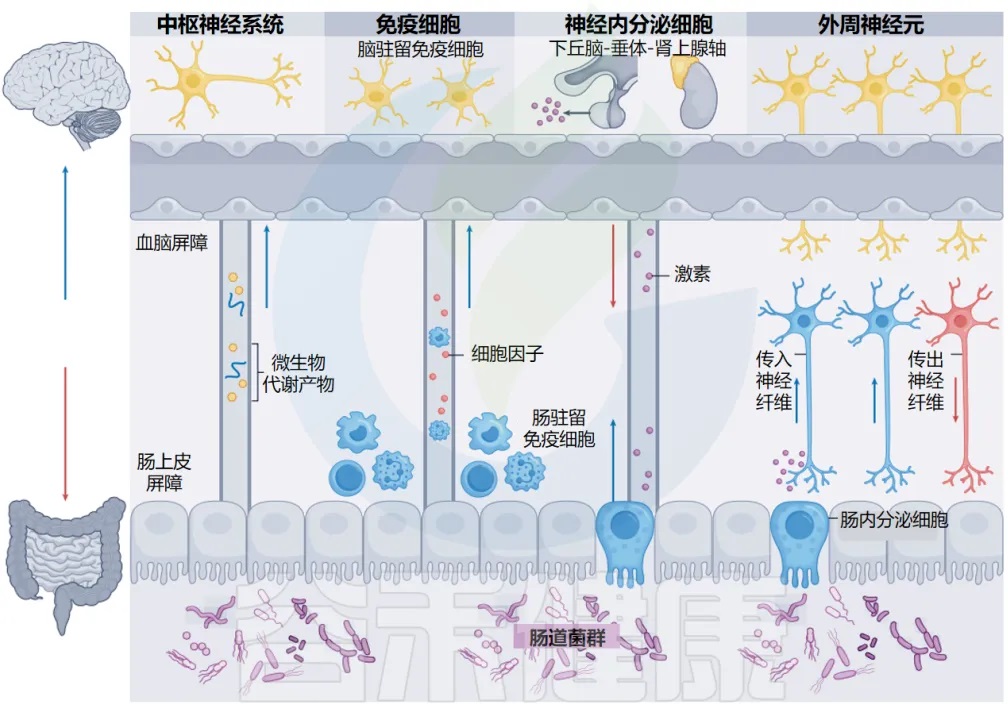
doi.org/10.1038/s41579-024-01136-9
聚焦核心:肠道神经上皮回路的精密机制
这些途径以多种方式相互交叉和影响。免疫细胞和周围神经元之间(神经-免疫轴)、神经内分泌细胞和免疫细胞之间(神经内分泌-免疫轴)、以及肠上皮细胞和周围神经元之间的双向串扰(肠神经上皮轴),为肠道和大脑之间的通信增加了额外的复杂性。
其中,肠上皮的化学感应细胞与支配肠道并延伸到中枢神经系统的周围神经元之间的关系尤为关键。这些肠道神经上皮回路代表了微生物-宿主相互作用的最前沿和最精密的机制。
本文我们将深入了解这些肠道神经上皮回路的分子机制、细胞间相互作用,以及它们如何导致疾病状态,揭示肠道微生物群如何通过这一精密的神经网络实现对宿主行为的影响。理解这些途径有助于促进基于微生物组的胃肠道和神经系统疾病新疗法的开发。
01肠道神经-免疫轴胃肠道免疫系统和神经系统
在哺乳动物中,胃肠道包含最大的免疫系统、微生物群生态系统和内源性神经系统,它们之间复杂的相互作用有助于维持正常的胃肠道生理功能。
特别是胃肠道的固有神经系统,即肠神经系统,调节着重要的胃肠道功能。肠神经系统回路的破坏会导致全身性的胃肠道症状,如腹泻、便秘、内脏疼痛等,这些症状影响着世界上高达40%的人口。
注:肠神经系统,enteric nervous system,简称 ENS,被誉为"第二大脑"。
神经免疫微环境的动态感知机制
胃肠道免疫系统和神经系统都进化出了感知和快速响应动态肠道环境的机制,能够实时监测并快速响应肠腔内的营养、微生物及病理性刺激信号。
许多神经将胃肠道粘膜中的局部免疫细胞连接起来,形成神经元免疫细胞单位,这些细胞单位可以通过肠道管腔营养来源和微生物来源的线索重塑。这些单元不仅能够独立启动局部免疫应答,还通过细胞间通讯网络进行信息整合,最终形成由肠道微生物群精密调控的"肠道神经-免疫轴"。这些协调一致的信号轴调节胃肠道屏障功能、免疫力和宿主保护。
病原感染中的神经免疫协同防御
肠道神经和免疫相互作用在感染期间尤为重要。感染应激可激活特定的胃肠道功能,可以通过腹泻反应快速清除病原体,腹泻反应可以通过增加局部水分泌到管腔中并促进推进性收缩模式来清除病原体,这两种反应都需要肠神经系统(ENS)的输入。
此外,感染或炎症引起的肠神经系统结构和/或活动紊乱可以促进或减少炎症,产生胃肠道症状,并限制组织病理学。
肠神经系统也可以再生,从而在损伤后恢复胃肠道功能。然而,在许多情况下,完全恢复往往受到限制,并且肠神经系统的损害可能产生长期后果,例如感染后胃肠道疾病。
肠道神经和免疫的相互作用的证据
尽管免疫系统与神经系统过去被分开单独研究,但现在越来越清楚,这两个复杂系统在功能上密切相关。这两个系统相互交流并不是一个新概念。两千年前,罗马医生Aulus Cornelius Celsus将炎症的四个主要症状归纳为:
疼痛、发红、肿胀、发热
其中疼痛由感觉神经系统引起,后三者则与血管和免疫功能相关。
神经对于宿主抵御病原体的调控也是进化上保守的特性,这一点从简单的多细胞动物(如线虫)到脊椎动物(如鱼和哺乳动物)的研究中都有明确证据。
过去几十年,科学家们发现神经—免疫交流在生理、抗感染、防御、修复和疾病中的多种作用。
肠道神经解剖——层层保护系统
肠道的神经解剖结构由居于器官内外的感觉神经元和自主神经元共同组成(感觉神经元负责感知信息,自主神经元负责自动控制),胃肠道在解剖学上由肠系膜、浆膜、肌肉、粘膜下层、固有层和上皮组成,由多个周围神经元群支配,这些神经元群与局部免疫细胞配合和协调反应。
肠系膜:是连接肠道与腹壁的重要结构,其主要功能是支撑、固定和保护肠道,同时为肠道提供血液供应和淋巴引流。
浆膜:保护器官,减少摩擦,参与免疫反应、维持器官位置。
肌肉:负责肠道蠕动的动力系统,推动食物通过消化道、进行机械性消化以及促进营养物质的吸收。
粘膜下层:提供营养和支持,还通过其神经和血管网络调节消化和分泌活动。
固有层:为上皮细胞提供结构支持,是免疫细胞聚集的防御前线,参与免疫防御、营养吸收和消化过程。
上皮:保护、分泌、吸收、免疫防御。
肠道支配神经元的命名法基于细胞体是位于胃肠道外部还是内部。肠道相关神经元通常归类为属于内源性肠道神经系统(ENS)。
相比之下,肠道外源性神经元包括体感神经元和自主神经神经元,其细胞体位于外周感觉或自主神经节、脊髓或脑干中。
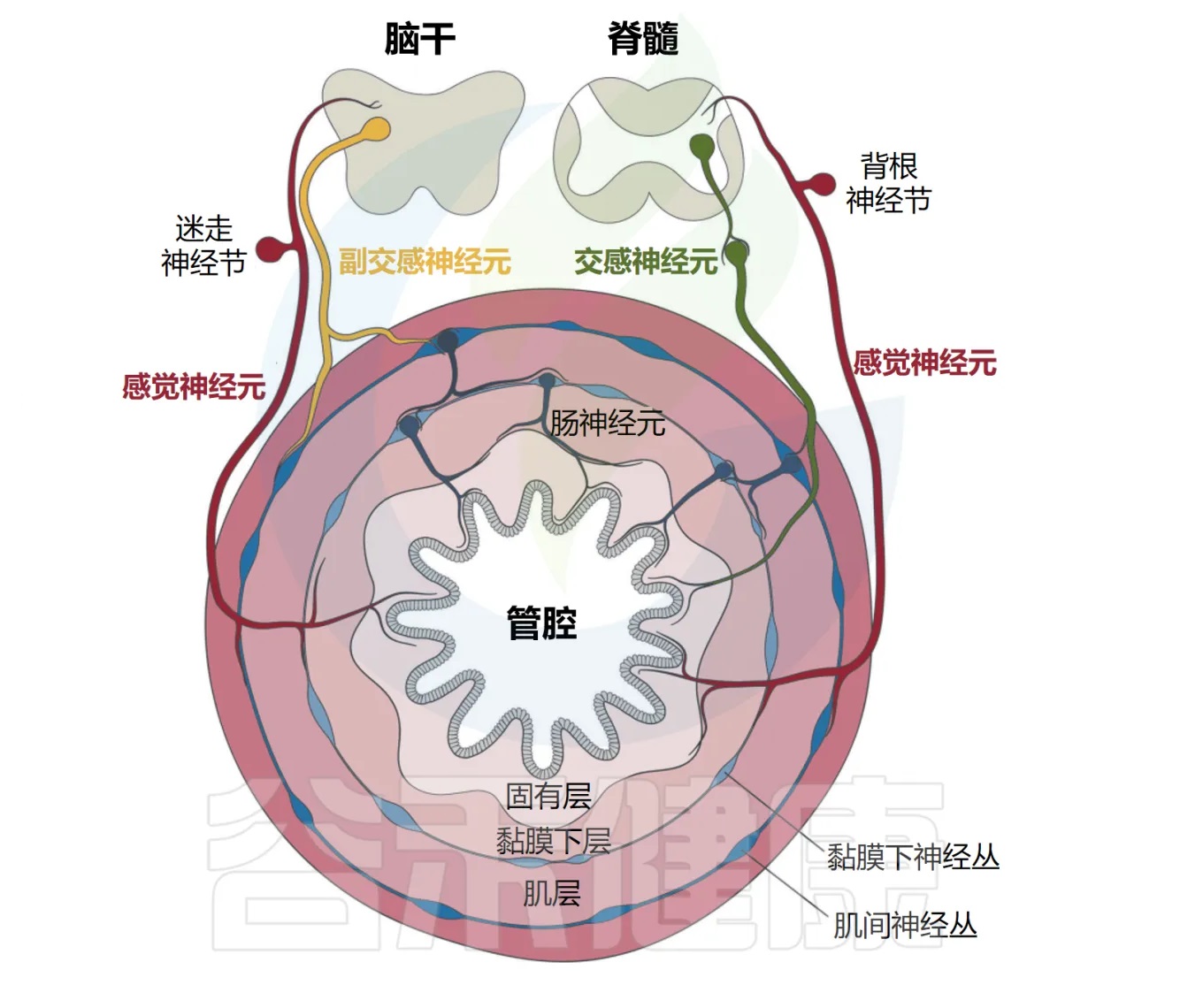
Yang et al. Cell Mol Immunol, 2023.
肠道外源性感觉神经元位于结节/颈静脉迷走神经节(VG)和背根神经节(DRG)中,分别将信号从肠道传递到脑干和脊髓。
自主神经神经元也支配肠道,包括迷走神经传出副交感神经运动神经元和位于自主神经节中的交感神经元。
肠道还拥有自己的内在和自主神经系统,由肠道神经元组成,它们的细胞体位于肌间神经丛和粘膜下神经丛中(如下图)。
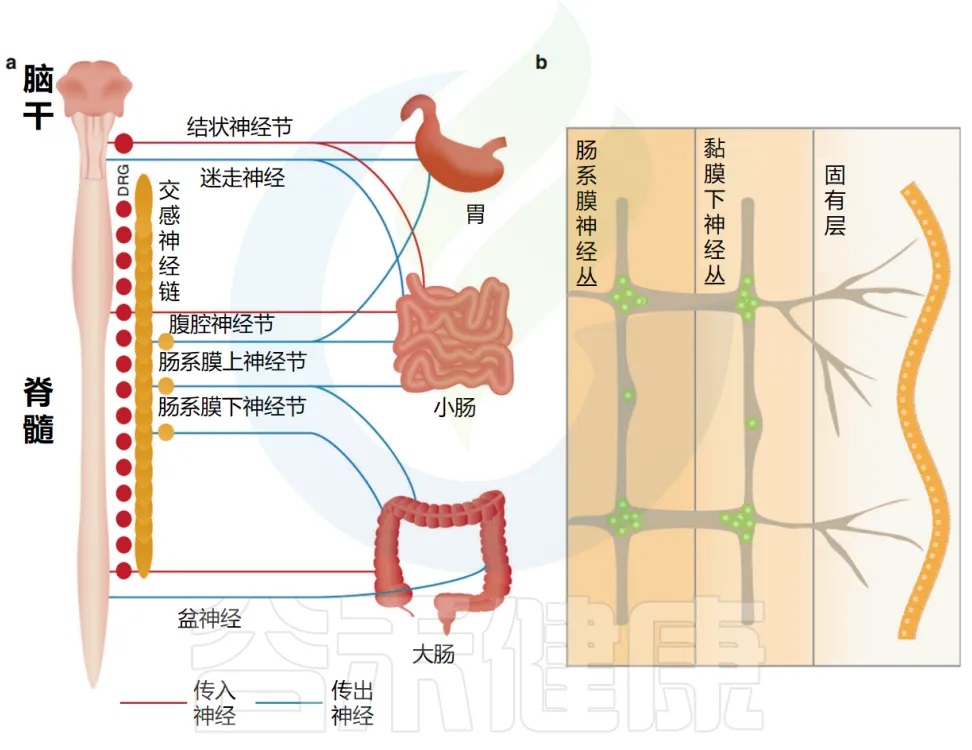
doi.org/10.1038/s41385-020-00368-1
交感神经 vs 副交感神经:肠道的刹车和油门
交感神经元和副交感自主神经神经元分别起源于脊髓和脑干,并介导从大脑到肠道的信号转导。
交感神经元(刹车)驱动身体的压力反应,执行抑制性肠道功能,包括减慢肠道蠕动和分泌。交感神经元通过儿茶酚胺(多巴胺、肾上腺素、去甲肾上腺素)向 α 或 β 肾上腺素能受体发出信号。这些神经元根据其抑制功能进行亚分类,包括节后血管收缩神经元、分泌抑制神经元和运动抑制神经元。
副交感神经元(油门)主要起源于脑干,通过传出迷走神经支配肠道,并通过神经递质乙酰胆碱(ACh)介导肠道生理学,以驱动运动、消化和分泌功能。
神经支配的地理分布
迷走神经副交感神经元沿前尾方向支配胃肠道,胃的神经支配密度最高,小肠和结肠的神经支配密度降低。
这种分布差异与不同肠段的消化功能需求相关:胃的高密度神经支配支持其机械研磨与酸性环境调控,而结肠的低密度则反映其以水分吸收和粪便塑形为主的生理特性。
交感神经元和副交感神经元都与肌间神经丛中的 ENS 形成连接,形成错综复杂的局部神经回路。
神经元——两根触手
一根触手伸向肠道:负责收集信息
另一根触手伸向大脑:负责传递消息
它们能感知什么?
这些感觉神经元群检测营养物质、机械拉伸、管腔威胁和免疫刺激,包括细胞因子。
除了感知,还会“说话”
这些神经元还通过从周围神经末梢释放神经肽在肠道内发出信号(神经肽就像"化学信号",用来和周围的细胞交流。)。迷走神经节神经元主要支配近端小肠,而 DRG 神经元支配整个胃肠道。
肠道神经网络的双层架构
肠道神经元完全驻留在胃肠道内,并组织成环绕肠管的神经节网络,并在空间上分为两层:肌间神经丛,位于圆形和纵向肌肉层之间,以及粘膜下层的粘膜下神经丛。
这两个神经丛通过中间神经元、运动神经元和肠神经胶质细胞紧密相连。它们一起形成介导蠕动和分泌功能的反射回路。
此外,它们还整合来自外源性感觉、副交感神经和交感神经神经元的信号,以介导肠道生理学。
肠道神经和免疫的共同语言
神经系统和免疫系统已经进化出一种共同的语言,在它们对环境损伤的每一步反应中进行交流,从起始到解决。
神经系统和免疫系统:互相听懂语言
神经元表达许多典型在免疫细胞中表达的受体,包括模式识别受体如Toll样受体(TLRs)和炎症细胞因子受体,使免疫细胞能够调节神经元活动。例如,炎症细胞因子IL-1β通过增强感觉神经元的敏感性来调节炎症环境下的疼痛。
免疫细胞也能够通过表达神经递质和神经肽的受体,感知神经元来源的信号。例如,先天淋巴样细胞表达降钙素基因相关肽(CGRP)和神经调节素U(NMU)的受体。
微生物:神经-免疫对话的调节员
神经系统与免疫系统之间的交流机制从进化角度来看是有道理的,因为这种机制减少了应对某些损伤的代价,并使两个系统能够协调复杂的宿主反应。微生物组在调节神经元激活和免疫发育中也起着关键作用。
鉴于免疫细胞和神经元都可以直接或间接感知微生物,微生物组的组成在神经元分化或成熟中起着关键作用,以调节内脏疼痛、肠道蠕动和肠道生理的其他方面。
02肠道神经-免疫轴的调节中枢神经系统的调节
短链脂肪酸它如何发挥作用?
尽管生物屏障严重限制微生物进入 CNS,但是某些肠道微生物代谢物,如短链脂肪酸(SCFA),可以穿过血脑屏障并起神经调节剂的作用。例如,乙酸盐优先被下丘脑吸收,下丘脑是参与食欲控制的大脑中枢,直接抑制摄食行为 。
尽管 SCFA 受体在大脑中通常以低水平表达,但这些纤维发酵产物可以通过抑制组蛋白脱乙酰酶来调节神经元基因表达。
4-乙基苯基硫酸盐,参与情绪处理的大脑区域
除了 SCFAs,最近有报道称微生物代谢物 4-乙基苯基硫酸盐可以改变参与情绪处理的大脑区域,例如海马体和杏仁核,并诱导小鼠的焦虑样行为。由于无菌动物在基线时表现出异常的大脑化学和结构,这些改变发生的时间已成为一个关键的研究重点。目前越来越多的工作揭示了母婴肠道微生物组对早期神经发育结果的影响。
免疫细胞的调节
在皮肤、肺和肠道等屏障组织中,免疫细胞和神经纤维紧密相邻,它们经常互相聊天,交换神经免疫调节分子来保护身体健康。
为什么要这样合作?
这种神经免疫轴在面对感染、过敏原或毒素时尤为重要,因为这些情况需要快速的组织保护反应,然后进行行为适应以避免未来再次遭遇。
具体怎么合作?
- 食物过敏的例子:
通过食物过敏的动物模型,两项最近的研究发现,肠道里的肥大细胞发现过敏原,它们向大脑发送特定信息,大脑记住这种食物,下次就会产生回避行为。
- 皮肤过敏的例子:
皮肤中的γδ T细胞受到微生物调节,它们能调节感觉神经元的活动,控制过敏反应的强度。肠道黏膜γδ T细胞是否参与神经元信号传递仍有待确定。
免疫细胞的远程通讯:如何向大脑发送消息?
免疫细胞不只是在局部工作。它们还有两种方式向大脑汇报:
方式一:血液快递
免疫细胞把细胞因子释放到血液中,就像发快递一样,把信息送到大脑。
方式二:亲自出差
肠道中某些免疫细胞,例如IgA+浆细胞(专门产生抗体)和自然杀伤细胞(专门杀死异常细胞),也能搬家到大脑或脑膜,从而在中枢神经系统中发挥作用。
肠道细菌的重要作用
这些细胞的功能成熟很大程度上依赖于来自肠道的微生物信号。
- 实验证据:
无菌动物(没有肠道菌群的动物)大脑中的IgA+浆细胞和“激活”的自然杀伤细胞数量会减少。
大脑常驻免疫细胞也会受到肠道细菌的影响
例如小胶质细胞和T细胞,也会受到来自肠道菌群的信号影响。 在这方面,细胞因子IL-17,特别是来自脑膜γδ T细胞的IL-17,作为肠道菌群和行为之间潜在的联系受到了广泛关注。
神经内分泌细胞的调节
下丘脑:身体的应激总指挥
下丘脑也是通过下丘脑-垂体-肾上腺(HPA)轴调节身体应激反应的关键指挥者。这个主要的神经内分泌系统包含几个严格调控的激素级联反应(就像接力赛一样,一个传一个),促进器官间的稳态。
肠道细菌影响压力反应
无菌动物具有夸大的HPA反应,并伴有应激诱导的糖皮质激素水平升高。
早期接触共生微生物对HPA轴的正常调节非常重要。简单说,婴儿期的肠道细菌会影响我们一生应对压力的能力。
肠内分泌细胞:肠道里的激素工厂
肠道也包含其自身的神经内分泌细胞群,称为肠内分泌细胞 (EECs):
数量不多,只占肠道上皮细胞的1%
但分布在整个肠道,像遍布各地的小工厂
这些激素调节消化、葡萄糖稳态、食欲。虽然主要在营养感知的背景下进行研究,但 EECs 越来越被认为是肠道菌群的关键传感器和肠-脑信号传导的介质。
肠道激素:连接肠道与大脑的信使
肠道菌群会影响多种循环激素的分泌:
GLP1(胰高血糖素样肽1):调节血糖
PYY(肽YY):控制食欲
5-HT(5-羟色胺):影响情绪
CCK(胆囊收缩素):促进消化
胰岛素样肽5:调节代谢
这些激素作用范围很广
这些激素中的大多数在胃肠道神经纤维、下丘脑和其他大脑区域都有靶点。
由于这些激素及其前体也由身体的各种神经元和非神经元细胞产生,因此了解 EEC 来源的信号对动物行为的具体贡献一直是一个重大挑战,近年来随着基因工具的进步,解决这一问题成为可能。
外周神经元的调节
第四条高速路:外周神经系统的闪电传输
肠道微生物与大脑之间的第四个联系是外周神经系统 (PNS),特别是自主神经系统 (ANS),它具有副交感神经和交感神经两个分支。
神经传输有什么特点?
与前面提到的激素传输或细胞迁移不同,神经系统传输信息超级快:
速度:几分之一秒内就能完成
优势:能对刺激做出快速反应
肠道的双重神经网络:外在 vs 内在
- 外在
作为一种内脏器官,胃肠道由“外在”传入和传出神经纤维支配,其细胞体位于大脑或脊髓区域,分别介导肠道到大脑和大脑到肠道的信号传递 。
- 内在
“内在”肠神经系统 (ENS) 的神经纤维也分布在胃肠道中,其细胞体位于肠壁外层。它们在很大程度上自主地执行基本的肠道功能,并接收来自微生物组和中枢神经系统的输入。
迷走神经:肠脑对话的专线电话
迷走神经作为副交感神经系统的主要分支,尤其与肠-脑通讯密切相关,具有传入和传出神经纤维。它在维持肠道稳态以及调节情绪、食欲和能量平衡方面发挥重要作用。
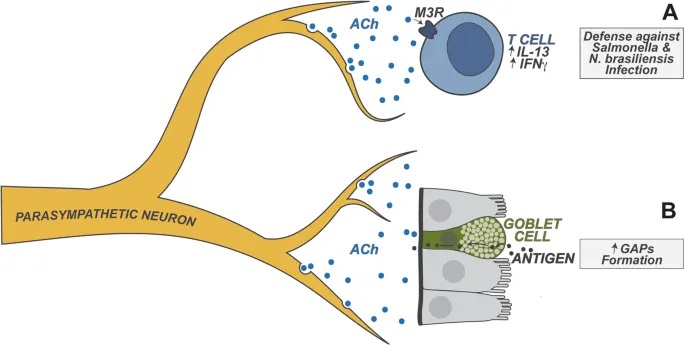
doi.org/10.1038/s41423-023-01054-5
实验证据
在迷走神经切断动物(即接受了迷走神经切断术的动物)中,肠道菌群的许多效应都会消失。然而,微生物信号是否能直接调节体内迷走神经的活动,目前证据仍然有限。
脊髓传入神经:疼痛信号的传递者
脊髓传入神经通过脊髓将感觉信息从肠道分别传递到大脑。我们对微生物组通过脊髓神经发出信号的许多了解都与内脏疼痛有关,因为许多这些纤维都是疼痛感应的。无菌动物表现出对结直肠扩张的超敏反应,而益生菌治疗可以缓解这种反应。共生微生物是否通过脊髓通路影响大脑生理或行为,目前仍不清楚。
交感神经系统:应激反应的调节者
交感神经系统调节多种胃肠道功能,尤其是在应对急性应激时。无菌小鼠的交感神经活动长期升高,这与这些动物体内HPA轴反应的增强相呼应。有趣的是,微生物群对交感神经活动的调节依赖于迷走神经传入纤维的信号,突显了周围神经系统相互关联的性质。
肠道神经元:免疫系统的调度员
肠道神经元是异质性的,能释放两大类物质来调节免疫功能:
- 细胞因子:
IL-18:调节抗菌肽的杯状细胞表达,抗菌肽介导宿主对肠道鼠伤寒沙门氏菌感染的保护
IL-6:抑制结肠中 RORγ+ 调节性T细胞的分化
- 神经肽:
NMU(神经调节素U)
CGRP(降钙素基因相关肽)
VIP(血管活性肠肽)
神经元与先天淋巴细胞的密切合作
肠道神经元还协调肠道先天淋巴细胞 (ILC) 的功能方面也起着重要作用。ILC 是协调下游适应性免疫的早期反应先天淋巴细胞。
- 空间优势
肠道神经元靠近 ILC,为这些神经元调节 ILC 功能奠定了细胞基础。
- ILC2的调节:过敏反应控制
ILC2 高度表达 NMUR1,NMUR1 是神经肽神经中介U(NMU)的受体。肠道感觉神经元的一个亚群表达 NMU,NMU 在过敏情况下释放。
- ILC3的调节:昼夜节律与宿主防御
肠道神经元在调节肠固有层 3 型 ILC (ILC3) 的功能中也起着关键作用。ILC3 表达高水平的 VIPR2,VIPR2 是神经肽 VIP 的受体。
肠道神经元的一个子集(以及迷走神经感觉神经元)表达高水平的 VIP,并且已发现它们在稳态和宿主防御期间调节 ILC3 功能。
- 具体调节过程
进食触发:食物消耗以昼夜节律方式触发VIP的神经元产生;
抑制作用:VIP抑制ILC3介导的IL-22产生,消除抗菌肽的肠道表达;
实验验证:VIP+神经元的化学激活导致IL-22+ ILC3比例降低,使宿主易受口腔啮齿柠檬酸杆菌感染。
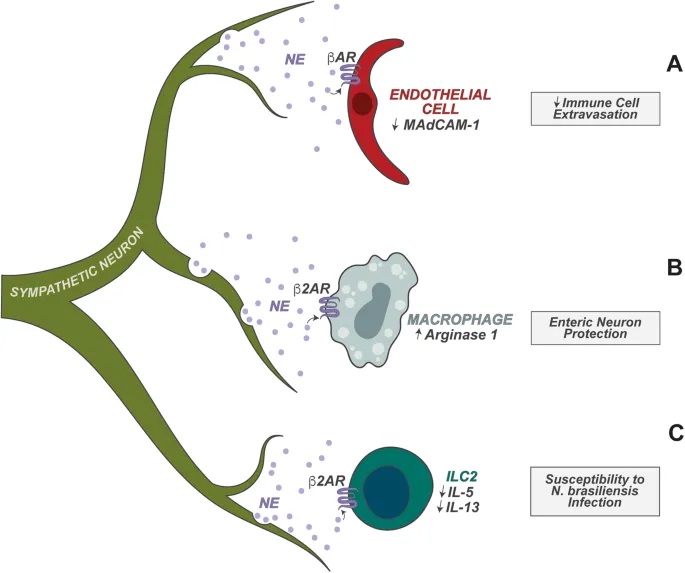
doi.org/10.1038/s41423-023-01054-5
03微生物群 - 神经上皮信号传导肠道上皮每天都要面对来自食物和肠道菌群的各种化学物质。有时,有害刺激物和病原体会进入胃肠道,需要迅速采取损害控制措施。
为了理解管腔环境并区分“好”和“坏”,EEC(肠内分泌细胞) 和周围神经共同形成了一个广泛的肠道感觉网络。
信息处理:局部处理 vs 上报大脑
这些感觉信息有两种处理方式:
局部处理:一些信息保存在肠神经系统(ENS)内,就地解决
上报大脑:另一些信息传递到中枢神经系统,引起饱腹感、渴望等感觉,并改变行为
同时,大脑也会向肠道发送指令,引起特定的器官间反馈反应。
肠道神经上皮界面的肠道微生物群到大脑通路
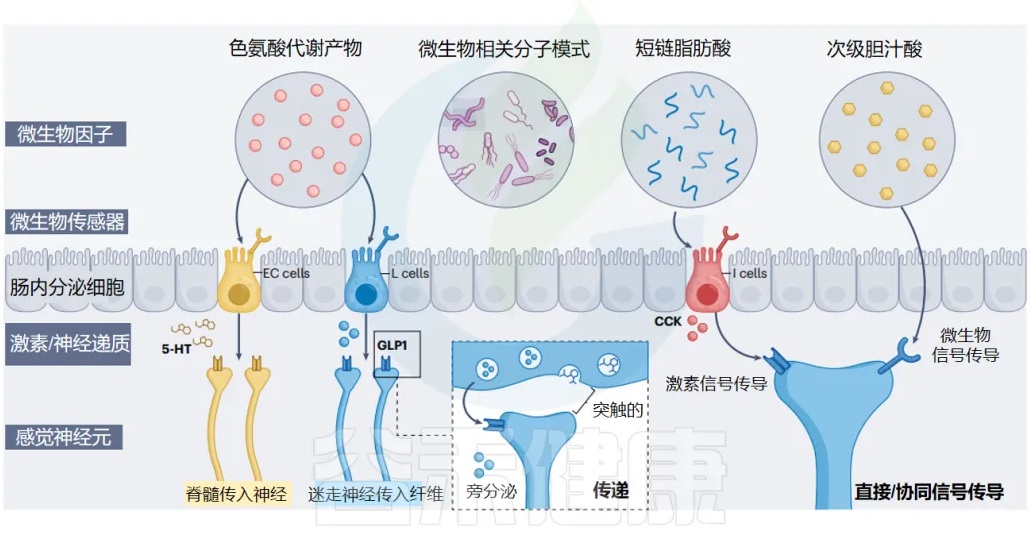
Ohara et al. 2025. Nat Rev Microbiol
肠内分泌细胞:肠道的化学传感器
肠内分泌细胞 (EECs) 是肠道的主要化学感应上皮细胞,通常根据其主要激素产物进行分类。产生 CCK、GLP1/PYY 和 5-HT 的 EEC 分别称为 I 细胞、L 细胞、肠嗜铬细胞(EC)。
在 EEC 家族中,这三个亚群最密切地参与肠-脑通讯:
I 细胞主要位于上肠
L 细胞主要位于下肠
EC 细胞分散在整个肠道中
EECs的灵活性
一些 EEC 在其生命周期中分泌多种不同的激素或经历激素转换,这表明 EEC 亚型并非完全固定。
重要的是,微生物组感应受体在远端肠道的 L 细胞和 EC 细胞中富集,这个区域正好是细菌载量最高的地方,并且主要被认为发生微生物-EEC 信号传导。
简单说,细菌最多的地方,正好是感应细菌信号的传感器最多的地方。
微生物相关分子模式 (MAMP)
MAMP
微生物相关分子模式(MAMP)就想是细菌身上的身份标识牌,是微生物上进化上保守的结构,就像每个细菌都带着固定的身份证。宿主细胞可以通过模式识别受体来读取这些身份信息,特别是先天免疫细胞,它们是识别细菌身份的专家。
Toll样受体
在模式识别受体中,Toll 样受体(TLR)在维持肠上皮细胞稳态中起着至关重要的作用。
肠内分泌细胞表达不同的TLR
体外和体内研究表明,肠内分泌细胞 (EECs) 表达几种不同的功能性 TLR,包括:
TLR4:专门识别脂多糖
TLR5:专门识别鞭毛蛋白
TLR9:专门识别未甲基化的细菌DNA
TLR信号如何影响激素分泌?
肠道中的 TLR 信号传导与 CCK(胆囊收缩素)、GLP1(胰高血糖素样肽1) 、5-HT(血清素)分泌的调节有关,但这仍有待进一步验证。
TLR4 也在感觉传入神经元中表达,但其与微生物组感应的相关性尚不清楚。
短链脂肪酸(SCFA)
短链脂肪酸(SCFA)是膳食纤维发酵的最终产物,由厌氧菌在结肠中大量产生。
特定的支链短链脂肪酸,如异戊酸盐和异丁酸盐,由肠道细菌通过支链氨基酸发酵制成。特征最明显的 SCFA 受体是游离脂肪酸受体2 (FFAR2)和 FFAR3,它们都在多个 EEC 亚群中表达,说明很多肠内分泌细胞都能听到SCFA的信号。
FFAR受体:如何传递SCFA信号?
FFAR 是一种 G 蛋白偶联受体,当被激活时,它与几个下游信号级联反应相连,就像按下按钮后,触发一连串的反应。
- 对L细胞的影响
SCFA 与 L 细胞上的 FFAR2 和 FFAR3 结合会触发细胞内钙动员(也就是钙离子在细胞内快速移动)以及 GLP1 和 PYY 的释放。
EC细胞:用嗅觉受体来感应SCFA
在结肠中,EC 细胞也通过 FFAR 以及嗅觉 G 蛋白偶联受体 OLFR78 和 OLFR558(refs)受到 SCFA 的调节。
不同种类的SCFA有不同的分工
乙酸盐通过OLFR78促进结肠EC细胞分化
异戊酸盐与 EC 细胞上的 OLFR558 结合以刺激 5-HT(血清素)产生
尽管FFAR3在 I 细胞中广泛表达,但尚不清楚 SCFA 是否调节CCK的产生。FFAR2 和 FFAR3 在肠道支配感觉神经元中也有功能表达,表明传入神经纤维可能直接对SCFA做出反应。
次级胆汁酸
次级胆汁酸是肠道微生物群产生并被宿主识别的另一类重要代谢物。最初是肝脏产生的初级胆汁酸,这些初级胆汁酸到达远端肠道后,被肠道细菌进行"二次加工",变成了次级胆汁酸。
简单说,这是肝脏和肠道细菌合作的产物。
主要的次级胆汁酸:两大明星分子
脱氧胆酸(DCA)和石胆酸是两种含量最丰富的次级胆汁酸,能够通过多种宿主受体发出信号,特别是 TGR5(也称为 G 蛋白偶联胆汁酸受体 1)和法尼醇 X 受体。两种受体都在 L 细胞中表达,并参与 GLP1 和 PYY 释放的调节,这就解释了为什么肠道细菌的变化会影响我们的血糖控制和食欲调节。
对EC细胞的影响:调节血清素产生
次级胆汁酸还向 EC 细胞发出信号,通过 TGR5 和可能通过 Tph1 的下游转录指导 5-HT 的产生,Tph1 编码 5-HT 生物合成的限速酶。
目前尚不清楚次级胆汁酸是否作用于 I 细胞,但这些胆汁酸的一部分可以通过肠肝循环到达近端肠道,并且表达 CCK A 型受体的迷走神经传入神经亚群以 TGR5 依赖性方式对 DCA 有反应。
色氨酸和吲哚衍生物
色氨酸是一种从膳食蛋白质中获得的必需氨基酸,人体无法自己制造,其分解产物代表了另一类有助于宿主健康的微生物代谢物。
吲哚途径:细菌的化学加工厂
在色氨酸降解的三个主要途径中,吲哚途径由肠道中的许多细菌物种进行,将色氨酸转化为吲哚及其衍生物,如吲哚-3-乙酸(IAA)和吲哚-3-醛。
吲哚类物质如何影响EECs?
吲哚是 L 细胞中 GLP1 分泌的已知诱导剂。也就是说,吲哚能够刺激L细胞释放GLP1。
在斑马鱼中,吲哚和吲哚-3-醛强烈激活 EEC 并通过瞬时受体电位锚蛋白 1 通道触发 5-HT 释放。
瞬时受体电位锚蛋白1:多功能的感应通道
瞬时受体电位锚蛋白 1 不仅能感应吲哚类物质,还有其他身份,它也是环境刺激物的传感器,比如能感应芥末油(这就解释了为什么吃芥末会有刺激感)。
瞬时受体电位锚蛋白 1 在哺乳动物EC细胞和感觉神经元中高度表达,可能是促进胃肠道蠕动和清除摄入毒素的机制。
04微生物信号的传递在检测到微生物群衍生因子后,肠道感觉网络将此信息传递给CNS。这种传输究竟是如何发生的,特别是在脑-身体通信的背景下,是目前积极研究的一个领域。
新兴的经典肠道神经上皮通路涉及:
微生物对 EEC 的刺激
激素释放和附近传入粘膜神经末梢的激活
神经信号传递到 CNS
肠道感觉网络
肠内分泌细胞(EEC)和肠道支配感觉神经元在肠粘膜屏障处共同形成一个复杂的感觉网络,能够感知和响应各种微生物结构和代谢物。这些包括色氨酸代谢物、微生物相关分子模式、短链脂肪酸和次级胆汁酸。
结肠中的两大主力
在结肠中,有两类重要的EEC:
EC细胞(肠嗜铬细胞):生产5-羟色胺(5-HT)
L细胞:生产胰高血糖素样肽1(GLP1)
这两类细胞都表达这些微生物信号的受体,能够直接听到细菌的声音。
I细胞主要位于小肠中,生产胆囊收缩素(CCK),同样表达微生物传感器。
信号传递的两种方式
当EEC被激活时,它们会通过两种方式释放信号分子:
旁分泌:向周围环境释放
突触传递:直接传递给神经元
EEC会释放:
激素
神经递质
传递给:
附近的迷走神经传入神经
脊髓传入神经
不仅影响EEC,还直接影响神经
微生物输入还可以直接调节感觉神经纤维的敏感性,从而增强 EEC-神经荷尔蒙信号传导。
不同信号走不同高速路
根据所涉及的微生物传感器、EEC 亚群、神经肽和感觉神经元类型,不同的微生物线索可以通过不同的肠道神经上皮途径输送,最终对大脑功能和行为产生不同的影响。
感觉细胞多样性
肠道里的神经元是怎么工作的?
肠道中有两大类感觉传入神经负责不同的监测任务:
化学感受器:专门感知各种化学刺激(比如营养物质、激素等)
机械感受器:专门感知机械刺激(比如肠道的伸缩、压力等)
最近对迷走神经和脊髓神经元的分析发现了多种感觉神经元细胞类型,甚至在化学感受器和机械感受器中也是如此。
为什么需要这么多不同类型的神经元?
结合遗传的研究方法,得出一个研究的共识,即单个感觉神经元之间存在很大的分工。每种神经元都有自己的专业领域,就像专科医生一样。
这些神经元到底分工有多细?
一些具体的例子:
GLP1R+神经元:专门检测肠道扩张(监测肠道是否被撑大)
GPR65+神经元:专门检测营养物质(监测食物成分)
检测糖的神经元:只对糖类敏感
检测脂肪的神经元:只对脂肪敏感
复杂分工的深层原因:系统的精密设计
这种刺激特异性神经元反应可能反映了肠道神经上皮水平信息感知和传递方式的复杂性,部分原因是 EEC 和感觉神经元群的异质性。这种精密的设计确保了肠道能够准确识别和传递各种不同的信号。
未来:寻找微生物组专属神经元
这些观察结果提出了一个有趣的问题,即是否有专门的“微生物组响应”感觉神经元来支配肠道,以及是否存在基于微生物刺激的亚型。
当然,GPR65 + 迷走神经神经元是不错的候选者,因为它们是在整个胃肠道中具有致密粘膜神经末梢的化学感受器。
然而,随着迷走神经支配沿结肠长度向远端减少,脊神经可能同样有助于将微生物线索传递给 CNS。
旁分泌传递与突触传递
传统方式:EEC的广播信号传递
当EEC受到刺激后,它们会采用最常见的信号传递方式:
将激素释放到周围组织中
激活邻近的传入神经末梢
这通常被认为以旁分泌方式发生——即最接近 EEC 范围,只要表达相关受体的纤维,就能接收信号并传播给大脑,也就是“近水楼台先得月”。
新发现:EEC的专线连接方式
科学家们发现了一种更直接的连接方式!研究发现了一种独特的 I 细胞和 L 细胞亚群,被称为"神经足"细胞。
- 什么是"神经足"细胞?
它们有独特的轴突样突起(像神经元一样长出"脚")
这些"脚"与迷走神经传入神经形成功能性突触
形成直接的物理接触
更多证据:EC细胞也有类似的专线
对于 EC 细胞和脊髓传入纤维提出了类似类型的连接。支持这种突触连接的证据:
EEC需要依赖电压门控钠通道(如Nav1.3)进行激活
EEC能够分泌神经递质(如谷氨酸)进行信号转导
这些特征都很像神经细胞的行为
然而,最近的高分辨率成像研究尚未发现令人信服的证据证明 EEC 和传入神经之间存在突触接触,这表明神经足细胞要么非常罕见,要么仅存在于某些 EEC 亚型中。另一种解释是,考虑到大多数 EEC 的寿命较短,EEC-神经突触是高度动态的。
了解 EEC 的特定子集是否可以直接进入大脑很有价值,因为它们将是影响与肠道微生物群相关的情绪和行为变化的候选者。
协作微生物-宿主信号传导
到目前为止,我们已经将肠道神经上皮回路描述为一条线性通路,信号在到达 CNS 之前从肠道微生物群传递到 EEC,再传递到内脏传入神经。
微生物群 → EEC → 内脏传入神经 → 中枢神经系统
新发现:微生物的捷径通道
一些微生物因子,包括 SCFA、次级胆汁酸、蛋白酶,可以绕过上皮层,并直接作用于感觉传入神经。
协同作用:1+1>2的效果
感觉神经纤维如何整合微生物和宿主来源线索的细节开始浮出水面。
- 例子1:DCA + CCK的强强联合
脱氧胆酸(DCA,来自微生物群的次级胆汁酸)+ CCK(来自I细胞的激素)
它们分别通过TGR5和CCK A型受体
协同激活迷走神经传入神经
导致下丘脑的更大激活和对摄食行为的更强影响
注:它是一种次级胆汁酸,由肠道菌群代谢初级胆汁酸而产生。
- 例子2:丙酸盐增强CCK效果
丙酸盐可以增强CCK向迷走神经传入神经的传递
部分通过增强FFAR3下游的Cckar表达
这些发现表明,微生物代谢物可以与肠道激素合作以影响感觉神经放电。
复杂的生物网络系统
鉴于最近对免疫细胞在协调脑-身体回路和肠胶质细胞在塑造肠道神经活动中的作用的见解,微生物群-神经上皮相互作用可能涉及多个细胞输入的影响,这个系统作为更大的互连生物系统网络的一部分,远比简单的线性通路复杂。
简单说,肠脑通讯不是一条高速公路,而是一个复杂的交通网络,有多条道路、多个路口,各种车辆(不同的信号分子和细胞)在其中协调运行。
05调整肠道微生物群肠道感觉网络收集的有关微生物组的信息,在组织本身、脑干和脊髓以及高级大脑区域内进行整合和处理。
大脑处理完信息后会做什么?
中枢神经系统的效应肢体会积极响应,主要包括:
HPA轴(下丘脑-垂体-肾上腺轴)
自主神经系统的传出臂
它们的任务是对动态变化的肠道环境做出反应,调节胃肠道生理学的各个方面。
近年来,宿主通过局部和远程信号传导机制对肠道微生物群的定向作用受到了相当大的关注。
肠神经上皮界面的脑到肠道微生物群通路
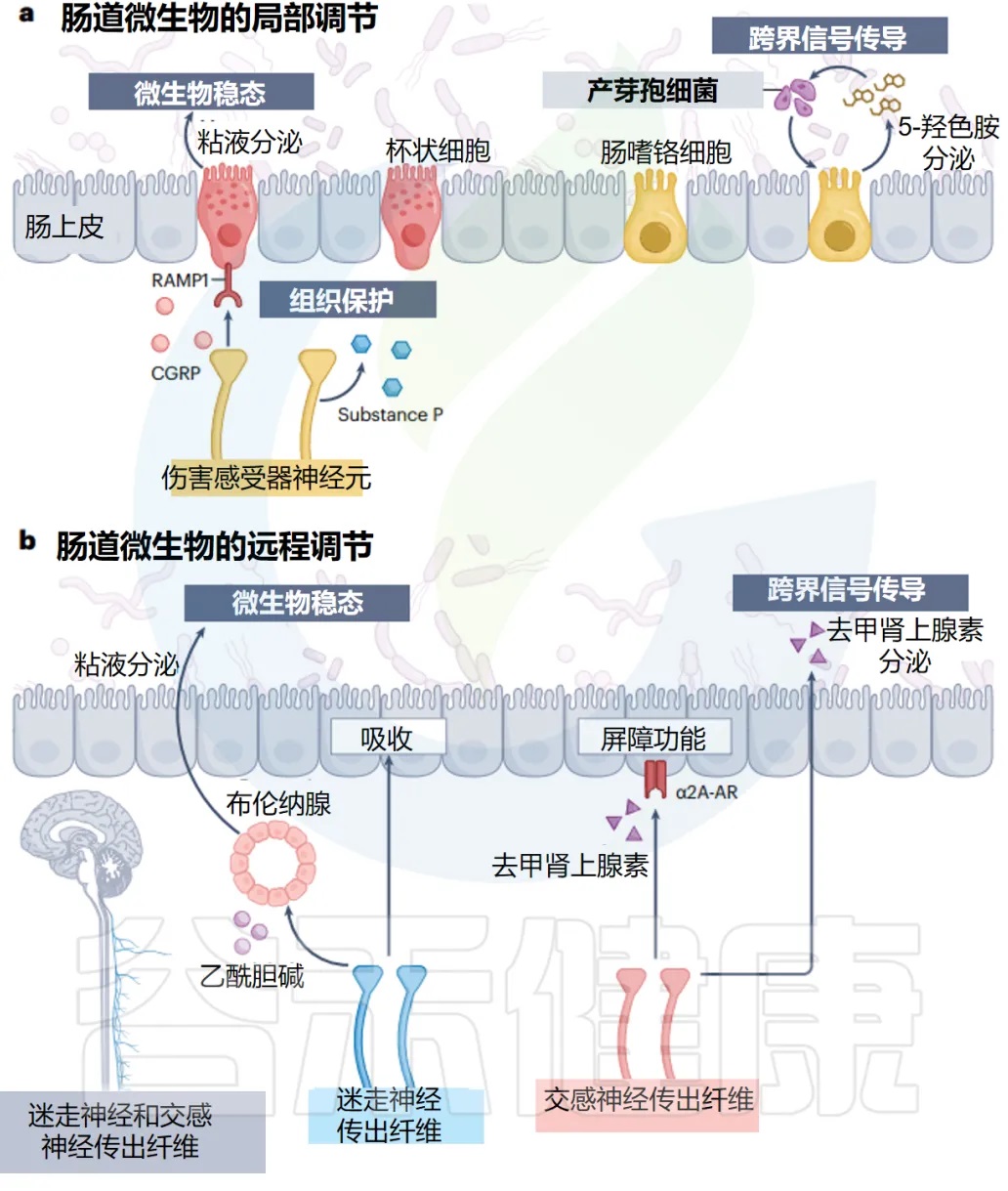
doi.org/10.1038/s41579-024-01136-9
局 部 调 控
传统认知:感觉神经只负责"上报"信息
传统上,感觉神经是将信息传递到 CNS 的传入纤维,就像信息传递员一样,只负责把肠道的情况报告给大脑。
新发现:感觉神经还有"管理"功能
现在人们普遍认识到,感觉神经元还通过在屏障组织局部释放各种神经肽和神经递质来执行传出功能。
- 管理方式:
通过作用于附近的免疫和非免疫细胞,感觉传入神经是维持组织健康不可或缺的一部分。
肠道中的疼痛神经:伤害感受器
在肠道中,许多具有局部效应功能的感觉神经元是伤害感受器,它们通常在皮肤中介导疼痛感。
- 伤害感受器:微生物管家
尽管它们的确切特征和功能正在阐明,但最近的两项互补研究发现,伤害感受器在调节肠道微生物稳态方面具有新作用。
- 实验证据:
在抑制伤害感受器后,拟杆菌门和厚壁菌门显著改变
Turicibacteraceae和Erysipelotrichaceae科(如Turicibacter 和 Allobaculum)增加
Oscillospira的减少
在没有功能性伤害感受器的情况下,小鼠以微生物组依赖性方式更容易患结肠炎。
伤害感受器的保护机制:释放保护性分子
伤害感受器通过释放 P 物质和降钙素基因相关肽来促进组织保护,这些肽向邻近的肠道杯状细胞发出信号以驱动粘液分泌。
有趣的是,伤害感受器释放的 P 物质和降钙素基因相关肽受共生信号调节。因此,感觉神经元同时监测和调整肠道菌群的组成以支持肠道稳态。
EC细胞与5-HT的调节系统
一个显著的例子是 EC 细胞,它在压力、机械压力和迷走神经刺激下将 5-HT 释放到肠腔中。
- 微生物的影响:
EC 衍生的管腔 5-HT 水平受微生物线索的调节。
孢子形成细菌,包括梭菌科、Turicibacteraceae科,约占宿主外周 5-HT 产生的 50%。
微生物的策略:操控宿主为自己服务
因此,孢子形成细菌识别肠腔中的 5-HT,并通过结肠中的 EC 细胞进一步诱导宿主 5-HT 的产生,来促进自身在微生物组中的成员身份。
这种微生物群-EEC 串扰是孢子形成者独有的,还是其他细菌物种参与界间信号传导仍有待确定。
远 端 调 节
宿主调节微生物的双重策略:局部 vs 远程
宿主有两套不同的调节策略:
策略1:局部信号调节——就地解决问题
来自肠道感觉细胞的局部信号
提供了一种快速直接的方式
独立于中枢神经系统输入来调节肠道菌群
策略2:远程肠脑回路调节——统筹全局管理
远程肠脑回路考虑了宿主的生理和精神状态以及来自外部世界的输入
实现了实现微生物稳态的整体方法
ANS 的两个主要分支——迷走神经和交感神经,通过它们在胃肠道中的不同功能输出,来协调这种反馈反应。
迷走神经:身体休息和消化时的管家
虽然大多数迷走神经纤维将感觉信息传递到大脑,但有些也向肠道提供副交感神经流出,主要支配 ENS 并促进肠道蠕动和上皮分泌物,作为身体“休息和消化”反应的一部分。
最近的证据表明,迷走神经传出纤维在通过近端小肠 Brunner 腺调节肠道微生物群方面,具有惊人的作用。
- 对特定微生物的影响:
乳酸菌属对这种神经腺回路的扰动特别敏感,在迷走神经刺激时扩大,并在参与压力信号时丰度降低。
迷走神经传出神经元的活动,也极大地影响了肠上皮的吸收能力,可能会改变饮食-微生物群动力学和微生物代谢物对宿主的获取。
交感神经:压力状态下的应急管理员
- 交感神经的基本功能
交感神经为肠道提供肾上腺素能神经纤维,在那里它们支配 ENS 和肠粘膜,并释放去甲肾上腺素,尤其是在应对压力时。
- 对微生物群的具体影响
交感神经激活导致粘蛋白降解剂(如Akkermansia)增多,Turicibacter spp137 减少。
这些微生物组的变化伴随着粘液产生、抗菌基因表达和上皮周转率的变化,揭示了交感神经、上皮细胞和肠道细菌之间的密切关系。
交感神经的化学武器:去甲肾上腺素的直接作用
- 直接的化学信号传递
交感传出神经元影响微生物组的另一种机制是,通过将去甲肾上腺素释放到肠腔中。
- 跨界信号传导的例子
QseC 组氨酸激酶对宿主来源的儿茶酚胺(如肾上腺素和去甲肾上腺素)的细菌感应,是王国间信号传导的另一个例子。
- 对病原菌的影响
在某些大肠杆菌菌株中,儿茶酚胺可以改变毒力基因表达和致病性。有趣的是,肠腔中游离儿茶酚胺的水平部分受肠道微生物群的调节。
这可能具有临床意义,因为 GLP1 受体激动剂利拉鲁肽是一种常见的抗糖尿病药物,被发现可以激活交感神经传出纤维,触发去甲肾上腺素释放到肠腔中,并诱导大肠杆菌的扩增 。
总的来说,这些研究表明,交感神经可以直接影响肠道细菌定植。
06未来方向和展望神经免疫学是一个快速发展的领域。最近在不同的神经元亚群如何调节肠道免疫反应方面的突破,加深了我们对生理和病理条件下肠道免疫的理解。
除了被动接受和应对有害的威胁外,免疫系统还向神经系统发出信号以启动防御性反应。同时,神经系统在对潜在威胁的预期和感知下,积极调节肠道中的免疫反应。神经系统和免疫系统之间的协调使宿主能够正确处理复杂的刺激和不断变化的环境。
肠道微生物群也是调节肠脑轴中神经元和免疫激活的关键臂。结合微生物组、转录组、蛋白质组的多组学研究,配合光遗传学和化学遗传学等新兴技术,将深化我们对神经元如何塑造肠道生态系统的理解。
肠道菌群检测技术的应用将成为连接基础研究与临床实践的重要桥梁。基于微生物组构成和神经反应模式的个体化治疗将成为现实,通过功能性微生物组分析,结合肠道菌群检测报告中的神经递质等相关指标,实现疾病风险预测和治疗效果的个性化评估。自迷走神经电刺激在减轻炎症方面的发现以来,生物电子医学在临床应用中展现出广阔前景,无创迷走神经刺激已在克罗恩病临床试验中显示疗效。
神经递质和神经肽受体信号传导的治疗靶向为药物创新提供了新思路。β-肾上腺素能受体拮抗剂和CGRP受体拮抗剂等现有药物,凭借其调节肠道免疫的能力,可重新用于胃肠道功能障碍治疗,同时基于微生物代谢物的新药开发和靶向EEC的小分子化合物研究正在兴起。
这些突破将更大地改变焦虑、抑郁、自闭症、帕金森病等神经疾病以及肠易激综合征、炎症性肠病等消化系统疾病的治疗策略。通过微生物疗法、肠道靶向神经调节和神经-免疫平衡调节的联合治疗,未来,临床医生可能会根据患者的肠道菌群特征、免疫状态和神经系统表型制定个性化治疗方案。
医学正从标准化治疗转向个体化精准医疗,肠道-菌群-免疫-神经将成为未来疾病治疗的重要方向。短链脂肪酸、色氨酸代谢物以及其他菌群代谢产物正被开发为新型神经调节剂,它们能通过血脑屏障或迷走神经途径影响中枢神经系统功能。
早期干预肠道菌群失调可能成为预防神经精神疾病的关键途径,特别是对具有遗传风险的人群。肠道健康将成为整体健康管理的重要组成部分。
主要参考文献
Jacobson, A., Yang, D., Vella, M. et al. The intestinal neuro-immune axis: crosstalk between neurons, immune cells, and microbes. Mucosal Immunol 14, 555–565 (2021).
Ohara, T.E., Hsiao, E.Y. Microbiota–neuroepithelial signalling across the gut–brain axis. Nat Rev Microbiol 23, 371–384 (2025).
Yang, D., Almanzar, N. & Chiu, I.M. The role of cellular and molecular neuroimmune crosstalk in gut immunity. Cell Mol Immunol 20, 1259–1269 (2023).
本文转自:谷禾健康
https://wap.sciencenet.cn/blog-2040048-1493421.html
上一篇:[转载]久治不愈的疼痛,基于肠道菌群调节的科学依据与临床前景
下一篇:[转载]基于微生物组数据进行疾病预测的混合模型——BCGLMM