博文
[转载]久治不愈的疼痛,基于肠道菌群调节的科学依据与临床前景
||

慢性疼痛已成为困扰全球五分之一成年人的重大公共卫生挑战,表现为一种复杂的、多维度失调的病理状态,深刻影响患者的生理、心理乃至社交。
这一持续3个月或更长时间的疼痛现象,呈现出锐痛、刺痛、灼烧感、酸痛等多样化特征,可能局限于特定部位或广泛分布全身,因其易于复发的特性,给个人、家庭及整个社会带来了沉重的经济与医疗负担。
尽管现代医学在疼痛管理方面已取得一定进展,但现有的治疗策略——如阿片类药物、非甾体抗炎药(NSAIDs)、抗惊厥药及抗抑郁药等,往往伴随着疗效有限、副作用显著(如成瘾、胃肠道损伤、中枢神经系统抑制等)以及个体差异巨大等问题。
更重要的是,这些疗法多以对症处理为主,难以触及慢性疼痛复杂病理生理机制的核心——包括外周敏化、中枢敏化、神经炎症、神经-免疫失衡等关键病理过程,导致许多患者的临床需求远未得到满足。因此,探索慢性疼痛发生发展的深层机制,并据此开发更为精准、高效且安全的创新性治疗策略,已成为疼痛研究领域亟待突破的关键瓶颈。
近年来飞速发展的肠道菌群研究为我们理解和干预慢性疼痛提供了一个新视角。肠道菌群通过"微生物群-肠-脑轴"这一复杂的双向通讯网络,影响着中枢神经系统的功能,包括情绪、认知乃至疼痛感知。越来越多的证据表明,肠道菌群失调与多种慢性疾病的发生发展密切相关,特别是在神经病理性疼痛、炎症性疼痛、内脏痛等多种慢性疼痛模型中,菌群结构与功能的特征性改变及其与疼痛表型的密切联系正以前所未有的速度向纵深拓展。
本文旨在系统阐述慢性疼痛的核心病理特征,并概述肠道菌群失调对宿主生理的广泛影响;深入剖析微生物群-肠-脑轴在疼痛感知与调节中的多通路作用,包括神经、免疫、内分泌及关键代谢产物(如短链脂肪酸、次级胆汁酸、色氨酸代谢物)的介导机制;同时整合最新的临床前与临床研究证据,展示在不同慢性疼痛模型中肠道菌群的特征性改变;评估了当前基于肠道菌群调控的慢性疼痛干预策略,为慢性疼痛的基础研究与临床转化提供参考。
01关于慢性疼痛慢性疼痛持续3个月或更长时间,可能持续性的,也可能时好时坏地反复发作。它可能影响人们到无法工作、正常进食、参与体育活动或享受生活的程度。
慢性疼痛有哪些症状?
慢性疼痛有:锐痛、刺痛、灼烧感、搏动性疼痛、酸痛、僵硬感等。
慢性疼痛可能局限于特定部位(背部、颈部、关节)或广泛分布全身。
患有慢性疼痛的人常常也会感到疲倦,睡眠问题,食欲不振和/或对食物失去兴趣,以及体重减轻。
经典闭环:疼痛、抑郁、失眠
疼痛可能会让人专注于疼痛,出现抑郁和易怒,抑郁和易怒通常会导致失眠和疲劳,进而导致更多的易怒、抑郁和疼痛。
慢性疼痛的原因?
一些已知的慢性疼痛原因包括:
纤维肌痛
这包括关节、肌肉和骨骼的广泛疼痛,通常表现为隐痛或酸痛。
关节炎
关节炎引起的疼痛也发生在关节中,通常表现为隐痛。这是关节炎对关节造成的损伤所导致的。
肠易激综合征 IBS
腹痛和痉挛可能由于 IBS 发生,这是由于肠道和大脑之间的联系。肠易激综合征引起的慢性疼痛通常包括腹部痉挛和剧烈疼痛,甚至背痛。
慢性低背部疼痛
持续的下体疼痛可能来自多种原因,包括先前的损伤或特定状况,如坐骨神经痛或椎间盘突出。
慢性头痛或偏头痛
虽然头痛和偏头痛不同,但你可能会因为其中任何一种而出现慢性疼痛。如果头痛或偏头痛每月出现 15 天或更多天,则被视为慢性。
子宫内膜异位症
这种状况会影响盆腔和腹部区域,并在月经周期期间、之前或之后引起慢性盆腔疼痛。它还可能导致消化问题和一般的胃痛。
慢性疲劳症候群
患有慢性疲劳综合征的人可能会经历身体疼痛、头痛和喉咙痛,伴随极度疲劳、疲劳和睡眠障碍等症状。
还有很多其他例如癌症等疾病,总的来说,包括神经性的(神经损伤或刺激)、伤害性的(组织损伤、受伤、手术等)、肌肉骨骼性的(韧带、肌腱、肌肉、关节、骨骼等)、炎症性的(免疫系统对感染或受伤的反应)、心因性的(心理状况引起的疼痛)、机械性的(受到物理压力)等。
为什么传统的对症治疗往往收效甚微,甚至可能带来新的问题?要回答这些问题,我们需要深入探讨慢性疼痛的病理生理学基础。
02慢性疼痛的病理生理学核心机制慢性疼痛的本质远非简单的伤害性感受信号的持续传递,而是一个涉及外周及中枢神经系统发生复杂可塑性改变的病理过程。
慢性疼痛的核心特征在于,神经系统对伤害性及非伤害性刺激的反应模式发生了持久性的、异常的增强和放大,使得疼痛感知与初始损伤或刺激的程度和范围不再匹配,甚至在原始致伤因素消失后依然存在。
理解这些核心机制,是后续探讨肠道菌群如何影响疼痛的关键。
外周敏化与中枢敏化:疼痛信号的恶性循环
☆ 外周敏化
外周敏化(Peripheral Sensitization)是指在外周组织损伤或炎症部位,伤害性感受器(痛觉感受器)的兴奋性异常增高的现象。
组织损伤后释放的多种炎症介质,如缓激肽、前列腺素(PGE₂)、TNF-α、IL-1β、神经生长因子(NGF)等,可以直接或间接地作用于感觉神经末梢上的特异性受体和离子通道(如瞬时受体电位香草酸受体1亚型 TRPV1、酸敏感离子通道 ASIC等)。
这些介质通过激活下游信号通路(如PKA、PKC、MAPK等),导致离子通道磷酸化、表达上调或膜转运增加,从而降低伤害性感受器的激活阈值,并增强其对刺激的反应强度。
其结果是,即使是轻微的刺激也会引发强烈的疼痛感(痛觉过敏,hyperalgesia),甚至非伤害性刺激(如轻触)也能诱发疼痛(异常疼痛,allodynia)。
☆ 中枢敏化——慢性疼痛持续化和扩散的关键机制
中枢敏化(Central Sensitization)指脊髓背角和更高级中枢(如丘脑、杏仁核、前扣带皮层等)神经元对伤害性信号的反应性增强和持久性增高。其形成涉及复杂的神经元可塑性改变:
突触传递增强
长期或强烈的伤害性输入,导致初级传入神经元末梢释放过量的兴奋性神经递质,如谷氨酸和P物质。谷氨酸激活突触后膜上的AMPA受体和NMDA受体(N-甲基-D-天冬氨酸受体)。特别是NMDA受体的激活,允许Ca²⁺内流,触发一系列下游信号级联反应,导致突触后神经元兴奋性增强,出现wind-up效应和长时程增强(LTP)。
抑制性中间神经元功能障碍
中枢敏化过程中,脊髓背角的抑制性神经元(如释放GABA或甘氨酸的神经元)功能减弱或凋亡,导致对兴奋性信号的抑制不足,进一步加剧了疼痛信号的放大。
下行抑制通路功能减弱
来自脑干(如中缝大核、蓝斑核)的下行抑制通路,通过释放5-羟色胺(5-HT)和去甲肾上腺素(NE)等神经递质,对脊髓水平的疼痛传递发挥重要的抑制作用。在慢性疼痛状态下,这些下行抑制通路的功能往往受损,导致疼痛信号的“闸门”失控。
基因表达谱改变
长期的中枢敏化可导致神经元内基因表达发生持久性改变,合成更多促进疼痛的受体、离子通道和神经递质,从而巩固和维持疼痛状态。
神经炎症:疼痛的“催化剂”与“放大器”
神经炎症是指在中枢神经系统(CNS)内发生的炎症反应,以神经胶质细胞(主要是小胶质细胞和星形胶质细胞)的激活为核心特征。在慢性疼痛状态下,神经炎症不仅参与疼痛的启动,更在疼痛的维持和慢性化中扮演关键角色。
小胶质细胞的激活——促炎
作为中枢神经系统中的主要免疫细胞,小胶质细胞(Microglia)在接收到外周损伤信号或神经元异常活动信号后被迅速激活。激活的小胶质细胞形态改变,并大量释放促炎细胞因子(如TNF-α, IL-1β, IL-6)、趋化因子(如CCL2, CXCL1)以及活性氧(ROS)等。这些物质直接增强神经元的兴奋性,促进中枢敏化的形成。
星形胶质细胞的激活——疼痛持久
星形胶质细胞(Astrocytes)的激活通常稍晚于小胶质细胞,但在疼痛的慢性化维持中作用更为持久。激活的星形胶质细胞同样释放多种促炎介质,并且可以通过减少对谷氨酸等兴奋性神经递质的清除、下调GABA能抑制以及形成胶质瘢痕等方式,进一步加剧神经元兴奋性的异常和疼痛的持续。
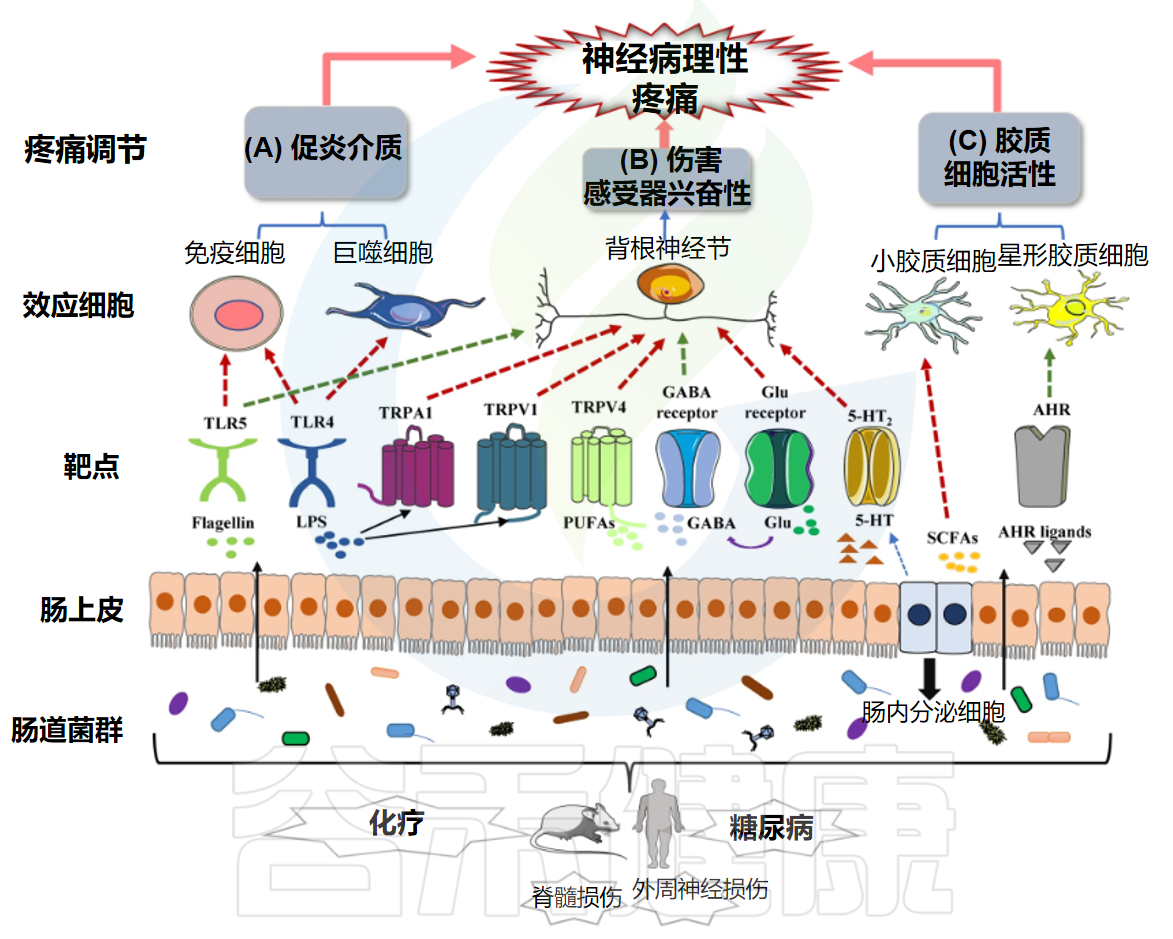
神经免疫交互作用:复杂的对话网络
慢性疼痛的持续化并非单纯的神经系统事件,而是神经系统与免疫系统之间复杂交互作用的结果。
免疫系统→神经系统
外周免疫细胞(如巨噬细胞、T淋巴细胞)可以释放细胞因子和趋化因子,这些因子不仅作用于外周神经元,还可以通过血脑屏障(在某些病理状态下其通透性会增加)或迷走神经等途径影响中枢神经胶质细胞和神经元的活性。
神经系统→免疫系统
神经系统也可以通过释放神经递质和神经肽来调节免疫细胞的功能。这种双向的神经免疫对话失衡,是导致炎症反应迁延不愈、疼痛信号持续放大的重要原因。例如,某些T细胞亚群(如Th1, Th17)及其分泌的细胞因子被认为促进疼痛,而调节性T细胞(Treg)则可能发挥疼痛缓解作用。
关键分子与信号通路:疼痛机制的核心节点
上述病理生理过程的实现,依赖于一系列关键分子和信号通路的参与。简要了解这些节点,有助于后续理解肠道菌群如何通过影响这些靶点来调控疼痛:
离子通道
- TRP通道家族(TRPV1, TRPA1, TRPM8等)参与温度、化学和机械刺激的感受;
- 电压门控钠离子通道(Nav1.7, Nav1.8, Nav1.9等)负责动作电位的产生和传导;
- P2X受体(特别是P2X3, P2X4, P2X7)是ATP的受体,参与神经元和胶质细胞的激活。
神经递质受体
NMDA受体是中枢敏化的核心;AMPA受体介导快速兴奋性突触传递;GABA受体和甘氨酸受体介导抑制性传递。
细胞因子及其受体
TNF-α、IL-1β、IL-6等促炎细胞因子及其相应的受体在神经炎症和神经元敏化中起关键作用。
信号转导通路
如MAPK通路(ERK, JNK, p38)、NF-κB通路、PI3K-Akt通路等,这些通路被上游受体激活后,调控基因表达,影响神经元功能和炎症反应。
慢性疼痛的病理生理机制是一个多层面、多环节、动态演变的复杂过程,涉及外周与中枢神经系统的敏化、神经炎症的驱动以及神经-免疫的失衡互动。正是这些核心机制的异常,构成了慢性疼痛难以治愈的根源。
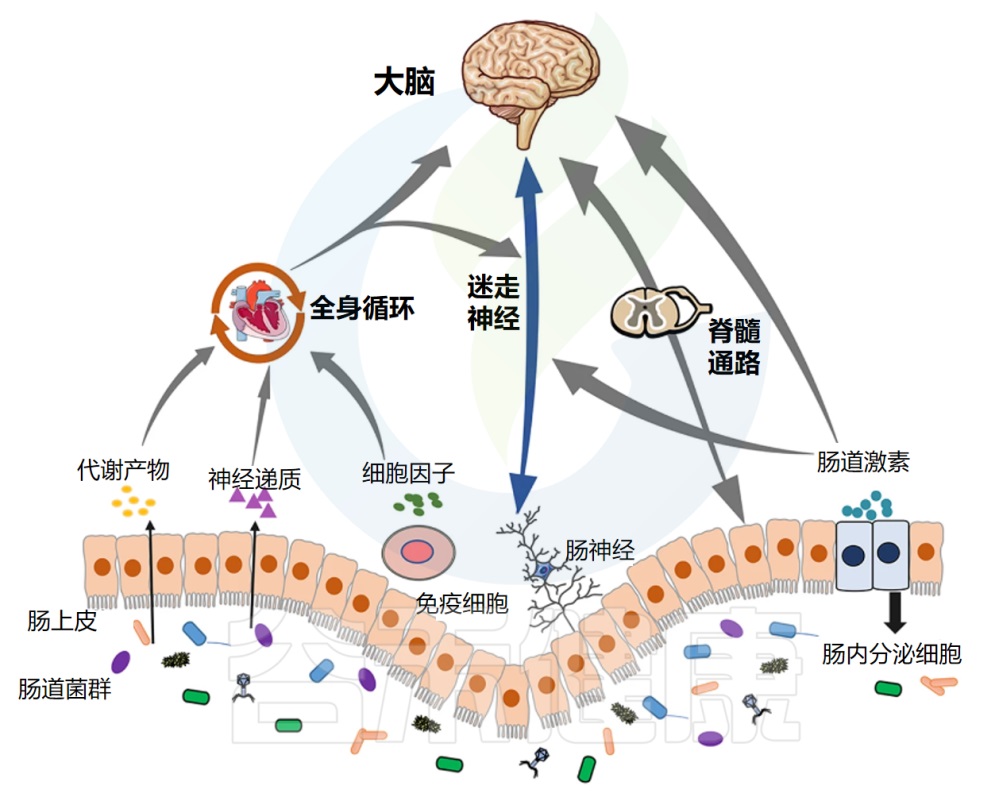
03肠道菌群与慢性疼痛:多维度关联的深层机制肠道菌群在健康与疾病中的作用日益受到重视,其与中枢神经系统功能及相关疾病的复杂联系,包括慢性疼痛,正通过“微生物群-脑-肠轴”(Microbiota-Gut-Brain Axis, MGBA)这一概念得到系统性的阐释。
微生物群-脑-肠轴是一个复杂的、双向的通讯网络,整合了神经、免疫、内分泌、代谢等多个信号通路,允许肠道微生物与大脑之间进行持续的对话。肠道菌群的稳态或失调,能够深刻影响这一轴的功能,从而在慢性疼痛的发生、发展和维持中扮演关键角色。
微生物群-脑-肠轴:疼痛调控的关键枢纽
脑-肠-菌轴构成了肠道微生物影响宿主疼痛感知和调控的主要生理基础。其主要通讯途径包括:
神经通路
免疫通路
内分泌通路
代谢通路
▼
神经通路:迷走神经的桥梁作用
迷走神经(Vagus Nerve),作为第十对脑神经,是连接脑干与胸腹腔脏器之间最长、分布最广的神经通路,构成了微生物群-脑-肠轴中最为直接和关键的神经通讯链路。其在拉丁语中意为“流浪者”,形象地描述了它在体内广泛的行程。
迷走神经具有双向传导功能,但其传入纤维(afferent fibers)占据了绝大多数(约80-90%),这意味着它主要负责将来自内脏(包括胃肠道)的各种生理和病理信号传递给中枢神经系统。
这些信号包括机械牵张(如肠道扩张)、化学刺激(如营养物质、pH变化、毒素),以及至关重要的来自肠道菌群及其代谢产物的信号。
1、迷走神经传入信号的感知与传递
肠道菌群并不直接与大脑进行物理接触,但它们产生的海量代谢物以及对肠道内环境的塑造,能够被迷走神经末梢灵敏地感知。这一感知过程可以是直接的,也更多是通过间接途径实现:
——间接激活:肠道内分泌细胞的关键中介作用
肠道内分泌细胞(Enteroendocrine Cells, EECs)是散在于肠道上皮细胞间的特化感觉细胞,它们能够直接感受肠腔内的化学环境变化,包括菌群代谢产物的刺激。当菌群代谢产物,特别是短链脂肪酸(SCFAs),如乙酸、丙酸和丁酸,作用于EECs表面的特异性G蛋白偶联受体(如GPR41/FFAR3, GPR43/FFAR2)时,会触发EECs释放多种神经活性物质。
5-羟色胺(Serotonin, 5-HT)肠道是体内5-羟色胺的主要合成场所(约90%),主要由肠嗜铬细胞(EC cells,一类EECs)合成和释放。短链脂肪酸,特别是丁酸,能有效刺激EC细胞产生和释放5-羟色胺。释放的5-HT随后作用于邻近迷走神经传入纤维末梢上的5-HT₃受体,这是一种配体门控离子通道,其激活会导致神经元去极化,产生动作电位,从而将信号传入中枢。5-HT₃受体在内脏感觉(包括恶心、饱腹感和疼痛)的传递中扮演重要角色。
胰高血糖素样肽-1(GLP-1)由肠道L细胞(另一类EECs)在短链脂肪酸等菌群代谢物刺激下释放。GLP-1不仅参与血糖调节和饱腹感信号,其受体也存在于迷走神经传入纤维上。GLP-1与迷走神经的相互作用,将肠道代谢状态的信息传递给大脑,参与能量平衡和内脏功能的调节,并可能间接影响疼痛感知。
其他神经肽和激素EECs还能释放胆囊收缩素(CCK)、P物质(Substance P)等多种信号分子,这些分子均可能通过作用于迷走神经末梢上的相应受体,将菌群相关的肠道信息编码并上传。
——直接激活(可能性较低但存在)
虽然EECs是主要的信号转导中介,但也有研究提示某些微生物成分或代谢物可能直接与迷走神经末梢上的模式识别受体(PRRs,如某些Toll样受体)相互作用,但这方面的直接证据相对较少,且其生理相关性尚待进一步阐明。
这些由菌群活动引发的、经由迷走神经传入的信号,首先汇聚于脑干的孤束核(Nucleus of the Solitary Tract, NTS)。NTS是内脏感觉信息传入中枢的第一个整合处理站。从NTS开始,这些信号进一步投射到更高级的脑区,包括:
臂旁核(Parabrachial Nucleus)参与疼痛和厌恶情绪的处理。
丘脑(Thalamus)作为感觉信息的中继站,将信号传递到大脑皮层。
杏仁核(Amygdala)情绪(尤其是恐惧和焦虑)处理中心,与疼痛的情感成分密切相关。
岛叶(Insula)和前扣带皮层(Anterior Cingulate Cortex, ACC)参与内感受、疼痛的感知、情感和认知评价。
通过这一系列复杂的神经投射,肠道菌群的状态能够深刻影响宿主对疼痛的感知强度、情感反应以及认知评价。
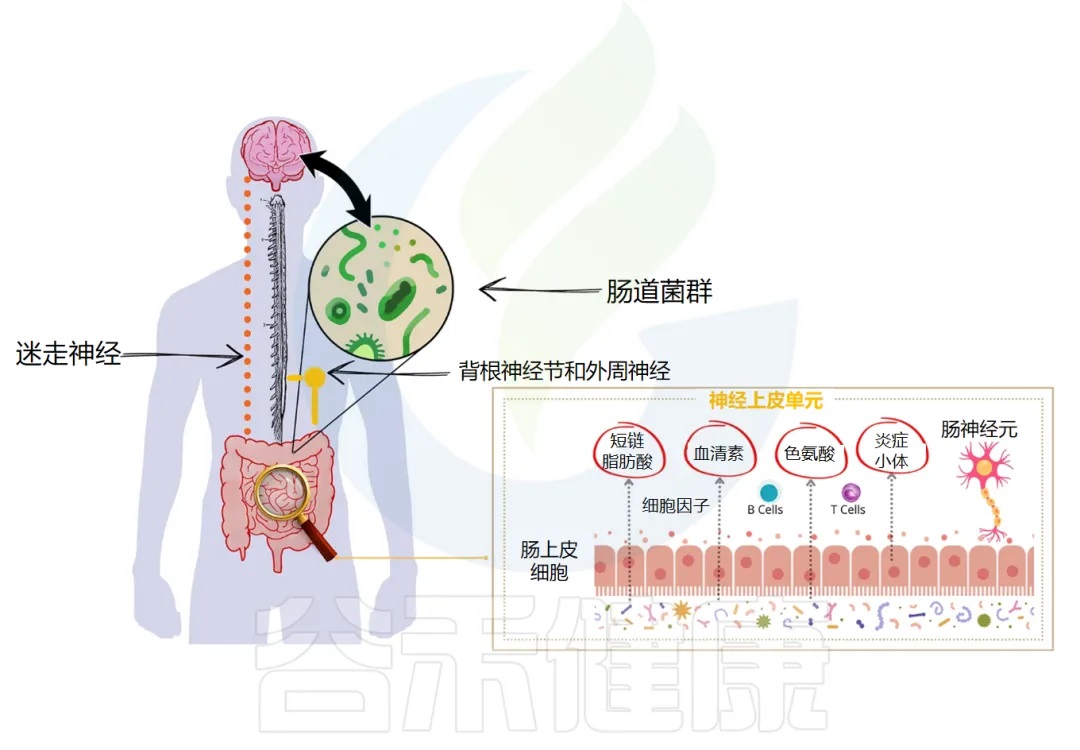
2、 迷走神经在菌群介导的镇痛及行为调节中的关键作用——来自迷走神经切断术的证据
迷走神经的完整性对于许多肠道菌群介导的生理效应至关重要,尤其是在情绪和疼痛调节方面。迷走神经切断术(Vagotomy),特别是保留肝支和胃支的膈下迷走神经切断术(Surgical Subdiaphragmatic Vagotomy, SDG),已成为研究迷走神经在菌群-脑轴中作用的关键实验手段。
益生菌的镇痛与抗焦虑/抑郁效应依赖于迷走神经
研究表明,迷走神经的完整性对于某些菌群介导的镇痛效应至关重要;迷走神经切断术可以阻断特定益生菌的抗焦虑和抗抑郁作用,并可能影响其对内脏痛的调节。
例如,经典研究表明,益生菌鼠李糖乳杆菌(Lactobacillus rhamnosus JB-1)能够通过迷走神经依赖的机制减轻小鼠的焦虑和抑郁样行为,并改变中枢GABA受体的表达。当迷走神经被切断后,这些有益效应便消失了。
类似地,一些益生菌在动物模型中能够缓解内脏疼痛。但是,当研究者切断迷走神经后,这种镇痛效果会消失或明显减弱。这有力证明了迷走神经的重要作用,它是有益菌株信号传递到大脑的必要通路,也是产生镇痛效应的关键环节。
3. 迷走神经传出信号对肠道和菌群的反向调控
微生物群-肠-脑轴的通讯是双向的。大脑不仅接收来自肠道和菌群的信号,也通过迷走神经的传出纤维(efferent fibers)主动调节肠道功能,进而间接影响肠道菌群的生态位和组成。
- 调节肠道蠕动和分泌
迷走神经传出信号是胃肠道运动(如胃排空、小肠蠕动)和消化液分泌(如胃酸、胰酶)的主要神经调节器。这些生理活动直接影响食糜在肠道内的停留时间、营养物质的消化吸收效率以及肠道内的物理化学环境(如pH值),从而为不同类型的微生物创造或改变其生存和繁殖的生态位。
- 维持肠道屏障完整性
迷走神经的传出信号,特别是通过胆碱能抗炎通路(Cholinergic Anti-inflammatory Pathway, CAP),在维持肠道屏障功能和控制局部炎症中发挥重要作用。该通路涉及迷走神经释放乙酰胆碱(ACh),ACh作用于肠道黏膜免疫细胞(如巨噬细胞)表面的α7烟碱型乙酰胆碱受体(α7nAChR),从而抑制促炎细胞因子的产生,减轻炎症反应,保护肠道屏障。一个健康的肠道屏障对于限制有害菌及其产物(如LPS)的易位至关重要。
- 影响黏液层
迷走神经可能参与调节肠道黏液层厚度和成分,黏液层是肠道上皮的第一道物理和化学屏障,也是特定菌群(如Akkermansia muciniphila)的栖息地和营养来源。
通过这些传出途径,中枢神经系统的状态(如应激、情绪)可以通过迷走神经影响肠道生理和菌群稳态,形成一个完整的反馈回路。
▼
免疫通路:菌群塑造的全身性免疫网络与疼痛
肠道不仅是消化吸收的主要场所,更是人体最大、最复杂的免疫器官,其广阔的黏膜表面(约200-300平方米)直接暴露于数以万亿计的共生微生物及其代谢产物之中。
这种持续的、动态的相互作用,使得肠道菌群在宿主免疫系统的发育、成熟、校准和功能调节中扮演着无可替代的核心角色。它们如同免疫系统的“陪练员”和“调校师”,通过与肠道相关淋巴组织——包括派尔集合淋巴结(Peyer's patches)、肠系膜淋巴结(mesenteric lymph nodes)以及弥散在肠黏膜固有层和上皮内的免疫细胞的持续对话,塑造着宿主的先天性和适应性免疫反应,其影响深远,不仅限于肠道局部,更能波及全身,包括对疼痛感知和慢性化的调控。
1、菌群介导的免疫细胞分化与平衡:塑造敌我识别与炎症刹车
肠道菌群通过其组成成分和代谢产物,能够精准地诱导和调控不同免疫细胞亚群的分化与功能平衡,这对维持免疫稳态、防止过度炎症反应以及有效清除病原体至关重要。当这种平衡被打破时,往往与慢性炎症和疼痛的发生发展相关。
Th17细胞的诱导与促炎效应
分节丝状菌(Segmented Filamentous Bacteria, SFB)是一种特殊的、能紧密附着于小肠上皮细胞的共生菌。分节丝状菌能有效诱导辅助性T细胞17(Th17)的分化。
Th17细胞以其分泌的标志性细胞因子IL-17以及IL-21、IL-22等而闻名。
IL-17家族(特别是IL-17A和IL-17F)是强效的促炎细胞因子,能够招募中性粒细胞,诱导其他促炎细胞因子(如TNF-α, IL-1β, IL-6)和趋化因子的产生,参与组织炎症和自身免疫性疾病的病理过程。因此,在多种自身免疫性疾病(如类风湿关节炎、多发性硬化)和炎症性疼痛模型中,Th17细胞及其相关通路被认为是驱动炎症和疼痛的关键因素。
SFB的定植虽然在抵抗某些病原体感染中具有保护作用,但其过度激活或在特定遗传背景下,可能导致Th17反应失控,加剧炎症和疼痛。
Treg的诱导与抗炎 / 镇痛效应
与Th17细胞的促炎作用相对的是调节性T细胞(Treg),它们是维持免疫耐受和抑制过度免疫反应的关键刹车细胞,主要通过分泌IL-10和TGF-β等抑制性细胞因子,以及细胞接触依赖性机制来发挥作用。
某些梭菌属细菌(如 Clostridium clusters IV和 XIVa,这些是主要的产丁酸菌群)和脆弱拟杆菌(Bacteroides fragilis)及其荚膜多糖A(Polysaccharide A, PSA)则能有效诱导Treg细胞的产生和IL-10的分泌。
产丁酸菌这些梭菌属细菌通过发酵膳食纤维产生大量丁酸。丁酸不仅是结肠上皮细胞的能量来源,更是一种重要的信号分子,能够通过抑制组蛋白去乙酰化酶(HDACs)等机制,促进Treg细胞的分化和功能,增强IL-10的表达。IL-10能够抑制巨噬细胞和树突状细胞等抗原提呈细胞的活化,下调促炎细胞因子的产生,从而起到强大的抗炎作用,并可能间接或直接地缓解疼痛。
脆弱拟杆菌及其PSAPSA是脆弱拟杆菌荚膜上的一种特殊多糖,它能够通过与树突状细胞上的Toll样受体2(TLR2)结合,诱导其产生IL-10,并促进CD4+ T细胞向Treg细胞分化。PSA介导的免疫调节作用已被证明能够在多种炎症和自身免疫疾病动物模型(如实验性自身免疫性脑脊髓炎,EAE,多发性硬化的动物模型)中发挥保护作用,减轻神经炎症。
这种由特定菌群驱动的Th17/Treg平衡,对于决定机体对炎症刺激的反应强度和持续时间至关重要。菌群失调若导致Th17细胞过度活化而Treg细胞功能不足,则易于引发或加剧慢性炎症性疼痛。
2. 细胞因子网络的调控:菌群失调与慢性低度炎症的“导火索”
肠道菌群稳态的维持对于局部和全身细胞因子网络的平衡至关重要。菌群失调,有益菌减少、潜在致病菌增多、菌群多样性下降,往往伴随着免疫失衡和慢性低度炎症状态的形成。
- 促炎细胞因子的过度产生
菌群失调常常导致TNF-α、IL-1β、IL-6等关键促炎细胞因子的过量产生。这些细胞因子不仅在肠道局部加剧炎症反应、破坏肠道屏障,更关键的是,它们可以释放入血液循环,形成一种全身性的慢性低度炎症背景。这种状态是多种慢性疾病(包括心血管疾病、糖尿病、神经退行性疾病以及慢性疼痛)的共同病理生理基础。
- 抗炎细胞因子的相对不足
菌群失调也可能导致IL-10和TGF-β等关键抗炎细胞因子的产生减少,使得炎症反应难以被有效控制和终止。
- 对疼痛的直接和间接影响
这些循环中的促炎细胞因子能够直接作用于外周伤害性感受器,降低其激活阈值,导致外周敏化。例如,TNF-α和IL-1β能直接激活或敏化TRPV1等痛觉相关离子通道。
同时,它们也能穿过在某些病理状态下通透性增加的血脑屏障(BBB)和血脊髓屏障(BSCB),或通过激活脑血管内皮细胞产生次级信使,作用于中枢神经系统,激活小胶质细胞和星形胶质细胞,诱导神经炎症,促进中枢敏化。
因此,菌群失调介导的细胞因子网络紊乱,是连接肠道与远端疼痛感知的关键免疫学桥梁。
3、微生物相关分子模式与模式识别受体:免疫系统的警报系统
肠道菌群的结构成分,如细菌细胞壁的组分,被称为微生物相关分子模式(MAMPs)。
宿主的先天免疫细胞(如巨噬细胞、树突状细胞)以及一些非免疫细胞(包括肠上皮细胞、神经元和胶质细胞)表面表达着一系列模式识别受体(PRRs),用于识别这些MAMPs并发起适当的免疫应答。
- 关键MAMPs及其识别
脂多糖(LPS)主要来自革兰氏阴性菌的外膜,是研究最为深入的MAMP之一。LPS主要通过与宿主细胞表面的Toll样受体4(TLR4)复合物(包括MD-2和CD14)结合而被识别。
肽聚糖(PGN)肽聚糖是革兰氏阳性菌和革兰氏阴性菌细胞壁的主要成分,主要通过Toll样受体2(TLR2)以及胞内的NOD样受体(NOD-like receptors, NLRs,如NOD1和NOD2)被识别。
鞭毛蛋白(Flagellin)是细菌鞭毛的结构蛋白,通过Toll样受体5(TLR5)被识别。
细菌DNA / RNA通过胞内的TLR9(识别CpG DNA)和TLR3/7/8(识别病毒或细菌RNA)被识别。
- PRR激活与炎症信号通路
当MAMPs与相应的PRRs结合后,会迅速激活下游的信号转导通路,其中最经典的是NF-κB(核因子κB)通路和MAPK(丝裂原活化蛋白激酶)通路。这些通路的激活导致多种促炎基因的转录上调,大量释放炎症介质,包括前述的促炎细胞因子(TNF-α、IL-1β、IL-6)、趋化因子(吸引更多免疫细胞至炎症部位)、黏附分子以及一氧化氮(NO)和前列腺素等。
- 肠道屏障受损与MAMPs易位(肠漏)
在健康的肠道中,完整的肠道屏障(包括物理屏障、化学屏障、免疫屏障)能够有效地将大部分肠道菌群及其MAMPs限制在肠腔内,仅允许少量、受控的MAMPs与免疫系统相互作用以维持免疫张力。
然而,当肠道菌群失调、饮食因素、应激、药物(如NSAIDs)等因素导致肠道屏障功能受损,即出现“肠漏”时,大量的MAMPs(特别是LPS)会从肠腔跨过受损的屏障易位进入血液循环,导致所谓的“代谢性内毒素血症”。
循环中的LPS能够激活全身各处的TLR4,引发持续的、低度的全身性炎症反应,这与胰岛素抵抗、肥胖、非酒精性脂肪肝以及多种慢性疼痛状态(特别是神经病理性疼痛和纤维肌痛)的发生发展密切相关。LPS也可以直接作用于背根神经节(DRG)的感觉神经元和中枢的胶质细胞,增强其对伤害性刺激的反应,促进疼痛的产生和维持。
综上所述,肠道菌群通过塑造免疫细胞的分化平衡(如Th17/Treg平衡)、调控全身细胞因子网络以及通过MAMPs-PRRs相互作用激活先天免疫,构成了影响宿主疼痛感知和慢性化的关键免疫通路。菌群失调导致的免疫失衡和慢性炎症状态,是连接肠道微生态与疼痛病理生理过程的重要桥梁。因此,靶向调节肠道菌群以恢复免疫稳态,已成为开发新型疼痛干预策略的重要方向。
doi: 10.1186/s10194-020-01170-x
▼
内分泌通路:HPA轴的菌群调节与应激疼痛
下丘脑-垂体-肾上腺(HPA)轴是机体最主要的应激反应系统。慢性应激是慢性疼痛发生和恶化的重要风险因素。肠道菌群能够双向调节HPA轴的活性。
无菌动物模型研究显示,缺乏正常菌群的动物对应激表现出异常的HPA轴反应(通常是过度反应),表现为促肾上腺皮质激素释放激素(CRH)和皮质酮水平的升高。早期定植特定菌群可以部分逆转这种异常。
- 菌群代谢产物的影响
SCFAs等菌群代谢产物可以通过影响迷走神经或直接作用于肾上腺等方式,调节HPA轴。
- 肠道屏障与LPS
菌群失调导致的肠漏和LPS易位,可以激活免疫系统,间接刺激HPA轴。
HPA轴的失调,特别是皮质醇节律的紊乱和长期高水平,不仅与抑郁、焦虑等情绪障碍相关,也直接促进疼痛的慢性化。例如,糖皮质激素可以影响神经元的兴奋性和胶质细胞的活性。因此,菌群通过调节HPA轴的稳态,间接影响宿主对疼痛的易感性和疼痛程度。
▼
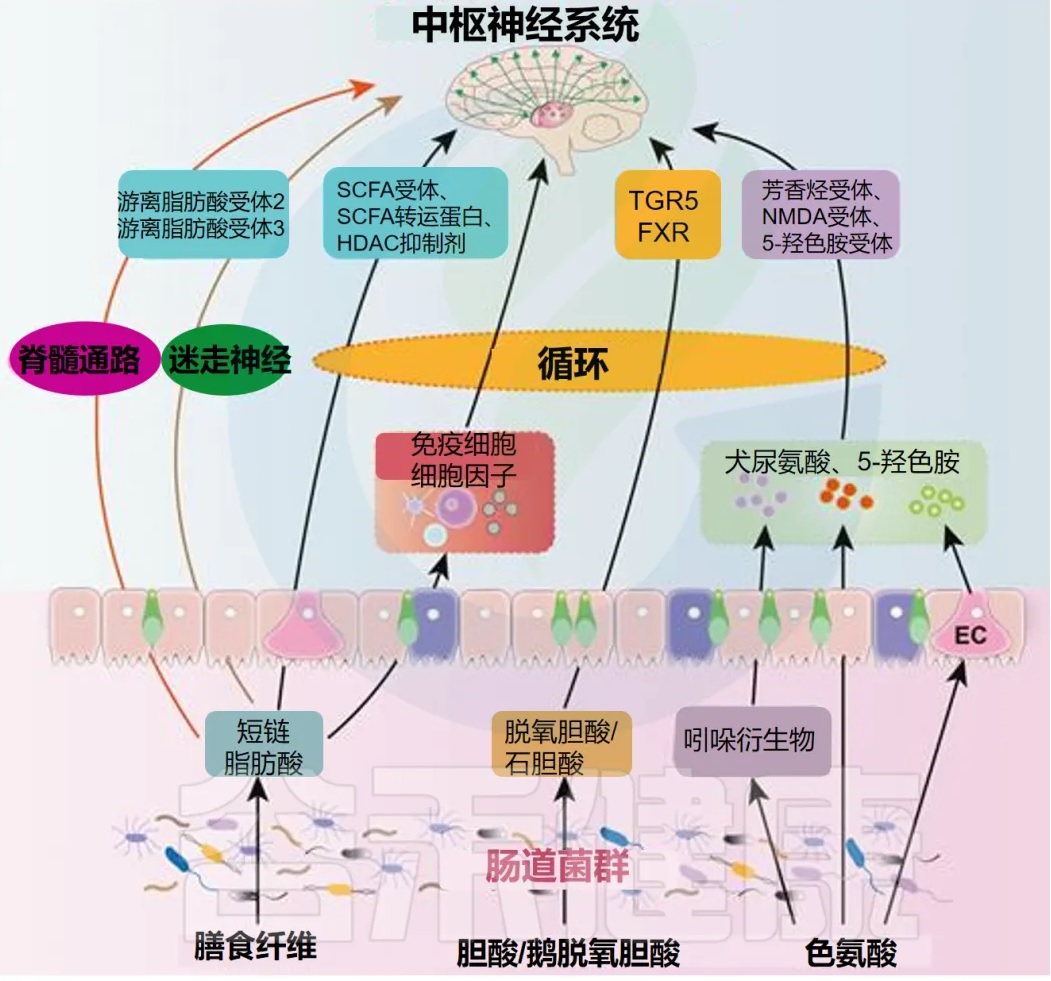
代谢通路:菌群工厂的杰作与疼痛调控
肠道菌群拥有庞大的酶系统,能够代谢宿主不能消化的膳食成分(如膳食纤维)以及宿主自身产生的物质(如胆汁酸),产生大量具有生物活性的小分子代谢物,这些代谢物是菌群影响宿主生理(包括疼痛)的关键介质。
- 短链脂肪酸(SCFAs)
主要包括乙酸、丙酸、丁酸,是膳食纤维经厌氧菌发酵的主要产物。SCFAs不仅是结肠上皮细胞的主要能源物质,维持肠道屏障的完整性(例如丁酸能促进紧密连接蛋白如occludin和ZO-1的表达),还具有广泛的全身性调节作用:
抗炎作用SCFAs可以通过激活G蛋白偶联受体(GPR41, GPR43, GPR109A)或抑制组蛋白去乙酰化酶(HDACs,特别是丁酸)来发挥抗炎效应。HDAC抑制能够调节基因表达,减少促炎细胞因子的产生,促进Treg分化,从而缓解炎症和神经炎症。
神经调节短链脂肪酸可以穿过血脑屏障,直接影响中枢神经系统。例如,丁酸被证明可以促进神经营养因子的表达,调节神经递质(如GABA, 谷氨酸)的平衡,并影响小胶质细胞的活化状态。
疼痛缓解多项研究表明,补充短链脂肪酸或促进其产生的益生元/益生菌能够缓解多种动物模型中的炎性疼痛和神经病理性疼痛。其机制可能涉及减轻神经炎症、改善肠道屏障、调节免疫应答等。例如,丁酸盐已被证明可以减轻化疗引起的神经病理性疼痛。
- 次级胆汁酸
初级胆汁酸(如胆酸CA,鹅去氧胆酸CDCA)在肝脏合成后排入肠道,在肠道菌群(主要是梭菌属)的酶(如7α-脱羟酶)作用下转化为次级胆汁酸,如脱氧胆酸(DCA)和石胆酸(LCA)。这些次级胆汁酸是重要的信号分子,主要通过激活法尼醇X受体(FXR)和G蛋白偶联胆汁酸受体1(TGR5,又称GPBAR1)发挥作用。
TGR5的激活与镇痛TGR5广泛表达于肠道内分泌细胞、免疫细胞以及感觉神经元(包括背根神经节DRG神经元)。TGR5的激活被证明具有镇痛效应,特别是在内脏痛模型中。例如,TGR5激动剂可以抑制DRG神经元的兴奋性,减少痛觉相关神经肽的释放。也有研究提示TGR5在神经病理性疼痛中可能发挥保护作用。
菌群对胆汁酸谱的影响菌群失调会导致胆汁酸代谢谱的改变,影响FXR和TGR5信号通路的活化,进而可能影响疼痛感知。
- 色氨酸代谢产物
膳食中的必需氨基酸色氨酸在宿主和肠道菌群的共同作用下,可以通过多条途径代谢,产生一系列具有神经活性的分子。
血清素途径(5-HT)约90%的5-HT在肠道由肠嗜铬细胞合成,菌群可以通过产生SCFAs等方式刺激5-HT的合成和释放。5-HT在肠道局部调节蠕动和感觉,进入循环后可影响情绪和中枢神经功能。5-HT在疼痛调控中作用复杂,既可作为下行抑制通路的递质发挥镇痛作用,在外周也可能促进疼痛。
犬尿氨酸途径(Kynurenine, KYN)这是色氨酸在宿主细胞(受菌群信号调控,如LPS)和某些菌群中主要的代谢途径。KYN可进一步代谢为犬尿喹啉酸(KYNA)和喹啉酸(QUIN)。- 犬尿喹啉酸是NMDA受体的拮抗剂,具有神经保护作用;- 而喹啉酸是NMDA受体的激动剂,具有神经毒性,并与神经炎症和疼痛相关。- 菌群失调可能导致KYN途径失衡,如QUIN/KYNA比值升高,促进中枢敏化和疼痛。
吲哚(Indole)及其衍生物某些肠道菌(如大肠杆菌、梭菌)能将色氨酸代谢为吲哚及其衍生物(如吲哚丙酸IPA,吲哚乙酸IAA)。这些分子可以作为芳香烃受体(AhR)的配体,调节免疫反应和肠道屏障功能,并可能影响疼痛。
- 脂多糖等微生物相关分子模式(MAMPs)
如前所述,LPS是革兰氏阴性菌外膜的主要成分。在肠道屏障功能受损(“肠漏”)的情况下,LPS会从肠腔易位进入血液循环,形成“代谢性内毒素血症”。
LPS是TLR4的强效激动剂,能够激活全身各处的免疫细胞(如巨噬细胞、单核细胞)和中枢的胶质细胞,诱导大量促炎细胞因子(TNF-α, IL-1β, IL-6)的释放,直接或间接触发并加剧疼痛,特别是神经病理性疼痛和炎症性疼痛。LPS本身也被证明可以直接作用于某些感觉神经元,增强其对伤害性刺激的反应。
特定慢性疼痛模型中肠道菌群改变的证据
大量临床前和部分临床研究已经揭示了肠道菌群失调与多种慢性疼痛状态之间的密切关联。
神经病理性疼痛
神经病理性疼痛由躯体感觉神经系统的损伤或疾病直接引起。
化疗诱导的神经痛(CIPN)
化疗是治疗癌症的重要手段,但许多化疗药物,如紫杉醇、奥沙利铂、长春新碱、硼替佐米等,常导致严重的剂量限制性副作用——CIPN。
患者表现为肢体远端的麻木、刺痛、烧灼感和痛觉过敏/异常疼痛,严重影响生活质量并可能导致化疗方案的调整甚至中断。
多种化疗药物(如紫杉醇、奥沙利铂)可引起严重的CIPN,其患者和动物模型中均观察到肠道菌群的显著改变,如多样性下降,厚壁菌门/拟杆菌门(F/B)比值改变,特定菌属如Akkermansia muciniphila(常被认为是益生菌)和产丁酸菌(如Faecalibacterium prausnitzii)的丰度下降,而一些潜在致病菌(如某些变形菌门细菌)丰度增加。补充A. muciniphila或其活性成分被证明可以缓解CIPN。
坐骨神经损伤(SNI)/慢性压迫损伤(CCI)模型
这些经典的神经病理性疼痛动物模型中,也观察到肠道菌群失调,伴随肠道屏障功能受损、LPS水平升高和神经炎症,粪便移植自CCI大鼠可诱导幼稚大鼠产生痛觉过敏。FMT或特定益生菌干预能够改善疼痛行为,并逆转部分菌群和炎症指标。
糖尿病神经病变(DPN)
糖尿病患者常伴有肠道菌群失调,这被认为是糖尿病神经病变发生的风险因素之一。糖尿病患者的菌群失调通常表现为产丁酸菌(如Faecalibacterium prausnitzii, Roseburia)的减少,某些机会致病菌(如肠杆菌科细菌)的增加,以及整体多样性的下降。菌群失调可能通过加剧代谢紊乱、促进全身性炎症和氧化应激来促进糖尿病神经病变的发生。
炎症性疼痛
类风湿关节炎(RA)RA患者中肠道菌群失调现象较为普遍,特征包括菌群多样性降低,特定菌属如Prevotella copri的富集(可能与疾病活动度和自身抗体产生有关),而一些产丁酸菌如Faecalibacterium、Roseburia的减少。FMT和益生菌干预在类风湿关节炎动物模型中显示出减轻关节炎症和疼痛的潜力。
骨关节炎(OA)OA也被认为与低度慢性炎症有关,新兴研究开始关注肠道菌群在OA中的作用。一些研究发现OA患者肠道菌群组成与健康对照存在差异,可能通过代谢产物(如LPS, SCFAs)影响软骨代谢和滑膜炎症。
炎症性肠病(IBD)相关疼痛IBD(如克罗恩病和溃疡性结肠炎)患者常伴有腹痛,即使在黏膜炎症缓解后疼痛也可能持续存在。肠道菌群失调是IBD的核心病理因素,直接参与IBD的发生发展,并通过影响内脏敏感性、肠道屏障和免疫反应来驱动IBD相关疼痛。
内脏痛
肠易激综合征(IBS),是最常见的内脏痛相关功能性胃肠病,其患者肠道菌群失调的证据最为充分。表现为菌群多样性降低,F/B比值改变,特定菌属如乳杆菌属和双歧杆菌属的减少,而某些潜在致病菌(如肠杆菌科细菌)的增加。
菌群失调通过多种机制导致IBS的核心症状——腹痛和内脏高敏感性,包括:肠道屏障功能受损、低度免疫激活、5-HT信号通路异常、SCFAs谱改变等。针对IBS的菌群干预(如低FODMAP饮食、特定益生菌、FMT)已成为研究和治疗的热点。
中枢性疼痛综合征
这类疼痛综合征(如纤维肌痛、偏头痛)的病理机制被认为主要涉及中枢神经系统的功能失调,但外周因素也可能参与其中。
纤维肌痛纤维肌痛患者常伴有胃肠道症状和肠道菌群改变的报道,如菌群多样性下降,特定菌属丰度异常。虽然因果关系尚不明确,但推测菌群失调可能通过影响神经炎症、神经递质前体(如色氨酸)的供应以及HPA轴功能来参与纤维肌痛的病理过程。
偏头痛越来越多的研究关注肠道菌群与偏头痛的联系。一些研究发现偏头痛患者与健康对照相比,肠道菌群组成存在差异,例如某些产丁酸菌的减少。潜在机制可能涉及肠道屏障、神经炎症、5-HT代谢以及菌群对三叉神经血管系统的间接影响。
宿主遗传背景、性别差异与肠道菌群在疼痛中的交互作用
- 宿主遗传背景
宿主基因可以直接影响肠道菌群的组成(例如通过影响免疫系统、肠道黏液层构成等),反过来,肠道菌群也可以通过表观遗传修饰(如DNA甲基化、组蛋白修饰,SCFAs是重要的HDAC抑制剂)等方式影响宿主的基因表达。这种基因-菌群的交互作用共同塑造了个体对疼痛的易感性和慢性化风险。
- 性别差异
慢性疼痛在女性中更为普遍,其严重程度和对治疗的反应也存在性别差异。肠道菌群的组成和功能同样存在显著的性别差异,这可能受到性激素的影响。
研究表明,性别、性激素、肠道菌群和免疫反应之间存在复杂的交互作用,共同影响疼痛的性别二态性。例如,雌激素水平的变化可以影响肠道菌群和肠道屏障功能,进而可能影响疼痛敏感性。
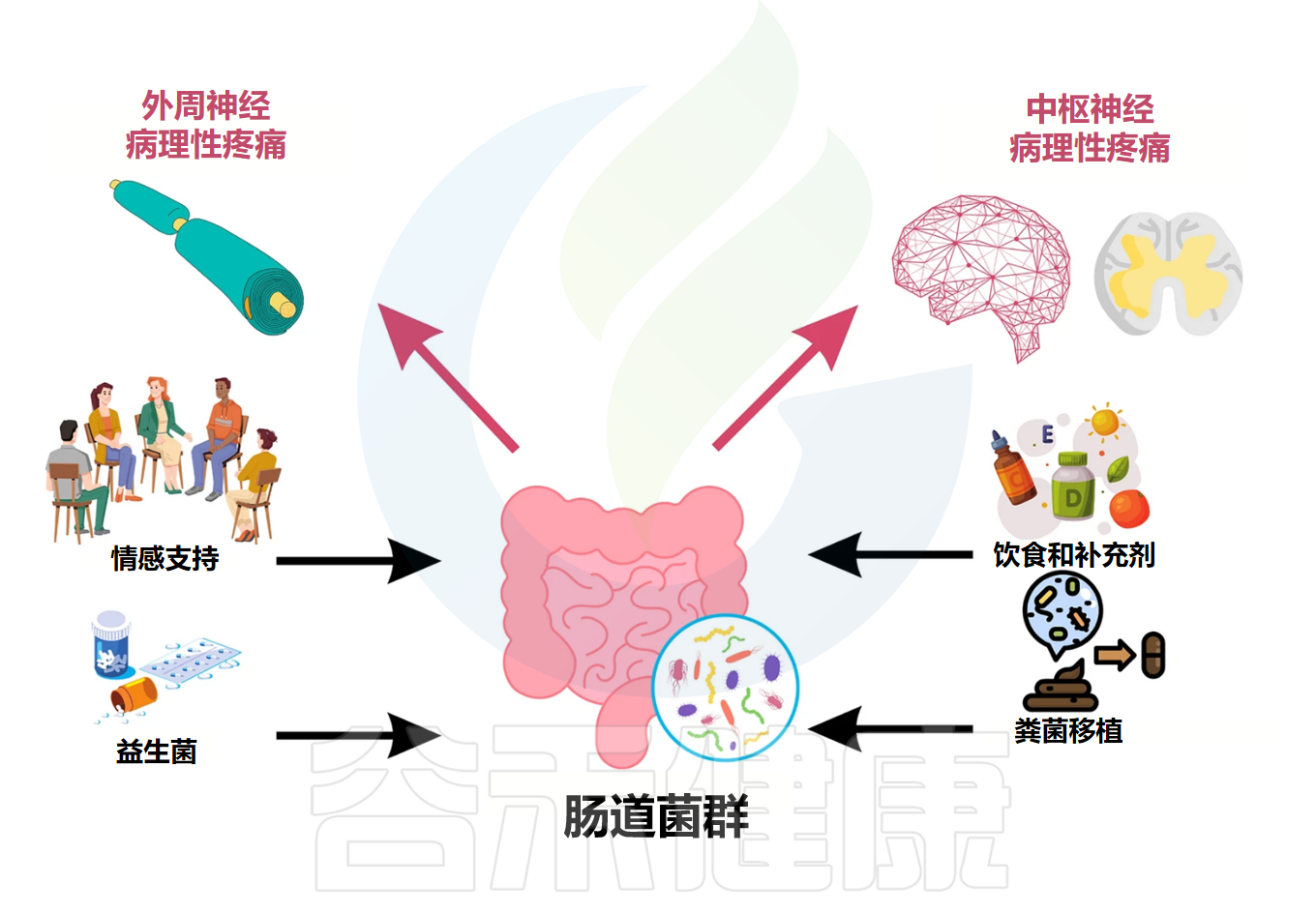
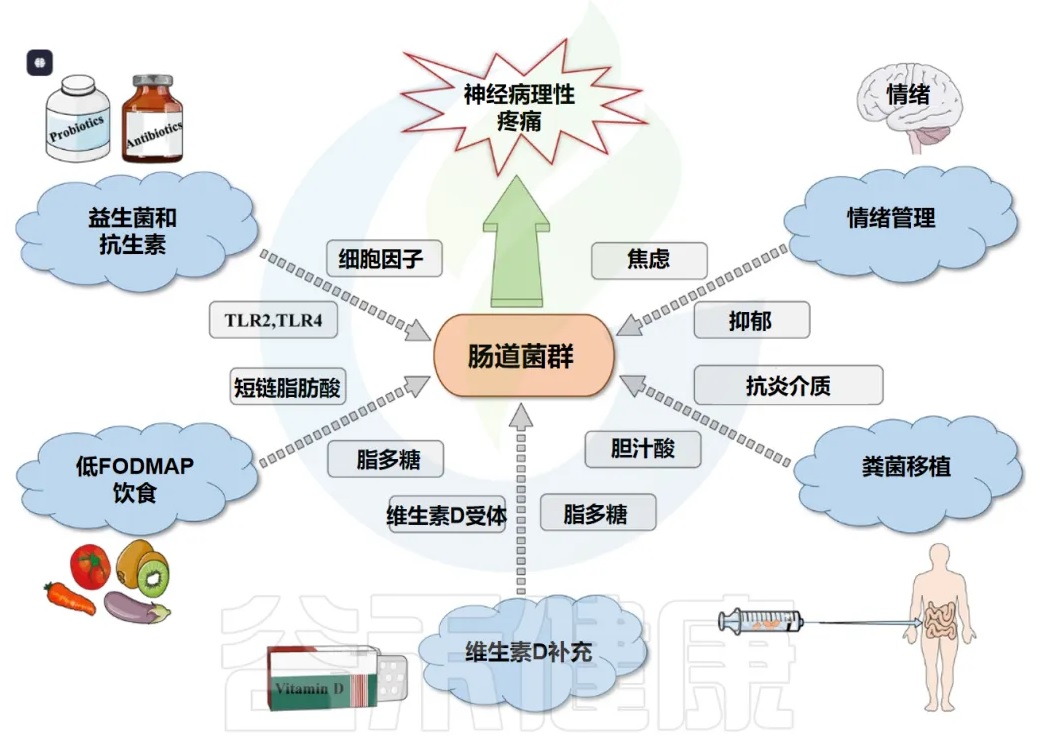
04靶向肠道菌群:慢性疼痛干预的新策略与临床前景鉴于肠道菌群在慢性疼痛病理生理机制中的核心作用日益明确,针对肠道菌群的调控策略已成为开发新型疼痛干预措施的重要方向。这些策略旨在通过恢复肠道微生态平衡、调节菌群代谢、改善肠道屏障功能及抑制神经炎症等途径,达到缓解疼痛的目的。
饮食干预与益生元
饮食是塑造肠道菌群组成和功能最直接、最持久的因素之一。通过合理的膳食结构调整和特定益生元的补充,可以有效地引导肠道菌群向有益于宿主健康(包括疼痛缓解)的方向发展。
机制
塑造菌群结构不同膳食成分为不同类型的微生物提供生长底物。例如,高纤维饮食能显著增加产短链脂肪酸菌(如双歧杆菌属、乳杆菌属、普拉梭菌等)的丰度。
增加SCFAs产生膳食纤维(特别是可发酵纤维)是肠道菌群产生短链脂肪酸(如丁酸、丙酸、乙酸)的主要原料。如前所述,SCFAs具有抗炎、维持肠道屏障、调节神经功能等多重益处,与疼痛缓解密切相关。
改善肠道屏障功能某些膳食成分(如丁酸盐、多酚)能够增强肠道上皮细胞间的紧密连接,减少肠漏,从而降低LPS等内毒素的易位,减轻全身性炎症。
调节免疫反应饮食可以直接或通过菌群间接影响宿主的免疫状态,如某些多不饱和脂肪酸、维生素D等具有免疫调节作用。
代表性饮食模式
高纤维饮食富含水果、蔬菜、全谷物和豆类的饮食,是增加SCFAs产生、促进有益菌生长的基石。饮食(例如,纤维)与肠道微生物群的组成相关。
地中海饮食以大量蔬菜、水果、豆类、坚果、全谷物、鱼类和橄榄油为特征,限制红肉和加工食品。这种饮食模式富含膳食纤维、单不饱和脂肪酸和多酚,已被证明具有抗炎作用,并能积极调节肠道菌群,在一些慢性炎症性疾病和疼痛管理中显示出潜力。
低FODMAP饮食FODMAPs(Fermentable Oligo-, Di-, Mono-saccharides And Polyols,可发酵的寡糖、双糖、单糖和多元醇)是一些在小肠吸收不良但在结肠快速发酵产气的短链碳水化合物。对于肠易激综合征(IBS)患者,短期采用低FODMAP饮食可以减少肠道产气和腹胀,从而缓解腹痛等症状。这间接反映了通过减少特定发酵底物来调节菌群活动对内脏痛的影响。
特定益生元
益生元是选择性地被宿主微生物利用并从而赋予健康益处的底物。它们通常是不可消化的碳水化合物。
菊粉和低聚果糖(FOS):常见于菊苣、洋葱、大蒜等植物中,能够显著促进双歧杆菌和乳杆菌的生长,增加SCFAs的产生。
低聚半乳糖(GOS)也具有良好的益生效应,能被多种有益菌利用。
抗生素和益生元/益生菌/合生元通过改变肠道微生物群来治疗疼痛有一定的希望。
适用人群与注意事项
饮食干预和益生元补充通常被认为是相对安全的。然而,个体对不同膳食成分和益生元的反应存在差异。例如,突然大量增加膳食纤维或某些益生元可能导致部分人群出现腹胀、产气等不适。对于特定疾病(如IBS),某些益生元(如高FODMAPs的菊粉)可能反而加剧症状。因此,饮食调整和益生元的使用最好在医生或营养师指导下进行,循序渐进,并关注个体耐受性。
doi: 10.1186/s10194-020-01170-x
益生菌与合生元(Synbiotics)
益生菌是指当摄入足够数量时能对宿主健康产生有益作用的活性微生物。合生元则是益生菌和益生元的组合。
菌株特异性原理
益生菌的作用具有高度的菌株特异性,这意味着并非所有益生菌都具有相同的功能,其效果取决于具体的菌株。不同菌株通过不同机制发挥作用,例如:
产生抗炎因子某些菌株能产生具有抗炎活性的代谢产物或细胞表面分子。
竞争性抑制病原菌通过竞争营养物质、占据黏附位点或产生抗菌物质来抑制有害菌的生长。
调节免疫系统如前所述,特定菌株能诱导Treg细胞分化,或调节细胞因子谱。
增强肠道屏障功能促进黏蛋白分泌,增强紧密连接蛋白表达。
调节神经递质影响5-HT、GABA等神经递质合成或代谢。
益生菌通过调节宿主肠道植物群或肠道免疫系统的平衡来支持宿主健康,并指出广泛使用的益生菌如双歧杆菌和乳杆菌在治疗慢性疼痛疾病方面具有潜力。例如,干酪乳杆菌改善了关节炎大鼠的症状,并抑制了体内促炎因子的表达。
临床研究证据
IBS:多种益生菌菌株,在缓解IBS腹痛、腹胀等症状方面显示出一定的效果。例如 :- Bifidobacterium infantis 35624- Lactobacillus rhamnosus GG- Lactobacillus plantarum 299v
关节炎疼痛临床前研究中,干酪乳杆菌改善了关节炎。一些针对人类关节炎(如RA, OA)的小型临床试验也初步评估了特定益生菌对疼痛和炎症指标的辅助改善作用。
纤维肌痛益生菌和其他微生物群靶向策略可以为管理纤维肌痛症状提供突破,并列举了如两歧双歧杆菌、长双歧杆菌等在纤维肌痛患者益生菌制剂中的应用。一项研究显示,多种益生菌对纤维肌痛患者的记忆和注意力有影响。双歧杆菌:长双歧杆菌认识两歧双歧杆菌(Bifidobacterium bifidum)及其健康益处
其他疼痛类型益生菌鼠李糖乳杆菌GG或De Simone配方干预后,机械伤害感受阈值显著增加,疼痛减轻。
然而,许多现有研究仅在动物中进行,其结果可能在临床阶段有所不同,且由于疼痛的不同亚型和个体差异,限制了益生菌在临床治疗慢性疼痛中的应用。更多高质量的人类数据是无价的。
合生元的优势
合生元将益生菌和为其提供选择性生长底物的益生元结合起来,理论上可以产生协同增效作用,即“1+1>2”的效果。益生元有助于益生菌在肠道内的定植、存活和发挥功能。
适用人群与选择标准
选择益生菌时,应考虑疼痛的类型、可能的菌群失调特征以及具体菌株的循证依据。由于菌株特异性的存在,不能一概而论。患者应在医生指导下选择经过临床验证、安全性较高的产品。目前,益生菌主要作为辅助干预手段,不应替代标准治疗。
粪菌移植(FMT)
FMT是指将健康个体粪便中的功能菌群,通过灌肠、口服胶囊或经内镜等途径,移植到患者肠道内,以重建健康的肠道微生态。
作用机制
FMT的核心机制在于通过引入一个完整、多样且功能健全的微生物群,来纠正受体肠道内的菌群失调,恢复肠道屏障功能,调节免疫反应,并改变菌群代谢谱,从而达到治疗疾病的目的。
在难治性慢性疼痛中的探索性应用
粪便微生物群移植已经成为慢性内脏疼痛病症(例如炎症性肠病和肠易激综合征)的有益疗法,通过恢复肠道细菌的健康平衡。
一项研究显示,FMT在剂量依赖性的情况下,对IBS相关症状的管理非常有效。目前,FMT在治疗复发性艰难梭菌感染方面已获得广泛认可,其在IBS、IBD等其他菌群失调相关疾病(包括其伴随的疼痛)中的应用也正积极探索中,并已有一些案例报道和小型临床试验显示出一定的潜力。
挑战与风险
标准化供体的筛选标准、粪便样本的处理和制备流程、移植的途径和剂量等尚缺乏统一的国际标准。
供体筛选严格筛选健康供体以排除潜在病原体(包括已知和未知的)至关重要。
长期安全性FMT的长期影响(如对代谢、免疫甚至肿瘤发生风险的潜在影响)仍需更多研究来评估。
伦理问题涉及生物样本的使用和潜在的未知风险。
关于FMT在疼痛治疗中的使用存在一些争议,深入阐明肠道菌群在慢性疼痛中的调节机制,增加临床数据,将有助于未来在临床实践中应用FMT。
适用人群的严格筛选
目前,FMT主要用于标准治疗无效或复发性艰难梭菌感染。对于其他疾病(包括慢性疼痛),FMT仍主要处于临床研究阶段,应在严格的伦理审查和知情同意下,由经验丰富的医疗团队在特定情况下审慎考虑。
▼
新兴与未来疗法
随着对肠道菌群及其与宿主互作机制认识的深入,更多精准靶向的菌群干预策略正在涌现。
后生元(Postbiotics)
指对宿主健康有益的无生命微生物和/或其成分,包括菌体成分(如细胞壁片段、胞外多糖)或菌群代谢产物(如SCFAs、特定酶、有机酸)。直接应用这些已明确功能的分子,可能比直接移植活菌更安全、更可控,且易于标准化。
工程益生菌(Engineered Probiotics)
通过基因工程技术改造益生菌菌株,使其能够:
高效表达特定治疗分子如抗炎细胞因子(IL-10)、神经肽或酶。
感知并响应疾病相关的生物标志物在特定病理条件下激活治疗途径。
靶向降解有害代谢物或清除病原体这种“活体药物”为精准菌群干预提供了巨大潜力,但其安全性和调控仍面临挑战。
噬菌体疗法(Phage Therapy)
噬菌体是特异性裂解细菌的病毒。通过筛选能够靶向清除特定有害菌(如在某些疼痛状态下过度增殖的条件致病菌)的噬菌体,可以实现对肠道菌群的精准“编辑”,而不破坏有益菌群。
针对菌群的药物开发
开发能够选择性调节肠道菌群特定功能的小分子药物。例如:
抑制有害菌关键酶的活性,从而减少有害代谢产物的产生。
促进有益菌关键酶的活性,增加有益代谢产物的合成。
靶向菌群的特定受体或转运体。
尽管靶向肠道菌群为慢性疼痛的治疗带来了希望,但仍面临诸多挑战。肠道菌群的组成和功能具有高度的个体特异性,且受饮食、生活方式、遗传、药物等多种因素影响。因此,“一刀切”的菌群干预方案可能效果有限,未来的发展方向在于个体化菌群干。
通过宏基因组学、代谢组学等多组学技术,分析个体患者的肠道菌群特征(如关键菌种的缺失/富集、特定代谢通路的异常),结合临床表型,识别与疼痛相关的菌群失调模式。
基于精准诊断结果,为患者量身定制干预方案,如选择最合适的益生菌菌株、益生元种类,甚至进行个性化的FMT供体筛选或开发定制化的后生元/工程菌。在干预过程中,持续监测患者菌群和临床症状的变化,及时调整干预策略。
肠道微生物组的调节可能很快成为慢性疼痛管理的重要工具,靶向肠道菌群为慢性疼痛的治疗开辟了充满潜力的新途径。随着研究的深入和技术的进步,有望从“经验性”干预走向“精准化”菌群调控,为饱受慢性疼痛困扰的患者带来更有效、更安全的个体化治疗方案。
注:本账号内容仅供学习和交流,不构成任何形式的医疗建议。
主要参考文献
Cai W, Haddad M, Haddad R, et al., The gut microbiota promotes pain in fibromyalgia. Neuron. 2025 Apr 18:S0896-6273(25)00252-1.
Minerbi A, Fitzcharles MA. Gut microbiome: pertinence in fibromyalgia. Clin Exp Rheumatol. 2020 Jan-Feb;38 Suppl 123(1):99-104. Epub 2020 Feb 12. PMID: 32116215.
Niu M, Li J, Zhuang X, Yangyang C, Chen Y, Zhang Y, Maes M. Unraveling the role of gut microbiota and plasma metabolites in fibromyalgia: Insights from Mendelian randomization and dietary interventions. Mol Pain. 2025 Jan-Dec;21:17448069251332140.
Erdrich S, Hawrelak JA, Myers SP, Harnett JE. Determining the association between fibromyalgia, the gut microbiome and its biomarkers: A systematic review. BMC Musculoskelet Disord. 2020 Mar 20;21(1):181.
Minerbi A, Fitzcharles MA. Gut microbiome: pertinence in fibromyalgia. Clin Exp Rheumatol. 2020 Jan-Feb;38 Suppl 123(1):99-104. Epub 2020 Feb 12. PMID: 32116215.
Häuser, Winfrieda,b,*; Fitzcharles, Mary-Annc,d; Henningsen, Peterb. Fibromyalgia syndrome—a bodily distress disorder/somatic symptom disorder?. PAIN Reports 10(1):p e1223, February 2025.
Liu L, Wu Q, Chen Y, Ren H, Zhang Q, Yang H, Zhang W, Ding T, Wang S, Zhang Y, Liu Y, Sun J. Gut microbiota in chronic pain: Novel insights into mechanisms and promising therapeutic strategies. Int Immunopharmacol. 2023 Feb;115:109685.
本文转自:谷禾健康
https://wap.sciencenet.cn/blog-2040048-1493419.html
上一篇:[转载]肠道微生物的营养获取策略:一个隐秘而精妙的生态系统
下一篇:[转载]肠道神经免疫轴:神经元、免疫细胞和微生物之间的串扰