博文
亚麻醉剂量氙气吸入提高健康人EPO水平的随机对照试验
||
亚麻醉剂量氙气吸入提高健康人EPO水平的随机对照试验
该文章发表后有学者提出质疑,其中最关键的结论,是氙气对EPO的升高作用,其统计学不够规范,没有进行组间对照,这对于对照试验来说,非常不合适。
亚麻醉剂量氙气可提高人体促红细胞生成素水平:一项随机对照试验
背景
已获批的麻醉剂氙气具有器官保护作用,最近被世界反兴奋剂机构列入禁用物质清单。氙气被认为可触发缺氧诱导因子1α(HIF-1α)的产生,进而促进促红细胞生成素的生成,但相关数据仅限于体内实验研究。因此,我们评估了氙气对健康人促红细胞生成素水平的影响。
方法
24名健康志愿者被随机分配至两组,一组自主吸入30%氙气(氙气/氧气 30%/60%),另一组吸入对照气体(氮气/氧气 40%/60%),持续45分钟。主要结局指标为暴露后多个时间点的促红细胞生成素水平。次要结局指标包括暴露后多个时间点的血清睾酮、细胞因子、生长因子水平,以及血液和呼出样本中的氙气浓度。此外,暴露期间对血流动力学安全参数进行监测。
结果
氙气给药后8小时,促红细胞生成素水平显著升高(1.34[±0.368];p=0.008),与基线值相比,在24小时达到峰值(1.45[±0.498];p=0.01),且在暴露后24小时内,血液和呼出样本中仍可检测到氙气。相比之下,对照组未观察到显著变化。基质细胞衍生因子1(SDF-1)的测量显示其水平显著升高(p=0.005),而生长因子、细胞因子或雄激素方面未观察到差异。在体外趋化试验中,氙气暴露后参与者的血清样本中,内皮祖细胞(EPCs)的迁移呈现增加趋势(p=0.080)。
结论
本研究首次证实氙气可提高健康志愿者的促红细胞生成素水平。
本研究已在欧洲药品管理局(EudraCT编号:2014-000973-38)和临床试验.gov(NCT编号:02129400)注册。
1 引言
2014年,世界反兴奋剂机构(WADA)正式将氙气列入运动员禁用物质清单,原因是有报道称,从2004年雅典奥运会到2014年索契奥运会期间,俄罗斯运动员使用氙气来获取潜在的运动表现优势[1]。近期有证据表明,俄罗斯田径联合会和俄罗斯国家反兴奋剂机构等多家俄罗斯机构积极参与了在精英体育中氙气的研究、生产、应用及隐瞒工作[2-4]。起初,体育界和实验研究人员都未对这些报道给予太多关注,但当氙气使用与其刺激促红细胞生成素(EPO)及促进恢复的潜在关联变得明显后,他们的兴趣迅速增长[1,5,6]。促红细胞生成素因其能提高运动表现的能力而在国际体育界被广泛列为禁用物质,尤其对精英运动员而言,它通过增加红细胞数量和携氧能力来发挥作用。这种糖蛋白是在缺氧诱导因子1α(HIF-1α)的作用下自然生成的,产生于肾脏、肝脏、血管平滑肌和心肌,并通过跨膜促红细胞生成素受体(EPOR)发挥作用[7]。除了刺激红细胞生成外,促红细胞生成素还被认为能激活多种心脏保护通路,包括磷脂酰肌醇3激酶(PI3K)、活化蛋白激酶B(PKB/Akt)、Janus激酶和信号转导与激活因子(JAK-STAT)以及糖原合成酶激酶3b(GSK-3b),从而抑制细胞凋亡、开放线粒体通透性转换孔(mPTP),最终增强心肌功能[7,8]。因此,多项研究试图将这些发现转化到临床实践中[9]。
氙气是一种已被充分研究的麻醉剂,过去几十年的多项实验和临床研究已证实其具有器官保护特性。尽管氙气原本被认为是化学惰性气体,但它却对人体表现出显著的生物学特性,然而人们对其在分子水平上的作用知之甚少。马及其同事[12]提出,氙气的调节作用是通过激活缺氧诱导因子1α介导的。在肾缺血再灌注的小鼠模型中,氙气暴露后约24小时,缺氧诱导因子1α的激活增加了386%,其下游效应物促红细胞生成素增加了高达160%[12]。值得注意的是,目前已知的其他麻醉剂均不会触发促红细胞生成素水平的升高[13]。
尽管这些发现前景广阔,但尚未有临床研究探讨氙气对人体循环中促红细胞生成素水平的影响。因此,我们旨在研究氙气诱导对血清促红细胞生成素水平的影响。由于最近有研究表明氙气诱导的缺氧诱导因子1α表达可触发巨噬细胞迁移抑制因子(MIF)和基质细胞衍生因子1(SDF-1)的表达[14,15],我们进一步评估了其潜在的分子机制,包括在健康研究对象中这些心脏保护生物标志物的分泌情况。此外,我们分析了氙气暴露后的血液和呼出样本,以评估检测体育运动中氙气滥用的潜在测量方法,并描述吸入后氙气的消除动力学。
2 材料与方法
2.1 试验设计
经当地机构审查委员会(EK 059/14)和德国联邦药品管理局(BfArM)批准,并在获得参与者书面知情同意后,健康研究对象被纳入这项单中心、随机、盲法试验。本研究已在欧洲药品管理局(EudraCT编号:2014-000973-38)和临床试验.gov(NCT编号:02129400)注册。
2.2 参与者
研究对象需为男性白种人,年龄超过18岁,愿意且能够完成本研究的要求(包括签署书面知情同意书),无合并症且未服用任何药物,满足这些条件者方可入选。排除标准包括:有尼古丁、酒精、药物或药物滥用史;已知对研究用药过敏或过敏;参与其他临床试验;因医疗或法律原因无法提供书面知情同意;过去2个月内有过伴随失血的创伤;研究纳入前2个月或更短时间内有过献血行为。本研究在亚琛工业大学医院进行,数据来自麻醉科。
2.3 干预措施
使用医疗级氙气[来自液化空气集团(德国杜塞尔多夫)的麻醉用氙气和林德集团(德国慕尼黑)的氧气(Conoxia)]。初步试点实验表明,吸入30%氙气45分钟后促红细胞生成素水平会升高,而吸入15%氙气45分钟后则不会,因此我们决定比较吸入30%氙气(氙气/氧气 30%/60%)和对照气体(氮气/氧气 40%/60%)45分钟的效果,使用带有改良应用装置的氙气专用闭合回路呼吸机(Felix Dual®,Taema,法国)(见在线资源1)。通过与常规侧流气体监测仪串联的热线传感器测量氙气的潮气末浓度,氧气和二氧化碳也通过该监测仪进行监测。选择30%的亚麻醉剂量氙气是为了使参与者能够自主呼吸并保持意识清醒。让研究参与者吸入100%氧气(6-12升/分钟)以排出体内氮气,直到呼气中的氧气浓度至少达到91%。然后将呼吸机切换到自动模式(闭合回路),当达到目标浓度后,研究参与者自主吸入氙气或对照气体[16]。研究参与者始终自主呼吸。
2.4 安全性测量
通过脉搏血氧仪、无创动脉压测量、氧气、二氧化碳和氙气浓度对研究参与者进行持续监测,随后每15分钟记录一次。观察研究期间的任何不良事件并随后进行记录。
2.5 促红细胞生成素和睾酮的测量
首次血液样本在干预前立即采集(基线),然后在0、2、4、8和24小时后采集,之后在2、3、4和5天的每天早上(晚上10点)采集。所有血液样本都收集在血清分离管(Sarstedt AG & Co,德国纽姆brecht)中用于促红细胞生成素评估,随后按照制造商的指南使用IMMULITE®/IMMULITE 1000促红细胞生成素检测程序(西门子医疗诊断产品有限公司,英国兰贝里斯)进行分析。同时,使用Cobas E模块(ECLIA检测;罗氏,德国)测定血清睾酮水平。
2.6 细胞因子的测量
使用市售的ELISA检测试剂盒(R&D Systems,德国威斯巴登)按照制造商的说明测定基质细胞衍生因子SDF-1α的血清浓度。采用如前所述的ELISA技术[17]评估巨噬细胞迁移抑制因子的血清水平,使用捕获抗体MAB289和检测抗体BAF289(均来自R&D Systems)。
2.7 从健康志愿者中分离内皮祖细胞用于体外培养和迁移实验
所有细胞培养活性测定均在 laminar flow hood 的无菌条件下进行。细胞在37°C、5%二氧化碳的培养箱中培养。分离前,六孔板用人类纤连蛋白(Biochrom,德国柏林;4.38μg/cm²)包被。用于分离的单个核细胞(MNCs)来自健康志愿者的血沉棕黄层,这些志愿者已签署知情同意书,且符合当地伦理委员会的要求。通过Ficoll密度梯度离心(GE医疗)分离单个核细胞,应用EasySep™人CD34选择试剂盒(StemCell Technologies,德国科隆)通过磁分离法将CD34+细胞富集至>90%,操作遵循制造商的协议。将CD34+细胞接种到纤连蛋白包被的六孔板中,在MV2内皮生长培养基(PromoCell,德国海德堡)中培养,该培养基添加了相应的补充包(PromoCell),其中包含FCS-25、hEGF-2.5、HC-100、VEGF-25、hbFGF-5、R3 IGF-1和AA-500。4天后更换培养基以去除非贴壁细胞,并在第6天收获细胞。在迁移实验前分离贴壁细胞时,移除培养基,用磷酸盐缓冲盐水(PBS)洗涤细胞。之后,加入accutase(Sigma-Aldrich),将培养板孵育15分钟。随后,向accutase溶液中加入等量的MV2内皮生长培养基。将该溶液以2000转/分钟离心15分钟。用磷酸盐缓冲盐水洗涤三次后,将沉淀重悬于含有0.5%牛血清白蛋白的MV2基础内皮生长培养基(血清饥饿培养基)中。通过荧光激活细胞分选(FACS)分析确认早期内皮祖细胞的纯度。
内皮祖细胞迁移实验使用24孔板格式的transwell小室(康宁公司,美国康宁,纽约州)和含有孔径为5μm的滤膜的细胞培养插入物(康宁公司)进行。按照上述方法分离细胞并计数。迁移实验中,每孔使用50,000个细胞(溶于200μl培养基)。下室含有来自不同患者不同时间点(术前以及术后2小时和24小时)的血清样本,这些样本在含有0.5%牛血清白蛋白的MV2基础内皮生长培养基中按1:5稀释。将相同培养基中的内皮祖细胞放入每个孔的上室中。在37°C、5%二氧化碳的条件下迁移3小时后,取出所有细胞培养插入物。为优化计数条件,对迁移的细胞进行固定,并用溶于3.6%多聚甲醛的Hoechst染料(ImmunoChemistry Technologies, LLC,美国明尼苏达州布卢明顿)染色(1:1000)。最后,将固定的细胞孵育过夜。第二天早上在显微镜下(100倍放大)拍照,并使用半自动软件ImageJ(美国国立卫生研究院,马里兰州贝塞斯达)计数迁移的细胞。
2.8 用于检测血液中氙气的气相色谱分析
在氙气暴露后的以下时间点采集血液和呼出样本:0、2、4、8、24、48和72小时。用于分析氙气血液消除动力学的血液 aliquots(3ml)直接转移到顶空瓶中,用丁基-特氟龙隔膜气密压接。呼出样本直接收集到顶空瓶中,并按上述方法密封。根据MHE方法[18],使用连接到TruTOF GC/TOF-MS(LECO,德国门兴格拉德巴赫)的HS40顶空进样器(珀金埃尔默公司,美国谢尔顿,康涅狄格州)进行气相色谱分析。所有样本在50°C恒温20分钟后进行三次分析。
2.9 结局指标
主要结局指标为暴露前及暴露后0、2、4、8、24、48、72、96和120小时测量的血清促红细胞生成素水平。次要结局指标包括循环血清中的睾酮、多种细胞因子及生长因子水平。此外,我们还测量了暴露后血液和呼出样本中的氙气浓度,以提供氙气消除动力学相关信息。最后,在干预期间对血红蛋白水平和安全性数据(脉搏血氧饱和度、无创动脉压测量值、心率、氧气及二氧化碳水平)进行了测量和记录。
2.10 随机化与盲法
研究开始前,亚琛临床试验中心预先制定了一份随机化列表。随机化序列通过随机化软件(RandList版本1.2,DatInf)生成。为每位符合条件的研究参与者分配一个按数字顺序排列的注册号。在独立研究者(JN)于单独的准备室采集基线血液样本后,参与者被送至干预室并交由研究医师(MB)处理。在研究研究者(JN)离开且干预开始前,研究医师(MB)打开分配给该研究参与者的按序号密封的随机化信封。研究参与者被随机分配至30%氙气组(氙气/氧气 30%/60%)或对照组(氮气/氧气 40%/60%),且对所接受的干预措施不知情。然而,大多数接受氙气的研究参与者能够分辨出氙气的亚麻醉效应。由于氙气的应用技术限制,无法对研究医师(MB)实施盲法。干预完成后,研究参与者被送回术前等候室,由研究研究者(JN)进一步检查。后续的医学检查由研究者(JN)在准备室进行。负责评估所有结局指标的研究参与者和研究人员(JN/AG/CE/MC/CS)在研究结束前均对干预分组情况不知情。
2.11 统计方法
本探索性试点研究的检验效能计算采用双侧检验,显著性水平α=0.05。健康志愿者的数据显示,促红细胞生成素平均水平为5.7 IU/L,共同标准差为1.7 IU/L[19]。基于先前的实验数据[14],我们预期氙气组在暴露后24小时促红细胞生成素水平将升高至9.1 IU/L。检验效能β=0.8时,每组所需样本量为12名参与者。为弥补可能出现的脱落情况,我们每组纳入14名参与者。检验效能计算采用nQuery Advisor®7.0版本(Statistical Solutions,美国马萨诸塞州索格斯)。本研究未进行中期分析,也未制定终止指南。
鉴于本试点研究的探索性性质,根据统计学家(H. Niggemann)的建议,采用学生t检验(两组)对单个时间点的组间单次测量数据(呈正态分布)进行比较。p值<0.05被认为具有统计学显著性。促红细胞生成素水平及其他介质(生长因子、细胞因子、趋化因子和睾酮水平)均标准化为1。通过对数据进行标准化,旨在避免不同基线值对整体结果产生影响并掩盖真实结果。所有其他数据(包括血红蛋白值)均以描述性方式呈现,即均值和标准差。所有统计分析均采用IBM SPSS 20版本(IBM公司,美国纽约州阿蒙克)进行。图表采用GraphPad PRISM®6版本(GraphPad Software Inc.,美国加利福尼亚州拉霍亚)制作。
3 结果
3.1 参与者
在最初筛选并纳入的志愿者中,24名研究参与者参与了本试验分析,并被随访至暴露后5天(图1)。2名接受30%氙气的志愿者因出现恶心和呕吐症状,中断了干预。2名接受60%氧气的志愿者因与治疗无关的疾病和/或因尼古丁滥用被排除研究,无法进行随访(图1)。人口统计学数据和干预安全性数据如表1和表2所示,组间无差异。接受分析的研究志愿者均进行高强度运动:平均每周6-9小时(表1)。
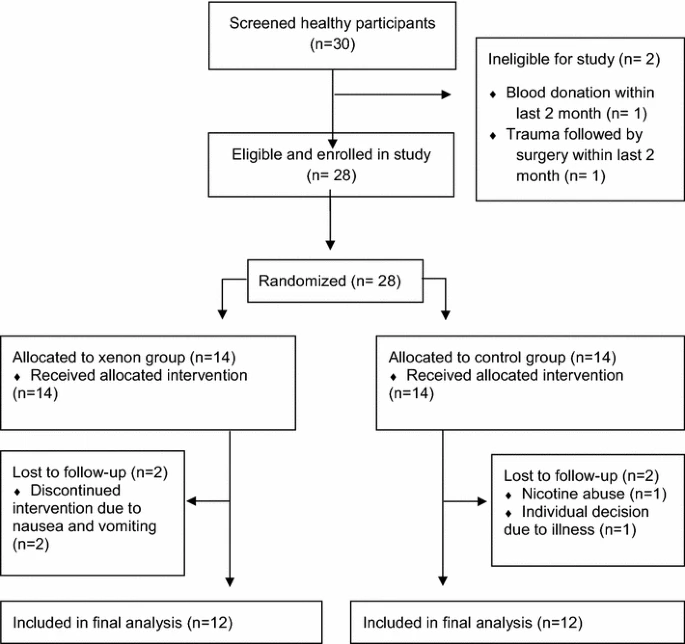
图1遵循CONSORT声明的随机临床试验流程图
表1 研究参与者的基线特征
表2 氙气和对照气体暴露前及暴露期间的安全性参数
3.2 氙气给药期间的安全性测量
所有研究参与者在氙气或对照气体暴露期间血流动力学均保持稳定(图2;表2)。值得注意的是,有2人出现恶心和呕吐症状,这与已知的恶心和呕吐发生率相符——与全凭静脉麻醉相比,其发生率高于丙泊酚麻醉[19](表2)。这2名出现恶心症状的参与者不得不提前终止氙气吸入,并被排除在分析之外(表2;图1)。所有参与者在任何时候都能迅速被唤醒,且在所有时间点均保持体温稳定,这与氙气的麻醉相关数据一致[20]。关于神经行为变化,大多数受试志愿者报告出现欣快感,随后进入一段主观上的深度放松状态,这一点未得到更详细的评估。
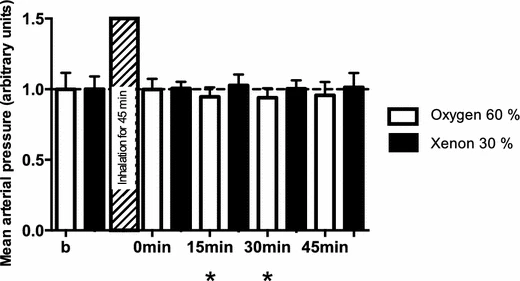
图2 30%氙气与对照气体(60%氧气)暴露对平均动脉血压(MAP)的影响
氙气组的平均动脉血压值有升高趋势,而对照组在暴露15分钟和30分钟后显著下降;*p<0.05;与暴露前基线值相比
3.3 健康研究志愿者的血清促红细胞生成素和血红蛋白水平
两组在暴露于氙气后,血清促红细胞生成素水平均先出现轻微且无统计学意义的下降,之后氙气组在8小时后开始显著升高(1.34[±0.368],p=0.008),而对照组的促红细胞生成素水平未出现显著变化(1.11[±0.34],p=0.267)。氙气暴露后24小时,循环中促红细胞生成素水平达到最大增幅(增加45%,p=0.010),与基线相比,直至氙气暴露后96小时,血清水平仍显著升高(增加42%,p=0.043)(图3a)。相比之下,对照组未观察到促红细胞生成素水平的显著升高(图3b)。
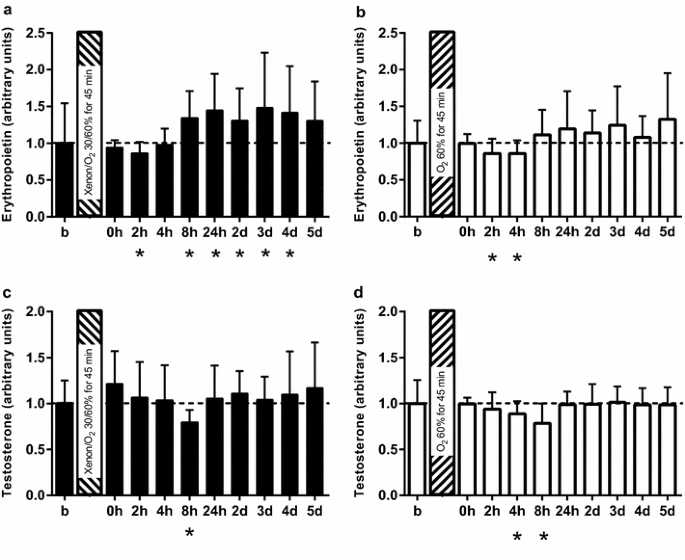
图3 促红细胞生成素(EPO)(a、b)和睾酮(c、d)在氙气(氙气/氧气 30%/60%)及对照气体(氮气/氧气 40%/60%)暴露前后的血清水平。氙气组中,促红细胞生成素水平(标准化为1)从暴露后8小时开始显著升高(a),24小时后达到峰值,升高45%(p=0.01),而对照组的促红细胞生成素水平与基线值相比未显示显著变化(b)。暴露后8小时,氙气组(-20%;p=0.000)(c)和对照组(-22%;p=0.005)(d)的睾酮水平均显著下降。在后续观察期间,氙气组的睾酮水平略有升高,但未达到显著水平(c)。结果以均值(标准差)表示;*p<0.05;与暴露前基线水平相比
由于已知促红细胞生成素通过缺氧诱导因子(HIF)依赖的方式刺激红细胞生成[12],我们分析了健康志愿者亚组(n=6)的血红蛋白水平。在氙气暴露后第4天,我们未发现血红蛋白水平有变化(1%;p=0.793);然而,在氙气暴露后第5天,我们观察到血红蛋白水平有升高5%的趋势(p=0.085),但在这个小队列中,这一差异未达到统计学显著性(见在线资源5和6)。
3.4 健康研究志愿者的血清睾酮水平
由于已知包括睾酮在内的雄激素会刺激促红细胞生成素的产生,反之亦然[21],我们在不同时间点检测了其循环血清水平,但未发现组间存在显著差异(图3c、d)。暴露后8小时,氙气组(-20%;p=0.000)(图3c)和对照组(-22%;p=0.005)(图3d)的睾酮水平均显著下降,这与先前关于睾酮昼夜节律的报道一致[22]。
3.5 细胞因子和生长因子的释放
近期数据强调了氙气预处理后缺氧诱导因子1α的表达[12,23],而缺氧诱导因子1α进而会触发巨噬细胞迁移抑制因子(MIF)和基质细胞衍生因子1(SDF-1)的表达[14,15]。在这方面,多项研究已证实其作为心肌调节关键介质的核心功能[23,24]。因此,我们检测了参与者血清中这两种因子的水平。循环中巨噬细胞迁移抑制因子水平未显示显著变化(图4a、b),而氙气组在暴露后4小时和8小时,循环血清中基质细胞衍生因子1水平显著升高(图4c、d),这表明基质细胞衍生因子1可能在氙气诱导的对运动员表现的影响中充当相关的关键介质。此外,氙气对生长因子释放的影响在很大程度上尚不明确,生长因子可能调节多种细胞过程(如细胞生长、增殖和分化),从而提供提高运动表现的效果[25,26]。因此,我们检测了治疗后转化生长因子β(TGF-ß)、血小板衍生生长因子(PDGF)、胰岛素样生长因子(IGF)和成纤维细胞生长因子(FGF)的血清水平。然而,如在线资源2(a-h)所示,在不同时间点内或组间均未观察到显著差异。
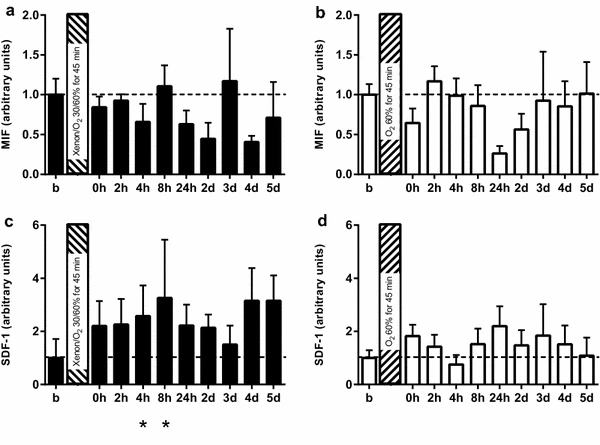
图4巨噬细胞迁移抑制因子(MIF)(a、b)和基质细胞衍生因子1(SDF-1)(c、d)在氙气(氙气/氧气 30%/60%)及对照气体(氮气/氧气 40%/60%)暴露前后的血清水平。循环中巨噬细胞迁移抑制因子水平未出现显著变化(a、b),而氙气组在暴露后4小时和8小时,循环血清中基质细胞衍生因子1水平显著升高(c)。结果以均值(标准差)表示;*p<0.05;与暴露前基线水平相比
3.6 氙气对内皮祖细胞募集的影响
接下来,我们旨在进一步研究氙气诱导对基质细胞衍生因子1水平的影响。由于无法在参与者中进一步评估其对心肌调节的作用(例如激活已知的保护性激酶ERK1/2),我们重点关注了其已知的募集内皮祖细胞的能力——内皮祖细胞在血管修复机制和血管生成中起着关键作用。因此,我们进行了探索性分析,在体外趋化试验中比较了氙气暴露后参与者与对照组血清的趋化作用。
我们观察到氙气组术后血清样本中的细胞迁移情况有所不同,但差异未达到显著水平(p=0.080)。这些结果表明,氙气可能促进内皮祖细胞迁移增强,从而在高氧需求的组织和肌肉中促进血管生成和氧气供应增加(图5)。
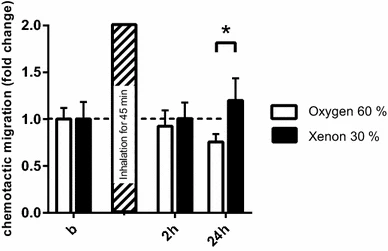
图5 内皮祖细胞(EPC)迁移
为研究氙气对内皮祖细胞迁移的影响,迁移实验中每孔使用50,000个细胞,将其与MV2血清饥饿培养基一起放入改良Boyden小室的上室。下室中的血清样本用相同的MV2血清饥饿培养基按1:5稀释。细胞在3小时内通过5μm的transwell膜迁移。迁移实验显示,暴露后24小时,氙气组术后血清样本中的细胞迁移情况与对照组不同。结果以均值(标准差)表示;*p=0.08;暴露后24小时对照组与氙气组比较
3.7 健康研究志愿者血液和呼出气体中氙气的检测
对研究志愿者的氙气测量显示,暴露后24小时内,呼出样本中仍可检测到氙气(4.67±5.32μg/ml)(图6a)。暴露后48小时,检测数据低于检测限(<1μg/ml)。与呼出样本类似,氙气暴露后的血液样本(17.0±4.99μg/ml)在吸入后24小时内也可检测到(图6b),吸入后48小时则低于检测限(<5μg/ml)。
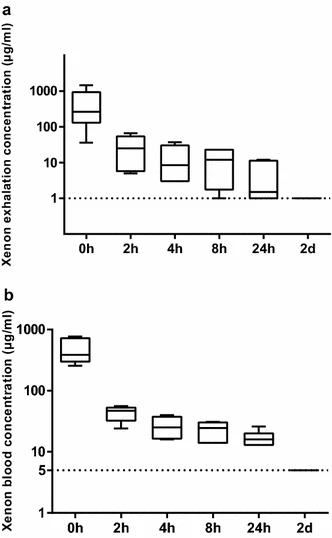
图 6研究参与者血液和呼出气体中氙气的检测
对研究参与者的氙气测量显示,暴露后24小时内,呼出样本中仍可检测到氙气(4.67±5.32μg/ml)(图a)。暴露后48小时,检测数据低于检测限(<1μg/ml)。氙气暴露后的血液样本(17.0±4.99μg/ml)在吸入后24小时内也可检测到(图b),吸入后48小时则低于检测限(<5μg/ml)
4 讨论
本研究首次证实了氙气对健康人促红细胞生成素水平的影响。健康参与者单次吸入30%氙气45分钟后,从8小时开始,血清中促红细胞生成素水平升高。
这些发现显著拓展了当前关于氙气诱导缺氧诱导因子1α和促红细胞生成素表达的认知[12]。在之前的研究中,马及其同事在分子水平上证实,氙气预处理通过PI3K-mTOR-p70S65通路以非经典方式诱导缺氧诱导因子1α及其下游效应物促红细胞生成素的稳定和表达[12,27]。相比之下,应用挥发性麻醉剂后未检测到缺氧诱导因子1α的显著增加[13]。此外,有研究表明氙气可诱导细胞外信号调节激酶1/2的激活[28],而后者已知会增加缺氧诱导因子1α的表达[29,30]。
一项针对心脏手术患者的小型研究得出了氙气对人体循环中促红细胞生成素水平影响的初步数据。在这项二次分析中,接受平衡氙气麻醉的患者血清中促红细胞生成素水平显著升高[31]。
为了获取更多关于氙气诱导促红细胞生成素合成的潜在信号通路信息,我们重点研究了氙气对几种生物标志物和细胞迁移的影响,这些都可能对运动员的表现产生重大影响。有趣的是,我们的数据显示,与对照组的血清样本相比,氙气暴露后参与者的血清对内皮祖细胞迁移的促进作用更明显,这表明氙气的有益作用至少部分可能是通过改善心脏和其他肌肉的血管形成及增加氧气供应来实现的。这些数据与氙气组血清中基质细胞衍生因子1水平显著升高的结果一致,已知基质细胞衍生因子1是一种强效趋化因子,可引导内皮祖细胞向氧分压降低的组织迁移[15]。此外,已知基质细胞衍生因子1通过CXCR4依赖的方式激活磷脂酰肌醇3激酶、丝裂原活化蛋白激酶和JAK-STAT,从而触发保护机制[23,24]。重要的是,这些信号通路被认为在心肌调节机制中至关重要,这可能也对肺和肌肉产生有益影响[23,32-34]。在这方面,需要更多的实验研究来探讨氙气是否也通过基质细胞衍生因子1/CXCR4通路发挥其提高运动表现的作用。值得注意的是,我们未观察到氙气对一组公认的生长因子或细胞因子有诱导作用,这些因子被用作反映人体显著适应过程的有效生物标志物。然而,鉴于本临床试验的局限性,我们无法在健康参与者中进一步研究潜在的机制,这一点应在未来的研究中进行全面探讨。
关于氙气对促红细胞生成素合成影响的持续时间,以及暴露后24小时仍可在血液中检测到氙气这一事实,我们可以认为氙气持续刺激了已知的促红细胞生成素通路,导致促红细胞生成素介导的保护性激酶的持续激活。图7概述了当前推测的氙气/促红细胞生成素轴可能产生有益作用的机制。由于已知组织缺氧也会触发缺氧诱导因子1α的激活[30],有人可能会认为缺氧刺激也能提高促红细胞生成素水平。事实上,先前的研究表明,缺氧(8%氧气)会刺激缺氧诱导因子1α的激活,但有趣的是,这种效应仅持续2小时[35]。Fig. 7
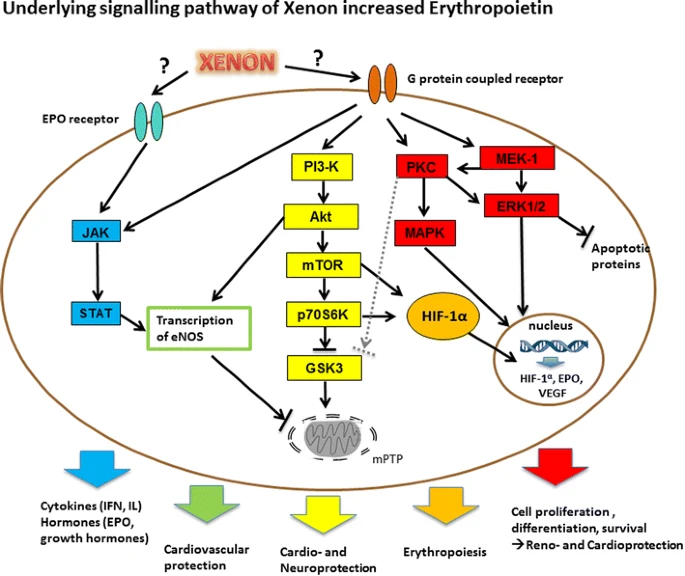
图7氙气升高促红细胞生成素(EPO)的潜在信号通路
示意图展示了氙气通过EPO介导的保护作用的潜在机制。**黑色箭头**表示激活或上调作用,而**带横杆的黑色箭头**表示抑制或下调作用。氙气预处理通过PI3K-mTOR-p70S65通路诱导缺氧诱导因子1α(HIF-1α)及其下游效应物EPO的稳定和表达[12,27]。此外,有研究表明氙气可诱导细胞外信号调节激酶1/2(Erk1/2)的激活[28],而后者已知会增加HIF-1α的表达[29,30]。此外,氙气诱导的基质细胞衍生因子1(SDF-1)合成可激活PI3K、丝裂原活化蛋白激酶(MAPK)和JAK-STAT通路。最后,氙气通过激活蛋白激酶C及其下游靶点p38 MAPK触发心脏保护作用[50]。
考虑到促红细胞生成素的有益作用,我们认为这些作用主要源于其众所周知的细胞保护特性以及对脑、肾和心血管系统的多效性影响[7],这可能显著提高不同器官系统的功能能力。此外,促红细胞生成素可调节多种细胞过程,如祖干细胞发育、细胞完整性和血管生成,并抑制损伤引起的凋亡机制,这对于在剧烈运动中对氧气和葡萄糖需求较高的运动员而言尤为重要。在此背景下,此前已有多项临床研究试图将这些发现转化到临床中,探讨促红细胞生成素在急性心肌梗死患者中的调节作用。尽管大规模试验的结果存在矛盾,但一项使用较低剂量和不同应用策略的小型试验显示,在恢复心肌血流后,心肌损伤程度减轻,炎症反应降低[9,36,37]。此前有研究表明,在缺血性急性肾衰竭期间,促红细胞生成素的上调可减少贫血并促进肾脏再生过程[38]。因此,马及其同事提出,通过调节缺氧诱导因子1α进而增加促红细胞生成素,是一种具有前景的临床应用策略。考虑到本研究结果对运动员的相关性,建议未来的研究探讨其对运动表现的潜在影响。
由于已知促红细胞生成素通过缺氧诱导因子依赖的方式刺激红细胞生成[12],我们另外分析了健康志愿者亚组的血红蛋白水平,发现在氙气暴露后第5天,血红蛋白水平有升高趋势。由于红细胞生成的刺激大约需要4天才能有效检测到网织红细胞的增加[39],我们必须承认,为了更全面地评估氙气对健康志愿者红细胞生成的诱导作用,需要延长观察期。在比较氙气和其他促红细胞生成素刺激剂对血红蛋白水平的影响时,这一问题再次凸显。此前的研究表明,在健康志愿者中重组促红细胞生成素给药后,大约需要2周才能检测到血红蛋白显著增加6%[40]。在已证实贫血的患者中,重组促红细胞生成素刺激应用后4周,血红蛋白被认为可增加>1g/dL[41]。需要进一步的研究来评估这些发现的临床意义,特别是在危重症/高风险手术患者中,这可能为氙气的治疗应用开辟新途径。
除了氙气对促红细胞生成素水平的影响外,氙气还具有许多特性,可能使其成为一种兴奋剂。此前的研究表明,吸入氙气可改善运动员高强度体能训练后的功能状态[5]。此外,氙气对运动表现的影响在登山者中也得到了证实[6]。研究表明,其潜在机制源于对心血管系统的稳定作用(心率降低和血压稳定)以及对交感神经系统过度兴奋的抑制[5,6]。此外,氙气可改善士气、降低皮质醇水平,并防止运动员血液中常见的转氨酶活性升高,这可能提供膜稳定作用,从而减少肌肉疲劳[5,6]。值得注意的是,上述研究发表在俄罗斯期刊上,因此研究界获取这些信息存在一定限制。在大鼠模型中,梅洛尼等人[42]发现,在疼痛暴露后2小时内吸入氙气,可巩固创伤后应激障碍的恐惧记忆。即使在低浓度下,氙气也能抑制参与恐惧学习和记忆的海马体和杏仁核NMDA(N-甲基-D-天冬氨酸)受体。与独立于经典阿片受体通路的NMDA、AMPA(α-氨基-3-羟基-5-甲基-4-异恶唑丙酸)和红藻氨酸受体相关镇痛作用一致[43],氙气可能调节运动员对潜在艰苦和痛苦训练的感知和态度。吸入氙气可触发多种可能提高运动员表现和促进恢复的效应,这进一步支持了世界反兴奋剂机构将氙气列为潜在兴奋剂的决定。
在此背景下,我们首次证实,在呼出样本中氙气可被检测到长达24小时,并且在血液中氙气也可被检测到24小时。这些发现与最近发表的一例病例报告一致。泰维斯等人[44]在接受平衡氙气麻醉的69岁女性血液样本中发现,暴露后24小时仍可检测到氙气(检测限为50nmol/ml)[44]。需要进一步优化采样和分析程序,以提高检测限,从而在未来更好地检测体育运动中的作弊行为。
此外,氙气作为一种麻醉剂,在临床实践中具有显著优势。其血-气分配系数较低,为0.115,是所有可用麻醉剂中最低的,这使得麻醉后苏醒迅速[45]。尽管氙气原本被认为是化学惰性气体,但它却反复表现出显著的器官保护特性,主要在脑或心肌缺血/再灌注损伤的情况下。值得注意的是,这些效应在亚麻醉浓度下也经常被观察到[10]。氙气对血流动力学稳定的作用体现在,在氙气麻醉期间,心率显著降低,血压值也较低[20]。考虑到这些发现,氙气未来可能在心脏手术和神经外科手术的标准麻醉以及重症监护治疗中发挥重要作用。除了已经提到的氙气特性外,我们首次证实氙气可诱导促红细胞生成素水平升高,这进一步扩展了其作为麻醉剂的积极特性。值得注意的是,已知的其他麻醉剂均不会触发促红细胞生成素水平的升高[13]。需要进一步的研究来评估其临床意义,特别是在危重症和高风险手术患者中,这可能为氙气的治疗潜力开辟新途径。
我们承认本研究存在一些局限性,需要仔细考虑。首先,理想情况下,我们试验中使用的气体混合物应固定在大气氧水平。然而,由于闭合回路呼吸机的技术应用限制,我们只能在排出研究参与者肺部的氮气后再吸入氙气。这通过吸入100%氧气直至呼气氧浓度>91%来实现。30%氙气目标浓度的应用导致吸入氧浓度为60%。因此,对照气体也混合了相当的氧浓度。此外,我们知晓“常氧氧悖论”。巴莱斯特拉及其同事[46]假设,在常氧条件下,谷胱甘肽可中和游离氧自由基,并在高氧期间上调。在停止吸氧后,大量的谷胱甘肽分子能够中和所有游离氧自由基,模拟相对缺氧状态,因此可能促进两组中促红细胞生成素的合成[46]。另一方面,近期数据报告称,在暴露后最初8小时内,高氧会导致促红细胞生成素值降低[35,47,48]。这些结果与我们的发现一致,即在氙气或对照气体暴露后的最初几小时内,促红细胞生成素水平初步下降。其次,我们知晓促红细胞生成素和睾酮的昼夜节律可能会影响我们的结果。因此,我们的方案注重氙气组和对照组血液样本采集时间的一致性。
第三,我们通过测量暴露后多个时间点血液和呼出样本中的氙气浓度,重点研究了氙气的消除动力学。在未来的试验中,应考虑检测参与者暴露期间血液中的氙气,以更全面地评估触发促红细胞生成素显著增加所需的目标血药浓度。
第四,如前所述,红细胞生成是一个缓慢的过程。因此,我们必须承认,为了全面评估氙气诱导的健康志愿者血红蛋白水平变化,需要延长观察期。此外,本研究是在一个小队列中进行的,因此可能不足以检测促红细胞生成素诱导的效应。我们承认,对本研究数据的解读应持谨慎态度,并将其视为生成假设。然而,本研究结果来自一项随机、单盲、对照临床试验,该试验在比较24小时后的促红细胞生成素水平方面具有足够的检验效能。
第五,目前尚不清楚6天内总共120ml的失血量是否会影响观察到的生物标志物和促红细胞生成素水平的变化。然而,米勒等人[49]发现,在75ml急性失血后,促红细胞生成素水平没有显著变化,这表明少量失血不会影响促红细胞生成素的合成。最后,由于氙气的给药方式,无法对研究医师(MB)实施盲法。不过,由于该研究医师未参与后续的数据采集和分析,因此盲法的缺失不太可能影响结局指标。
最后,这些是首项显示氙气对人体血清促红细胞生成素水平影响的人体数据。鼓励开展进一步的实验和临床研究,更全面地探讨其影响促红细胞生成素产生的潜在机制,这无法仅通过一项临床试验来解答。需要开展更多研究来评估其对运动员运动能力的影响。此外,还需要进一步研究采用更灵敏和特异的测量方法,以延长对体育运动中氙气使用的检测时间。
5 结论
本研究首次表明,吸入亚麻醉剂量氙气1小时可刺激人体血清促红细胞生成素水平。在健康志愿者中,直至暴露后24小时,仍可在血液和呼出气体中检测到氙气暴露的痕迹。
Anoop Balachandran对氙气提高健康人EPO研究的评论
尊敬的编辑:
这封信是关于最近发表在《运动医学》上题为《亚麻醉剂量氙气可提高人体促红细胞生成素水平:一项随机对照试验》的研究[1]。这是首个探讨氙气对健康人群循环中促红细胞生成素(EPO)水平影响这一重要问题的研究。正如论文引言中所述,促红细胞生成素长期以来被公认为一种强效的 performance-enhancing 物质[2]。因此,该研究结果可能在运动表现领域具有重要意义。
该研究将24名受试者随机分配至氙气吸入组或对照气体吸入组,吸入时间为45分钟。主要结局指标为血液中的促红细胞生成素水平。经过5天的数据收集,研究得出结论——正如标题所示,氙气可提高人体促红细胞生成素水平。然而,所报道的统计分析并不足以支持这一结论。
尽管在“统计分析”部分提到“根据统计学家的建议,使用学生t检验(两组)在单个时间点对各组间的单次测量值进行比较”,但论文中仅报道了组内分析或与基线得分的变化分析。因此,氙气有效的结论似乎是基于氙气组观察到的显著组内变化与对照组的非显著变化进行比较得出的。布兰德和奥尔特曼通过模拟数据有力地表明,比较组内p值的做法在概念上是错误的、无效的,且极具误导性[3]。如果要在试验中声称优效性,应进行比较组间均值差异的统计检验,即分组×时间的方差分析或两样本t检验。
总之,目前关于氙气可提高人体促红细胞生成素水平的结论是不恰当的,且可能具有误导性。我们强烈建议进行随机对照试验的作者在比较结局时采用组间比较的方法,而非组内比较或与基线对比的方法。
参考文献
1. Stoppe C, Ney J, Brenke M, et al. Sub-anesthetic xenon increases erythropoietin levels in humans: a randomized controlled trial. Sports Med. 2016;46(11):1753–66.
2. Momaya A, Fawal M, Estes R. Performance-enhancing substances in sports: a review of the literature. Sports Med. 2015;45(4):517–31.
3. Bland JM, Altman DG. Comparisons against baseline within randomised groups are often used and can be highly misleading. Trials. 2011;12:264-6215-12-264.
作者对阿努普·巴拉钱德兰等人的回复:关于《亚麻醉剂量氙气可提高人体促红细胞生成素水平:一项随机对照试验》的评论
我们要感谢巴拉钱德兰博士及其同事的有趣来信[1],这开启了关于统计检验在探索性试点研究中的整体价值和重要性的讨论,而探索性试点研究的主要目的是发现实施和评估干预措施时可能存在的问题。此外,开展试点研究是为了解决对大规模试验的设计和实施至关重要的问题,因此它通常也被称为可行性研究或先锋研究。
我们同意布兰德和奥尔特曼的观点,即缺失组间比较可能会产生误导,应谨慎解读[2]。然而,与之明显相反的是,图基此前曾指出,探索性分析本身应强调图形或数值描述,而随后的经典验证性分析则应强调显著结果与非显著结果的区分[3]。出于这个原因,本研究没有提供我们的进一步分析结果[4],尽管我们的统计分析显示,在比较氙气组和对照组从基线到最大水平的促红细胞生成素水平增幅时,存在显著差异(中位数9.00[第25–75百分位数4.3–11.4] vs. 2.95[第25–75百分位数2.02–8.32];p=0.016)。我们决定不报道这些结果,而是旨在证明存在一种直观的生物学效应,这种效应基于合理的潜在科学原理和令人信服的临床前数据[5–7]。弗里德曼等人支持这种对试点研究结果报道的考量,他们认为我们需要相信,那些阅读、解读和使用这些报告的人有足够的智慧理解其局限性[8]。
不过,我们同意巴拉钱德兰等人的观点,即观察到的结果应在后续的验证性研究中得到更仔细的研究,因为目前尚不清楚应测量治疗的哪些方面,以及何种反应指标有助于证明临床或功能上的相关效应。因此,我们的研究结果应结合弗里德曼等人的研究来审视和解读,他们强烈支持发表早期试点研究,无论其统计显著性如何[8]。显然,探索性和验证性数据分析都是必要的,因为这两种分析方法的目标各不相同。
References
Balachandran A. Comment on “Sub-anesthetic xenon increases erythropoietin levels in humans: a randomized controlled trial.” Sports Med. 2016. doi:10.1007/s40279-016-0659-x
1. Bland JM, Altman DG. Comparisons against baseline within randomised groups are often used and can be highly misleading. Trials. 2011;12:264.
2. Tukey JW. Exploratory data analysis: past, present and future. Technical report. Princeton: Princeton University; 1993.
3. Stoppe C, Ney J, Brenke M, Goetzenich A, Emontzpohl C, Schälte G, et al. Sub-anesthetic xenon increases erythropoietin levels in humans: a randomized controlled trial. Sports Med. 2016;46(11):1753–66.
4. Ma D, Lim T, Xu J, Tang H, Wan Y, Zhao H, et al. Xenon preconditioning protects against renal ischemic-reperfusion injury via HIF-1alpha activation. J Am Soc Nephrol. 2009;20:713–20.
5. Goetzenich A, Hatam N, Preuss S, Moza A, Bleilevens C, Roehl AB, et al. The role of hypoxia-inducible factor-1α and vascular endothelial growth factor in late-phase preconditioning with xenon, isoflurane and levosimendan in rat cardiomyocytes. Interact Cardiovasc Thorac Surg. 2014;18:321–8.
6. Stoppe C, Coburn M, Fahlenkamp A, Ney J, Kraemer S, Rossaint R, et al. Elevated serum concentrations of erythropoietin after xenon anaesthesia in cardiac surgery: secondary analysis of a randomized controlled trial. Br J Anaesth. 2015;114:701–3.
7. Friedman L. Commentary: why we should report results from clinical trial pilot studies. Trials. 2013;14:14.
https://wap.sciencenet.cn/blog-41174-1491607.html
上一篇:结合微藻与氢氧化细菌的新型光-化能自养系统用于从二氧化碳生产微生物蛋白
下一篇:《线粒体学》概念