博文
[转载]人体微生物进入临床应用转化的潜力和障碍
||
在过去十年中,临床微生物组研究的格局发生了巨大变化。通过利用体内和体外实验、多组学方法和计算生物学,发现了许多详细的作用机制和微生物关联指标,并确定了在许多疾病和治疗方式中改变微生物组的有效方法。
尽管微生物组领域的临床转化仍处于早期阶段,其基础性发现正稳步为医疗领域带来变革性应用奠定基础。重要的是,微生物组的相关发现从基础研究到转化的速度已超过许多其他重要的新兴生物医学进展。例如,癌症免疫疗法的相关发现是在第一种获批疗法面世前50年取得的,而癌症免疫疗法在过去十年极大地革新了癌症治疗。
同样,推动mRNA疫苗发展的尿嘧啶修饰创新发生在首次人体试验前15年(若非新冠疫情的紧迫需求,这一过程本会耗时更长)。临床微生物组研究在过去20年取得了实质性进展,正从相关性走向因果性和干预,并已催生首批FDA批准的疗法。
驱动微生物-微生物及微生物-宿主相互作用的具体功能机制正被越来越精准地揭示,这为药物靶点和患者群体的选择带来了改进。
这些进展,加之监管环境的日益完善,正在切实降低基于微生物组的治疗和诊断的临床转化风险。
本文介绍和讨论微生物组研究成果如何推进临床实践的关键研究示例。讨论将微生物组数据整合到常规临床实践、精准医疗以及个性化医疗保健和营养方面的主要挑战和机遇的前瞻性观点。
当前的微生物临床应用进展过去几年微生物如火如荼的研究通过有效使用微生物培养和临床前建模以及宿主和微生物基因组学、转录组学、蛋白质组学和代谢组学以及临床前和临床观察或干预试验中的高级生物信息学分析,阐明了微生物组在调节宿主免疫、代谢甚至行为中的作用。
但是将微生物组整合到临床实践中需要以下一项或多项组合:
1)明确微生物群影响健康、疾病或治疗反应的作用机制
2)使用来自微生物特征的指标对健康状况、疾病或治疗结果进行统计诊断或预测
3)证明有可能改变微生物组以在患者中引发特定结果。
这项机制、指标和调节因素原则可用于评估转化医学的进展,并明确在任何特定临床实践推广应用中所面临的挑战。
微生物组通过特定的生物化学和物理相互作用对宿主产生影响,这些作用主要通过免疫、神经和内分泌系统以及代谢合作与拮抗来发挥。可以通过研究这些相互作用,确定特定的药物靶点,从而阻断或增强微生物功能,进而促进健康结果。
统计学和机器学习方法可用于基于关联性识别潜在的微生物因素,这些因素可以预测或诊断健康或疾病,从而能够开发微生物群健康指数。
比较幸运的是,现在已经可以指出一些能够诊断疾病或指示治疗成功的微生物指标,但定义一个“健康的”微生物组仍然很困难。这是因为与健康或疾病相关的参考范围会受到诸如地理位置、年龄、饮食、生活方式和遗传等无数混杂因素的影响。
饮食、益生元、噬菌体、益生菌、活生物治疗剂、药物(包括但不限于抗微生物剂)和生活方式改变已成功用于通过微生物调节解决症状和改善宿主-微生物协同作用,尽管成功的个体间差异很大。未来使用考虑个体微生物组和现实生活方式干预的个性化微生物组干预将有助于缩小研究与实践之间的差距。
这三种模式(机制、度量和调节因素)中的每一种都有助于一定程度的临床实施,因此并非所有模式都适用于特定应用。自过去 5 年的研究示例,这些示例为这三种模式提供了令人信服的示例,其中一些已经成熟,可以临床采用。
这些如何(或可以)转化为临床实践,包括开发基于微生物组的诊断、治疗和营养策略。
接下来本文将按照身体部位组织分开讲述。
01阴道微生物组阴道微生物组如何构建天然防御屏障?
以乳杆菌属(Lactobacillus)为主的阴道微生物组创造了一个酸性环境,防止感染并支持平衡的微生物生态系统。
同一种微生物“亦敌亦友”
解码微生物群中的菌种甚至菌株水平基因型和表型变异,有助于识别致病潜力的差异。
白色念珠菌(Candida albicans)的不同菌株通过调控I型干扰素通路,在阴道上皮中产生截然不同的免疫调节作用,可能引发外阴阴道念珠菌病,也可能促进免疫耐受。
阴道卷曲乳杆菌(Lactobacillus crispatus)的某些菌株因携带β-咔啉生物碱合成能力,可降低 I 型干扰素,反应展现出更强的抗炎和定植优势。
从母体阴道到婴儿肠道的免疫保护
乳酸杆菌属的菌种和菌株会附着在阴道上皮细胞上,帮助维持3.5~4.5 之间的 pH 值,从而防止与细菌性阴道病 (BV) 和性传播疾病相关的病原体过度生长。
它们还可以跨代传播到新生儿的肠道微生物组,可遗传菌株在人类抗原呈递细胞上表现出免疫抑制表型。因此,确定成功传播且在调节炎症和粘附上皮方面更有效的乳酸杆菌种类和菌株,尤其是在不同种族和社会文化背景的女性中,应该是提高活体生物治疗药物和预防策略的疗效和特异性的研究重点。
结合临床观察和指标综合判别诊疗阴道感染,因为由于菌株的普遍性而变得复杂,这些菌株可能具有共生或感染作用,具体取决于环境。
同一种菌株在不同环境下——不同的行为特征
例如,加德纳菌属(Gardnerella)历来被标记为致病性,但已被证明在某些人中是良性的,其丰度会随着月经周期的变化和避孕药的使用而波动,进一步说明了微生物与宿主关系的动态性质。
菌株亚型:疾病风险的预测指标
使用阴道微生物指标需要对微生物组的地理、种族和时间动态进行广泛评估,以明确哪些分类群或菌株与健康或疾病相关。
B组链球菌(GBS)的研究为我们提供了理解微生物精细分类的重要案例。这种与新生儿脑膜炎相关的常见病原体,通过其VIIb型分泌系统的特征分析,已被识别出四种不同亚型,这些亚型可用于直接治疗和减少传播,尤其是免疫系统尚未完全发育的新生儿。
抗生素过度使用的隐忧
目前在美国,每预防一例新生儿 GBS 败血症,就有 200 名母亲及其婴儿接受产前高剂量抗生素预防。更好地定义微生物风险可以减少不必要的抗菌药物给药,而且鉴于早期抗菌药物给药、微生物组扰动和儿童慢性病发展之间的关系,这一点至关重要,以减少过度医疗干预。
阴道菌群治疗的创新前沿
许多临床疗法旨在通过调节 pH 值或雌激素或通过益生菌来重建主要的乳酸产生菌株。
——阴道菌群移植
在一项针对 5 名患者的研究中,该移植导致 BV 消退,缓解持续至少2年。
阴道微生物组移植也在单个案例研究中被探索为一种不孕症治疗方法,通过调节阴道 pH 值来提高精子活性,从而提高妊娠成功率。
阴道菌群干预:从益生菌到噬菌体技术
基于阴道的益生菌乳酸菌也用于诱导酸性 pH 值以降低 BV 风险或治疗疾病,但噬菌体对引入物种的捕食可能会使治疗复杂化。噬菌体在临床上也可用于治疗BV,公司现在正在将噬菌体和 CRISPR 方法相结合来治疗顽固性大肠杆菌尿路感染。
目前,越来越有机会利用从大规模阴道微生物组研究中获得的知识来推进精确的阴道微生物组干预,例如下面的ISALA 项目,这些研究将微生物群落分析与更深入地了解激素、生殖阶段、免疫反应(例如,GBS 特异性抗包膜抗体)、环境暴露、饮食、行为和个人卫生产品如何改变阴道微生物组。

随着测序技术的进步,阴道菌群检测已从传统的培养法发展为利用高通量测序技术,使得菌群的构成分析更加全面。这些先进检测手段使临床医生能够获取阴道微生物组的完整图谱,包括多样性指数、优势菌种构成以及潜在致病菌的存在。
结合人工智能算法,这些检测数据可转化为个体化风险评估和治疗建议,将传统的"一刀切"治疗方案转变为基于个体微生物特征的精准干预策略。
扩展阅读:
02胃肠道微生物组胃肠道(GI)是宿主-微生物组-环境相互作用研究最广泛的生态位之一。这种串扰的结果往往超越了肠道,以系统的方式调节健康和疾病。
新生儿肠道微生物组
新生儿肠道微生物组如何形成?
新生儿出生时,肠道微生物主要来自母亲的阴道和肠道菌群。自然分娩的婴儿通过产道接触母体微生物,而剖腹产婴儿则缺少这一过程,导致其肠道菌群与自然分娩婴儿不同。
研究表明,通过阴道接种(将母体阴道分泌物涂抹给剖腹产婴儿),可以增加母体微生物传播并改变婴儿粪便微生物群的组成。
母体粪菌移植(口服稀释的母体粪便剂量),可帮助剖腹产婴儿的肠道菌群接近自然分娩状态,且3个月内没有不良反应。

对这些队列的后续分析还确定了来自父亲微生物组的贡献。
这些发现表明上述两种方法可能有助于改善剖腹产婴儿的肠道健康,但要有效地将这些方法转化为临床应用,还需要:
为粪菌移植进行合理的供体匹配
进行长期临床结果评估
母乳喂养如何塑造婴儿肠道菌群?
婴儿肠道微生物群的改变也可能来自营养和母乳的获取。
母乳含有多种成分,对婴儿肠道微生物组的建立与调节至关重要:
补体成分:在针对微生物病原体的先天免疫防御中起关键作用的蛋白质,可以淘汰特定细菌,增强对肠道感染的抵抗力
牛奶相关免疫球蛋白A (IgA) 和抗菌肽(如乳铁蛋白和溶菌酶)塑造婴儿肠道微生物组、免疫发育和早期感染保护。
这些机制为新生儿重症监护病房营养计划以及富含关键母乳低聚糖、益生菌菌株、抗菌肽和 IgA 的合成牛奶替代品的开发提供信息,以模拟天然母乳的效果。母乳的动态成分(随时间变化)是复杂生物系统,现有合成配方难以完全模拟其效果。
◐ 纯母乳喂养的婴儿肠道菌群发展更规律
◑ 前3个月断奶使用配方奶粉会破坏这一发育过程,可能导致微生物群过早成熟,增加哮喘等疾病风险

CHILD 队列最近的一项研究使用因果模型来识别婴儿肠道微生物组中的生物体(如活泼瘤胃球菌Ruminococcus gnavus)和功能(如色氨酸代谢),这些生物体在机制上将纯母乳喂养与预防哮喘联系起来,为临床转化提供了具体目标。
关于活泼瘤胃球菌详见我们之前的文章:活泼瘤胃球菌(Ruminococcus gnavus)——多种疾病风险的潜在标志物
色氨酸代谢详见:色氨酸代谢与肠内外健康稳态
益生菌在新生儿健康中的作用与风险
近期几项研究已经确定了针对新生儿胃肠道微生物组的临床相关治疗的作用机制。
一个典型例子是益生菌——婴儿长双歧杆菌亚种(Bifidobacterium longum subsp. infantis):
在婴儿肠道中能够代谢人乳寡糖,产生吲哚-3-乙酸
这种代谢产物会上调细胞因子干扰素β(IFNβ)的表达,从而在生命早期促进积极的免疫调节。
可用于治疗急性营养不良,促进体重增加,改善极低出生体重婴儿的健康状况
——争议案例
虽然B. infantis在改善营养不良方面显示出潜力,但在特定人群(如早产儿)中使用时需要格外谨慎,可能存在安全隐患。
最近发生了一起与Evivo产品(含有B.infantis EV001和中链甘油三酯[MCT]油)相关的早产儿死亡事件。基于此事件,美国食品药品监督管理局(FDA)向临床医生发出警告信,提醒在新生儿重症监护病房(NICU)使用益生菌的潜在风险。

——循证医学
大型临床试验支持益生菌在早产儿中的使用是安全且有益的,可以降低健康并发症的风险,比如坏死性小肠结肠炎。
具体来说,2023年的一项涉及106个试验、共25,840名早产儿的荟萃分析发现,益生菌(包括婴儿双歧杆菌菌株)与全因死亡率的显著降低相关。特别是多菌株益生菌能够将死亡率降低高达31%。
这些研究结果表明,在早产儿护理中适当使用益生菌可能是一种有效的预防性干预措施,有助于改善早产儿的健康结果和生存率,但需要多项评估,评估人群适用性,避免过度依赖单一菌株。
成人肠道微生物组
成人肠道微生物组通过多种途径影响健康:
产生短链脂肪酸(SCFAs)调节免疫系统
通过胆汁酸代谢和生态竞争减少感染性疾病
帮助发酵纤维和其他营养物质,辅助消化
产生多种的代谢产物,影响全身系统功能
微生物组紊乱与疾病
当肠道微生物组遭到破坏,微生物之间及微生物与宿主之间的功能性相互作用扰乱时,可能导致疾病发生,例如:
微生物胆汁酸代谢的紊乱与艰难梭状芽孢杆菌(C. difficile)感染风险增加相关,可能的原因是由微生物产生的次级胆汁酸可以抑制艰难梭菌孢子的萌发,而炎症会导致肠道环境有利于病原体的生长。
这类功能紊乱可以通过基于微生物组的干预措施进行纠正,正如口服微生物组疗法VOWST(原名SER-109)在三期随机对照试验中所证明的那样。
微生物组与药物互作
肠道微生物组与环境(包括饮食)之间的相互作用十分复杂,并且与个体的微生物代谢功能能力密切相关,这对临床转化和潜在患者群体干预措施的安全性有重要影响。这种异质性可能影响微生物与药物的相互作用,进而影响药物疗效。
研究发现约150种膳食异种生物与肠道微生物之间存在相互作用
微生物代谢可使这些化合物毒化或解毒,导致个体反应差异
常规服用的他汀类药物用于降低心脏病风险时,但可能会干扰微生物的次级胆汁酸代谢,可能促进炎症诱导的胰岛素抵抗和葡萄糖耐受不良
而通过给予次级胆汁酸熊去氧胆酸作为治疗手段可以逆转这一过程。
最近的一项研究绘制了大约150种膳食异种生物与肠道微生物之间的相互作用
揭示了微生物代谢如何使这些化合物毒化或解毒,并识别出导致个体反应差异的相关酶。
有研究发现,常规服用的他汀类药物用于降低心脏病风险时,会干扰微生物的次级胆汁酸代谢,促进炎症诱导的胰岛素抵抗和葡萄糖耐受不良,而通过给予次级胆汁酸熊去氧胆酸作为治疗手段可以逆转这一过程。

为什么药物对人效果不一?探索药物-微生物群相互作用对效果的影响
癌症、炎症和肠道微生物组
肠道微生物组如何影响免疫治疗的效果?
黑色素瘤:多样性低→免疫疗法成功率低
产丁酸菌高、益生菌高→免疫疗法成功率高
肠道微生物多样性低已被证明是晚期黑色素瘤免疫治疗失败的可靠预测指标。
在一项包含175名接受免疫治疗的黑色素瘤患者的队列研究中,肠道相关的产丁酸菌(Agathobaculum butyriciproducens)和益生菌干酪乳杆菌(Lactobacillus gasseri)的丰度可预测12个月无进展生存期的增加和增强的抗癌免疫力,而普雷沃氏菌属(Prevotella copri)则与更短的无进展生存期和炎症相关。
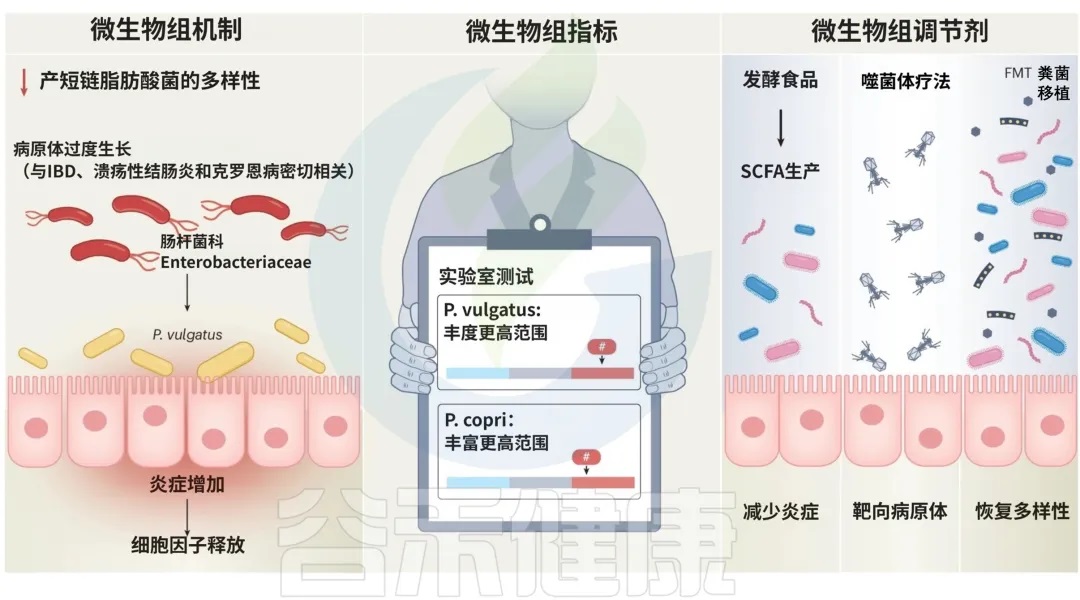
炎症性肠病:与P. copri 、Enterobacteriaceae有关
P. copri 已被强调为一种特别依赖环境的细菌,与正面和负面的健康结果都有关联。实际上,P. copri 菌株的比例以及更普遍地说,肠杆菌科(Enterobacteriaceae)细菌,已被密切联系到炎症性肠病(IBD)的发展和进展,包括溃疡性结肠炎(UC)和克罗恩病。溃疡性结肠炎患者可以根据粪便中源自Phocaeicola vulgatus 菌产生的蛋白酶丰度进行预后评估,这些蛋白酶通过破坏上皮屏障并导致炎症而与疾病严重程度相关。
如何通过靶向干预改善癌症治疗响应?
——噬菌体疗法
有针对性地消除促发疾病的菌株可改善患者预后,例如,一种针对肺炎克雷伯氏菌(Klebsiella pneumoniae)特定分支的噬菌体混合物在炎症性肠病患者体内富集,在临床前模型中能够抑制肠道炎症,并在一项I期人体试验中被证明是可行且安全的。
全面认识——肺炎克雷伯菌 (Klebsiella pneumoniae)
PHAGE-2研究将益生菌(动物双歧杆菌Bifidobacterium animalis subsp. lactis BL04)与一组针对大肠杆菌(E. coli)的噬菌体混合物结合,用于改善68名健康成人的胃肠道健康。这项随机对照试验发现,这种组合能显著减少胃肠炎症和结肠疼痛,改善粪便稠度,并增加乳酸杆菌的丰度,同时不影响整体肠道菌群多样性。
doi.org/10.1038/s41591-025-03615-9
来自动物研究和小型人类队列的有力证据表明,饮食对微生物组的调节可以影响癌症治疗中患者对免疫检查点阻断(ICB)的反应。一项研究发现,在128名接受ICB治疗的患者中,更高的膳食纤维摄入改善了无进展生存期,而益生菌削弱了这种影响,这在临床前模型中得到了证实。
——粪菌移植 (FMT)
也在一项包含16名患者的试验中进行了测试,其中从对黑色素瘤的抗PD-1治疗有成功结果的个体中选择捐赠者,为那些同一治疗失败的个体进行移植。来自响应者的FMT结合抗PD-1治疗在15名可评估患者中的6名显示临床益处,增加了CD8+ T细胞活化并减少了表达白细胞介素-8(IL-8)的髓样细胞。
——广谱抗生素
当在嵌合抗原受体T细胞输注前使用时,与较差的ICB结果相关,无进展生存期和总体生存期降低。
——饮食
饮食作为调节因素也被探索用于其他癌症类型。试验证明,食用海军豆增加了肠道微生物多样性和哌啶酸浓度,并降低了血清吲哚衍生物,这逆转了在肥胖和结直肠肿瘤患者中观察到的特征。
这表明通过使用饮食、FMT或益生菌来修改微生物组,并减少抗生素介导的修改,可能在癌症预防和治疗中起关键作用。
注:海军豆原产于美洲,椭圆形略扁,豆粒呈白色,是美国海军中水手的主食。
肠道微生物组和心脏代谢健康
肠道微生物如何促进肥胖?
——Megamonas rupellensis降解肌醇、脂质吸收增强
研究表明肠道微生物组的某些特征有助于促进肥胖。其中一种机制涉及Megamonas rupellensis主动降解肠道结肠细胞脂质膜中的肌醇,这减少了肌醇衍生的对脂肪酸摄取通路的抑制,从而增加脂质吸收。
肌醇缺乏还与胰岛素抵抗和多囊卵巢综合征相关,这表明该机制可能有更广泛的作用。
——微生物酶与能量提取
其他促肥胖的机制还包括微生物糖苷水解酶的作用。微生物产生的糖苷水解酶可以分解人体无法消化的复杂碳水化合物,增加宿主可利用的能量摄入。这种额外的能量提取能力是微生物组促进肥胖的另一重要机制。
为什么有些人节食减肥不成功?
在节食后未能减重人群中革兰氏阴性厌氧菌生长率的降低。
而那些节食后能够减重的人群中,短链脂肪酸的产生增加,胰高糖素样肽1(GLP-1)分泌增加。
肠道微生物群的某些指标,例如肠道相关的Prevotella的丰度,可以预测个体在膳食干预后减重的成功率。
体重管理的微观关键:脂肪组织、肠道菌群与肥胖的关联
微生物如何影响我们的食欲?
有趣的是,P. vulgatus能够产生泛酸,促进GLP-1的分泌。
肠道细菌产生谷氨酸也被认为可通过结肠嗜铬细胞增加食欲,这些细胞通过迷走神经向大脑发送信号。这展示了微生物组如何通过"肠-脑轴"调节我们的进食行为。
携带与支链氨基酸合成相关的生物合成功能的P. copri亚群也是2型糖尿病的诊断标志。
微生物组对肥胖影响的最新研究分析
与健康体重相关的菌——Christensenellaceae
人体研究表明,克里斯滕森菌科(Christensenellaceae)与低体重指数(BMI)和其他健康指标如低甘油三酯水平相关。基于这些观察,克里斯滕森菌科被提议作为治疗肥胖的候选新型活体生物治疗剂。
这些微生物与体重之间的关联可能是菌株特异性的。
对7,190个健康成人肠道宏基因组的分析发现,细菌基因组中的特定单核苷酸多态性与BMI相关,尽管在忽略单核苷酸多态性时,相同细菌种类的相对丰度与BMI并无关联。
意外的健康标志物:芽囊原虫
最近芽囊原虫属(Blastocystis)在肠道微生物组中的存在也被证明与多种健康指标相关:
更多摄入植物性食物
更健康的心脏代谢特征
较低的BMI
减少的炎症和代谢紊乱标志物
注:芽囊原虫是一种多样性极高的单细胞真核生物,目前已被分类为至少28个亚型(subtypes, STs),其中至少有8个亚型在人类中发现。尽管早期的宏基因组研究已探讨了芽囊原虫的流行情况,但需要更大规模和多样化的队列研究来建立肠道芽囊原虫、营养和心脏代谢健康结果之间的关系。
通过外部验证,研究显示芽囊原虫携带率与体脂、炎症性肠病(IBD)、结直肠癌(CRC)和糖尿病等疾病呈负相关。
总的来说,该研究揭示了芽囊原虫作为健康生活方式标志物的潜在有益作用,并提出了其可能解释个体对饮食反应差异的机制。重要的是,当代医疗实践经常试图从肠道中清除这种生物。
粪菌移植、药物干预治疗肥胖
关于微生物修饰策略治疗肥胖的研究主要集中在肠道菌群在调节饮食或手术对体重增减影响方面的作用。
粪菌移植(FMT)治疗肥胖的潜力产生了相互矛盾的结果,这可能是由于持续的饮食选择压力、微生物组的生态稳定性或相关的免疫反应,使得将微生物组修改为非致肥状态变得困难。
虽然一些动物模型的证据表明,以GLP-1为靶点的减肥药物(如索马鲁肽和替尔泊肽)也会改变微生物组,但几乎没有证据表明这些药物与微生物组有因果关系,导致体重减轻增强或停药后体重减轻时间延长。
微生物组定向辅食的突破
基于微生物组的饮食干预也已被证实可用于治疗营养不良。在一项涉及123名营养不良儿童的随机研究中,一种旨在促进微生物组介导体重增长的微生物组定向辅食(MDCF-2)能够调节肠道微生物群,并改善生长和健康结局。
——关键菌群 P. copri、F.prausnitzii
MDCF-2 的成功部分归因于普雷沃氏菌(P. copri)中碳水化合物酶代谢活性的变化,以及由普拉梭菌(Faecalibacterium prausnitzii)产生的N-酰基酰胺具有的促进食欲作用。
广泛存在于人群的双面使者——Prevotella copri与疾病和健康
肠道核心菌属——普拉梭菌(Faecalibacterium Prausnitzii),预防炎症的下一代益生菌
微生物组如何预测心脏代谢健康?
利用微生物组预测饮食和特定营养素对心脏代谢健康影响的兴趣日益增长。例如,在一项涵盖2500名非洲裔人群的队列研究中,微生物组的α-多样性及特定微生物特征均与高血压、高血糖、肥胖和糖尿病相关联。
甜味剂案例:其影响依赖基线菌群
在最早的实例之一中,非营养性甜味剂糖精对葡萄糖耐量产生了有害影响(最初在小鼠中发现)。在人类中,这种影响被发现依赖于补充前的微生物组,这种关系最近也适用于其他非营养性甜味剂。
个性化饮食方案:微生物组指导的精准营养学
更广泛地说,2015年一项研究开发出一种机器学习算法,将人体数据和微生物组数据整合,从而预测个体对任何食物项目的餐后葡萄糖反应。
基于这种方法,23位糖尿病参与者的微生物组数据被用来预测“个体化餐后靶向”饮食,在改善葡萄糖指标和代谢健康参数方面显著优于地中海饮食,在一项随机试点研究中,61%的受试者实现了糖尿病缓解。
一项更大规模的随机对照试验(n = 347)开发了一套基于粪便微生物组和患者健康数据的“个性化饮食方案”,在包括甘油三酯、糖化血红蛋白(HbA1c)、体重和腰围等心脏代谢健康标志物方面显示出显著改善。
间歇性禁食 & 肠道菌群 & 心血管代谢疾病
基于微生物组的个性化营养干预可能是未来营养医学的主要发展方向,有望革新我们对慢性代谢疾病的预防和管理方法。
微生物组-神经免疫轴:心血管疾病的预防和治疗希望
饮食-肠道微生物群对心血管疾病的相互作用
03口腔微生物组口腔微生物群可能成为喉咙甚至肺部微生物的来源,因此是健康监测和干预的重要部位。
口腔菌群在肠道定植引发疾病
有趣的是,口腔微生物在肠道中的高水平通常与不良健康结局相关。例如,口腔菌具核梭杆菌(Fusobacterium nucleatum)在健康个体的胃肠道中很少有显著丰度,但当肠道微生态被破坏时,该菌种会在结肠定植,并通过其表面蛋白FAP2与结直肠癌肿瘤中高度表达的一种糖蛋白特异性结合,优先定位于结直肠腺癌。一旦与肿瘤共定位,具核梭杆菌可能通过激活癌细胞增殖加剧CRC的恶性程度,这一过程可能与其产生的甲酸促进芳香烃受体蛋白1(AHR1)信号通路中的TLR4激活有关。
一些研究表明,结直肠癌患者口腔和远端胃肠道肿瘤中发现的具核梭杆菌菌株是相同的,而另一些研究则认为结直肠肿瘤中的具核梭杆菌菌株与口腔菌株不同。这些机制为阻断肿瘤形成提供了多种机会,无论是通过噬菌体或CRISPR技术有针对性地去除该菌种,还是抑制促进转移的微生物代谢机制。
最近的研究表明,口腔中的微生物生物膜能够促进抗生素耐药性和远端炎症的发生,增加牙周病的风险,并降低抗菌治疗的效果。通过刷牙和使用抗菌牙产品来破坏这些生物膜可能是有益的,但也可能破坏口腔中的氮循环,从而降低血液中的一氧化氮水平,导致血管收缩和血压升高。
口腔微生物组还可用于疾病诊断
例如,口腔微生物组与特发性肺纤维化有关。口腔微生物多样性较低与特发性肺纤维化患者的肺功能和生存率较高相关,链球菌(Streptococcus )被确定为与较好预后相关的关键物种。用抗生素复方新诺明(磺胺类抗菌药)治疗患者会导致变异链球菌(Streptococcus mutans)的富集,该菌被认为与疾病进展恶化相关,表明使用抗生素还存在其他未预料到的代价。
其他研究显示,口腔微生态失衡和拟杆菌门的变化可通过对淀粉样β斑块形成的特定微生物驱动影响,成为阿尔茨海默病的风险因素,这或许可以通过治疗手段加以解决。
04肺微生物组肠-肺轴:远程控制如何影响肺部健康?
新兴研究正在揭示共生微生物影响肺部疾病的机制,包括直接作用于肺部和通过肠-肺轴的远程作用。
例如,临床研究表明,肠道微生物不仅能产生亚油酸,还能将其代谢为12,13-二羟基-9Z,15Z-十八碳烯酸,这种物质通过巨噬细胞效应功能、B细胞相互作用及表观遗传修饰,引发全身炎症,增强对过敏原的炎症反应,包括在肺部,从而加剧哮喘疾病。
慢性阻塞性肺疾病:肺内微生物的保护作用
——乳酸杆菌:肺部健康的守护者
关于慢性阻塞性肺疾病的一项研究表明,患病者肺内气道相关乳酸杆菌种类的缺失或活性降低与炎症、细胞凋亡及纤维化组织损伤有关。
——健康肺部的微生物代谢机制
而在健康对照组中,痰液内乳酸杆菌的丰富度与色氨酸代谢增加及吲哚-3-乙酸合成相关,这种代谢物通过AHR1介导的IL-22通路减轻了肺上皮的中性粒细胞炎症。
微生物靶向治疗——补充代谢物、菌群移植、噬菌体疗法
在小鼠模型中,无论是直接补充吲哚-3-乙酸,还是通过定植活乳酸杆菌于肺组织,都可改善肺功能并减少炎症,突出显示了以微生物—宿主相互作用为靶点的潜在治疗途径。
通过针对性移除引发疾病并发症的致病菌,或许也能实现对肺部微生物群的调控,例如,应用噬菌体疗法治疗囊性纤维化患者的下呼吸道感染
呼吸道病毒感染后,为何会引发细菌性肺炎?气道和肠道微生物组改变是关键
05皮肤微生物组皮肤是一个独特的界面,在这里宿主免疫细胞与多样的外源性微生物群落之间持续交流。
表皮葡萄球菌:抗菌抗炎
凝固酶阴性的葡萄球菌,尤其是表皮葡萄球菌,是调节皮肤免疫的关键参与者,其机制已被充分研究。这些细菌产生的产物具有抗菌、抗炎甚至抗肿瘤的作用,从而增强了先天和适应性免疫反应。
皮肤微生物的保护机制:脂质代谢与免疫调节
例如,皮肤细菌代谢皮脂生成短链脂肪酸,可抑制组蛋白去乙酰化酶的活性,而表皮葡萄球菌产生的脂磷壁酸可激活TLR通路,阻断与皮肤组织损伤相关的炎症,促进伤口愈合,并有助于这些有益微生物的生存。
这也提示特定皮肤共生菌可能成为候选治疗剂,其应用在近期临床试验中已展现出良好前景。
微生物疗法:皮肤疾病治疗的创新途径
例如,将人表皮葡萄球菌涂敷于皮肤可减少金黄色葡萄球菌的存活,从而改善特应性皮炎患者的病情。
类似,具有类似抗金黄色葡萄球菌活性和免疫激活潜力的粘液玫瑰单胞菌(Roseomonas mucosa) 和线状透明颤菌(Vitreoscilla filiformis)也被证明可以改善特应性皮炎的疾病结局。
这些研究成果推动了皮肤微生物疗法从实验室到临床应用的快速转化,为患者提供了新的治疗选择。
微生物组标志物的诊断价值
人类皮肤微生物组研究正促进可预测或诊断多种疾病状态的指标的开发。
皮肤感染的早期检测
特应性皮炎和银屑病的疾病活动度评估
与全身性衰弱状态相关的皮肤菌群特征
...
噬菌体疗法革新皮肤感染治疗
噬菌体疗法早于抗菌治疗出现,并且从20世纪初到今天一直用于治疗皮肤、口腔、肺部和胃肠道的感染。许多公司曾成立以推广这些疗法,其中一些至今仍以健康、美容或制药公司的形式存在。
噬菌体疗法目前在治疗系统性细菌感染方面具有很高的转化潜力。
一项回顾性研究对2008年至2022年间来自12个国家35家医院的难治性感染病例进行了个体化噬菌体疗法的评估,结果发现:
噬菌体疗法使77.2%患者临床症状得到改善
并在61.3%的患者中清除了目标细菌
当与抗生素联合应用时,清除率提升到70%
这项研究不仅强调了抗生素的协同作用,也突出了噬菌体耐药性的出现,强调今后在临床试验中需要采用个体化的方法来应对这一问题。
随着我们对皮肤微生物组的理解不断深入,未来可能出现更加个性化的皮肤健康管理方案:
皮肤健康微生物指数的开发
基于个体微生物组特征的定制化护肤品
针对特定皮肤问题的微生物干预策略
环境暴露的动态监测体系建立
微生物代谢产物的靶向调控
皮肤-肠道轴的整体干预
预防性微生物管理,维持皮肤健康平衡
随着微生物组研究的不断深入,基于微生物组的新型预防和诊疗手段正在逐步推动临床实践的变革,其中肠道菌群检测作为关键工具正在帮助科学家突破研究瓶颈。
但仍然存在许多挑战。
确定可以由医生测量、用于诊断疾病或作为治疗成功预后的特定微生物特征范围,依然是一项艰巨的挑战。
造成这一现象的主要原因包括:个体之间及种群间在菌株水平上的功能变异、微生物组成和结构存在显著的地理差异、缺乏纵向分析以解释特征丰度的时间波动从而证明其真实存在或缺失,以及缺乏对微生物特征的定量测量。
目前已经比较可靠的可以预测微生物组如何影响我们对特定影响因素(包括生活方式、营养、药物和时间等)的生理反应(除少数明显的例子外如使用抗生素或精准噬菌体疗法治疗特定感染)。
随着人体微生物组的研究越来越深入,科学家们不再只是发现微生物组与疾病之间的关联,而是开始探索它们之间的因果关系,研究微生物之间的相互作用,以及它们如何与人体互动,这使得基于微生物组的治疗和诊断方法的临床转化风险显著降低,帮助更好地选择药物靶点和确定适合治疗的患者群体。
未来的研究将进一步完善目前的理解,为利用人体微生物组力量的新型诊断、预防和治疗方法铺平道路。期待有足够的后端干预或精准药物等来实现对微生物组的精准调控以改善健康或提供治疗效果。
主要参考文献
Gilbert JA, Azad MB, Bäckhed F, Blaser MJ, Byndloss M, Chiu CY, Chu H, Dugas LR, Elinav E, Gibbons SM, Gilbert KE, Henn MR, Ishaq SL, Ley RE, Lynch SV, Segal E, Spector TD, Strandwitz P, Suez J, Tropini C, Whiteson K, Knight R. Clinical translation of microbiome research. Nat Med. 2025 Apr;31(4):1099-1113.
Schmartz, G. P. et al. Decoding the diagnostic and therapeutic potential of microbiota using pan-body pan-disease microbiomics. Nat. Commun. 15, 8261 (2024).
Piperni, E. et al. Intestinal Blastocystis is linked to healthier diets and more favorable cardiometabolic outcomes in 56,989 individuals from 32 countries. Cell 187, 4554–4570 (2024).
Lev-Sagie, A. et al. Vaginal microbiome transplantation in women with intractable bacterial vaginosis. Nat. Med. 25, 1500–1504
(2019) fda.gov/media/82945/download
Benoit, P. et al. Seven-year performance of a clinical metagenomic next-generation sequencing test for diagnosis of central nervous system infections. Nat. Med. 30, 3522–3533 (2024).
本文转自:谷禾健康
https://wap.sciencenet.cn/blog-2040048-1489119.html
上一篇:[转载]广泛存在于人群的双面使者——Prevotella copri与疾病和健康
下一篇:[转载]植物多糖代谢专家——卵形拟杆菌(Bacteroides ovatus)影响神经递质水平及健康