博文
死亡红细胞的黏性膜阻塞小血管  精选
精选
|
死亡红细胞的黏性膜阻塞小血管
血管内皮损伤引发与红细胞的相互作用,为治疗心脏病发作、中风和COVID-19的危险并发症提供线索
在多种危及生命的疾病中,血管内皮(血管内壁)会受到损伤。《自然》杂志上,Wu 等人的研究表明,濒临死亡的内皮细胞会直接诱导红细胞破坏。这些破裂细胞的残骸随后像胶水一样黏附在内皮上,并聚集更多红细胞,阻塞脑、肺和肾脏等重要器官的小血管。
微血管阻塞的机制与矛盾现象
微血管(人体内最小的血管)阻塞发生在许多疾病中,包括心脏病发作、中风、败血症和重症COVID-19,且与高重症率和死亡率相关²³。尽管潜在机制尚不明确,但通常认为该路径涉及内皮损伤和凝血系统过度激活,进而导致微血管阻塞和缺血(器官和组织的血流及氧气供应中断)。有趣且矛盾的是,微血管阻塞在缺血一段时间后血流恢复时(即缺血-再灌注损伤)更为明显。
Wu 及其团队在这一过程中发现了一个意外的缺失环节。他们利用体内小鼠模型、体外实验和人体尸检组织样本(以重症COVID-19作为缺血-再灌注损伤的典型疾病模型)开展了一系列全面的跨学科实验。研究发现,缺血损伤后内皮细胞死亡时,会通过溶血(类似气球爆裂的过程)诱导附近红细胞破坏。这些破裂红细胞的膜随后在内皮上形成类似胶水的黏附层,溶血红细胞的堆积最终导致微血管阻塞。
细胞死亡与补体系统的作用
作者指出,缺血发生时,内皮细胞会经历一种称为坏死性凋亡(necroptosis)的细胞死亡类型。这种程序性“细胞自杀”涉及一系列有序的级联事件,最终导致内皮细胞中MLKL蛋白的激活。MLKL随后激活血液中循环的补体系统蛋白。补体系统被触发后,这些蛋白会组装成复合物(通常在病原体或受损细胞的膜上形成以确保其被破坏)。然而,在缺血诱导的坏死性凋亡中,补体级联会攻击濒临死亡的内皮细胞附近的红细胞,引发溶血、红细胞“栓子”形成和微血管阻塞。
红细胞与内皮损伤的关联网络
作者的发现进一步拓展了红细胞与内皮损伤相互关联的机制。例如,在镰状细胞病中,由于影响血红蛋白的基因突变,红细胞形状和功能异常。数十年来,科学家已知这些异常红细胞的黏附特性会促进内皮损伤,进而导致血管阻塞和缺血。但研究还发现,红细胞通过其他机制参与内皮损伤⁴⁵。
- COVID-19中的红细胞聚集:重症COVID-19患者的红细胞过度聚集已被证实会损伤内皮糖萼⁶(内皮表面富含蛋白质和糖类的层,与血液中循环因子相互作用)。Wu 团队在分析的尸检样本中也观察到内皮糖萼损伤的证据。红细胞聚集在血流缓慢时尤为明显,这与作者在低流量条件下观察到红细胞栓子形成的结果一致。
- 红细胞变形能力的影响:红细胞的变形能力是其通过微小毛细血管的关键。在镰状细胞病和缺铁性贫血等疾病中,红细胞膜硬度增加会导致内皮细胞表面整合素和其他黏附分子的表达。这些蛋白被认为是信号分子的受体,可能参与Wu 团队发现的坏死性凋亡通路⁷⁸。
计算模型与低剪切应力的作用
这些临床和体外观察得到了计算模型的支持。模型显示,异常红细胞膜硬度和聚集会影响剪切应力(血液及其成分流经表面时施加的力),而剪切应力是内皮细胞健康的重要调节因素⁹¹⁰。综合来看,先前描述的红细胞变化会加剧内皮损伤,而Wu 等人的研究表明,这种损伤可能引发内皮细胞诱导的溶血和后续微血管阻塞,尤其是在低剪切应力条件下(图1)。
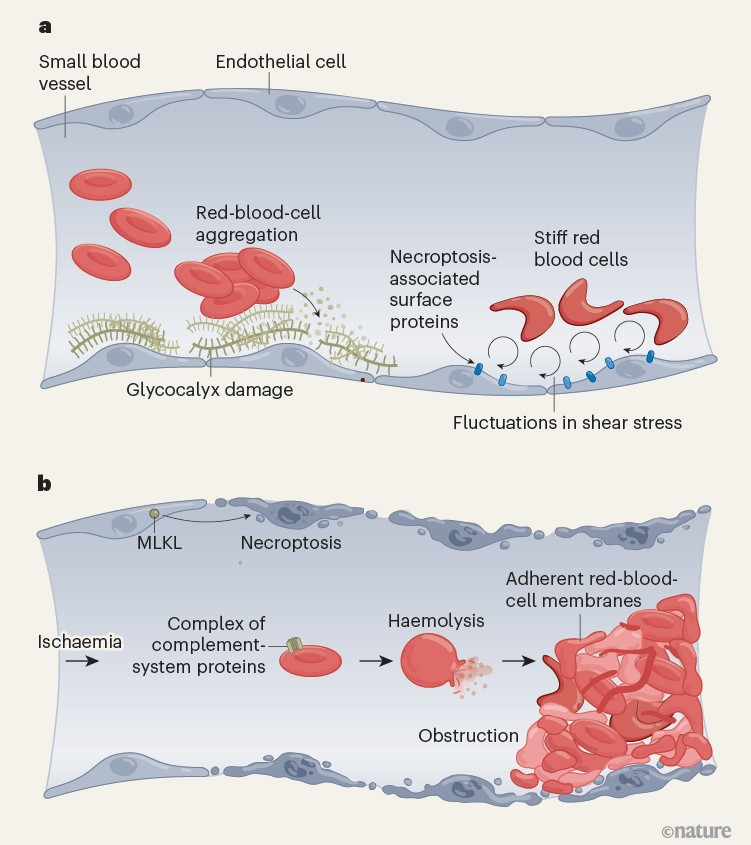
图1 | 小血管阻塞机制
a. 红细胞与血管内皮细胞的相互作用为微血管阻塞奠定基础。例如,红细胞过度聚集会机械性损伤包裹内皮细胞的糖萼层,使其易受损伤。此外,红细胞的病理性硬化(如镰状细胞病中)会导致细胞贴近血管壁,改变血流模式。这些改变引发剪切应力(血流对血管表面施加的力)波动,促使内皮细胞表达与坏死性凋亡(necroptosis)相关的细胞表面蛋白。
b. 矛盾的是,微血管阻塞可在缺血(血流中断)后恢复供血时发生。Wu 等人¹发现,在缺血导致的低剪切应力、低氧和酸性条件下,内皮细胞会发生由MLKL蛋白介导的坏死性凋亡。这触发补体系统免疫蛋白在红细胞表面形成复合物,导致红细胞破裂(溶血)。红细胞膜的黏性残骸在内皮表面堆积,阻塞血管并引发进一步缺血。
研究局限与未解问题
尽管Wu团队对缺血后微血管阻塞的机制提出了突破性见解,但研究仍存在一些局限:
- 器官特异性差异:在尸检研究中,作者注意到不同器官系统因凝血导致的血管阻塞程度不同,但未解释其原因。有趣的是,在COVID-19患者中,尽管肺部是重症患者受影响最严重的器官之一,但红细胞介导的微血管阻塞在肺部却最不显著。这种器官受累差异表明,某些器官的微血管床可能比其他器官更容易发生本研究描述的阻塞类型。
- 坏死性凋亡通路的上游机制:尽管作者证实了MLKL功能在诱导溶血中的重要性,并显示坏死性凋亡改变与红细胞栓子形成存在空间相关性,但未探究MLKL激活的上游通路以确认这种细胞死亡形式是否为直接机制。MLKL可能通过其他途径参与红细胞溶血¹¹。
临床启示与治疗前景
这项研究的临床潜在影响广泛:
- 传统治疗的局限性:传统观点认为,微血管阻塞是凝血通路(包括纤维蛋白沉积和血小板在内皮损伤部位聚集)的产物,且会加重病情。但靶向这些通路的治疗尚未持续改善临床结局¹²。
- 新治疗靶点:Wu团队的发现提出了一条新通路——通过阻断内皮细胞对红细胞破裂的作用,改善缺血状态下的微血管血流和氧气供应。但正如作者指出,任何治疗都必须在预防出血和避免过度凝血之间谨慎平衡。值得注意的是,坏死性凋亡表面的红细胞堆积可形成“密封层”,防止内皮损伤部位失血。进一步揭示该通路机制并测试抑制效果,可能为多种危及生命的疾病治疗带来重大进展。
Ischaemic endothelial necroptosis induces haemolysis and COVID-19 angiopathy
微血管病变是SARS-CoV-2感染的主要并发症,并可导致疾病的急性和慢性后遗症¹。在COVID-19中,内皮病变和凝血功能失调显著,被认为是微血管阻塞的主要原因¹²。本研究发现,COVID-19患者器官的微血管中存在广泛的内皮细胞(EC)死亡。值得注意的是,内皮细胞死亡与纤维蛋白形成或血小板沉积无关,而与微血管红细胞(RBC)溶血相关。重要的是,这种红细胞微血管病变与缺血-再灌注损伤相关,并在心肌梗死、肠道缺血、中风、脓毒性和心源性休克患者的微血管中显著存在。 从机制上讲,缺血诱导了MLKL依赖性内皮细胞坏死性凋亡和补体依赖性红细胞溶血。在 endothelial cell死亡部位沉积的溶血红细胞膜形成了一种此前未被认识的止血机制,可防止微血管出血。这种溶血反应的过度激活会促进红细胞聚集和微血管阻塞。内皮细胞中Mlkl基因的缺失可减少红细胞溶血、微血管阻塞,并减轻缺血性器官损伤。 我们的研究证实,死亡的内皮细胞可诱导一种独立于血小板和纤维蛋白的红细胞止血机制。靶向这一溶血过程的治疗可能减少COVID-19及其他与器官缺血相关的重大人类疾病中的微血管阻塞。
https://wap.sciencenet.cn/blog-41174-1489058.html
上一篇:氢气对烧伤后脓毒症治疗效应
下一篇:阿弥陀佛:中国寺院的生态价值!