博文
必需脂肪酸衍生物和阿尔茨海默病  精选
精选
|
尽管淀粉样蛋白和tau蛋白病变一直是研究的重点,但驱动阿尔茨海默病的答案,会不会存在于那些通常保护大脑的机制之中呢?
由《自然》研究定制媒体、路易斯安那州立大学制作
一幅由计算机渲染的相连神经元网络图,图中可见明显的错误折叠蛋白团块。
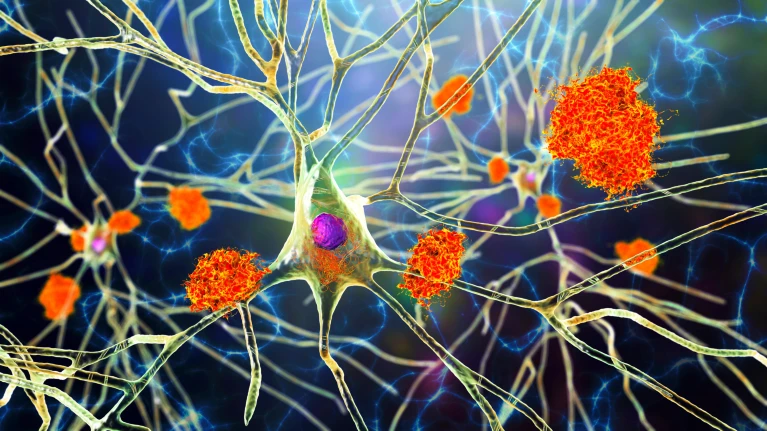
阿尔茨海默病的典型特征是神经元周围出现淀粉样蛋白斑块,以及神经元内部形成tau蛋白缠结。但这些现象的出现,会不会是神经保护机制失效所导致的呢? 图片来源:卡特琳娜·孔/科学图片库/盖蒂图片社
路易斯安那州立大学(LSU)新奥尔良健康科学中心的神经科学家尼古拉斯·巴赞(Nicolas Bazan)表示:“要解开阿尔茨海默病(AD)之谜,我们必须了解健康的大脑是如何保护自身免受损伤和病变的。我们需要确定是什么维持了健康衰老过程中突触的连接性和完整性,并且了解在阿尔茨海默病开始及发展时,这些过程是如何失效的。”
巴赞对阿尔茨海默病的研究走了一条与许多同行不同的道路。他的实验室没有专注于该疾病的病理特征——淀粉样β蛋白(Aβ)和tau蛋白,而是探索了一组称为脂质介质的信号分子,以及它们在阿尔茨海默病状态下的水平变化。
巴赞说:“我们正在探索这样一种理论,即随着阿尔茨海默病病理特征的形成,产生某些具有神经保护作用的脂质介质的途径会崩溃。” 这种神经保护作用的丧失,为Aβ和过度磷酸化的tau蛋白的毒性积累以及相关炎症提供了可乘之机,损害了神经元之间相互交流的能力。
如果这一理论被证明是正确的,那么增强这些神经保护分子的疗法,就有可能减缓甚至阻止阿尔茨海默病的进展以及随后出现的痴呆症状。
阿尔茨海默病的复杂世界
加利福尼亚西部健康科学大学的神经科学家米歇尔·鲍德里(Michel Baudry)说:“尽管成千上万的科学家不懈地努力去了解阿尔茨海默病的病理,但仍有许多未知有待探索。” 鲍德里本人的神经学研究已经有40年的历史,他是与学习和记忆相关机制方面的专家。他也在研究神经保护分子及其治疗潜力。
阿尔茨海默病是导致痴呆的最常见原因。它会导致大脑的某些部分萎缩,进而导致记忆力丧失、灰质减少以及认知功能下降。Aβ在神经元之间形成斑块,而过度磷酸化的tau蛋白则在神经元内部积累形成缠结。这两者都会损害神经元的功能和信号传导过程。目前尚不清楚Aβ和tau蛋白在疾病过程中究竟是如何相互作用的,同样也不清楚最初是什么引发了这些有毒物质的积累。
鲍德里说:“阿尔茨海默病的复杂性,还因为众多的遗传、生活方式和环境因素对其进展的影响而加剧。”
巴赞说:“随着年龄的增长,身体中慢性炎症会逐渐积累,再加上氧化应激的影响,这真是多种因素交织在一起。” 直到最近,科学家们还在努力创建能够准确复制人类阿尔茨海默病进展过程的动物模型。
大鼠与小鼠
尽管小鼠模型一直是用于深入了解阿尔茨海默病的传统工具,但研究人员现在开始认识到大鼠的价值。巴赞与阿尔茨海默病专家克劳迪奥·库埃洛(Claudio Cuello)有着密切的合作,库埃洛与索尼娅·多·卡莫(Sonia Do Carmo)及同事们在加拿大蒙特利尔的麦吉尔大学开发转基因动物模型。
库埃洛说:“在模拟阿尔茨海默病方面,大鼠比小鼠有几个优势。它们的大脑更大,组织结构也更复杂。大鼠的大脑会像人类一样在出生后继续发育。它们也具有很强的社交性,并且在应对认知挑战方面比小鼠表现得更好,这使得在不同的类似阿尔茨海默病病理阶段测试它们的认知能力变得更加容易。”
库埃洛的团队开发了几种阿尔茨海默病大鼠模型:一种可以复制Aβ病理的发展轨迹,另外两种则可以复制tau蛋白病理的不同方面。麦吉尔大学的tau转基因大鼠表现出了类似于人类的tau蛋白的强劲、渐进性积累,从14个月大时开始,认知能力下降速度加快。
巴赞说:“库埃洛的模型重现了人类类似阿尔茨海默病的淀粉样蛋白和tau蛋白病理,从疾病的发作到晚期,呈现出一个详细的连续过程。”
库埃洛补充道:“我们的合作是双向的。巴赞的研究方法精准而巧妙,尤其是在单细胞转录组水平上的深入见解,对于揭示阿尔茨海默病病理的病因和发病机制来说是无价的。”
揭示神经保护机制
巴赞对理解阿尔茨海默病病理的首批贡献之一,是他在2005年发现了一种具有神经保护作用的脂质介质——神经保护素D1,它源自饮食中的ω-3脂肪酸。神经保护素D1在大脑的记忆区域表达,它可以阻断促炎基因,减少Aβ的分泌,并上调抗凋亡基因,从而限制神经元损伤。他发现,在阿尔茨海默病早期的患者中,神经保护素D1的含量大幅减少。
2017年,巴赞的实验室进一步深入研究保护性脂质,发现了一组短暂存在但效力很强的分子——爱诺烷类物质,同样源自ω-3脂肪酸。爱诺烷类物质在大脑和眼睛的细胞受到损伤后立即产生,并在疾病发作时保护神经元和突触。
脂质介质可以根据它们对炎症的影响进行分类。爱诺烷类物质和神经保护素D1属于 “促体内平衡” 类,因为它们有助于控制炎症反应,而其他脂质介质则是促炎的,并会破坏体内平衡。
由于慢性神经炎症是阿尔茨海默病的另一个特征,该团队转而研究患有这种疾病的人体内的脂质介质。巴赞的实验室在136名参与者(包括阿尔茨海默病患者和有轻度至重度认知障碍的人)的脑脊液中筛选了22种不同的脂质介质。
巴赞说:“我们发现,随着认知障碍的加剧,患者的脂质介质谱会从促体内平衡状态明显转变为促炎状态。这表明患者的脂质介质谱可以用作生物标志物,以显示他们的阿尔茨海默病进展到了何种程度。”
阿尔茨海默病是一种tau蛋白病
巴赞的团队正在使用库埃洛的大鼠模型,来确定在阿尔茨海默病发作和进展过程中参与神经保护的确切细胞、信号通路和基因。他们正在使用机器学习算法来分析由单细胞和空间转录组学产生的大量数据集。
作为这个项目的一部分,巴赞扩大了对脂质介质谱的研究范围,以确定Aβ或tau蛋白病变对大脑炎症的影响哪个更强。
巴赞说:“在tau蛋白模型中,随着过度磷酸化的tau蛋白积累,症状会急剧加速恶化,包括炎症,这在Aβ模型中并不那么明显。我坚信阿尔茨海默病是一种tau蛋白病:我们的研究结果表明,tau蛋白的积累是认知能力下降和灰质减少的主要原因。”
极具潜力的治疗方法
现在的关键问题是,爱诺烷类物质是否能够在tau蛋白积累的情况下增强神经元的恢复能力,对抗炎症,并阻止细胞衰老。
该团队在阿尔茨海默病小鼠模型中尝试了一种很有前景的方法,给它们鼻腔内滴入含有神经保护素D1等促消退脂质介质的混合物。这种非侵入性治疗减少了小鼠大脑的炎症,并逆转了它们的记忆缺陷。
巴赞说:“我们认为,爱诺烷类物质有助于加强神经网络和细胞间的通讯,在细胞之间建立建设性的对话,从而保护突触。”
巴赞并不是唯一一个看到这些脂质介质潜力的科学家。鲍德里总结道:“爱诺烷类物质可能会对阿尔茨海默病的治疗产生巨大影响。增强患者体内的爱诺烷类物质水平,可能会减缓疾病的病理发展并减少认知能力下降。”
https://wap.sciencenet.cn/blog-41174-1483579.html
上一篇:饮用氢气纳米气泡水辐射防护作用研究【日本2025】
下一篇:肠道衰老的微生物分子促使造血干细胞走向癌变