博文
微生物拆除肠道防御
|
免疫系统成分的丰度在健康个体之间可以有显著差异。例如,在同一饲养设施中的小鼠之间观察到粪便免疫球蛋白A(IgA)水平存在很大差异(1)。通常,这种变异被归因于宿主遗传学、年龄以及微生物组成和病原体的识别。然而,为了自身利益而改变这一系统的微生物在很大程度上被忽视了。在本期第1436页上,Lu等人(2)报告称,小鼠肠道中的一种肠道细菌Tomasiella immunophila符合引起低肠IgA水平的致病因子的标准。T. immunophila释放出具有免疫球蛋白蛋白酶活性的囊泡,这些囊泡足以在体外和体内降低IgA水平。这种由肠道共生菌对宿主黏膜免疫进行剧烈操纵的现象特定于啮齿动物的免疫球蛋白,突显了研究与共同进化宿主相关的肠道微生物功能的重要性。
有大量证据表明肠道细菌会诱导肠IgA的产生。例如,无菌小鼠(没有肠道细菌)的粪便IgA水平比常规小鼠低10倍(3);用单一生物如分节丝状菌Morganella morganii或复杂微生物群落进行定植会导致快速招募产生IgA的浆细胞并提高粪便IgA水平(4, 5)。此外,将活体细菌从肠道携带到肠系膜淋巴结的树突状细胞会诱导B细胞的初步激活和类别转换,以生产针对微生物组特异性的IgA(6)。
肠道细菌通过降解IgA导致小鼠免疫缺陷
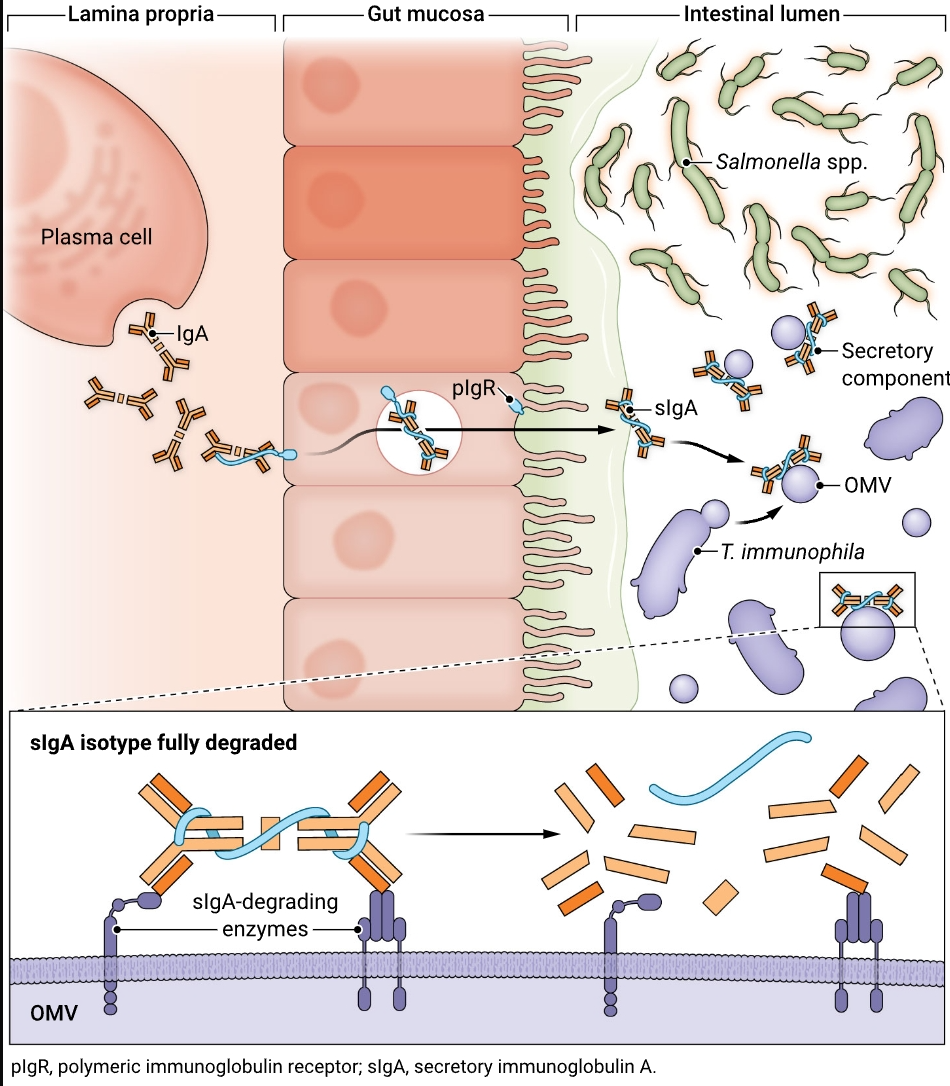
Tomasiella immunophila产生的外膜囊泡(OMVs)完全降解肠道腔内的肠IgA,阻止IgA介导的对沙门氏菌等病原体的保护。
Lu等人分析了高粪便IgA和低粪便IgA的小鼠粪便微生物培养物的IgA降解能力,发现来自低IgA小鼠的微生物群落能迅速降解IgA。他们使用高通量培养方法(culturomics)从整个培养的粪便社区缩小到保留此功能的逐步简化的子样本社区。通过宏基因组测序和代谢功能分析,确定了分离出具有IgA降解活性的新Muribaculaceae物种所需的培养基条件,并将其命名为T. immunophila。纯培养菌株的电子显微镜检查显示,大量的外膜囊泡产生了IgA降解活性,并通过分级定位。T. immunophila降解所有小鼠抗体同种型,优先降解kappa轻链。IgG同种型仅降解至Fc部分,而IgA则完全消化。这种程度的蛋白水解尚未描述过其他细菌蛋白酶(7)。目前尚不清楚这是否需要糖苷酶和蛋白酶活性,或者是否残留一些小型糖肽(见图)。尽管应用了蛋白质组学和重组生产的外膜囊泡蛋白检测,Lu等人无法确认负责该活性的基因和蛋白质。
T. immunophila降解IgA的功能是什么?共轭微生物结合IgA互补决定区表面暴露的表位对定植可能有正面或负面影响(8)。抗体和细菌之间也发生一系列非共轭相互作用(8)。金黄色葡萄球菌蛋白A和蛋白G结合IgG恒定区,用宿主蛋白包裹细菌,帮助免疫逃逸。链球菌产生一种IgA蛋白酶,在铰链区域切割小鼠IgA和人类IgA1,这一过程被认为有助于免疫逃逸(9, 10)。
除了免疫逃逸,理论上IgA降解可以在大肠生态系统中提供一个私有的代谢生态位(11)。分泌性IgA(SIgA)是一种大型、高度糖基化的蛋白质,对哺乳动物蛋白酶具有很强的抵抗力(12)。SIgA的蛋白质主干和N-和O-聚糖都可以作为细菌生长的碳和氮源。尽管对黏蛋白的宿主蛋白和聚糖的掠夺已被广泛研究(13),但尽管SIgA在肠道内容物中含量丰富且组成相似,对其降解的关注却很少。
T. immunophila具有高度免疫原性,这表明免疫逃逸可能在功能上很重要。然而,在IgA缺乏的小鼠中,肠道定植水平低于IgA充足的小鼠,这可能与生成私有代谢生态位一致。需要进一步的工作来确定维持这种功能在细菌中的进化驱动力。尽管如此,Lu等人提供了充分数据,表明这种活动对宿主有害。T. immunophila的存在降低了口服疫苗对小鼠沙门氏菌鼠伤寒和白色念珠菌的保护作用。很可能降解IgA还会改变IgA介导的对更具侵袭性的微生物组分以及肠道病毒的控制,从而影响慢性炎症和反复感染。换句话说,Lu等人已经证明单个细菌可以在肠道中产生免疫缺陷。
值得注意的是,T. immunophila产生的蛋白酶对人类抗体不活跃,表明存在强烈的宿主适应性。围绕使用“特定病原体自由”小鼠的问题进行了广泛讨论——即实验室小鼠的典型卫生状态(14)。可以使用不同的方法来多样化这种微生物组,包括转移人类粪便细菌以生成“人类化微生物组”小鼠,或使用野生小鼠的微生物组来重建多样化的微生物组,这两者都能改善实验小鼠的免疫系统成熟度(14)。Lu等人的发现表明,在研究非原生宿主物种的肠道微生物时应该保持一定程度的谨慎,并为聚焦于野生小鼠微生物组的功能研究提供了一个很好的论据。
问题仍然存在,即人类肠道微生物组中是否存在降解人类免疫球蛋白的细菌,以及是否与人类的低IgA表型有任何关联。由于Lu等人无法确定负责IgA降解能力的蛋白质和基因,目前还不可能应用生物信息学来解决这一问题。然而,诸如有限蛋白水解质谱等技术应该在后续工作中允许这样做(15)。一般来说,如果只有小鼠肠道细菌进化出利用肠IgA的能力,那将是令人惊讶的。通过鉴定血清IgA正常但粪便IgA低的人类,然后应用Lu等人使用的相同分离和功能追踪程序,可以分离出适应人类的降解免疫球蛋白的微生物。任何适应人类的免疫球蛋白降解微生物都将是微生物组工程中非常有趣的目标。 将微生物组研究从观察性相关研究转移到机制理解所需的大量工作仍然令人生畏。然而,Lu等人的研究在理解微生物-免疫系统相互作用方面代表了一个值得注意的、意想不到的谜题。
https://wap.sciencenet.cn/blog-41174-1452904.html
上一篇:比较基因组分析提供了心肌调节的机制线索
下一篇:NIH顶级官员是否操纵了数十年神经退行性疾病研究?《科学》报道