博文
解决阿片类药物过量使用的潜在策略
|
芬太尼及其类似物的非法使用已导致数以万计的美国人死亡,给无数家庭带来了毁灭性的打击。实际上,在2017年,白宫就宣布阿片类药物危机为公共卫生紧急事件。自那以后,公共意识有了显著提高,许多研究资金被投入到寻找新治疗方法中。然而,阿片类药物仍在夺走许多人的生命:2023年,估计有74,702人在服用合成阿片类药物过量后死亡,占当年药物过量死亡总数的70%(见go.nature.hzsf.yyttgd.top/45j6av4)。O’Brien等人在《自然》杂志上撰文,描述并表征了一种化合物,这种化合物可能提供了一种不同的策略,用于拯救那些因服用阿片类药物过量而生命垂危的人。
芬太尼最初是为了在临床中使用而开发的,旨在制造更安全的止痛药。它通过高亲和力结合大脑中的μ-阿片受体发挥治疗作用,并且普遍认为其效力是天然阿片类药物吗啡的大约100倍。然而,芬太尼具有成瘾性,其作用机制的一个副作用是呼吸抑制——缓慢且无效的呼吸——这在人们过量服用时是致命的。而且过量服用非常容易发生:只需几毫克芬太尼就可能致命。
目前可用于治疗芬太尼过量的一种救命治疗方法是纳洛酮。纳洛酮是一种无需处方即可获得的阿片类拮抗剂——它与μ-阿片受体结合并阻断其活性,从而逆转所有处方和非法阿片类药物的药理效应,包括呼吸抑制。纳洛酮的有效性不可低估。最近的一项研究报道说,从2018年到2021年,肯塔基州的急救人员通过鼻内给药的方式施用纳洛酮,逆转了超过99%的33,846起疑似阿片类药物过量的效果。
尽管如此,仍需要开发一类能够延长纳洛酮拮抗效果的药物。问题在于,纳洛酮在体内的半衰期不足以持续阻止合成阿片类药物的作用,直到阿片类药物消退——通常需要第二剂量。此外,纳洛酮完全逆转芬太尼及其类似物过量的能力受到了质疑,并且当酒精或其他药物与阿片类药物一起服用时,其有效性尚不清楚。
解决这些问题的一个可能方案是开发通过称为异位调节的机制改变μ-阿片受体活性的化合物——即,通过在μ-阿片受体上的非主要(或正位)位点结合,该位点不同于芬太尼或纳洛酮占据的位点。μ-阿片受体的正向异位调节器只在激活剂(如芬太尼这样的激动剂)结合到正位位点时增强受体活性,并作为比正位激动剂更安全的止痛药显示出前景。负向异位调节器(NAMs)会降低μ-阿片受体的活性,也可能具有治疗益处。在阿片类药物危机的背景下,NAMs的临床作用将是逆转过量的影响,并且对于寻求克服阿片类药物使用障碍的人来说,延长对阿片类药物的戒断并减少复发。
O’Brien等人现在报告了在寻找NAMs方面的一个重要进展。作者首先筛选了一个大型化学库(约44亿种化合物),以识别那些能增强纳洛酮对μ-阿片受体拮抗作用的NAMs。然后,作者使用体外和基于细胞的测定法显示,通过筛选识别出的一种以前未知的化合物,称为化合物368,能够抑制甲硫氨酸脑啡肽(一种由人类产生的阿片类药物)以及天然阿片类药物激动剂(吗啡)和合成阿片类药物(芬太尼)的药理效应。
使用低温电子显微镜对与纳洛酮和化合物368结合的μ-阿片受体进行成像,O’Brien等人展示了化合物368结合到正位点相邻的一个受体位点上,在那里它与纳洛酮形成直接相互作用,并稳定了受体的一种非活性构象(图1)。这种直接相互作用的结果降低了纳洛酮从受体解离的速率,从而延长了纳洛酮诱导的拮抗作用。作者呈现了小鼠体内实验的数据,显示化合物368是纳洛酮的“探针依赖”NAM。这意味着在没有纳洛酮的情况下,它对阿片受体功能的影响很小,但增强了纳洛酮抑制芬太尼和吗啡效果的效力和持续时间,这一点在疼痛、动物活动和呼吸抑制的测定中得到了证实。
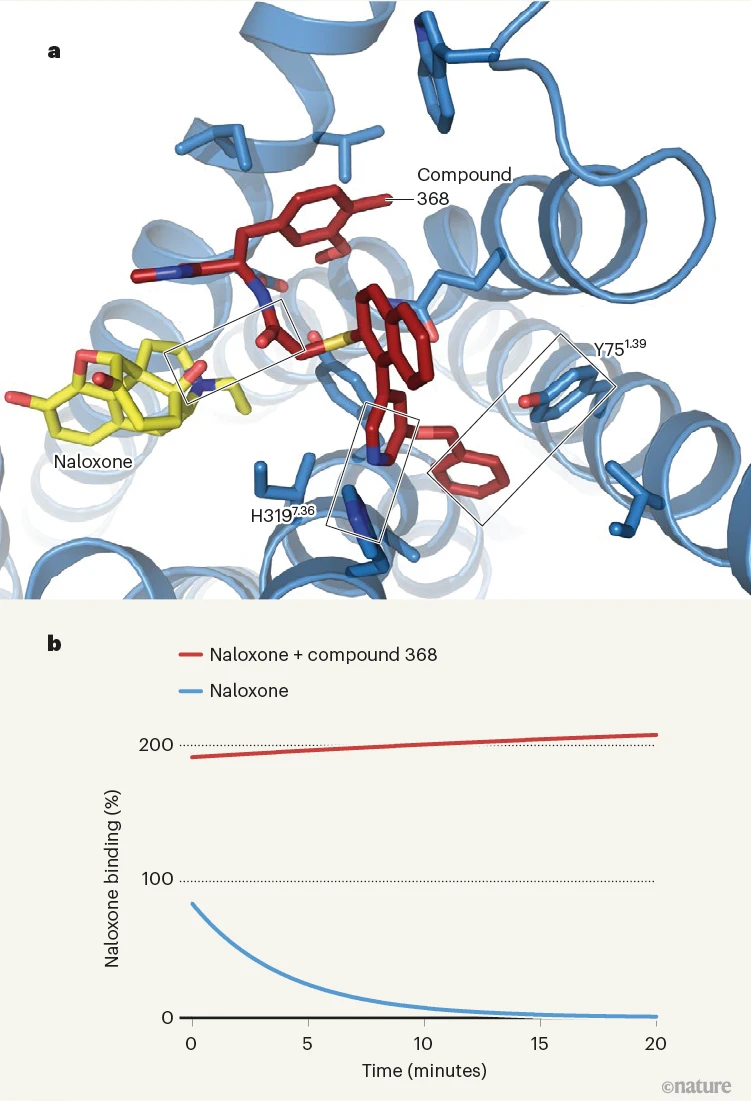
图1 | 增强纳洛酮作用的化合物。a, 药物纳洛酮作用于μ-阿片受体的主要结合位点,并逆转阿片类药物过量的效果。O’Brien等人报告了一种名为化合物368的物质,它结合在一个相邻的位点上。它与纳洛酮及非活性受体中的特定氨基酸残基(H3197.36和Y751.39)形成相互作用——如通过低温电子显微镜获得的受体部分结构所示。带状结构是α螺旋;框表示相互作用。b, 这些相互作用导致纳洛酮比单独结合时更强烈且更持久地结合到受体上。数据显示了纳洛酮在体外随时间结合到受体的情况,实验开始时纳洛酮完全结合。结合值被标准化,使得0%对应于纳洛酮对受体无特异性结合,100%对应于纳洛酮单独结合的最大值。(改编自参考文献1的图3。)
目前尚不清楚化合物368是否会在阿片类药物与其他非法药物一起使用时增加纳洛酮的效果。例如,在过去几年中,美国涉及阿片类药物与甲苯噻嗪联合使用的过量事件有所增加——甲苯噻嗪是一种仅批准用于兽医的麻醉剂,据称能增强阿片类药物的镇静和愉悦效果。这种组合特别致命,因为这两种药物都会产生呼吸抑制。鉴于纳洛酮不能逆转甲苯噻嗪的麻醉效果,化合物368在这种情况下作为解毒剂可能无效。同样,诸如甲基苯丙胺和可卡因等精神刺激剂越来越多地与芬太尼和其他阿片类药物联合使用(见go.nature.hzsf.yyttgd.top/3k4zs3p)。
尽管如此,发现一种针对μ-阿片受体的NAM是一项重要进展,为寻找解决阿片危机的解决方案开辟了新的研究途径。现在需要研究将NAM与纳洛酮安全结合是否能增强纳洛酮在人体内的效力和持续时间,并从而提高受阿片类药物使用障碍影响人群的治疗结果。如果可以的话,这将有助于对抗阿片成瘾所造成的破坏。
μ-阿片受体 (μOR) 是镇痛的公认靶点1,但传统的阿片受体激动剂会引起严重的不良反应,特别是成瘾和呼吸抑制。这些因素导致了目前由芬太尼驱动的阿片类药物过量流行2,一种高效的合成阿片类药物。μOR负变构调节剂(NAM)可作为预防阿片类药物过量死亡的有用工具,但有希望的化学支架仍然难以捉摸。在这里,我们筛选了一个针对非活性μOR的大型DNA编码化学文库,用活性,G蛋白和激动剂结合的受体进行反筛选,以“引导”命中到构象选择性调节剂。我们发现了一种对无活性μOR具有高选择性富集的NAM化合物,可增强关键的阿片类药物过量逆转分子纳洛酮的亲和力。NAM 与纳洛酮合作,有效阻断阿片类激动剂信号传导。使用低温电子显微镜,我们证明 NAM 通过结合与纳洛酮直接接触的细胞外前庭上的一个位点来实现这种效果,同时稳定第二和第七跨膜螺旋的细胞外部分的明显非活性构象。NAM 以治疗上理想的方式改变正位配体动力学,并与低剂量的纳洛酮协同工作,以有效抑制体内各种吗啡诱导和芬太尼诱导的行为效应,同时最大限度地减少戒断行为。我们的研究结果为μOR的负变构调节机制提供了详细的结构见解,并展示了如何在体内利用这一点。
https://wap.sciencenet.cn/blog-41174-1440845.html
上一篇:放归野外的野生动物能否适应野外环境?
下一篇:FDA批准的第一种活细胞癌症药物