氢镁联合更肥美!
已有研究表明,镁肥与氢肥可促进植物生长并提高代谢产物产量。镁与氢协同施肥是促进植物生长及次生代谢的潜在策略,但该策略在可产生多种单萜吲哚生物碱(monoterpenoid indole alkaloids, MIAs)的长春花(*Catharanthus roseus* (L.) G.Don)中的应用尚未见报道。本研究通过温室实验设置5个处理组(氧化镁组(MgO)、硫酸镁组(MgSO₄)、氢化镁组(MgH₂)、镁粉组(MgP)及对照组),探究并比较镁肥与镁-氢复合肥对长春花土壤pH值、镁吸收量、种子萌发、植株生长及MIA生物合成的影响。结果显示,施加MgH₂、MgP和MgO可显著将土壤pH值提升至6.14~6.38;与对照组相比,MgH₂和MgP处理组植株重量分别显著增加60%和29%;且MgH₂和MgP在提高植株镁含量、叶绿素含量、株高及重量方面的效果优于MgO和MgSO₄。四种肥料均能上调大部分MIA生物合成基因的表达,其中对文多灵(vindoline)合成途径相关基因的上调作用尤为显著。在各处理组中,MgH₂处理组的长春质碱(catharanthine)、文多灵和阿吗碱(ajmalicine)含量最高,分别达到对照组的167%、149%和517%。Pearson相关性分析表明,氢气释放量、土壤pH值与镁吸收量之间存在显著正相关,且三者均与植株生长指标及MIA含量呈显著正相关。上述结果表明,镁-氢复合肥可通过释放氢气并提高土壤pH值,促进长春花对镁的吸收、增加叶绿素含量、促进植株生长并提高MIA产量,凸显了MgH₂和镁粉作为新型肥料在提高药用植物生物碱产量方面的潜力。
Ou C, Qiu X, Zhao Q, Ding D, Zhang Y, De J, Wang Y, Tang K, Yang H, Pan Q. Magnesium Plus Hydrogen Fertilization Enhances Mg Uptake, Growth Performance and Monoterpenoid Indole Alkaloid Biosynthesis in Catharanthus roseus. Plants (Basel). 2025 Oct 31;14(21):3336.
1 引言
长春花(*Catharanthus roseus* (L.) G.Don)隶属于夹竹桃科(Apocynaceae),是一种富含生物碱的植物,可产生130多种单萜吲哚生物碱(MIAs),这些生物碱具有重要的药理活性[1]。其中,从长春花中提取的两种二聚吲哚生物碱——长春碱(vinblastine)和长春新碱(vincristine),因其抗癌作用而广为人知[2]。此外,长春花还能产生单体MIA,例如可用作抗高血压药的阿吗碱,以及可用作镇静剂的蛇根碱(serpentine)[1]。由于长春花植株中长春碱和长春新碱的含量极低,因此工业上主要通过其单体前体(文多灵和长春质碱)进行半合成,以实现这两种二聚MIA的商业化生产。因此,优化栽培策略对于提高长春花中具有药理价值的MIA产量至关重要。
施肥是保障作物产量的常用手段。已有研究表明,施加含大量元素或微量元素的肥料会影响长春花中生物碱的积累。例如,不同形态的氮素对长春花MIA产量的影响存在差异[3];在UV-B辐射条件下同步供应高浓度硝酸盐,可提高长春质碱和文多灵的积累量,但UV-B胁迫会显著抑制长春花生长[4];高浓度钾可有效调控MIA代谢,但会降低长春花生物量[5];尿素肥料及基质可促进长春花中利血平(reserpine)的产生[6];施氮肥可显著提高长春花突变体中的生物碱含量[7];盐胁迫条件下,外源施加氯化钙(CaCl₂)可提高文多灵、长春质碱和长春碱的含量[8];纳米铁肥可显著提高长春花的生长指标、光合色素含量及总蛋白含量[9];叶面喷施100 ppm锌可有效提高文多灵含量[10]。此外,与完全营养处理相比,镁(Mg)缺乏会使长春花的阿吗碱浓度降低22%[11]。综上,这些研究表明,营养供应可调控MIA的生物合成,但往往需要以牺牲植株生长为代价。目前,关于氮(N)、钾(K)、钙(Ca)、锌(Zn)对长春花影响的研究已较为广泛,但针对镁肥应用的研究较少,而关于镁与氢协同作用的研究则尚未见报道。这一未被探索的领域正是本研究的创新点所在。
镁是植物必需的大量元素,参与光合作用、同化物的生成与分配[12]。镁可促进植物对氮的吸收与利用,施镁肥能提高作物籽粒产量及氮利用效率(NUE)[13,14,15]。此外,镁肥还会影响植物体内生物碱的代谢:施用硫酸镁(MgSO₄)和碳酸镁钙(CaMg(CO₃)₂)均可提高卡塔丁马铃薯(Katahdin potato)块茎中的总糖苷生物碱(TGA)含量[16];当硫酸镁施用量为40磅/英亩时,马铃薯块茎中糖苷生物碱的积累量达到最高[17];叶面喷施2%硫酸镁溶液也可对印度烟草(Indian tobacco)总生物碱的形成产生积极影响[18];与对照组相比,施用硅钙钾镁肥可提高党参(*Codonopsis tangshen* Oliv.)中生物碱、多糖、黄酮及总蛋白的含量[19]。镁肥主要分为两类:(1)缓释镁肥(Mg-S),包括氧化镁(MgO)和氢氧化镁(Mg(OH)₂);(2)速释镁肥(Mg-R),包括硫酸镁(MgSO₄)[20]。这些研究表明,施镁肥可影响多种植物的生物碱代谢。已有报道指出,镁缺乏会降低长春花的阿吗碱浓度[11],但镁在长春花MIA合成中的具体作用仍不明确。
研究发现,氢气可不同程度地促进黑麦、绿豆和水稻的种子萌发[21]。此外,富氢水可影响植物激素合成、上调特定基因表达,并与信号分子相互作用,从而调控植物生长发育[22]。尤为重要的是,新证据表明,分子氢可直接调控植物次生代谢产物的生物合成。例如,已有研究证实,富氢水处理可显著上调药用植物掌叶榕(*Ficus hirta*)的苯丙烷类生物合成途径,提高黄酮类和香豆素类物质的含量[23]。氢化镁(MgH₂)是一种固态储氢材料,具有储氢量高(7.6 wt%)、成本低、资源丰富等特点,在工业、医药和农业领域具有潜在应用价值[24,25,26,27]。氢化镁水解时,1分子MgH₂可释放2分子氢气(H₂);镁粉(MgP)在水中也会发生类似反应,但1分子镁粉仅释放1分子氢气。由于具备释氢能力,MgH₂和MgP可作为镁-氢复合肥使用。此外,最新研究表明,以MgH₂形式供应的镁-氢复合物可激活植物复杂的防御机制,例如通过氢介导的调控作用提高水稻对镉(Cd)的耐受性[28]。然而,这种协同作用在提高药用植物中高价值次生代谢产物合成方面的潜力尚未得到探索。
本研究选用四种镁浓度相同的肥料(MgO、MgSO₄、MgH₂、MgP),探究镁肥及镁-氢复合肥对长春花土壤pH值、镁吸收量、种子萌发、植株生长、MIA生物合成及基因表达的影响,旨在探索MgH₂和镁粉作为农业肥料的潜在应用价值。本研究假设,与传统镁肥相比,MgH₂和镁粉可通过同步供应镁和释放氢气,提高长春花对镁的吸收、促进植株生长并增强MIA的生物合成。鉴于目前关于氢气对植物次生代谢产物影响的研究较少,且尚未见镁-氢协同施用对药用植物影响的报道,评估二者对长春花生长及MIA产量的影响具有重要意义。
2 材料与方法
2.1 试验材料与处理
长春花种子(“太平洋樱桃红”品种,Pacific Cherry Red)购自中国苏州丽美园艺科技有限公司。种子在添加四种镁肥(MgSO₄、MgO、MgH₂、镁粉(MgP,粒径50 μm,纯度98%))的基质土中萌发,其中MgSO₄和MgO分别代表传统速释镁肥和缓释镁肥,MgH₂和MgP代表新型缓释镁-氢复合肥。四种镁肥处理组的镁浓度均为7 mg/kg土壤。种子萌发2周后,将幼苗从育苗盘移栽至花盆(每盆1株),并再次向土壤中施加上述四种镁肥。第二次施镁肥4周后,每个处理组采集20株幼苗。测量株高和重量后,取幼苗顶部三层叶片,在液氮中研磨成粉,于-80 °C冰箱中保存,用于后续分析;用于MIA含量测定的样品则冷冻干燥72 h。
试验在温室中进行,温度控制为25±2 °C。基质土由泥炭土和蛭石按体积比6:4混合而成。七水合硫酸镁(MgSO₄·7H₂O)购自中国上海九鼎化工科技有限公司;氧化镁(MgO)购自中国上海迈瑞尔实验设备有限公司;MgH₂和镁粉由上海交通大学氢科学中心提供。对照组不施加任何镁肥。
2.2 种子出苗率测定
在塑料育苗盘中装入8 cm厚的基质土,并按上述方法施加四种镁肥。每个处理组设置3次重复,每个重复30粒种子。种子播种深度为1 cm,覆盖基质土后,每周浇水2 L。每日22:00统计出苗幼苗数量,当子叶出土时视为出苗。
播种后连续14天记录数据,计算出苗率及50%种子出苗时间(T₅₀%)。采用插值法计算50%种子出苗时间(精确到天的小数部分),计算公式如下:
T₅₀% = T + (50% - X)/(Y - X)
其中,T₅₀%为50%种子出苗时间,T为出苗率达到50%的前一天,X为T天的出苗率(%),Y为出苗率≥50%当天的出苗率(%)。
2.3 株高与重量测定
第二次施镁肥4周后,每个镁肥处理组的每个重复中随机选取5株幼苗,测定株高和鲜重(FW)。株高使用精度为0.5 mm的直尺测量;鲜重采用精度为0.0001 g的分析天平,按重复组批量测量。
2.4 叶绿素含量分析
将长春花叶片样品快速冷冻后,在液氮中研磨成粉。取0.1 g样品粉末,加入1 mL 80%丙酮缓冲液,在黑暗条件下放置5 min;随后以12,000 r/min的转速离心10 min,将上清液转移至2.0 mL离心管(EP管)中。沉淀用1 mL 80%丙酮缓冲液重悬,重复离心一次并收集上清液。合并两次上清液,经有机针式滤器过滤后,取200 μL滤液加入微孔板,使用微孔板扫描分光光度计(PowerWave XS,美国BIO-TEK仪器公司,佛蒙特州威努斯基市)测定吸光度。以80%丙酮缓冲液为空白对照,分别在663 nm和645 nm波长下测定上清液的吸光度。每个处理组设置3次重复。采用Arnon公式计算丙酮提取液中叶绿素a和叶绿素b的浓度:
ρₐ = 12.72A₆₆₃ - 2.59A₆₄₅ (1)
ρᵦ = 22.88A₆₄₅ - 4.67A₆₆₃ (2)
其中,ρₐ为叶绿素a浓度,ρᵦ为叶绿素b浓度,A₆₆₃为663 nm波长下的吸光度,A₆₄₅为645 nm波长下的吸光度。
2.5 植株组织镁含量测定
精确称取0.1 g样品(精确至0.0001 g)置于50 mL离心管中,加入5 mL水浸润样品,随后加入2 mL硝酸和1 mL过氧化氢。先在80 °C下加热30 min,再在125 °C下加热2 h;冷却至室温后,将溶液转移至50 mL容量瓶中,用超纯水定容至刻度并摇匀。样品预处理完成后,采用电感耦合等离子体发射光谱仪(ICP-OES,iCAP 7000,美国赛默飞世尔科技公司,马萨诸塞州沃尔瑟姆市)测定叶片中的镁含量。消解容器为聚四氟乙烯(teflon)材质,测定时设置空白对照和标准品用于ICP-OES校准。
2.6 基于实时荧光定量PCR(qRT-PCR)的相对表达量分析
在实时荧光定量PCR(qRT-PCR)实验中,总RNA提取自-80 °C保存的叶片样品。参照制造商(日本大阪TaKaRa公司)提供的实验方案,使用DNase I去除RNA中的DNA污染。以寡聚胸苷酸(oligo (dT))为引物,按照Prime Script™逆转录酶试剂(Prime Script™ Reverse Transcriptase Reagent)说明书的操作步骤,将500 ng RNA样品逆转录合成为cDNA。
qRT-PCR分析在Peltier Thermal Cycler PTC200(美国Bio-Rad公司)仪器上进行,以合成的cDNA为模板,采用基因特异性引物(见表S1)进行目标基因检测,其中单萜吲哚生物碱(MIA)生物合成相关基因的引物序列列于补充表S1(Supplementary Table S1)。PCR反应中使用SYBR Green荧光染料(SYBR Premix Ex Taq;TaKaRa公司)对双链DNA(dsDNA)的量进行定量分析。qRT-PCR的循环条件列于表S2(Table S2)。
采用相对阈值循环数(Ct值)法(参考《ABIPRISM700序列检测系统用户手册2版》,2001年更新;美国PerkinElmer/Applied Biosystems公司)估算反应体系中初始模板的量。
2.7 单萜吲哚生物碱(MIA)含量分析
采用配备电喷雾电离源(electrospray ionization source)的Prime UPLC-Q-TOF质谱仪(美国马萨诸塞州米尔福德市Waters公司)进行超高效液相色谱-四极杆飞行时间质谱(UPLC-Q/TOF MS)分析。数据采集、处理及仪器控制通过MassLynx 4.1软件完成。质谱检测参数设置如下:质量范围为m/z 50~1000(正离子模式);毛细管电压3.0 kV;样品锥电压35 V;提取锥电压3.0 V;离子引导电压3.0 V;离子源温度115 °C;脱溶剂气温度300 °C;脱溶剂气流速700 L/h。
为确保分析结果的准确性与可重复性,所有检测均通过Lock Spray接口采用独立参比喷雾进行校正:在正离子条件下,以酪氨酰-甘氨酰-甘氨酰-苯丙氨酰-亮氨酸(亮氨酸脑啡肽,Leucine-encephalin,浓度200 pg/μL)作为锁定质量化合物(lock mass,m/z 556.2771)进行实时校正(流速30 μL/min)。实验开始前,先以锁定质量化合物(亮氨酸脑啡肽)进行单点校正;随后使用甲酸钠溶液(由10%甲酸溶液/0.1 mol/L氢氧化钠溶液/乙腈按体积比10:10:80配制)在m/z 50~1000质量范围内进行多点校正,校正过程中所有检测点的误差均在1 ppm以内。仪器的分辨率为8000。
超高效液相色谱(UPLC)条件设置如下:采用BEH C18色谱柱(100 mm×2.1 mm,粒径1.7 μm,Waters公司);柱温维持在40 °C;流动相A为含0.1%甲酸的水溶液,流动相B为含0.1%甲酸的乙腈溶液;梯度洗脱程序为:0~4 min,流动相B占比从5%升至25%;9~12 min,流动相B占比从45%升至85%;14 min时,流动相B占比达到100%;14.5~16 min,流动相B占比恢复至5%;流速为0.35 mL/min;进样量为2 μL。 Acquity光电二极管阵列检测器(PDA)的检测波长固定为210 nm、254 nm和278 nm。本实验中UPLC-Q/TOF MS的色谱柱选择、梯度洗脱程序及PDA检测波长均参照此前报道的优化条件设置[29]。
MIA及其前体物质的标准品混合物(其中,次番木鳖苷(secologanin)、阿吗碱(ajmalicine)、长春质碱(catharanthine)和长春碱(vinblastine)购自美国密苏里州圣路易斯市Sigma-Aldrich公司;文多灵(vindoline)和脱水长春碱(anhydrovinblastine)购自中国上海市中药标准化研究中心)通过质谱/质谱(MS/MS)图谱(图S1和图S2)进行检测与鉴定。样品检测时每个处理设置3次重复,采用标准品的校正曲线对目标物质进行定量分析。
2.8 土壤pH值测定
每个镁肥处理组选取3盆植株的土壤样品,充分混合后组成一个混合样品,以确保结果的可重复性。去除土壤中可见的根系和有机残渣后,将土壤样品在室温下自然风干,随后过2 mm筛,用于pH值测定。
采用pH计(Fe28型,FiveEasy Plus系列,瑞士格里芬塞MettlerToledo公司)测定土壤pH值:按土水比1:2.5(质量体积比,w/v)制备土壤悬浊液,于上午9点进行pH值检测。每个混合样品重复测定3次,取平均值作为最终结果。
2.9 统计分析
所有实验均设置3次重复。种子出苗实验的育苗盘采用完全随机设计摆放。使用SPSS软件(14.0版本,美国伊利诺伊州芝加哥市)对数据进行统计分析:首先进行单因素方差分析(one-way ANOVA),随后采用邓肯多重范围检验(Duncan’s multiple range test)进行组间两两比较,并通过皮尔逊相关分析(Pearson correlation analysis)分析变量间的相关性。当p值≤0.05时,认为差异具有统计学意义。
在进行方差分析前,采用莱文检验(Levene test)验证数据的方差齐性;方差分析后,还通过邓尼特检验(Dunnett’s test)进一步识别各处理组间的显著差异(详见补充数据表1,SI datasheet1)。
3 结果
3.1 种子萌发
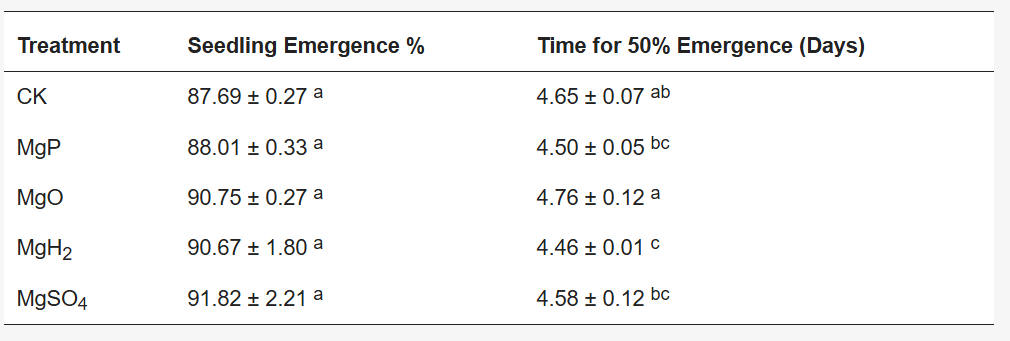
施加氧化镁(MgO)、硫酸镁(MgSO₄)和氢化镁(MgH₂)均能促进长春花种子出苗。其中,MgO、MgSO₄和MgH₂处理组的种子出苗率为90.67%~91.82%,对照组出苗率为87.69%,但各组间差异无统计学意义(表1)。施加MgO和MgH₂对50%种子出苗时间(T₅₀%)有轻微影响(表1)。
表1 四种镁肥处理后长春花的种子出苗率及50%种子出苗时间**
3.2 植株生长
在株高方面,MgH₂和镁粉(MgP)处理组的株高较对照组分别显著增加21%和17%,而MgO和MgSO₄处理组与对照组相比无显著差异(图1)。在植株重量方面,MgH₂和MgP处理组较对照组分别显著增加60%和29%。
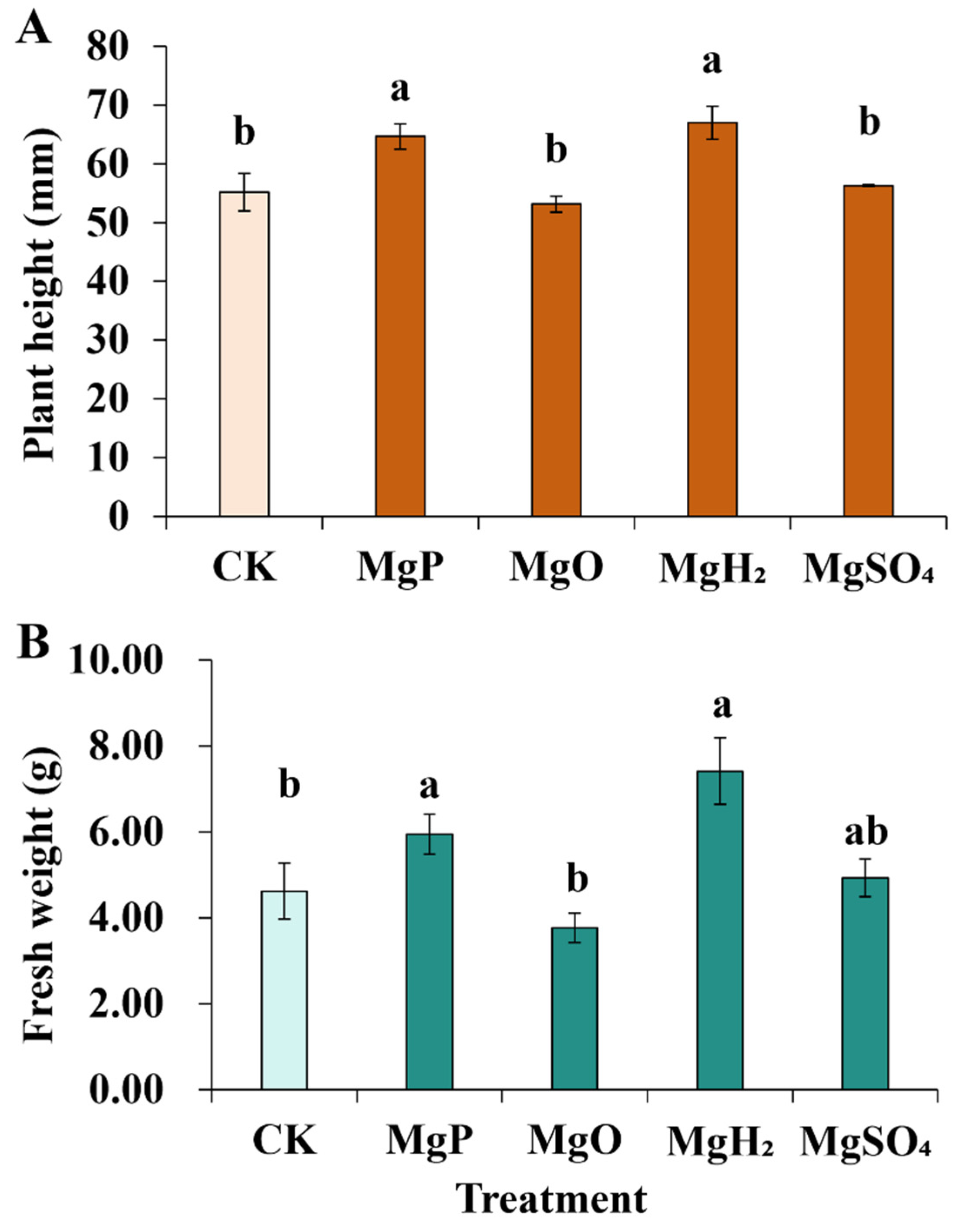
图1 施加镁肥1个月后长春花的株高(A)和鲜重(B)**
数据以“平均值±标准误(SE)”表示。采用单因素方差分析(one-way ANOVA)进行统计分析,随后通过邓肯多重范围检验进行组间两两比较。图中不同小写字母(a、b)表示不同镁肥处理组间存在显著差异(p<0.05)。每个处理组的样本量n=3(即每个处理设置3个生物学重复)。
3.3 叶绿素含量分析
与对照组相比,MgP和MgH₂处理组的总叶绿素含量分别显著增加13.5%和12.7%(图2A);相反,MgSO₄处理组的总叶绿素含量显著降低19.0%。这种差异主要由叶绿素b含量变化驱动:与对照组(CK)、MgO处理组和MgSO₄处理组相比,MgP和MgH₂处理组的叶绿素b含量显著更高;而MgSO₄处理组的叶绿素b含量显著低于MgP和MgH₂处理组。在叶绿素a含量方面,Mg、MgO和MgH₂处理组间无显著差异,但MgSO₄处理组的叶绿素a含量显著降低。
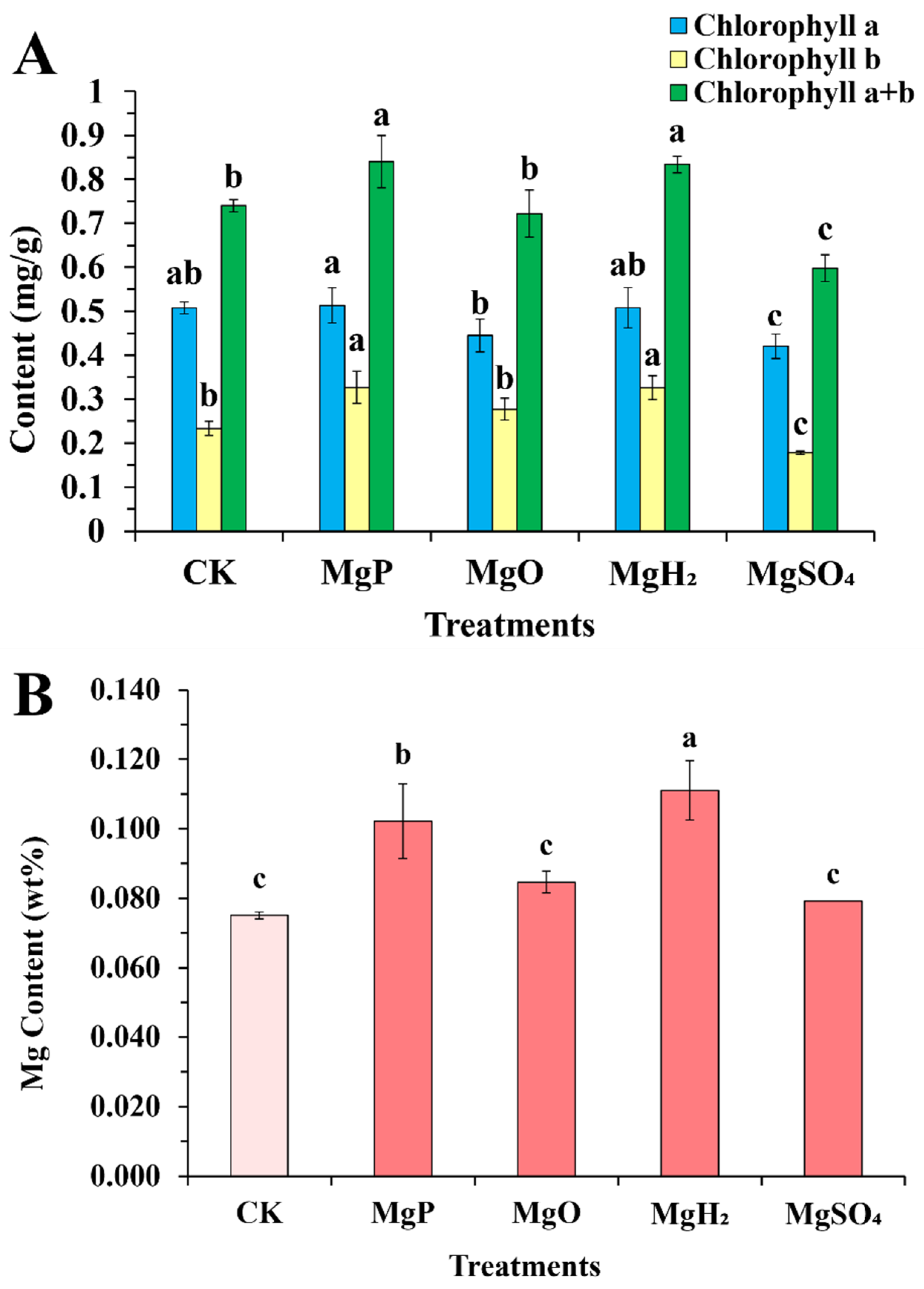
图2 四种镁肥处理1个月后长春花叶片的叶绿素含量(A)和镁含量(B)**
数据以“平均值±标准误(SE)”表示。采用单因素方差分析(one-way ANOVA)进行统计分析,随后通过邓肯多重范围检验进行组间两两比较。图中不同小写字母(a~c)表示不同镁肥处理组间存在显著差异(p<0.05)。每个处理组的样本量n=3(即每个处理设置3个生物学重复)。
3.4 镁含量分析
施加不同镁肥后长春花叶片的镁含量结果汇总于图2B。其中,MgH₂处理组叶片的镁积累量最高,较对照组增加48%;其次是MgP处理组,叶片镁含量较对照组增加36%;MgO和MgSO₄处理组的叶片镁含量分别较对照组增加13%和5%,但差异无统计学意义。总体而言,MgH₂和MgP处理组在提高长春花叶片镁含量方面的效果优于MgO和MgSO₄处理组。
3.5 土壤pH值分析
采用电位法测定施加不同镁肥后的土壤pH值,结果如图3所示。施加MgP、MgH₂和MgO均能轻微提高土壤pH值:对照组土壤pH值为5.97;施加MgSO₄后土壤pH值无明显变化;施加MgP和MgO后,土壤pH值升至6.14~6.15;MgH₂处理组的土壤pH值升至6.38,且差异具有统计学意义。
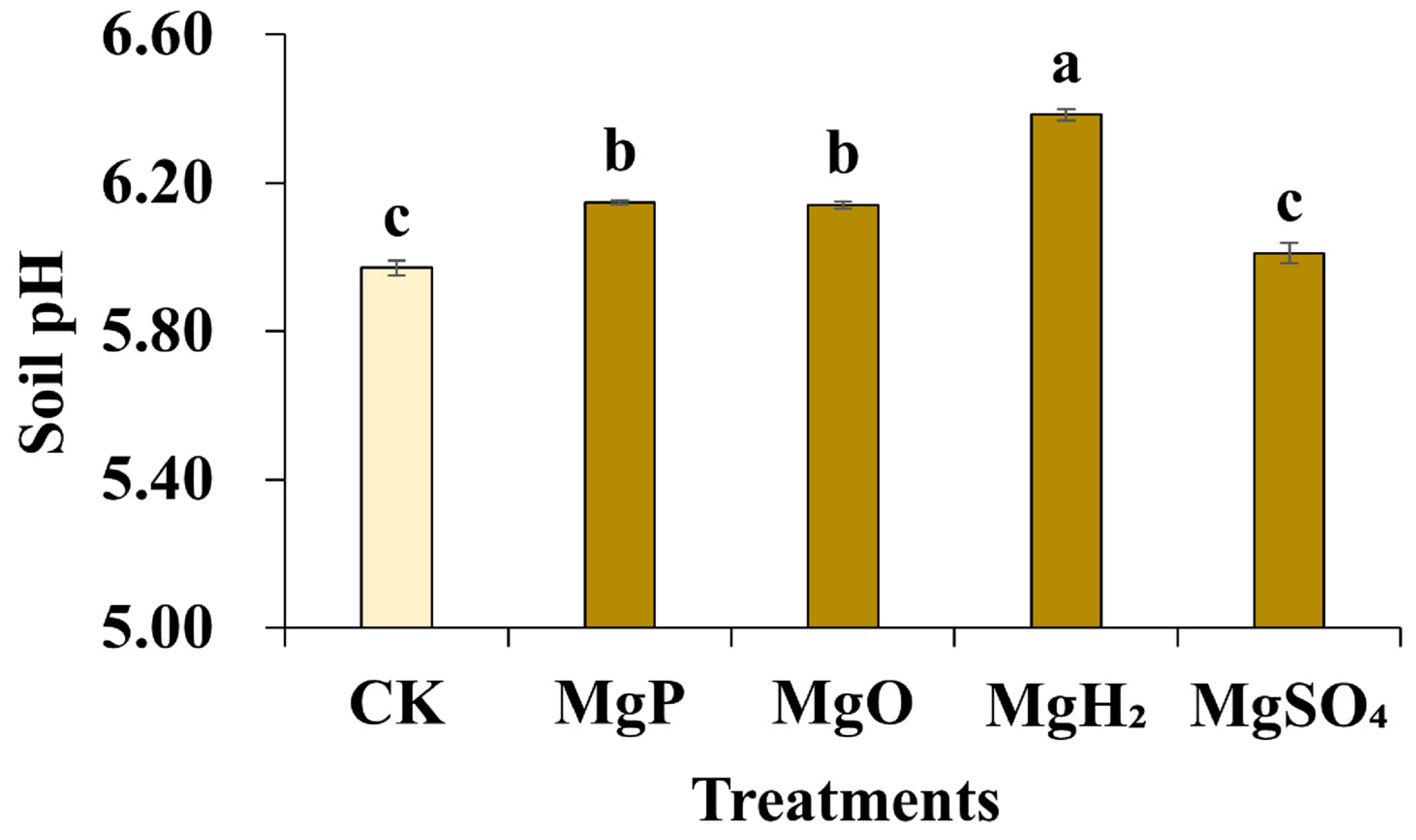
图3 施加镁肥1个月后的土壤pH值**
数据以“平均值±标准误(SE)”表示。采用单因素方差分析(one-way ANOVA)进行统计分析,随后通过邓肯多重范围检验进行组间两两比较。图中不同小写字母(a~c)表示不同镁肥处理组间存在显著差异(p<0.05)。每个处理组的样本量n=3(即每个处理设置3个生物学重复)。
3.6 MIA合成途径相关基因的表达分析
通过qPCR检测不同镁肥处理下MIA生物合成途径中18个关键酶基因及转录因子(TF)基因的表达水平。结果显示,四种镁肥均对大部分基因的表达具有促进作用,尤其对文多灵和长春碱合成相关基因(T16H、T3R、NMT、16OMT、D4H、DAT和PRX1)的表达促进效果显著(图4)。
具体而言:MgH₂处理显著诱导14个基因的表达,同时抑制2个基因的表达;MgP处理显著提高13个基因的表达水平,但显著降低4个基因的表达;MgO处理显著上调12个基因的表达,下调2个基因的表达;MgSO₄处理显著提高10个基因的表达,同时显著降低6个基因的表达。
在四种镁肥处理中,有12个基因在MgH₂处理组中表达量最高,包括TDC、GS、CS、TS、T16H、T3R、NMT、D4H、DAT、PRX1、CrEIN3和ORCA3,其表达量较对照组分别最高增加223%、7%、569%、53%、94%、180%、276%、119%、194%、160%、58%和254%;Redox1基因在MgP处理组中表达量最高,较对照组增加55%;SGD基因在MgO处理组中表达量最高,较对照组增加24%;STR、PAS、16OMT和CrWRKY1基因在MgSO₄处理组中表达量最高,较对照组分别增加39%、34%、250%和64%;而在MgSO₄处理组中,SGD、GS、GO、Redox1、DPAS和TS基因的表达量最低,较对照组分别显著降低38%、26%、50%、22%、60%和48%。
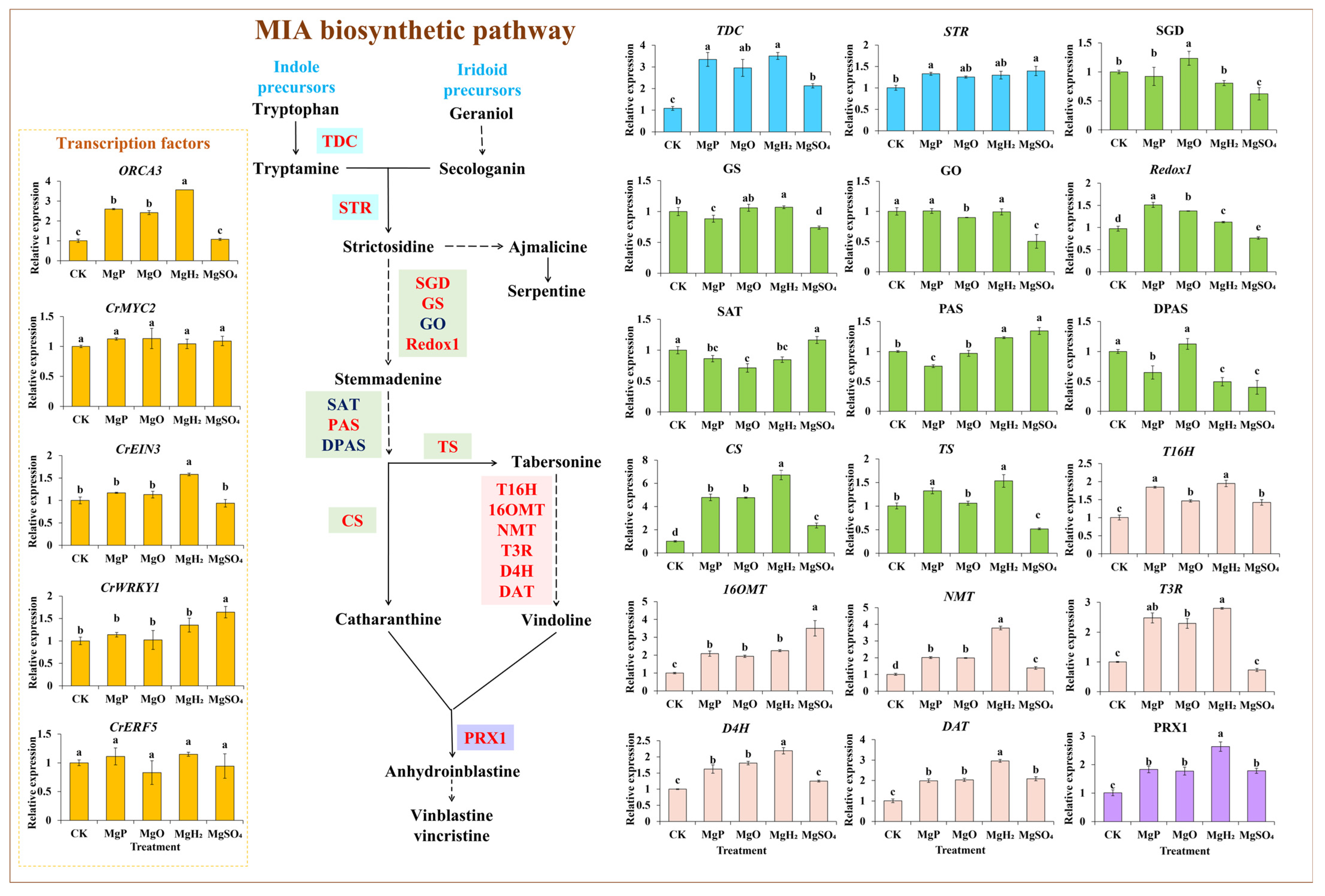
图4 四种镁肥对长春花MIA合成相关基因表达的影响
数据以“平均值±标准误(SE)”表示。采用单因素方差分析(one-way ANOVA)进行统计分析,随后通过邓肯多重范围检验(Duncan’s multiple range test)进行组间两两比较。图中不同小写字母(a~e)表示不同镁肥处理组间存在显著差异(p<0.05)。每个处理组的样本量n=3(即每个处理设置3个生物学重复)。
3.7 生物碱含量分析
施肥1个月后,与对照组相比,镁粉(MgP)、氧化镁(MgO)和氢化镁(MgH₂)处理组的长春质碱(catharanthine)、文多灵(vindoline)和阿吗碱(ajmalicine)含量均显著升高;而硫酸镁(MgSO₄)处理组仅阿吗碱含量升高,长春质碱和文多灵含量则显著降低(图5)。
其中,MgH₂处理组的长春质碱、文多灵和阿吗碱含量最高,较对照组分别增加67%、49%和417%;MgP处理组的上述三种生物碱含量较对照组分别增加33%、34%和192%;MgO处理组的三种生物碱含量较对照组分别增加31%、31%和159%;MgSO₄处理组中,仅阿吗碱含量较对照组增加89%,长春质碱和文多灵含量则分别较对照组降低26%和17%。
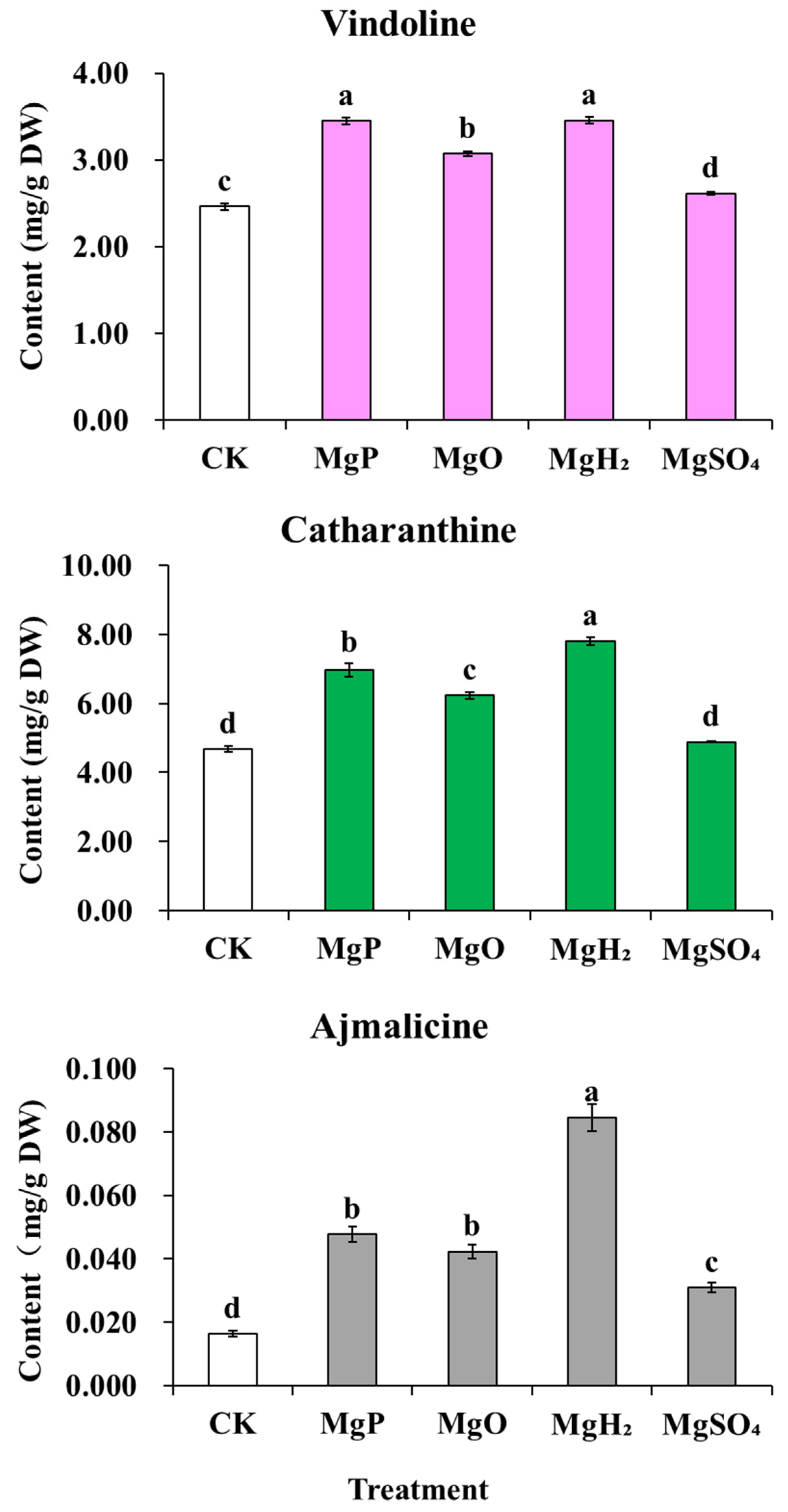
图5 四种镁肥对长春花MIA含量的影响**
数据以“平均值±标准误(SE)”表示。采用单因素方差分析(one-way ANOVA)进行统计分析,随后通过邓肯多重范围检验进行组间两两比较。图中不同小写字母(a~d)表示不同镁肥处理组间存在显著差异(p<0.05)。每个处理组的样本量n=3(即每个处理设置3个生物学重复)。
3.8 相关性分析
皮尔逊相关性分析(Pearson correlation analysis)结果显示,肥料释放的氢气(H₂)、土壤pH值与长春花的镁吸收量三者之间存在极显著正相关(p<0.001)(图6)。长春花的叶绿素含量、植株重量及株高与肥料释放的H₂、土壤pH值和镁吸收量均呈显著正相关(p<0.01或p<0.05)。种子出苗率(SE)与镁含量、H₂释放量及土壤pH值无显著相关性;50%种子出苗时间(TFE)与镁含量和H₂释放量呈显著负相关。
曼特尔相关性分析(Mantel correlation analysis)结果显示,文多灵、长春质碱和阿吗碱的含量与镁含量、肥料释放的H₂、土壤pH值及叶绿素含量均呈极显著正相关(p<0.01),而与种子出苗率(SE)、50%种子出苗时间(TFE)及植株重量的相关性较弱(图6)。

图6 肥料释放的H₂、土壤pH值、植株指标与MIA(文多灵、长春质碱、阿吗碱)含量的皮尔逊相关性及曼特尔检验结果**
H₂:1分子肥料释放的H₂分子数;SE:种子出苗率;TFE:50%种子出苗时间。显著性水平:*p<0.05,**p<0.01,***p<0.001。
进一步相关性分析显示,TDC、CS、TS、T16H、T3R、NMT、D4H、DAT、ORCA3和CrEIN3基因的表达量与H₂释放量、土壤pH值、镁吸收量及叶绿素含量呈显著正相关;而STR、SGD、Redox2、PAS、DPAS、OMT和CrMYC2基因的表达量与上述指标无显著相关性(图7)。此外,部分MIA合成相关基因(TDC、STR、DPAS、CS、TS、T16H、T3R、NMT、D4H、DAT、ORCA3、CrEIN3和CrERF5)的表达量与株高呈显著正相关(图7)。
总体而言,相关性分析表明,长春花的MIA生物合成与H₂释放量、土壤pH值、镁吸收量及叶绿素含量显著相关。

图7 镁-氢施肥条件下植株指标与MIA合成相关基因表达量的皮尔逊相关性分析**
颜色梯度和椭圆扁平程度代表皮尔逊相关系数大小;红色表示正相关,蓝色表示负相关。H₂:1分子肥料释放的H₂分子数;SE:种子出苗率;TFE:50%种子出苗时间。*表示差异显著(p<0.05)。
4 讨论
镁作为植物生长必需元素,已有研究证实施镁肥可提高作物产量和生物量[12,30]。同样,氢气对幼苗生长、不定根形成、根伸长、采收后保鲜、气孔关闭及花青素合成均具有积极作用[21],且施加分子氢可提高水稻的田间产量和籽粒品质[22]。本研究中,施加MgH₂、MgP和MgO对长春花植株重量具有显著促进作用(图1),且MgH₂和MgP处理还能显著提高长春花株高;相比之下,MgSO₄对长春花植株重量和株高的影响较小。这一结果与此前报道一致,即缓释镁肥在提高作物产量方面的效果优于速释镁肥[20]。
此外,长春花在施加MgH₂和MgP时对镁营养的吸收效果显著优于施加MgO和MgSO₄(图4)。皮尔逊相关性分析显示,长春花叶片的镁含量与H₂释放量呈显著正相关,表明镁-氢协同施肥具有协同效应。这类肥料不仅能提供Mg²⁺,还能在水解过程中释放H₂,最终促进叶绿素合成和植株生物量积累,同时上调MIA合成相关基因的表达,进而提高MIA积累量。尽管本研究中种子出苗率与镁吸收量、H₂释放量无显著相关性,但50%种子出苗时间与镁吸收量、H₂释放量呈显著负相关;且已有研究表明,氢气可通过促进糖和淀粉代谢加速黄瓜种子萌发[31],由此提示镁-氢复合肥或可促进长春花种子提前萌发。
镁在光合作用中的作用已明确——它是叶绿素分子的中心原子[32,33]。镁缺乏会导致叶脉间失绿,这是由于活性氧(ROS)过量产生引发叶绿素降解所致[34]。本研究中,长春花的镁含量与叶绿素含量呈强正相关,与上述机制一致。镁-氢复合肥(MgP和MgH₂)处理显著提高了长春花的镁含量和叶绿素含量,而单一镁肥(MgO和MgSO₄)对二者的提升效果较弱(图2);且镁含量和叶绿素含量均与H₂释放量呈正相关。这些结果表明,镁-氢复合肥释放的H₂可促进长春花对镁的吸收,进而提高叶绿素含量。
此外,H₂释放量与土壤pH值呈显著正相关(p<0.01)。MgH₂处理组的土壤pH值和长春花镁含量最高,其次是MgP和MgO处理组;而MgSO₄处理组的土壤pH值与对照组相当。已有研究指出,缓释镁肥对改善土壤酸性具有一定作用,可间接提高镁的利用效率[20]。MgH₂、MgP和MgO在土壤中均会缓慢生成氢氧化镁(Mg(OH)₂);且土壤酸性越强,越不利于阳离子留存,导致土壤交换性镁含量降低[12]。作为速释镁肥,MgSO₄中的镁阳离子在土壤中比缓释镁肥更易淋失[27]。本研究结果与上述结论一致:在四种肥料中,MgSO₄处理组的土壤pH值和镁吸收量最低。
在长春花中,次番木鳖苷(secologanin)的合成途径(鸢尾烷类途径)与色胺(tryptamine)的合成途径(吲哚途径)产生的产物,在 strictosidine合成酶(STR)催化下会缩合形成3α(S)-strictosidine[1]。随后,3α(S)-strictosidine经一系列酶促反应(包括氧化还原酶Redox1、tabersonine合成酶TS、α-水解酶CS等)生成长春质碱和tabersonine[35];tabersonine则在tabersonine 16-羟化酶(T16H1/2)、16-羟基tabersonine甲基转移酶(16OMT)、tabersonine 3-氧化酶(T3O)、tabersonine 3-O-乙酰转移酶(T3R)、N-甲基转移酶(NMT)、脱乙酰氧基文多灵-4-羟化酶(D4H)和脱乙酰文多灵4-O-乙酰转移酶(DAT)的催化下转化为文多灵[36]。最终,长春质碱与文多灵在过氧化物酶体硫解酶的作用下缩合形成长春碱(vinblastine)和长春新碱(vincristine)[37]。
MIA合成相关基因的表达受多种环境因素调控。已有研究报道,施钾肥可上调G10H、STR和DAT基因的转录水平[5];光照可激活文多灵合成后期相关基因的表达[38]。本研究结果显示,长春花中大部分MIA合成相关基因(尤其是文多灵合成途径相关基因)的表达量与叶片镁含量和叶绿素含量呈正相关。作为叶绿体光吸收复合物中叶绿素分子的中心原子,Mg²⁺可能在分子水平上维持天线色素反应中心及特定电子载体的构象,并保证它们之间的紧密接触,从而高效实现光能的吸收、传递与转化[12]——这一过程或可促进长春花中文多灵的合成。
已有研究指出,镁缺乏会降低长春花中阿吗碱的积累量[11],且镁肥对烟草、马铃薯、党参等植物的生物碱代谢具有积极影响[16,17,18,19];此外,氢气处理可上调药用植物掌叶榕(Ficus hirta)苯丙烷类合成途径中的关键结构基因,促进黄酮类和香豆素类物质的积累[23]。基于镁和氢气对植物次生代谢的上述作用,本研究探索了二者协同施用对长春花MIA合成的协同效应。结果表明,镁-氢复合肥(MgH₂和MgP)在促进MIA积累方面的效果优于单一镁肥(MgO和MgSO₄),其中MgH₂的促进作用最强,其次是MgP——这一生物碱含量变化趋势与基因表达量变化趋势一致。MgH₂释放的H₂分子数比MgP多1个;且已有研究报道,氢气可上调水稻中茉莉酸(JA)受体基因OsCOI1的表达[21,39]。此外,MIA含量与H₂释放量、镁含量及土壤pH值均呈极显著正相关。
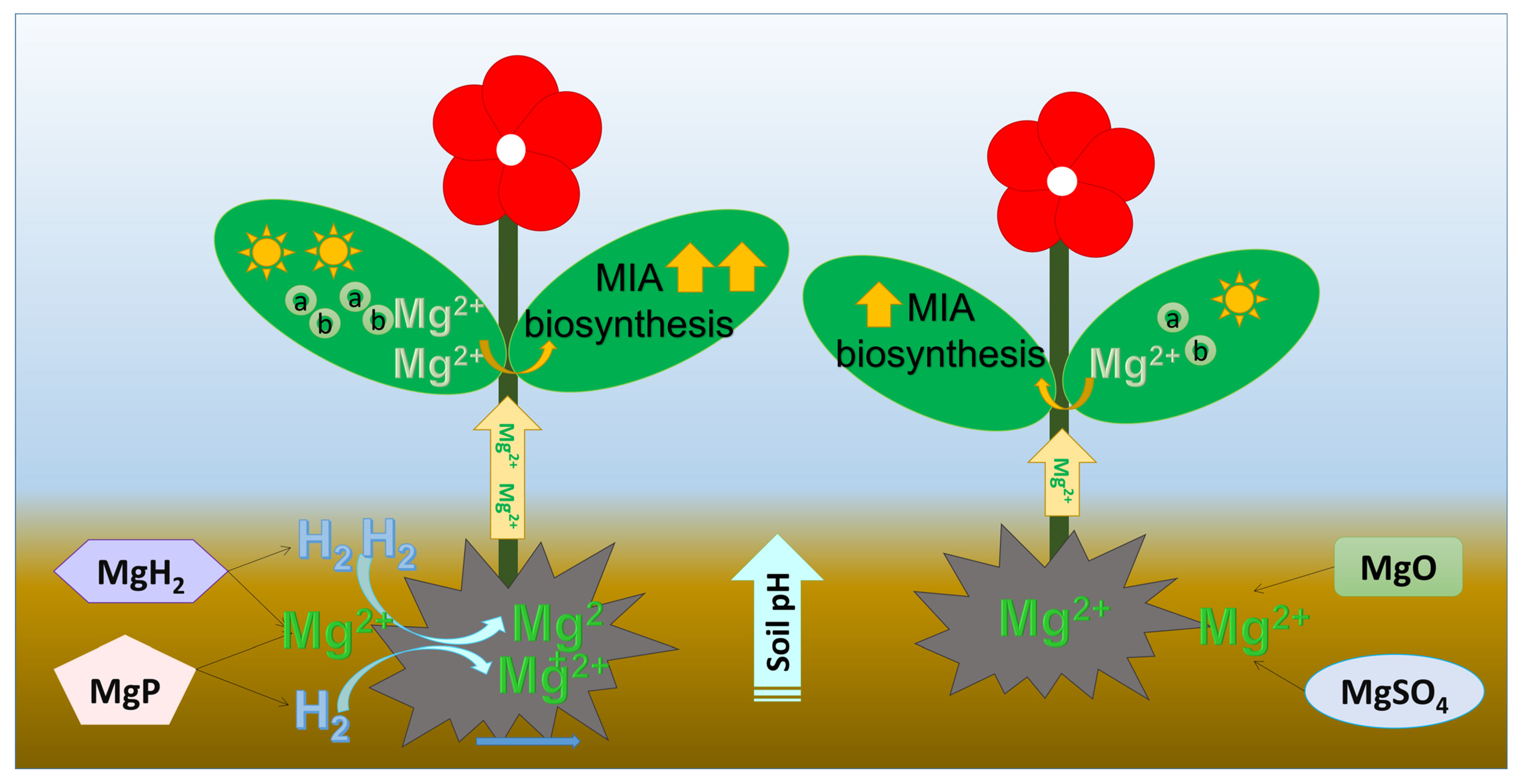
综上,MgH₂或MgP释放的H₂可提高土壤pH值和长春花对镁的吸收量,进而促进植株生长和MIA合成(图8)。结合镁阳离子的缓释特性与H₂的作用,MgH₂可作为促进长春花生长和MIA合成的最优肥料。
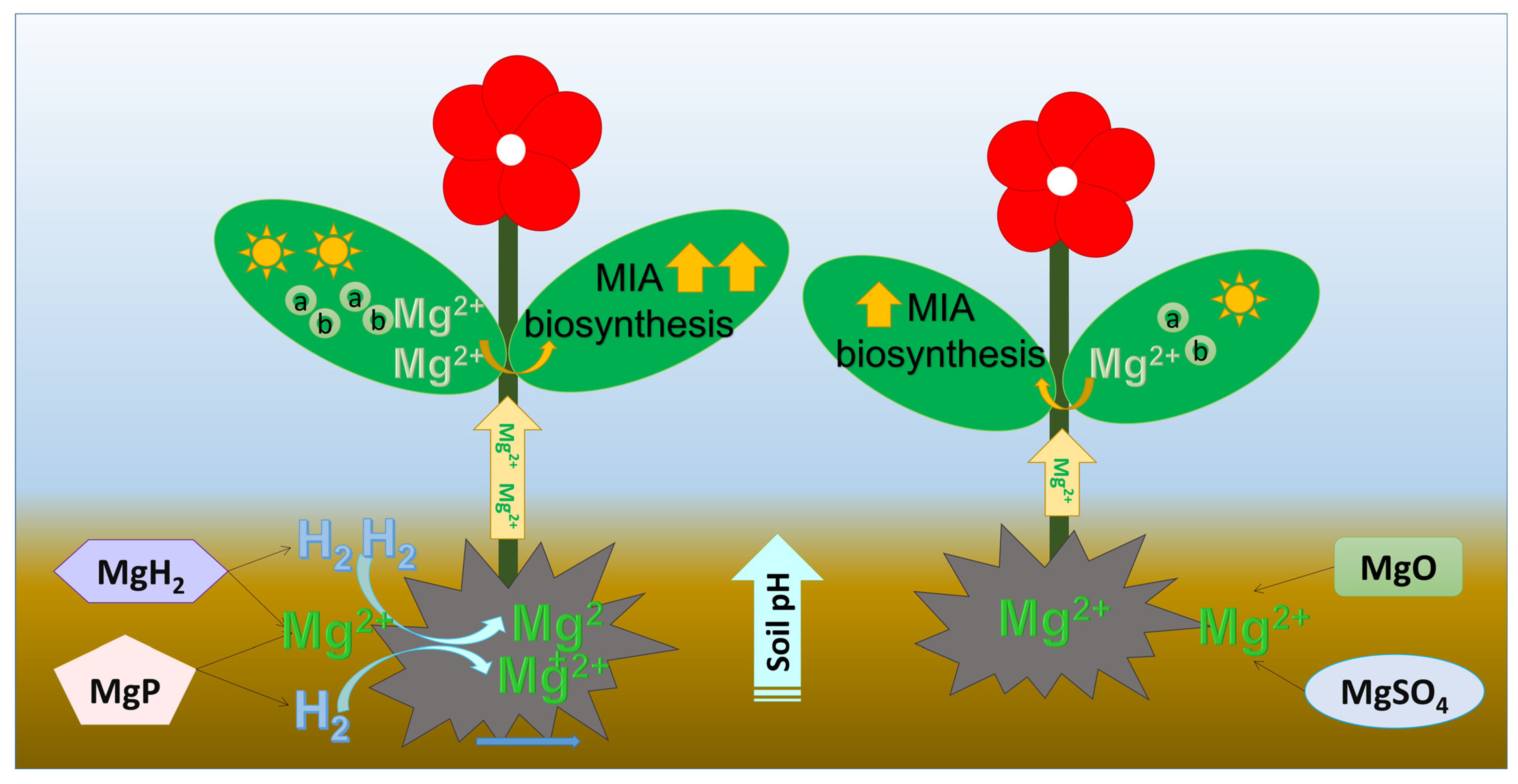
图8 镁-氢复合肥与单一镁肥对土壤pH值、镁吸收量、叶绿素含量、植株生长及MIA合成的影响机制示意图
a:叶绿素a;b:叶绿素b。
5 结论
本研究表明,与单一镁肥(MgO和MgSO₄)相比,镁-氢复合肥(MgH₂和MgP)在促进长春花镁吸收、植株生长及MIA合成方面的效果更强。结果证实,MgH₂或MgP释放的H₂可正向调节土壤pH值和长春花对镁的吸收,进而促进植株生长和MIA生物合成。其中,MgH₂因对土壤pH值、镁含量及植株生长具有综合调控作用,展现出作为长春花栽培创新肥料的巨大潜力。
本研究结果为通过优化栽培策略提高高价值抗癌生物碱产量的商业化生产提供了实践指导,同时也为未来探索镁-氢复合肥在田间条件下对长春花及其他药用植物的应用奠定了基础。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1510203.html?mobile=1
收藏

