光催化产氢医用敷料用于糖尿病伤口愈合
用于光催化产氢及糖尿病伤口愈合的半导体聚合物点医用敷料
通过材料释放氢气,用于医疗的学术研究,目前如火如荼。这类研究的最基本逻辑是,氢气是一种新发现的医疗气体,但使用起来不太方便,主要是溶解度低等问题。给使用材料作为氢气的载体提供了很好的理由。而且能产生氢气的材料非常多,给这类研究提供了大量的创新思路。例如通过电解,通过电化学反应,通过光照包括X光,而且每一种材料都几乎是无限量。但是开展这类研究必需考虑一个问题,到底是材料本身的作用,还是氢气释放后产生的作用。有一些研究没有很好回答这个问题,可能会导致错误结论。

该论文最近发表于ACS Applied Materials & Interfaces。
Mi F, Wang Y, Zhao N, Li Y, Li W, Fang X, Zhang X, Liu C, Shu P, Wu C. Medical Dressing with Semiconducting Polymer Dots for Photocatalytic Hydrogen Evolution and Diabetic Wound Healing. ACS Appl Mater Interfaces. 2025 Nov 11.
伤口愈合障碍是糖尿病患者最常见且最严重的并发症。本研究开发了一种新型糖尿病伤口愈合医用敷料,其核心机制是半导体聚合物点(Pdots)在红光照射下通过光催化作用产生氢气。该半导体聚合物点由半导体聚合物(PM6)和富勒烯衍生物(PCBM)组成,形成具有高效光催化产氢性能的给体-受体异质结结构。
表征结果显示,这种PM6:PCBM异质结半导体聚合物点的抗氧化能力,约为以往研究中给体-受体型半导体聚合物点的2.5倍。将该异质结半导体聚合物点直接负载到无菌医用敷料中后,研究发现:在低剂量红光照射下,该医用敷料能有效清除糖尿病伤口处的羟基自由基,促进抗炎细胞因子的表达,并加速伤口愈合。
通过对皮肤组织的免疫荧光染色分析,研究进一步揭示了氢气疗法在炎症过程中的作用——例如可促使巨噬细胞从M1型极化至M2型。本研究重点证实了负载半导体聚合物点的医用敷料具有高效产氢能力,为糖尿病伤口治疗提供了一种新方法。
全文
糖尿病患者伤口愈合障碍及光催化产氢疗法相关研究
伤口愈合障碍是糖尿病患者最常见且最严重的并发症之一,易引发糖尿病足溃疡(DFU),伴随伤口感染、溃烂及瘢痕形成[1-3]。病情严重时,患者可能需要截肢,给社会和家庭带来沉重负担。糖尿病足溃疡的病理生理机制复杂,涉及微血管功能障碍、神经病变、免疫功能异常及氧化应激增强[4-7]。其中,过量的活性氧(ROS)会加剧炎症反应、损害组织再生能力,并延缓伤口愈合[8-11]。在慢性溃疡中,巨噬细胞无法从促炎的M1表型转化为抗炎的M2表型,导致炎症持续存在,组织修复受阻。因此,目前有大量研究致力于开发基于肽的药物,通过调控炎症反应和巨噬细胞极化来加速糖尿病伤口愈合[12]。
氢气疗法是近年来新兴的一种极具潜力的气体疗法,因其能选择性清除毒性自由基,可缓解炎症反应并促进伤口愈合[13-15]。氢气是一种内源性小分子气体,具有安全性高、渗透性强、扩散性好等独特优势。然而,传统氢气递送方式存在持续性差、靶向性低的问题,难以实现氢气的长期蓄积,这严重限制了氢气疗法的疗效[16-21]。因此,开发有效的氢气递送系统对于提升氢气疗法的治疗效果至关重要。
光催化产氢为氢气疗法提供了一种极具前景的解决方案。在光照条件下,氢气可在组织内原位生成,且易于穿透细胞膜、扩散至邻近细胞,甚至能通过血脑屏障,展现出优异的治疗潜力[22-25]。可见光和近红外光操作便捷且属于非电离辐射,在此类光照下,光催化剂可持续产氢,显著提升氢气的稳定供给[26-29]。与无机半导体相比,共轭聚合物等有机半导体具有吸收截面大、吸收光谱可调、产氢速率高及生物相容性好等优势[30-36]。目前已有多种修饰策略被用于进一步提升半导体聚合物的光催化性能,其中,构建内异质结结构是促进光生载流子分离、进而提高光催化产氢效率的有效方法[37-40]。
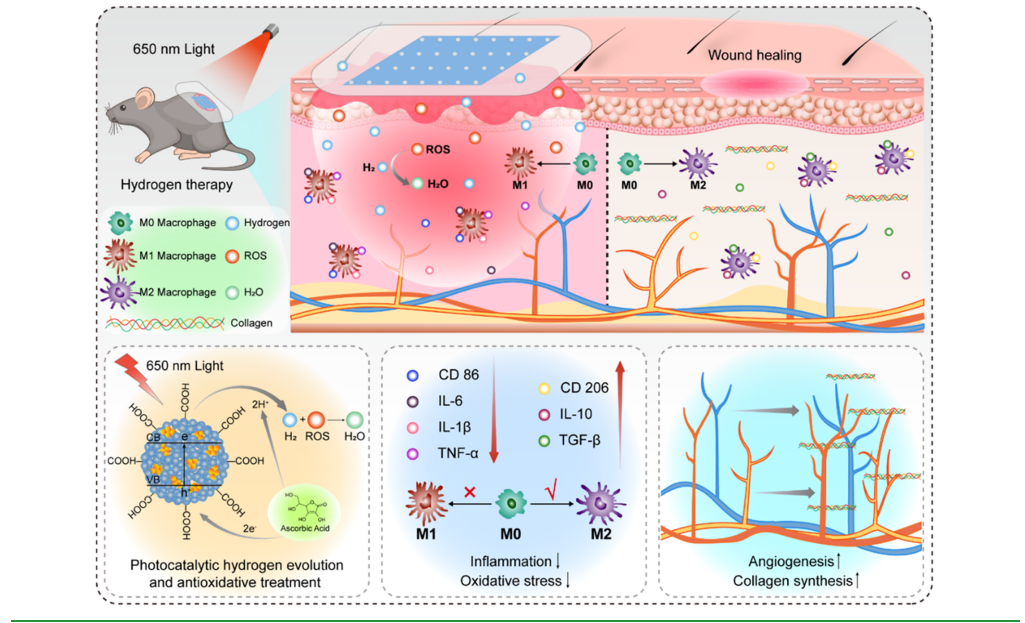
图1 基于异质结聚合物点(Pdot)的医用敷料用于红光触发糖尿病伤口光催化氢气治疗的示意图
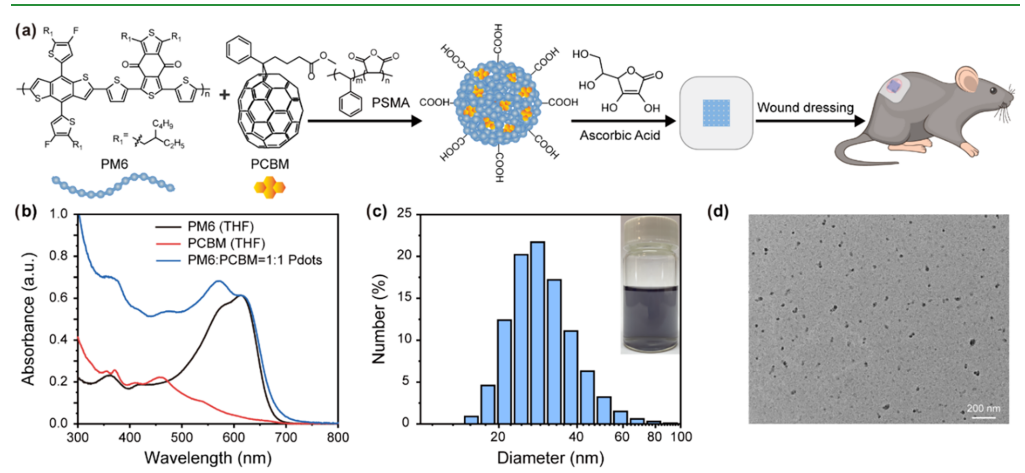
图1 异质结聚合物点(Pdots)的表征
(a)聚合物点(Pdots)的制备及用于小鼠伤口愈合的无菌医用敷料应用示意图。图中展示了共轭聚合物PM6、富勒烯衍生物PCBM及功能聚合物PSMA的化学结构。
(b)PM6聚合物与PCBM在四氢呋喃(THF)中的吸收光谱,以及PM6:PCBM质量比为1:1的异质结聚合物点水溶液的吸收光谱。
(c)通过动态光散射法测得的异质结聚合物点的水动力学直径分布。插图为浓度为20 μg/mL的异质结聚合物点水溶液的照片。
(d)异质结聚合物点的典型透射电子显微镜(TEM)图像。
本研究中,我们开发了一种负载异质结聚合物点(Pdots)的医用敷料,该敷料可通过光催化产氢用于糖尿病伤口愈合。所述异质结聚合物点以半导体聚合物PM6为电子给体、富勒烯衍生物PCBM为电子受体合成而成。在650 nm红光照射下,以抗坏血酸作为电子牺牲剂时,该聚合物点可实现高效的光催化产氢。

图2 异质结聚合物点(Pdots)光催化产氢性能表征
(a)在pH=2条件下(200 mM抗坏血酸溶液的pH值),PM6与PCBM的最高占据分子轨道(HOMO)-最低未占据分子轨道(LUMO)能级,与质子还原电势(H⁺/H₂)及水氧化电势(O₂/H₂O)的对比。
(b)以相对荧光值(RFU)表示的氢原子转移抗氧化能力(HORAC)测定结果。
(c)异质结聚合物点抗氧化能力的定量对比。
(d)羟基自由基(•OH)将非荧光性没食子酸(TA)氧化为荧光性羟基没食子酸(TAOH)的过程。
(e)白光照射下,存在聚合物点时TAOH的荧光光谱。
(f)异质结聚合物点光催化产氢量随时间的变化曲线。
通过将聚合物点直接负载到无菌医用敷料中,我们证实:在低剂量红光照射下,该敷料可有效促进糖尿病小鼠皮肤伤口愈合(见图1示意图)。这种医用敷料在皮肤伤口上操作简便;且与基于药物的治疗体系相比,氢气具有更强的组织渗透性,更适合用于原位抗炎治疗[41,42]。研究结果表明,负载聚合物点的医用敷料能有效清除糖尿病伤口处的羟基自由基,提高抗炎细胞因子水平,并加速伤口愈合。此外,我们通过对伤口愈合皮肤组织的免疫荧光染色分析发现,氢气疗法对炎症过程具有调控作用,例如可促使巨噬细胞从M1型极化至M2型。这些结果证实,负载异质结聚合物点的医用敷料具有优异的产氢性能,为糖尿病伤口治疗提供了一种极具潜力的新方法。
■ 结果与讨论
异质结聚合物点(Pdots)的制备与表征
在近期研究中我们已证实,与单组分聚合物点相比,异质结聚合物点具有更优异的光催化产氢效率[43,44]。异质结结构的形成有助于光生载流子在聚合物给体与受体之间定向迁移,从而显著提升光催化产氢效率[37,38]。此前,我们还开发了一种负载异质结聚合物点与抗坏血酸的脂质体纳米反应器,该反应器在深红光照射下展现出优异的光催化产氢性能,可有效缓解皮肤炎症,促进糖尿病小鼠皮肤伤口愈合[44]。本研究中,我们设计了一种光催化效率进一步提升的新型异质结聚合物点,并将其负载到医用敷料中,用于糖尿病伤口治疗。这种新型聚合物点由共轭聚合物PM6与富勒烯衍生物PCBM组成,在纳米颗粒内部形成给体-受体异质结。图1a展示了共轭聚合物PM6、PCBM以及两亲性共聚物聚苯乙烯-马来酸酐(PSMA)的化学结构。在异质结聚合物点中引入PSMA,可提升其胶体稳定性与水溶性;而加入抗坏血酸作为电子牺牲剂,则能促进水分子的氧化还原反应,从而实现产氢。将异质结聚合物点直接负载到无菌医用敷料中,可用于后续糖尿病皮肤损伤的抗炎与伤口愈合治疗。
图1b分别展示了共轭聚合物给体PM6、受体PCBM以及异质结聚合物点的吸收光谱。结果显示,PM6与PCBM在可见光范围内均具有强吸收能力;因此,PM6:PCBM质量比为1:1的异质结聚合物点呈现出覆盖整个可见光波长范围的宽吸收带。基于此,我们选择650 nm红光作为皮肤伤口愈合的治疗光源,以同时保证良好的生物相容性与较深的光穿透深度。采用动态光散射法(DLS)测定异质结聚合物点的粒径(图1c),并通过透射电子显微镜(TEM)表征其形貌(图1d)。
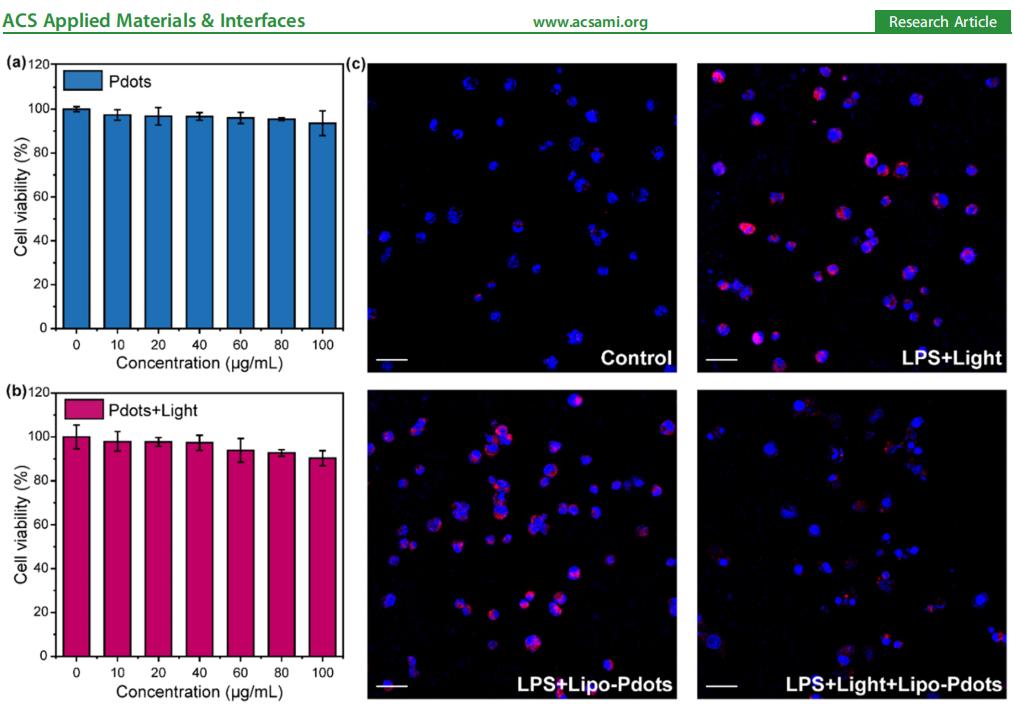
图3 异质结聚合物点(Pdots)的细胞实验
(a)巨噬细胞与不同浓度异质结聚合物点共培养后的细胞存活率。
(b)在红光(650 nm,45 J/cm²)照射条件下,巨噬细胞与异质结聚合物点共培养后的细胞存活率。
(c)脂多糖(LPS)诱导巨噬细胞产生活性氧(ROS)后,经脂质体-聚合物点(Lipo-Pdots)处理(有无光照)的共聚焦显微镜图像(比例尺:50 μm)。
研究结果显示,异质结聚合物点呈均匀分散的球形颗粒,平均直径约为25 nm。我们对聚合物点的粒径分布和ζ电位进行了30天的监测(图S1、图S2),结果表明该聚合物点具有良好的胶体稳定性,适合长期储存。图1c显示,该纳米颗粒水溶液呈清晰的蓝灰色,这与异质结聚合物点的吸收光谱特征一致。聚合物点的小尺寸使其具有较大的比表面积,有利于光催化产氢过程的进行。
异质结聚合物点的光催化产氢性能
异质结聚合物点的能级结构直接决定水分子能否发生氧化还原反应以产生氢气。图2a展示了通过电化学循环伏安曲线(图S1)计算得到的给体PM6与受体PCBM的最高占据分子轨道(HOMO)-最低未占据分子轨道(LUMO)能级。该HOMO-LUMO能级范围覆盖了质子还原电势(H⁺/H₂)和水氧化电势(O₂/H₂O),表明异质结聚合物点具备光催化分解水的能力。此外,图S3中莫特-肖特基(Mott-Schottky)曲线呈现倒“V”形,且瞬态光电流响应曲线中电流值升高,这些结果证实了聚合物点内部异质结结构的形成。图S4展示了在有无光照条件下,PM6、PCBM及异质结聚合物点的奈奎斯特(Nyquist)图,结果进一步证实:光照条件下,聚合物点中的电荷分离与迁移效率得到提升。
随后,我们通过一系列抗氧化表征实验探究异质结聚合物点的光催化产氢性能。采用羟基自由基抗氧化能力(HORAC)测定法评估聚合物点的抗氧化能力——该方法基于羟基自由基氧化荧光探针的原理,而抗氧化剂可减缓这一氧化过程。图2b展示了三种异质结聚合物点(分别由PTB7-Th:EH-IDTBR、PM6:EH-IDTBR、PM6:PCBM制备)的HORAC测定结果,其中第一种聚合物点为对照样品,相关研究已在我们近期的报告中阐述[41]。荧光强度变化的曲线下面积(AUC)可反映聚合物点的抗氧化能力,结果显示:PM6:PCBM异质结聚合物点的抗氧化能力远高于另外两种聚合物点。
以没食子酸为标准样品,可对HORAC测定结果进一步定量(图2c)。在650 nm光同等剂量照射下,PM6:PCBM形成的聚合物点展现出显著的抗氧化能力,其强度约为我们近期报告中PTB7-Th:EH-IDTBR异质结聚合物点的2.5倍[41]。综上,这些结果表明:由于具备高效的光催化产氢能力,PM6:PCBM聚合物点是一种强效的羟基自由基清除剂。
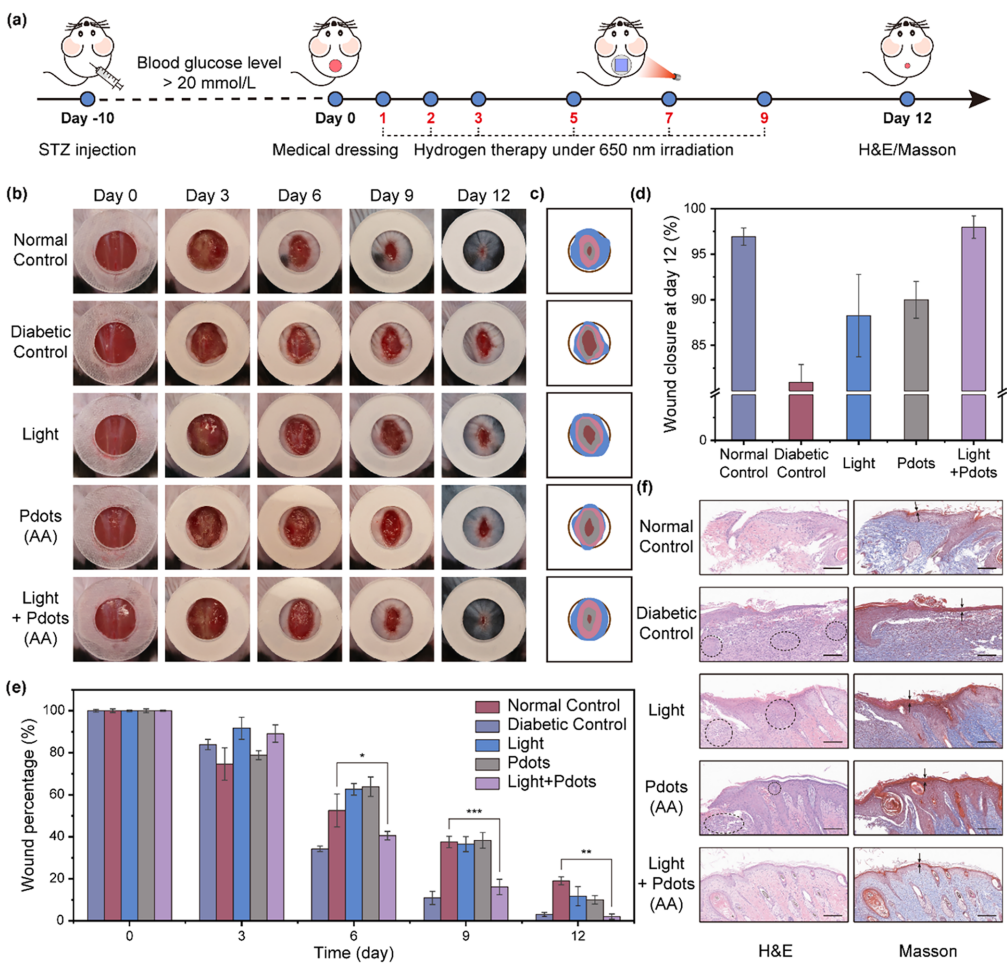 图4 基于聚合物点(Pdots)光催化产氢疗法的医用敷料对糖尿病伤口的在体治疗效果
图4 基于聚合物点(Pdots)光催化产氢疗法的医用敷料对糖尿病伤口的在体治疗效果
(a)糖尿病伤口模型构建及医用敷料治疗流程示意图。
(b)不同治疗方案下,12天内糖尿病伤口愈合过程的代表性图像。
(c)随治疗时间变化,糖尿病伤口形态的叠加对比图。
(d)12天后不同治疗方案下的伤口愈合率(每组含5只小鼠)。
(e)12天内伤口愈合率的统计结果(每组含5只小鼠)。
(f)12天后伤口皮肤组织的苏木精-伊红(H&E)染色(左)与马松三色染色(右)结果(比例尺:2 mm)。
我们采用荧光实验进一步研究异质结聚合物点对羟基自由基(•OH)的选择性清除能力。光照条件下,过氧化氢(H₂O₂)可分解产生•OH,•OH会与非荧光分子对苯二甲酸(TA)反应,生成蓝色荧光物质2-羟基对苯二甲酸(TAOH)(图2d)。
我们将TA分子与聚合物点混合,观察光照下的荧光变化。如图2e所示,纯TA组与TA-聚合物点混合组在光照下均呈现出较弱的荧光强度,表明溶液中•OH含量极低。与之相反,TA-H₂O₂混合组因光照诱导H₂O₂产生•OH,荧光强度显著升高。然而,在加入异质结聚合物点的体系中,荧光强度明显降低——这是因为在650 nm光照下,聚合物点催化水分子发生氧化还原反应产生氢气,同时通过清除•OH避免TA被氧化,从而显著降低了荧光强度(图2e)。
此外,图2f展示了PM6:PCBM异质结聚合物点的气相色谱分析结果。随着光照时间延长,光催化产氢反应持续进行,氢气累积量相应增加,这为聚合物点催化产氢提供了直接证据。荧光实验与气相色谱分析结果均证实:该异质结聚合物点具有高效的光催化产氢能力,同时具备优异的•OH清除性能。
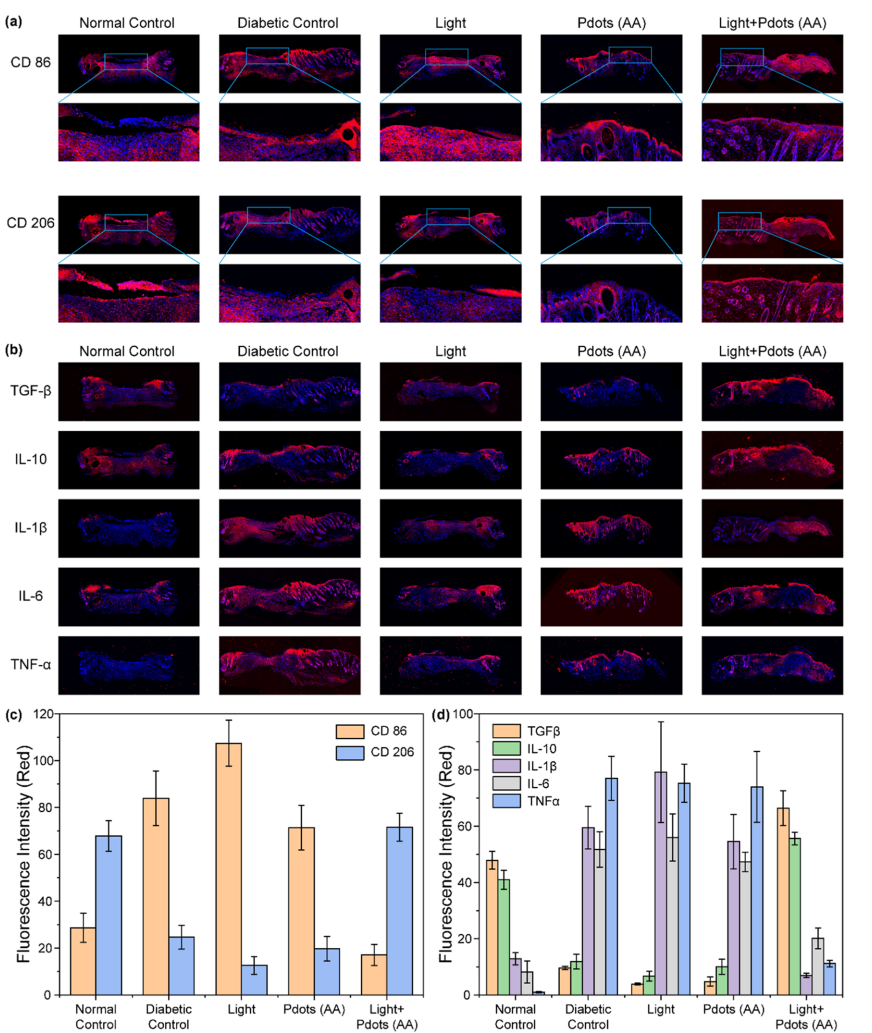 图5 (a, b) 不同治疗方案下,伤口愈合12天后皮肤组织切片的免疫荧光染色结果(每组含5只小鼠)。比例尺:200 μm。(c, d) 小鼠皮肤组织中巨噬细胞极化标志物及炎症相关细胞因子的荧光定量分析结果。
图5 (a, b) 不同治疗方案下,伤口愈合12天后皮肤组织切片的免疫荧光染色结果(每组含5只小鼠)。比例尺:200 μm。(c, d) 小鼠皮肤组织中巨噬细胞极化标志物及炎症相关细胞因子的荧光定量分析结果。
为评估异质结聚合物点(Pdots)的生物相容性及光毒性(二者对生物医学应用至关重要),我们开展了细胞存活率实验。将RAW 264.7细胞与不同浓度的异质结聚合物点共培养24小时,图3a显示了该聚合物点的细胞存活率结果。数据表明,即使聚合物点浓度升高至100 μg/mL,细胞存活率仍保持在90%以上,证明其具有良好的生物相容性。图3b显示,在光照条件下,细胞存活率仍维持在约90%,这表明在给定的光照剂量(650 nm,45 J/cm²)下,红光照射引发的光毒性可忽略不计。细胞存活率实验中的活/死细胞染色结果进一步证实,本研究中的聚合物点具有生物相容性且无光毒性(图S5)。
脂多糖(LPS)可诱导巨噬细胞产生炎症反应,导致过量活性氧(ROS)生成(图S6)。我们采用ROS敏感型荧光探针检测细胞内ROS水平,以评估异质结聚合物点的抗炎治疗效果。参考此前研究[40,41],我们利用脂质体包裹异质结聚合物点与抗坏血酸(形成Lipo-Pdots),以排除抗坏血酸对ROS清除过程的潜在干扰。图3c展示了不同处理组细胞的共聚焦荧光图像,其定量荧光分析结果见图S7。明亮的红色荧光表明,LPS诱导的巨噬细胞发生了严重的炎症反应;而经Lipo-Pdots(100 μg/mL)处理并结合红光照射(650 nm,45 J/cm²)后,细胞的红色荧光强度显著降低至原来的1/4,这表明氢气有效降低了细胞内ROS水平。上述结果证实,异质结聚合物点在红光照射下可成功催化产氢,且能有效缓解LPS诱导的细胞内炎症反应。此外,我们还利用人永生化角质形成细胞(HaCaT细胞)开展了细胞迁移实验(图S8、图S9)。结果显示,与对照组相比,经Lipo-Pdots处理并结合650 nm红光照射后,HaCaT细胞的迁移能力显著增强,这表明氢气疗法可有效促进HaCaT细胞迁移——该过程对皮肤伤口愈合具有积极意义。
负载聚合物点(Pdots)的医用敷料用于糖尿病伤口愈合
在将负载聚合物点的医用敷料用于糖尿病伤口愈合前,我们首先开展了一系列在体生物相容性研究。对血清生化指标(包括丙氨酸转氨酶、肌酐、尿素)的检测结果显示,注射磷酸盐缓冲液(PBS)与注射聚合物点的小鼠之间无显著差异(图S10)。此外,即使聚合物点浓度升高至120 μg/mL,经其处理的血液也未出现溶血现象(图S11)。我们还通过对组织切片进行苏木精-伊红(H&E)染色,评估了聚合物点对主要器官的全身毒性(图S12),结果显示注射PBS与注射聚合物点的小鼠之间无显著差异。
随后,通过向小鼠腹腔注射链脲佐菌素(STZ)构建糖尿病模型,模型构建成功率超过85%。STZ可特异性损伤胰腺β细胞,10天后小鼠出现持续性高血糖症状,血糖水平>20 mM(且连续≥3天维持该水平)(图S13)[45-47]。本研究采用由透明聚氨酯膜与脱脂棉垫组成的医用敷料用于糖尿病伤口愈合——无菌敷料为市售产品,价格低廉且规格多样。将异质结聚合物点(100 μg/mL)与抗坏血酸(200 mM)的混合物直接负载到医用敷料的脱脂棉垫中,用于糖尿病小鼠皮肤损伤的抗炎治疗;其中,防水透明膜既便于光照,又能促进氢气向皮肤组织扩散。
在糖尿病小鼠背部构建直径为1 cm的圆形皮肤伤口,作为皮肤伤口模型。将负载聚合物点的无菌敷料贴于小鼠伤口处,并进行红光照射(650 nm,60 J/cm²)以启动光催化产氢疗法,随后对12天内的伤口愈合过程进行监测(图4a)。与细胞实验(45 J/cm²)相比,本实验提高了光照剂量(60 J/cm²),以补偿组织相关的能量损耗,确保在伤口部位产生有效的局部光催化产氢效果。
图4b展示了12天内不同治疗方案下糖尿病伤口的变化图像。仅接受红光照射或仅使用异质结聚合物点的糖尿病小鼠,伤口愈合进程缓慢,与未治疗的糖尿病对照组相比改善甚微;相反,采用负载聚合物点的敷料进行光催化产氢治疗的小鼠,其背部皮肤伤口愈合速度显著加快。图4c呈现了所有实验组伤口形态及面积的变化,结果显示经医用敷料结合光照治疗的小鼠,其伤口愈合速度已接近健康小鼠水平。截至第12天,敷料结合光照治疗组的伤口愈合率超过97%(图4d、e),显著高于其他治疗组,且伤口处出现明显毛发生长,皮肤形态恢复健康状态。额外实验结果证实,仅负载抗坏血酸或仅负载聚合物点的医用敷料,在光照条件下对伤口愈合无明显促进作用(图S14)。这些结果表明,搭载聚合物点光催化体系的医用敷料,在红光照射下可有效催化产氢,并显著促进糖尿病小鼠皮肤伤口愈合。
我们进一步评估了光催化产氢对皮肤组织再生的影响。对不同治疗方案下小鼠(第12天)背部切除的皮肤组织进行组织学检查(图4f):苏木精-伊红(H&E)染色结果显示,经医用敷料结合光照治疗的糖尿病小鼠,其皮肤表皮结构更完整、表皮细胞层排列更规则,且炎症细胞浸润显著减少,这些特征与健康小鼠皮肤高度相似;马松三色染色结果进一步证实了该治疗方案的疗效——再生皮肤组织中胶原纤维密度增加,细胞核形态更规则。综上,这些结果表明光催化产氢治疗有助于糖尿病小鼠受损皮肤组织的结构修复与再生。
最后,我们探究了负载聚合物点的医用敷料通过光催化产氢对免疫调节性极化的影响。对第12天收集的皮肤组织进行免疫荧光分析,以评估糖尿病小鼠体内巨噬细胞极化及炎症相关细胞因子的表达情况(图5)。巨噬细胞在伤口愈合过程中发挥关键作用——通过极化为促炎的M1型或抗炎的M2型,调控炎症相关细胞因子的表达[48-51]。本研究中,CD86被用作M1型巨噬细胞的特异性标志物,而CD206则被用作M2型巨噬细胞的特异性标志物[52-54]。为评估伤口部位巨噬细胞的极化情况,我们采用上述标志物对皮肤组织进行免疫荧光染色。
图5显示,糖尿病小鼠皮肤组织中CD86的红色荧光信号较强,且促炎细胞因子(IL-1β、IL-6、TNF-α)表达水平升高,表明巨噬细胞向M1型极化,这也是导致皮肤伤口愈合延迟的原因之一。仅接受光照或仅使用医用敷料的小鼠也呈现出类似结果,说明单一的光照或敷料处理对调控炎症微环境的作用有限。与之相反,经医用敷料结合光照治疗的小鼠,其皮肤组织中CD86荧光信号显著减弱,而CD206荧光信号明显增强。荧光定量分析结果显示,在聚合物点结合光照治疗组的小鼠组织中,CD206荧光强度是CD86的3倍以上(图5c),这表明氢气可介导巨噬细胞从促炎的M1型极化为抗炎的M2型。相应地,接受氢气治疗的小鼠体内促炎细胞因子(IL-1β、IL-6、TNF-α)水平大幅降低,而抗炎细胞因子(IL-10)及转化生长因子-β(TGF-β)的表达水平,较仅接受聚合物点或仅接受光照治疗的糖尿病小鼠提高了5倍以上(图5d)。这种表型转换与正常小鼠组的反应高度相似,表明氢气治疗有助于糖尿病伤口的组织再生与炎症缓解。上述发现证实,负载聚合物点的医用敷料在糖尿病伤口愈合中发挥着关键作用。
■ 结论
本研究开发了一种负载异质结聚合物点(Pdots)的医用敷料,用于光催化产氢及糖尿病伤口愈合。通过构建以半导体聚合物PM6为给体、富勒烯衍生物PCBM为受体的异质结结构,我们发现该聚合物点在650 nm红光照射下可高效产氢,且相较于以往研究,其羟基自由基清除能力显著增强。光照条件下,负载聚合物点的医用敷料能明显加速糖尿病小鼠的伤口闭合,促进皮肤组织再生并恢复正常形态。机制研究表明,具有光催化产氢功能的聚合物点可通过下调促炎细胞因子、诱导巨噬细胞从M1型极化为M2型,有效减轻氧化应激与炎症反应,最终实现与健康小鼠相近的伤口愈合效果。值得注意的是,该医用敷料光毒性可忽略不计,且无需全身给药即可发挥作用,为伤口愈合提供了一种安全的治疗方案。
与金属基纳米催化剂及模拟酶纳米颗粒相比,本研究中的异质结聚合物点具有优异的生物相容性,更适用于生物医学领域;同时,其在650 nm红光照射下具有更强的组织穿透能力,且可直接负载于无菌医用敷料上,操作简便。本研究证实了负载聚合物点的医用敷料作为可持续氢气治疗平台的潜力,为解决糖尿病患者及其他类型皮肤伤口的慢性炎症与愈合障碍问题提供了一种极具前景的策略。未来研究中,我们将进一步探索基于聚合物点的光催化产氢策略在生物医学领域的更多应用。
■ 实验部分
异质结聚合物点(Pdots)的制备与表征
半导体聚合物PM6与富勒烯衍生物PCBM购自深圳市德润达光电材料有限公司。所有化学试剂均购自不同供应商,具体信息详见我们此前的报告[40,41]。采用再沉淀法制备异质结聚合物点:分别将给体聚合物PM6溶于三氯甲烷、受体PCBM溶于四氢呋喃(THF)、两亲性共聚物PSMA溶于四氢呋喃,配制浓度均为1 mg/mL的储备液;按设定的给体-受体比例混合上述溶液,并用四氢呋喃进一步稀释,得到前驱体溶液。在持续超声条件下,将5 mL聚合物前驱体溶液分5次快速注入10 mL超纯水(Milli-Q水)中,继续超声3分钟以确保混合均匀。通过旋转蒸发仪浓缩所得分散液,去除残留的四氢呋喃与水分;最终的聚合物点水溶液经0.22 μm纤维素膜过滤,以去除大颗粒杂质。
采用紫外-可见吸收光谱仪(UV-2600,日本岛津公司)测定聚合物点的光学性能;通过动态光散射仪(DLS,英国马尔文仪器公司Zetasizer Nano ZS,型号ZEN3601)分析聚合物点的水动力学直径;利用透射电子显微镜(TEM,日本日立公司HT7700)进一步表征聚合物点的尺寸与形貌;通过气相色谱仪(GC7920-1,北京奥普乐仪器有限公司)评估其产氢性能。
异质结聚合物点的羟基自由基抗氧化能力测定
采用OxiSelect羟基自由基抗氧化能力(HORAC)试剂盒(美国Cell Biolabs公司,加利福尼亚州圣迭戈市)评估异质结聚合物点的抗氧化能力。将异质结聚合物点与含荧光素和自由基引发剂的反应液混合,使用酶标仪(激发波长/发射波长:485 nm/535 nm)实时监测荧光变化。通过计算荧光衰减曲线下面积(AUC)对 antioxidant capacity进行定量,并以没食子酸为参比抗氧化剂,结合标准曲线进行校准。AUC值越高,表明待测样品的羟基自由基清除能力越强。
在TA-TAOH实验中,以过氧化氢(H₂O₂)作为白光照射下产生羟基自由基(•OH)的前体物质。非荧光性对苯二甲酸(TA)可与•OH特异性反应,生成具有强蓝色荧光的2-羟基对苯二甲酸(TAOH)。为评估•OH清除效率,配制多组总容积为1.5 mL的反应体系,分别含TA(6 mM)、(或不含)异质结聚合物点(0.1 mg/mL)、(或不含)H₂O₂(50 mM)。经650 nm红光(25 mW/cm²)持续照射2小时后,使用荧光分光光度计(日本日立公司F-4600)测定TAOH的荧光强度。荧光强度降低表明异质结聚合物点在光催化条件下具有有效的•OH清除能力。
细胞实验
RAW 264.7巨噬细胞的培养、脂质体-聚合物点(Lipo-Pdots)的制备及细胞存活率实验均参照我们近期报告中的实验方案进行[41]。通过共聚焦荧光成像测定聚合物点对细胞内活性氧(ROS)的产生与清除作用:将巨噬细胞以1×10⁴个细胞/cm²的密度接种于玻璃底培养皿中,培养至汇合度约70%;加入脂多糖(LPS,1 μg/mL)处理6小时,诱导细胞内氧化应激;随后分别进行以下处理:与Lipo-Pdots(0.2 mg/mL)共孵育、经650 nm红光(25 mW/cm²)照射30分钟,或二者联合处理。
不同处理后,向细胞中加入ROS敏感型荧光探针CellROX Deep Red(5 μM),以定性评估细胞内ROS水平;加入4',6-二脒基-2-苯基吲哚(DAPI,5 μg/mL)对细胞核进行染色20分钟,随后用磷酸盐缓冲液(PBS)清洗。使用共聚焦激光扫描显微镜(德国卡尔蔡司公司LSM 980)获取共聚焦荧光图像:DAPI(蓝色通道)激发波长设为405 nm,CellROX Deep Red(红色通道)激发波长设为639 nm。
小鼠糖尿病伤口愈合实验
雌性BALB/c小鼠(体重约20 g,6-8周龄)购自广东杰特赛特生物科技有限公司。所有动物实验均经南方科技大学机构动物护理和使用委员会(IACUC)批准。将链脲佐菌素(STZ)溶于柠檬酸盐缓冲液(由柠檬酸与柠檬酸钠配制)中,通过单次腹腔注射(剂量180 mg/kg)诱导小鼠糖尿病。小鼠禁食过夜后,连续10天测定血糖水平;筛选出血糖稳定升高(血糖值>20 mM)的小鼠,随机分为5组(每组n=5),用于后续实验。在糖尿病小鼠与健康小鼠的背部皮肤均制造直径为1 cm的全层圆形皮肤伤口。
向每个无菌医用敷料中加载200 μL混合溶液(含异质结聚合物点0.1 mg/mL与抗坏血酸200 mM)。在伤口造模后的第1、2、3、5、7、9天,对小鼠进行以下处理:贴敷医用敷料、(或不)经650 nm红光(50 mW/cm²)照射20分钟。第12天,处死小鼠,切除皮肤伤口组织,采用苏木精-伊红(H&E)染色与马松三色染色进行组织学分析;同时通过免疫荧光染色测定伤口组织中细胞因子CD86、CD206、转化生长因子-β(TGF-β)、白细胞介素-10(IL-10)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)的表达水平,以进一步探究该治疗方案对炎症的调控机制。
通讯作者
Chengbo Liu − Research Center for Biomedical Optics and Molecular Imaging, State Key Laboratory of Biomedical Imaging Science and System, Shenzhen Institute of Advanced Technology, Chinese Academy of Sciences, Shenzhen 518055 Guangdong, China; Email: cb.liu@siat.ac.cn
Peng Shu − HBN Research Institute and Biological Laboratory, Shenzhen Hujia Technology Co., Ltd., Shenzhen 518000 Guangdong, China; Guangdong Engineering Technology Research Center for Functional Skincare Innovation, Shenzhen Hujia Technology Co., Ltd., Shenzhen 518000 Guangdong, China; Email: shupeng@hbn.cn
Changfeng Wu − SUSTech−HBN Joint Laboratory of Optical Molecule and Skin Imaging, Department of Biomedical Engineering, Southern University of Science and Technology, Shenzhen 518055 Guangdong, China;
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1510107.html?mobile=1
收藏

