新型冠状病毒(SARS-CoV-2)大流行导致呼吸机和人工肺的临床需求激增,造成可用设备严重短缺,危及全球患者生命。受泥鳅等通过肠道空气呼吸的生物启发,本研究在啮齿动物和猪模型中证实了肠内通气法在实现全身氧合方面的有效性。经直肠输注液态氧气(即共轭全氟碳化合物,这类化合物历史上曾用于临床,通过气道给药实现液体通气)的耐受性良好,且在改善严重呼吸衰竭方面疗效显著。因此,通过将远端肠道改造为辅助呼吸器官,肠内通气疗法为急需呼吸支持的患者提供了一种新的辅助治疗范式。
研究亮点
1. 肠内通气(EVA)可实现哺乳动物的全身氧合
2. 在呼吸衰竭临床前模型中,肠内通气可提高存活率并改善机体活动能力
3. 在临床前模型中,肠内通气未引发明显并发症
4. 肠内通气或可成为治疗呼吸衰竭患者的突破性方法
背景
泥鳅等多种水生生物进化出了独特的肠道呼吸机制,以在严重缺氧环境中存活。迄今为止,哺乳动物能否利用类似能力,将肠道作为另一个气体交换部位,这一问题仍存在巨大争议。本研究通过肠内通气(经肛门肠内通气,EVA)技术,首次证实了哺乳动物体内肠道呼吸现象的可行性。
方法
在呼吸衰竭实验模型中,研究人员探究了两种不同的肠内通气模式:经直肠氧气通气(气态EVA,g-EVA)和经直肠输注含氧全氟碳化合物的液体通气(液态EVA,l-EVA)。在诱导小鼠和猪出现1型呼吸衰竭后,分析气态EVA和液态EVA的疗效,并在大鼠模型中进行临床前安全性分析。
结果
经直肠输注氧气和含氧液体均能有效挽救呼吸衰竭实验模型,提高模型动物的存活率、改善其活动能力并提升全身氧水平。啮齿动物和猪模型研究证实,灌肠式液态EVA操作具有良好的耐受性和可重复性,且未出现明显并发症。
结论
研究证实肠内通气在哺乳动物体内具有显著疗效,可实现全身循环氧合并改善呼吸衰竭症状。鉴于全氟化合物的临床安全性已得到验证,肠内通气有望为呼吸窘迫患者提供一种新的辅助氧合手段。
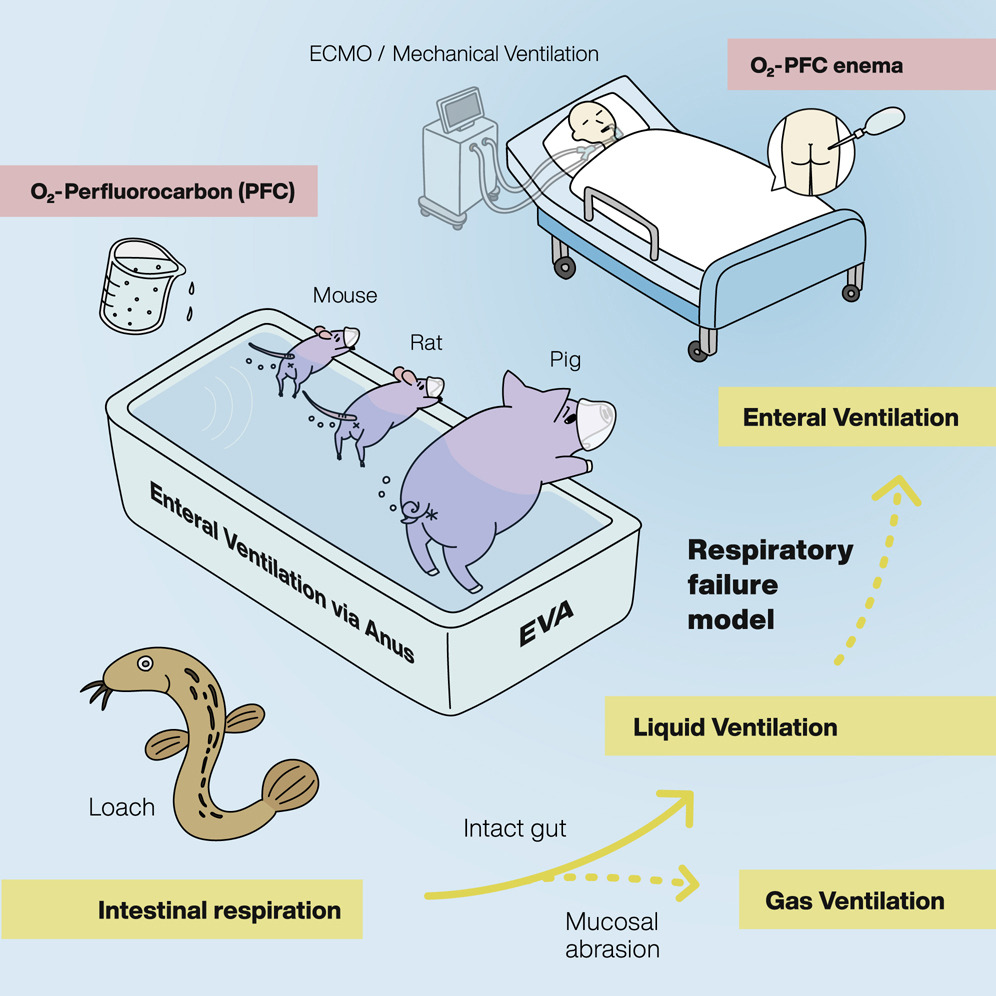
图文摘要
引言
改善缺氧是缓解呼吸衰竭的核心关键。值得注意的是,多种非哺乳动物进化出了特殊的辅助呼吸机制,可通过肺或鳃以外的器官适应缺氧环境并存活。例如,泥鳅(Misgumus anguillicandatus)、海参、 Corydoras(兵鲶属鱼类)及 Tetragnatha praedonia(一种蜘蛛)均利用后肠进行呼吸[1-3]。20世纪50-60年代的早期研究曾探索人类和动物体内的类似机制,但关于哺乳动物消化道(主要是上消化道)呼吸能力的研究结果可信度极低[4-7]。
哺乳动物直肠是一个由较薄黏膜层(尤其在肛管周围)覆盖的体腔,通过与门静脉和体循环均相连的痔静脉丛,直肠区域可实现丰富的血管引流。因此,经肛门给药易于在直肠区域吸收,且吸收速度快[8]。基于这一解剖学特征,我们推测哺乳动物的远端肠道可通过肠腔高效接触黏膜下血管,从而实现潜在的气体交换。
结果
泥鳅的后肠由极薄的上皮层、丰富的毛细血管和红细胞构成[9],这种结构使其在严重缺氧环境中能通过肠腔获取氧气(O₂)。为模拟这类肠道呼吸生物的远端肠道上皮结构,我们尝试磨损黏膜屏障以促进气体更高效扩散。首先,评估了化学和机械两种上皮层变薄方法对促进远端肠道气体交换的作用。在此过程中,我们筛选出了最利于肠道静脉流出氧合的方案[9](表S1,组1-8;图1B)。结果显示,中度机械磨损方案最利于肠腔氧气交换:与未磨损组相比,中度磨损组下腔静脉的溶解氧水平升高了13.6±5.66 mmHg(图1A-1C)。实时定量逆转录聚合酶链反应(qRT-PCR)分析表明,中度或重度磨损后,小鼠肠道中与血管生成相关的 Vegfa 基因和与黏膜炎症相关的 Anxa1 基因表达均显著上调,且泥鳅肠道中这两个基因的表达也出现类似上调(图S1A)[9]。因此,通过磨损预处理黏膜,可促进经肛门气态肠内通气(g-EVA)介导的远端肠道气体交换[10]。

图1 经肛门气态肠内通气(EVA)通过全身氧合挽救致命性缺氧
肠道上皮黏膜处于厌氧环境中,氧分压(PO₂)<10 mmHg,且对缺氧刺激敏感[10]。为进一步评估局部组织缺氧的变化,我们采用缺氧探针-1(Hypoxyprobe-1)试剂盒对缺氧处理(吸入氧浓度FiO₂=0.10)的小鼠肠道进行免疫化学染色,分为气态EVA处理组和未处理组。结果显示,未进行气态EVA处理时,正常小鼠的缺氧细胞(阳性染色细胞)仅局限于黏膜上皮;而吸入缺氧气体后,强阳性染色细胞数量显著增加,且分布于黏膜、黏膜下层及结缔组织中(图1D、S1B、S1C)。与之相反,无论是否进行黏膜磨损,气态EVA处理组的缺氧细胞数量均明显减少(图1D、S1C)。
我们进一步验证了气态EVA是否具有全身氧合作用及治疗效果,评估了其在致命性缺氧(FiO₂=0.08)条件下对模型动物的存活保护作用(表S1,组15-17)。对照组存活率为0%,中位存活时间<700秒(11分钟);相比之下,肠道完整的气态EVA处理组中位存活时间为1127秒(18分钟);而黏膜磨损+气态EVA处理组在50分钟时存活率达75%,与对照组相比差异具有统计学意义(p<0.001,Kaplan-Meier法及log-rank检验;图1E)。黏膜磨损+气态EVA处理组的致命性症状(如心脏骤停、濒死喘息持续、肠系膜动脉搏动消失)均得到缓解(表S2)。此外,黏膜磨损+气态EVA处理组下腔静脉氧分压显著高于假手术组(p=0.004):假手术组、未磨损+气态EVA组、磨损+气态EVA组的静脉氧分压分别为31.6±7.44、32.9±10.6、40.3±9.57 mmHg(FiO₂=0.21;图1F)。三组间的静脉pH值、静脉二氧化碳分压(CO₂)、碱剩余浓度、碳酸氢根离子浓度及乳酸浓度均无显著差异(图1G、1H、S2A-S2C)。类似地,在吸入缺氧气体条件下,磨损+气态EVA处理组小鼠心脏左心室动脉氧分压显著高于假手术组(p=0.030):假手术组与磨损+气态EVA组的氧分压分别为40.0±2.94、63.3±6.94 mmHg(FiO₂=0.10;图1I),两组间pH值和二氧化碳分压无统计学差异(图S2D、S2E)。以上结果表明,肠道气态通气可有效实现全身氧合,并缓解致命性缺氧。
尽管气态EVA(尤其在黏膜磨损条件下)具有一定疗效,但其临床可行性较低,对重症患者而言尤为如此。因此,我们尝试采用含氧全氟癸烷(PFD)——一种对氧气和二氧化碳具有优异吸附能力的液体,构建液态EVA(l-EVA)。全氟化合物具有良好的生物相容性,且经气道[11]、眼部[12]及血液[13]输注的人体安全性已得到验证;在临床中,全氟化合物的液体或气溶胶形式已用于肺内给药,以减轻儿童重症呼吸功能不全患者的肺损伤[11]。此外,全氟化合物表面张力低、密度高,可用作表面活性剂替代品[11,14]。理论上,通过直肠给药方式将疏水性、疏脂性全氟化合物作为惰性氧气载体,相比气态通气具有多项优势[8]。
本研究制备了载氧PFD(每分钟通入1升氧气,持续45分钟;图2A),随后对小鼠进行直肠输注,总剂量为每只小鼠1毫升,定义为液态EVA组。检测显示,PFD中的平均氧分压为438±19.9 mmHg(n=3;图S2J)。在10%氧浓度舱内的非致命性呼吸衰竭小鼠模型中(方法详见原文),评估液态EVA的治疗效果。结果显示,缺氧诱导后,延时视频分析表明液态EVA处理可显著缓解小鼠症状(视频S2)。对小鼠行走距离的统计显示,在缺氧舱内(FiO₂=0.10),载氧PFD输注组的行走距离显著高于假手术组(假手术组:0.408±1.02厘米/20秒;治疗组:3.34±4.05厘米,p<0.0001,图2B)。接下来,在10%缺氧条件下对人工通气控制的小鼠进行脉搏血氧饱和度(SpO₂)持续监测,结果显示缺氧缓解效果至少可维持60分钟(图2C)。在室内空气环境中,液态EVA组下腔静脉氧分压显著高于假手术组(120分钟时,p=0.037),两组差值为9.40±3.65 mmHg(图2D)。尽管假手术组与液态EVA组的静脉pH值无显著差异(图2E),但液态EVA组的静脉二氧化碳分压、碱剩余浓度及碳酸氢根离子浓度均呈下降趋势(分别为p<0.0001、p=0.021、p=0.001;图2F、S2F、S2G)。液态EVA处理60分钟后,处理组小鼠心脏左心室氧分压显著高于对照组(图S2H);120分钟时两组差值更显著(23.8±3.11 mmHg,p=0.020),而两组pH值无统计学差异(图S2I)。此外,我们还比较了液态EVA模型中载氧PFD处理后小鼠心脏心室的氧分压,发现在缺氧环境下,气态EVA组与液态EVA组的心室氧分压相当(气态EVA组:动脉氧分压PaO₂=63.3±6.95 mmHg;液态EVA组:PaO₂=63.8±5.59 mmHg,p=0.80)。以上数据表明,在肠道完整的缺氧小鼠模型中,经直肠输注载氧PFD即可有效恢复氧合水平。

图2 基于载氧全氟化合物(PFC)的肠内通气(EVA)在肠道完整情况下挽救致命性缺氧
视频S1. 气态EVA(g-EVA)准备过程,与图1相关
Mammalian enteral ventilation ameliorates respiratory failure: Med
视频S2. 液态EVA(l-EVA)处理组与假手术组在缺氧舱内的活动能力改善情况,与图2相关
为进一步评估肠内通气机制的治疗潜力,我们在大型动物模型的非致命性低通气(通气频率:5-6次/分钟)条件下应用了液态EVA(具体方法见原文“方法详情”部分)。在猪模型中,我们通过反复经直肠输注载氧全氟癸烷(O₂-PFD),对脉搏血氧饱和度(SpO₂)和血气指标进行了分析(图3A、3B)。输注400毫升载氧全氟癸烷后,猪的SpO₂和动脉氧分压(PaO₂)分别提升了15%(从66.6%±24.1%升至81.8%±11.2%,p=0.018)和13 mmHg(从57.2±13.5 mmHg升至70.8±6.22 mmHg,p=0.037;图3C、3D),而pH值、碳酸氢根离子浓度(HCO₃⁻)和呼气末二氧化碳分压(EtCO₂)未发生显著变化(pH值:从7.24±0.0837升至7.27±0.0665,p=0.053;HCO₃⁻:从26.5±8.55降至25.7±7.81,p=0.13;EtCO₂:从50.2±8.60 mmHg降至46.3±6.50 mmHg,p=0.053;图3E、3G、3H)。与之相对,动脉二氧化碳分压(PaCO₂)呈下降趋势(从61.5±18.8 mmHg降至54.4±10.5 mmHg,p=0.098;图3F)。移除释放完氧气的全氟癸烷并重新输注载氧全氟癸烷后,上述过程可周期性重复。在该重复循环中,载氧全氟癸烷对SpO₂和PaO₂的改善效果具有一致性和可重复性(较治疗前分别提升1.44±0.803倍和1.31±0.410倍,图3C、3D)。每次输注载氧全氟癸烷后,SpO₂改善(提升>5%)的平均持续时间为18.7±2.31分钟。整个实验过程中未观察到明显副作用,液态EVA处理组中与缺氧相关的皮肤苍白和末梢发冷症状均得到缓解(表S3)。以上结果证实,肠内通气(EVA)这一原理验证性方法,在两种哺乳动物模型中均能有效供氧并缓解呼吸衰竭症状。
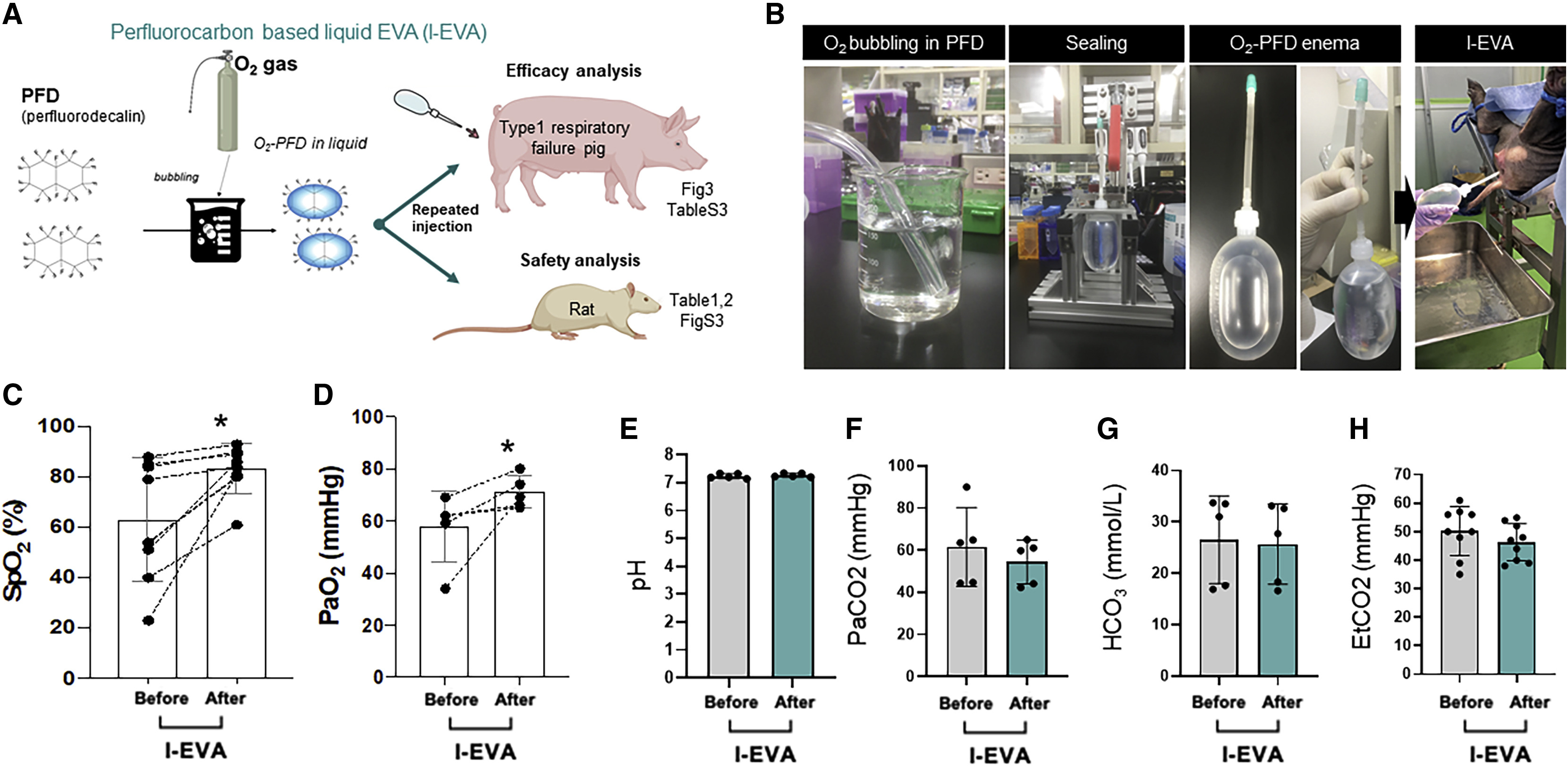
图3 液态EVA(l-EVA)在猪缺氧模型中实现全身性、可重复性氧合
为进一步评估液态EVA的安全性,我们在大鼠模型中建立了全氟癸烷(PFD)定量检测方法,以确定输注的化学物质是否存在潜在吸收。气相色谱-质谱联用(GC-MS)分析显示,尽管在几乎所有时间点均检测到微弱的色谱峰,但血清中全氟癸烷浓度仍低于定量下限(1 μg/mL,表1)。体格检查未发现腹泻、脱水等明显副作用。在第2天对大鼠进行大剂量全氟癸烷输注(6次输注,两种剂量:每次1毫升和1.5毫升)后,全面实验室检测进一步证实了安全性——包括血细胞比容、白蛋白和电解质在内的所有检测指标均未出现异常升高(表2)。对反复接受液态EVA处理的猪和大鼠进行死后病理分析发现,其肠道、肝脏/胆管和脾脏结构完整,网状内皮细胞未出现胞质空泡化(这是全氟癸烷全身吸收和蓄积的组织病理学特征[15],图S3A、S3B)。其他器官毒性标志物,如天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、谷氨酸脱氢酶(GLDH)、碱性磷酸酶(ALP)和肌酸激酶(CK),其水平与生理盐水对照组相当或更低(表2)。我们还检测了小鼠和猪血清中的细菌内毒素(脂多糖[LPS])水平,结果均低于检测下限(<0.003 EU/mL,表3),缓解了对细菌移位的担忧。因此,在我们的临床前模型中,至少在短期内,液态EVA方案未引发明显副作用。
表1 气相色谱-质谱联用检测全血中全氟癸烷(PFD)浓度
LLOQ:定量下限(1 μg/mL)。
表2 实验室检测评估全身毒性
ALP:碱性磷酸酶;AST:天冬氨酸转氨酶;CK:肌酸激酶;N.S.:无统计学意义。
与生理盐水对照组相比,各全氟癸烷处理组的ALT水平均有统计学意义上的降低,但这种差异是由生理盐水对照组ALT水平较高所致,并非全氟癸烷诱导的降低。
表3 输注载氧全氟癸烷(O₂-PFD)后的血清内毒素滴度
LLOQ:定量下限(0.003 EU/mL)。
讨论
受水生生物启发,我们在多种哺乳动物中探索了肠道通气机制。综合证据表明,通过气态EVA(g-EVA)和液态EVA(l-EVA)方案,经直肠途径实现具有治疗意义的高效气体交换是可行的。
在泥鳅(Misgurnus anguillicaudatus)中,肠道空气呼吸功能在孵化后约10天开始发育。近期对泥鳅后肠不同发育阶段的RNA测序(RNA-seq)分析发现,存在与肠道空气呼吸功能获得密切相关的基因特征,例如血管生成相关基因(VEGFA、SPON1B)和黏膜炎症相关基因(ANXA1)上调,氧化磷酸化相关基因(GDH)下调[9]。通过检测小鼠同源基因(Vegfa、Spon1、Anxa1、Glud1)在气态EVA处理后的表达,我们观察到小鼠远端肠道也出现了类似的基因表达变化(图S1A)[9]。在正常氧环境中,泥鳅通常通过鳃呼吸;但在缺氧环境下,它们会将后肠转化为辅助呼吸器官以维持生存。当长期处于缺氧环境时,泥鳅及其他具有类似功能的生物会通过调控转运体基因和血管生成基因,将肠道的消化功能转变为呼吸功能,同时增强自身的抗氧化系统和免疫防御能力[16]。气态EVA或液态EVA可能会像泥鳅那样,通过改变肠道消化功能(如降低转运体活性)来促进氧合,这一可能性仍需进一步研究。深入阐明肠道氧合的生理特征和分子机制,将有助于最大化肠道通气的氧合效率。
全氟化合物的应用为肠内通气的临床转化提供了有利条件,因为多项采用不同给药方式的临床研究均证实其在患者体内具有良好的安全性和耐受性[11-13]。例如,当全氟化合物乳剂通过血管或气道直接给药时,仅观察到较轻微的副作用,包括血压升高和器官损伤[12,17-19]。若按人体应用比例换算,该方法实现的动脉氧合水平可能足以缓解重症呼吸衰竭患者的症状。向体重10-20公斤的猪输注200-400毫升全氟癸烷后,其PaO₂提升了13 mmHg(从57.2±13.5 mmHg升至70.8±6.22 mmHg),血氧饱和度(SaO₂)提升了7%(从84%升至91%)[20]。根据氧含量计算公式(CaO₂=1.34×血红蛋白浓度×SaO₂ + 0.003×PaO₂),可算出通过肠内通气吸收的溶解氧为13.1毫升。假设一名60公斤的患者通过EVA获得相同的气体交换效率,那么38.6毫升的氧气输送量可使SaO₂提升5%,PaO₂提升10-20 mmHg。本研究中使用的全氟癸烷氧气溶解度为50毫升/分升,因此输注600-1200毫升载氧全氟癸烷有望提供具有救命意义的氧合效果,且气体交换效率仍有进一步提升的空间。值得注意的是,液态EVA的全氟化合物用量远低于经肺全液体通气所需的用量(1800毫升,即30毫升/公斤体重)。鉴于我们的临床前研究未发现明显毒性事件(至少在短期内),液态EVA的潜在适应症可能包括需要即时氧合支持的患者,如支气管哮喘发作、气道狭窄、新生儿窒息和急性呼吸衰竭患者。
有趣的是,液态EVA处理组的动脉二氧化碳分压(PaCO₂)呈下降趋势,这可能归因于全氟化合物优异的氧气和二氧化碳携带能力(分别为50毫升氧气/分升和160-210毫升二氧化碳/分升),而实验中动脉pH值未发生变化。这些结果表明,全氟化合物还可作为升高的二氧化碳的吸附剂,这提示未来需进一步研究肠道通气的气体交换机制。
在肺炎、急性呼吸窘迫综合征(ARDS)等重症导致的呼吸衰竭临床管理中,人工呼吸支持发挥着关键作用。机械通气是全球最常用的短期生命支持技术[21,22];而被称为体外膜肺氧合(ECMO)的“人工肺”,则是针对重症患者的另一种选择,常用作临时性姑息治疗手段[23]。然而,除了需关注机械通气相关肺损伤、出血和血栓形成等医源性并发症外,近期新型冠状病毒(SARS-CoV-2)大流行还导致呼吸机和ECMO的临床需求激增,造成设备严重短缺,危及全球患者生命。肠内通气(EVA)无需依赖此类有创呼吸设备,有望为短期内急需呼吸支持的患者提供一种新的辅助治疗范式。
研究局限性
本研究的第一个局限性是肠道氧合机制尚不明确。我们的综合数据(氧气升高、二氧化碳降低且无全氟癸烷吸收)支持存在基于扩散的气体交换机制(最可能发生在直肠区域),且全氟化合物的应用可增强该过程,但仍需进一步的机制研究验证。第二个局限性是,我们主要在类窒息性呼吸衰竭模型中评估了EVA的疗效;未来需在伴有全身炎症的重症肺炎和ARDS模型中开展进一步治疗研究,以扩大肠内通气方法的临床意义。第三个局限性是,尽管临床前动物研究证实了其显著的短期安全性,但在该方法广泛应用于临床前,评估其在人体中的安全性至关重要。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1510072.html?mobile=1
收藏

