嗜热菌氢气的代谢调节作用
氢气在嗜热自养型硫还原菌中调控氢化酶及还原性三羧酸循环的关键作用
博主点评:氢气医学效应机制是极其重要的研究内容,但一直没有取得突破性进展。研究氢气效应机制有一种可能途径,就是对氢气微生物效应进行深入研究,因为氢气在微生物中的作用更为明确,且存在代谢氢气的明确途径。对氢气微生物效应机制的分析能给氢气在高等生物效应研究中提供重要参考,甚至能找到真正的效应基础。
深海热液喷口处的许多嗜热自养菌为厌氧菌,其生长需要氢气(H₂)。然而,目前对于非产甲烷型嗜热氢营养菌如何适应低氢气环境的认知仍处于初步阶段。本研究以嗜热自养型硫代硫酸盐还原菌——热石营养脱硫杆菌(*Desulfurobacterium thermolithotrophum*)HR11为研究对象,在恒化器中于72°C条件下,分别以2 μM和43 μM的水溶液氢气浓度培养该菌株,以量化其生长速率、硫化氢(H₂S)产率动力学变化,以及蛋白质组对氢气可利用性的响应。
在2 μM氢气浓度条件下,培养体系的比生长速率、最大细胞浓度及硫化氢产量均下降,但细胞产率(每摩尔硫化氢对应的细胞生成量)未发生改变。差异蛋白质组分析显示,在检测到的887种蛋白质中,2 μM氢气条件下有79种蛋白质的丰度显著升高(倍数变化>2,校正后p值<0.01),66种蛋白质的丰度显著降低(倍数变化>2,校正后p值<0.01)。其中,在2 μM氢气培养的细胞中,膜结合型铁氧还蛋白依赖的[镍铁]([NiFe])氢化酶,以及胞质中NAD(P)⁺依赖的[NiFe]氢化酶丰度升高。此外,2 μM氢气条件下,膜结合型甲基萘醌依赖的[NiFe]氢化酶丰度增加——该酶可能通过产生质子动力势驱动ATP合成;而膜结合型甲基萘醌依赖的[铁铁]([FeFe])氢化酶与膜结合型NADH脱氢酶丰度则下降。用于二氧化碳(CO₂)固定的4种还原性三羧酸循环酶,在2 μM氢气条件下丰度同样更高。这些数据表明,氢化酶与CO₂固定酶的丰度受氢气可利用性调控,且支持以下观点:在低氢气环境中,该菌株的电子流向发生偏移,更倾向于CO₂的还原与同化。
研究意义
了解热石营养脱硫杆菌这类嗜热自养型硫还原菌如何适应不同氢气浓度,对于理解能量受限的海底热液环境中微生物的竞争与生存策略至关重要。本研究发现,热石营养脱硫杆菌在低氢气条件下会发生代谢适应性变化——当氢气受限(且该环境中通常还存在产甲烷菌等其他嗜热氢营养菌)时,这种代谢适应可能使其在热液喷口生态系统中具备竞争生长优势。此外,本研究还揭示了不同类型氢化酶之间的动态关联,以及它们如何与CO₂固定等其他关键代谢途径相互协调。
引言
嗜热硫还原微生物在深海热液喷口生态系统中发挥核心作用,参与硫循环与碳循环过程[1]。热液喷口的典型特征是化学梯度与温度梯度陡峭,且氢气(H₂)等关键电子供体的可利用性存在差异[2,3]。由于热液系统的宿主岩石类型与形成年龄不同,喷口处H₂的可利用性会显著变化[2-5]。
脱硫杆菌属(*Desulfurobacterium*)与热弧菌属(*Thermovibrio*)是热液喷口处常见的嗜热自养型硫还原菌与硫代硫酸盐还原菌[6-9],且常与产甲烷菌等其他嗜热氢营养菌共同被检测到[10-15]。这表明这些氢营养菌在自然生境中存在H₂竞争。在这类环境中,微生物适应低H₂浓度的能力,对其与其他氢营养菌的竞争及自身生存至关重要。
目前,关于氢营养菌在H₂受限条件下的生长动力学与生理变化研究,主要集中于产甲烷菌。产甲烷菌在H₂受限时会呈现“生长速率降低但细胞产率(即每摩尔甲烷对应的生物量生成量)升高”的代谢权衡现象[16-19]。此外,在低H₂培养条件下,产甲烷菌的CO₂固定途径会发生酶系切换:从主要依赖H₂驱动的亚甲基四氢甲烷蝶呤(H₄MPT)脱氢酶,转为依赖辅酶F₄₂₀的亚甲基-H₄MPT脱氢酶[17-19]。低H₂环境下的生长,加之产甲烷反应吉布斯自由能降低,还会导致CO₂与甲烷之间的碳同位素分馏效应增强[19-21],有研究认为这是由于热力学驱动不足及伍德-永达尔(Wood-Ljungdahl)产甲烷途径逆向进行所致[20]。
与之类似,热石营养脱硫杆菌HR11也存在“生长速率-生长产率”的代谢权衡现象,表现为生长速率下降[22]。此前研究发现,该菌株在低H₂条件下培养时,尽管细胞浓度与高H₂条件下相近,但未检测到硫化物生成。然而,H₂受限对嗜热自养型硫还原菌生理特性的影响尚不明确。
本研究在恒化器中以高、低两种H₂浓度培养热石营养脱硫杆菌HR11,量化其比生长速率、H₂S产量及细胞产率(每摩尔H₂S对应的细胞生成量)变化。通过整合新的长读长测序数据与此前的基因组草图[23],完成了该菌株的全基因组测序。结合恒化器实验与蛋白质组分析,识别差异丰度蛋白质,旨在验证热石营养脱硫杆菌HR11是否存在指示“生长速率-生长产率”代谢权衡的生理特征变化。本研究有助于深入理解嗜热硫代硫酸盐还原菌的生理特性,及其在海底生物圈中的生态功能与竞争动态。
结果
基因组测序
采用牛津纳米孔(Oxford Nanopore)长读长测序技术,对热石营养脱硫杆菌HR11进行全基因组测序,获得278,596条质控后读段,测序碱基总量为614,571,448 bp。基因组组装结果显示,该菌株基因组包含1条完整的环状染色体(长度1,562,359 bp)与1条完整的环状质粒(长度11,424 bp)。将纳米孔测序数据与此前的Illumina MiSeq测序数据[23]整合后,基因组平均覆盖度超过1700倍。注释结果显示,染色体上共含有1650个蛋白质编码基因。
生长动力学
在恒化器运行前的批次培养阶段,热石营养脱硫杆菌HR11的比生长速率随H₂浓度降低显著下降(P<0.001):43 μM H₂条件下为2.31±0.29 h⁻¹(95%置信区间,倍增时间18分钟,n=5),2 μM H₂条件下降至1.29±0.13 h⁻¹(倍增时间32分钟,n=5)(图1A)。
进入恒化器培养阶段后,体系中总细胞数量随H₂浓度降低显著减少(P<0.001):43 μM H₂条件下为1.94×10¹¹个细胞,2 μM H₂条件下降至2.51×10¹⁰个细胞(图1A)。恒化器中H₂S的生成量同样显著下降(P<0.001):43 μM H₂条件下为107±15 mmol(95%置信区间),2 μM H₂条件下降至13±2 mmol(图1B)。
在43 μM与2 μM H₂条件下,恒化培养阶段的平均细胞产率分别为2.40×10¹²个细胞/摩尔H₂S与2.21×10¹²个细胞/摩尔H₂S,二者无显著差异(P>0.5)(图S1)。
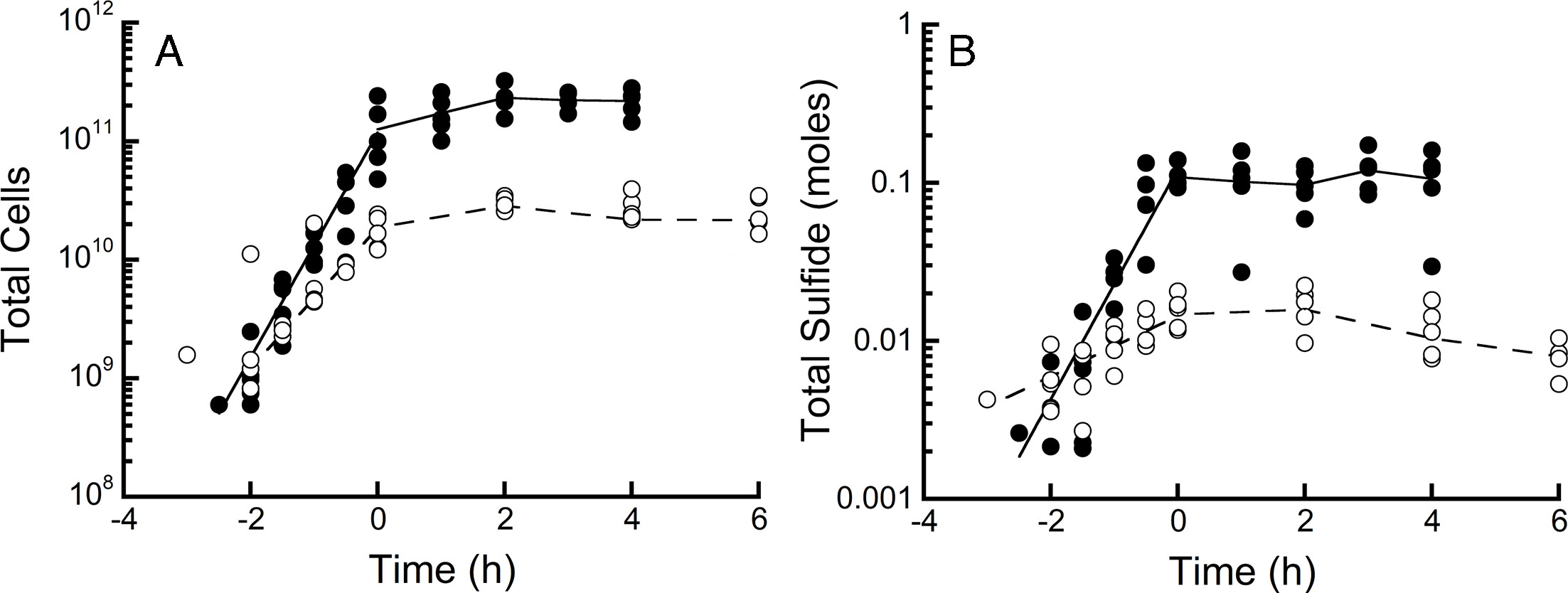 图1 热石营养脱硫杆菌的生长分析
图1 热石营养脱硫杆菌的生长分析
图1:热石营养脱硫杆菌HR11在批次培养阶段及后续恒化培养阶段,于43 μM(●)与2 μM(○)水溶液H₂条件下,每个生物反应器中的总细胞数量(A)与总硫化物含量(B)。恒化培养阶段从时间点0开始。
差异蛋白质组
分别从4个43 μM H₂恒化器与4个2 μM H₂恒化器中收集热石营养脱硫杆菌HR11的蛋白质样本。通过质谱检测共识别出887种独特蛋白质,其中737种蛋白质标记了等压标签,用于差异蛋白质组分析。
对8个蛋白质样本的主成分分析(图S2)与相关性分析(图S3)显示:4个43 μM H₂蛋白质样本(H1-H4)的相似性极高;4个2 μM H₂蛋白质样本中,有3个(L1-L3)的相似性极高。
负二项模型与蛋白质组数据分析及讨论
采用负二项模型对蛋白质组数据进行拟合,以估算蛋白质丰度变化,并解释生物变异性与重复样本离散度。通过多重检验校正P值,以控制假发现率。差异蛋白质组分析显示,共145种蛋白质的表达存在差异(平均倍数变化>2,校正后P值<0.01,图S4):与43 μM H₂条件相比,2 μM H₂条件下有79种蛋白质丰度升高超过2倍(表S1),66种蛋白质丰度降低超过2倍(表S2)。此外,有592种蛋白质虽被标记,但丰度变化不足2倍或校正后P值>0.01(表S3);150种蛋白质经质谱检测到,但未进行标记(表S4)。研究重点分析了蛋白质丰度差异与以下几类蛋白的关联:氢化酶、还原性三羧酸循环(rTCA循环)相关蛋白、NADH脱氢酶、推定的硫还原相关蛋白、c型细胞色素蛋白及膜结合型ATP合成酶。
HR11菌株基因组中含有两个操纵子:一个编码胞质中NAD(P)⁺依赖的[NiFe]氢化酶(*hydBCDA*,基因座标签GFV12_RS04425-GFV12_RS04440),另一个编码膜结合型铁氧还蛋白依赖的[NiFe]氢化酶(*echABCDEF*,基因座标签GFV12_RS04395-GFV12_RS04420),二者在同一条DNA链上相距51个核苷酸。估算结果显示,与43 μM H₂条件相比,2 μM H₂条件下培养的细胞中,HydBCDA丰度升高10.5-17.7倍(图2A、图3);同理,EchABCDEF丰度升高7.8-15.2倍(图2A、图3)。
HR11菌株基因组还包含两个编码膜结合型甲基萘醌依赖的氢化酶的操纵子,具体为一个[NiFe]氢化酶(*hynABC*,基因座标签GFV12_RS01850-GFV12_RS01860)和一个[FeFe]氢化酶(*hydLSH*,基因座标签GFV12_RS00720-GFV12_RS00730)。与43 μM H₂条件相比,2 μM H₂条件下HynABC丰度升高2.5-3.1倍,但仅HynAB亚基的校正后P值<0.01(图2A);HydSH亚基丰度降低2.2-2.7倍(可能表明其对H₂亲和力较低),而催化亚基HydL丰度无变化(图2A)。此外,基因组中还存在一个编码胞质中辅酶F₄₂₀样[NiFe]氢化酶的操纵子(*frhAGB*,基因座标签GFV12_RS01870-GFV12_RS01880),但在所有蛋白质组样本中均未检测到FrhAGB蛋白。
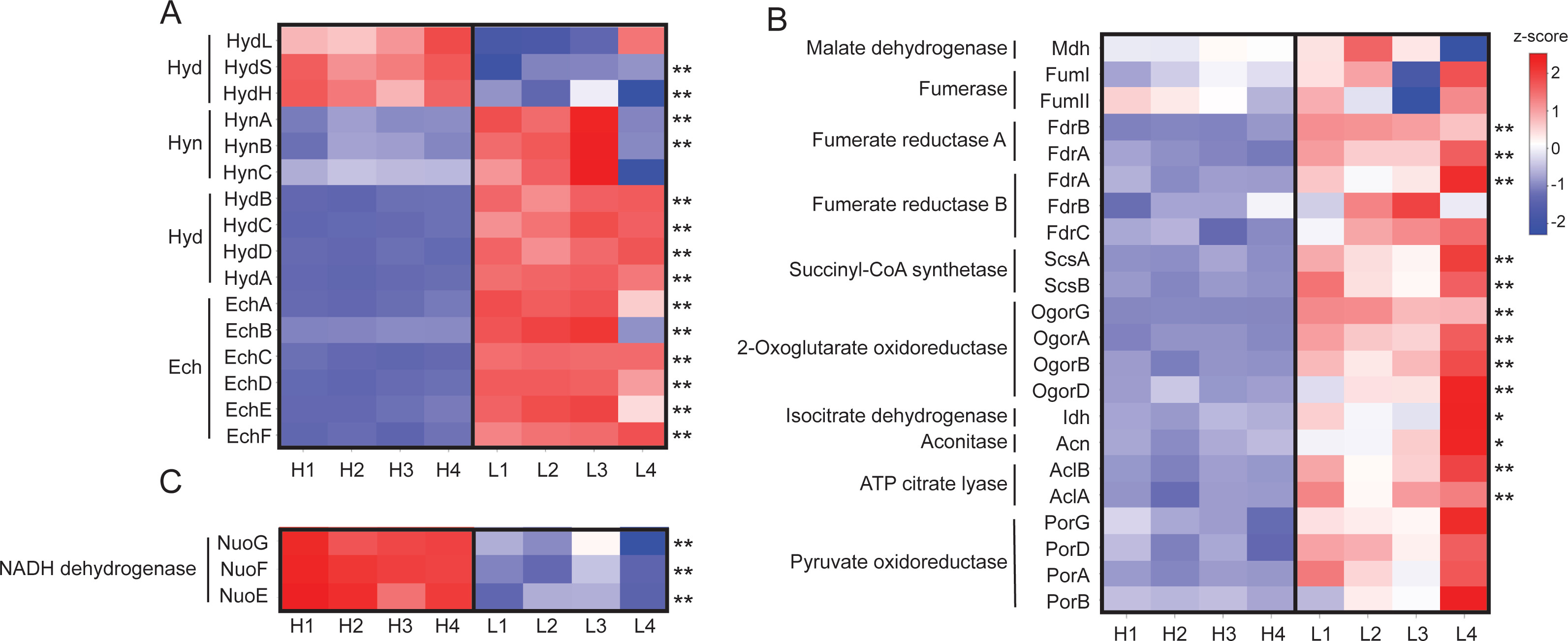
图2 关键蛋白质的蛋白质组热图
图2:热石营养脱硫杆菌HR11在高H₂(H1-H4)与低H₂(L1-L4)条件下培养时,膜结合型与胞质型氢化酶蛋白(A)、还原性三羧酸循环相关蛋白(B)及NADH脱氢酶蛋白(C)的差异丰度分析与热图。两种生长条件下平均丰度差异超过2倍,且校正后P值<0.05或<0.01的蛋白质,分别用“*”和“**”标注。
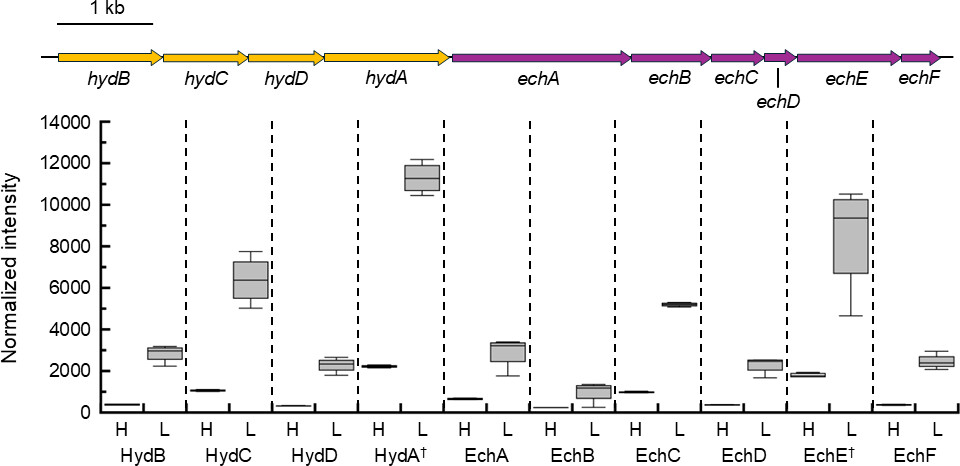
图3 NAD(P)⁺依赖型与铁氧还蛋白依赖型氢化酶的蛋白质组结果
图3:热石营养脱硫杆菌HR11在高H₂(H)与低H₂(L)条件下培养时,胞质中NAD(P)H依赖型氢化酶HydBCDA及膜结合型铁氧还蛋白依赖型氢化酶EchABCDEF的蛋白质组报告离子标准化强度。蛋白质按其亚基标识,并标注为其编码操纵子的一部分(按比例绘制)。箱体代表四分位距(IQR,从第一四分位数Q1延伸至第三四分位数Q3),箱体中间的实线代表中位数;须代表Q3+1.5×IQR或Q1-1.5×IQR。“†”表示每种氢化酶的催化亚基。
蛋白质组分析显示,与43 μM H₂条件相比,2 μM H₂条件下培养的细胞中,4种rTCA循环酶复合物丰度更高。HR11菌株基因组包含两个延胡索酸还原酶操纵子(*fdrABC*,基因座标签分别为GFV12_RS01890-GFV12_RS01900和GFV12_RS01905-GFV12_RS01915)。估算结果显示,其中一个同源操纵子的FdrAB亚基在2 μM H₂条件下丰度较43 μM H₂条件升高8.1-18.0倍(图2B);另一个延胡索酸还原酶操纵子的FdrA亚基在2 μM H₂条件下丰度升高2.4倍(图2B)。
基因组中编码琥珀酰辅酶A合成酶(*sucBA*,基因座标签GFV12_RS07365-GFV12_RS07370)和2-酮戊二酸氧化还原酶(*ogorDABG*,基因座标签GFV12_RS07375-GFV12_RS07390)的操纵子位于同一条DNA链上。估算结果显示,2 μM H₂条件下,SucAB和OgorABGD亚基丰度均较43 μM H₂条件升高3.2-4.8倍(图2B);ATP柠檬酸裂解酶的α和β亚基(AclAB,基因座标签GFV12_RS05570-GFV12_RS05575)丰度升高2.2-3.3倍(图2B);异柠檬酸脱氢酶(Idh,基因座标签GFV12_RS05580)和乌头酸酶(Acn,基因座标签GFV12_RS05585)丰度分别升高3.0倍和2.5倍,但仅校正后P值<0.05(图2B)。
苹果酸脱氢酶(Mdh,基因座标签GFV12_RS04390)、两种延胡索酸酶(FumI和FumII,基因座标签分别为GFV12_RS04385和GFV12_RS04605)及丙酮酸氧化还原酶(PorABGD,基因座标签GFV12_RS02030-GFV12_RS02045)的丰度在两种H₂条件下无差异(图2B)。
HR11菌株基因组编码膜结合型质子转运ATP合成酶(*atpBE*和*atpFF′HAGDC*,基因座标签分别为GFV12_RS07710-GFV12_RS07715和GFV12_RS06145-GFV12_RS06175)。所有ATP合成酶亚基均被标记并通过质谱检测到,但丰度未随H₂可利用性发生变化(表S3)。此外,基因组还在两个独立操纵子中编码膜结合型NADH脱氢酶复合物(*nuoGFE*和*nuoABCDHIJKLMN*,基因座标签分别为GFV12_RS03465-GFV12_RS03475和GFV12_RS05805-GFV12_RS05855)。估算结果显示,与43 μM H₂条件相比,2 μM H₂条件下NuoGFE亚基丰度降低3.2-3.7倍(图2C)。经质谱检测到NuoC和NuoI亚基,但未对其进行标记(表S4),其余Nuo亚基未检测到。
对于硫还原与硫代硫酸盐还原相关蛋白:推定的NAD(P)H依赖的硫氧还蛋白还原酶(TrxR,基因座标签GFV12_RS05945)、二硫键还原酶(TlpA,基因座标签GFV12_RS05950)和NADH硫氧化还原酶(Nsr,基因座标签GFV12_RS05415)在两种H₂条件下的丰度无差异(表S3)。在9种推定的c型细胞色素蛋白中,GFV12_RS01210在2 μM H₂条件下丰度升高2.2倍,GFV12_RS01165和GFV12_RS02640丰度分别降低3.4倍和4.8倍(表S2)。推定的过氧化物还原酶(GFV12_RS03815,其功能为保护细胞免受氧化应激并充当氧化还原信号调节剂[24])在低H₂条件下的丰度较在高H₂条件下升高14.2倍(表S1)。
HR11菌株基因组中缺乏产乙酸相关基因,即磷酸转乙酰酶基因、乙酸激酶基因和ADP型乙酰辅酶A合成酶基因;但含有AMP型乙酰辅酶A合成酶基因(GFV12_RS00945),该酶可催化乙酸活化为乙酰辅酶A[25]。估算结果显示,2 μM H₂条件下培养的细胞中,AMP型乙酰辅酶A合成酶丰度升高7.8倍(表S1)。
讨论
了解嗜热氢营养菌的生长与代谢策略,对于预测热液喷口环境中微生物的竞争结果至关重要。在H₂等资源稀缺的生境中,自养型氢营养菌通过代谢适应低H₂通量条件的能力,也会影响其生存。“生长速率-生长产率”代谢权衡是微生物根据营养可利用性优化生长与竞争的一种生态策略:在高营养浓度下,微生物生长速率高但细胞产率低(单位底物消耗生成的生物量较少);而在低营养浓度下,微生物生长速率低但细胞产率高(单位底物消耗生成的生物量较多)[26,27]。
自养型产甲烷菌会随H₂可利用性变化呈现“生长速率-生长产率”代谢权衡——在电子供体有限时,其代谢会向生物量生成倾斜,而非优先用于能量产生[16-19]。此前研究提出,热石营养脱硫杆菌HR11也存在类似的代谢权衡[22],而本研究中“蛋白质组随H₂可利用性变化向CO₂固定倾斜”的结果,进一步支持了这一观点。在氢营养型硫还原菌与产甲烷菌竞争有限H₂时,硫还原菌的这种代谢权衡可能会抵消产甲烷菌因代谢权衡获得的竞争优势。
氢化酶可催化H₂可逆转化为质子和电子,参与能量代谢、氧化还原平衡及电子传递过程(图4)。HR11菌株基因组编码5种不同的氢化酶复合物,本研究通过蛋白质组学检测到其中4种,表明该菌株具备多样化的H₂利用能力。根据Greening等人[28]提出的分类系统,热石营养脱硫杆菌HR11含有1组膜结合型HynABC [NiFe]氢化酶和A组膜结合型HydLSH [FeFe]氢化酶,且二者均通过蛋白质组学检测到。这两种氢化酶可能均以甲基萘醌-7(MK-7H6)作为电子载体——甲基萘醌-7是所有其他脱硫杆菌属物种中主要的呼吸脂溶性醌[8]。
在低H₂条件下丰度升高的HynABC氢化酶带有双精氨酸转运信号,表明其催化亚基朝向周质空间,因此在H₂氧化后,质子会留在周质中(图4)。甲基萘醌的还原与氧化均与质子跨膜转运偶联,而HynABC催化的H₂氧化过程也会产生质子动力势(图4)。这种质子梯度可能被膜结合型ATP合成酶(本研究也通过蛋白质组学检测到)利用,通过氧化磷酸化生成ATP(图4)。
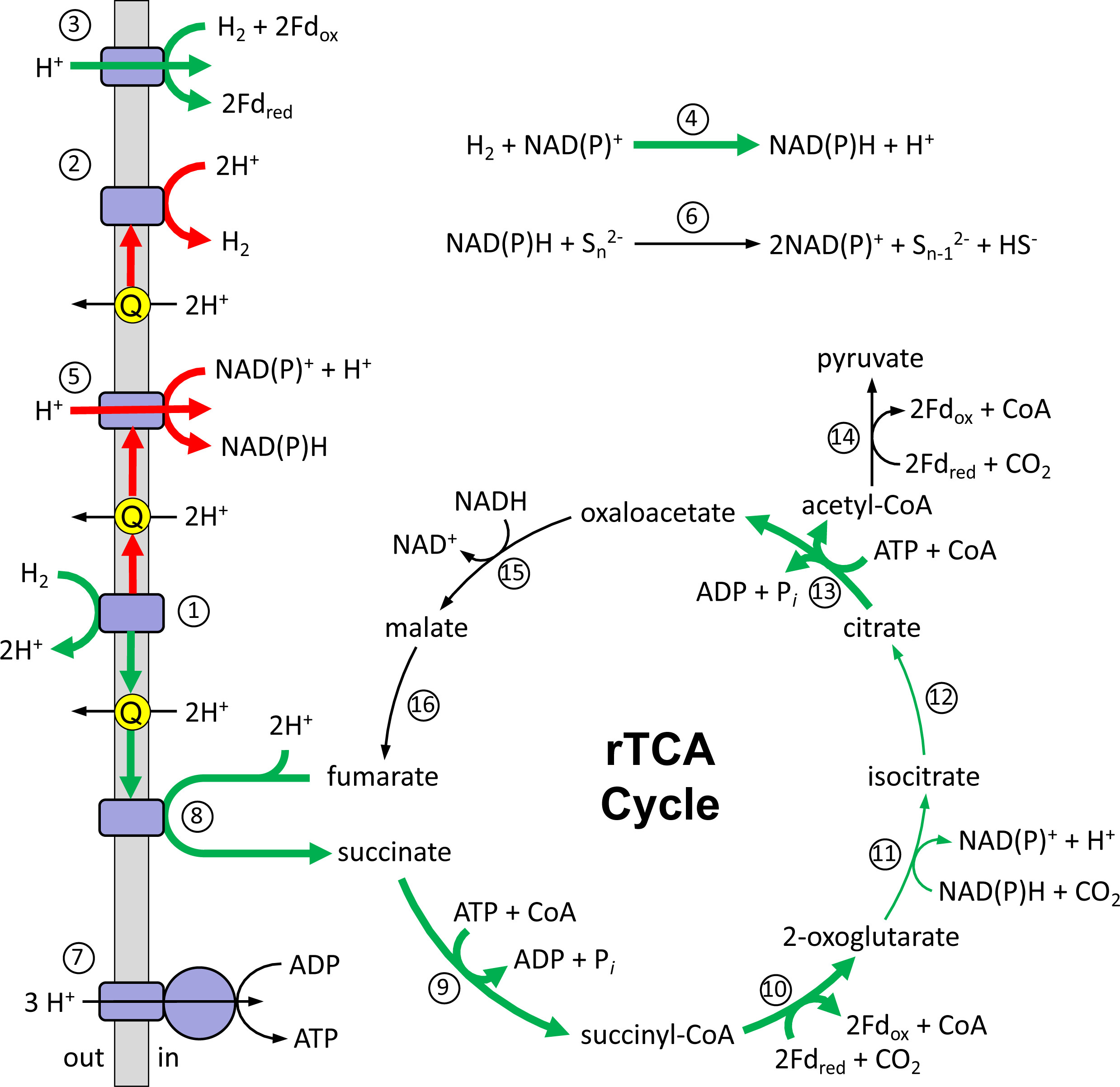
图4 热石营养脱硫杆菌(*D. thermolithotrophum*)代谢权衡模型
该图展示了热石营养脱硫杆菌HR11的推测代谢途径与代谢权衡关系。图中酶类标注如下:(1)甲基萘醌依赖型[NiFe]氢化酶(Hyn);(2)甲基萘醌依赖型[FeFe]氢化酶(HydLSH);(3)铁氧还蛋白依赖型[NiFe]氢化酶(Ech);(4)NAD(P)⁺依赖型[NiFe]氢化酶(HydBCDA);(5)NADH脱氢酶;(6)NAD(P)H依赖型硫还原酶;(7)ATP合成酶;(8)延胡索酸还原酶;(9)琥珀酰辅酶A合成酶;(10)2-酮戊二酸氧化还原酶;(11)异柠檬酸脱氢酶;(12)乌头酸酶;(13)ATP柠檬酸裂解酶;(14)丙酮酸氧化还原酶;(15)苹果酸脱氢酶;(16)延胡索酸酶。
图中缩写含义:CoA,辅酶A;Fd,电子载体铁氧还蛋白;Q,甲基萘醌;rTCA cycle,还原性三羧酸循环。
绿色粗箭头**表示低H₂条件下蛋白质丰度较髙H₂条件显著升高;**红色粗箭头**表示低H₂条件下蛋白质丰度较髙H₂条件显著降低;**黑色箭头**表示蛋白质丰度在两种H₂条件下无显著差异。
热石营养脱硫杆菌HR11还含有4组膜结合型铁氧还蛋白依赖的EchABCDEF氢化酶和3组胞质型NAD(P)⁺依赖的HydABCD氢化酶。本研究发现,这两种氢化酶在2 μM H₂条件下的丰度均高于43 μM H₂条件,且它们在同一条DNA链上相距51个核苷酸(图3),推测可能存在协同调控。这些数据表明,当H₂受限时,热石营养脱硫杆菌会调整H₂的利用方式,通过上述氢化酶直接生成还原态铁氧还蛋白和NAD(P)H,为细胞提供电子(图4)。
膜中甲基萘醌携带的电子流向,似乎会随H₂可利用性发生变化。Kubik与Holden的研究[22]显示,在血清瓶培养体系中,低H₂条件下热石营养脱硫杆菌HR11的生长速率降低,且未检测到硫化氢(H₂S)生成,但最大细胞浓度与高H₂条件下相当,这表明该菌株在H₂受限时会启动“生长速率-生长产率”代谢权衡。此外,当培养基中去除硫代硫酸盐、仅添加二氧化碳(CO₂)作为末端电子受体时,无论H₂浓度高低,该菌株均会出现生长缓慢的现象[22]。本研究进一步发现,在H₂受限的培养条件下,热石营养脱硫杆菌的蛋白质组会发生调整,表现出向CO₂固定倾斜的代谢特征。
代谢反应的吉布斯自由能,受环境中电子供体与受体的浓度依赖性热力学活性影响。H₂的中点电位极低(E₀′ = -414 mV),使其成为优质电子供体[29]。在H₂充足时,热石营养脱硫杆菌HR11可能通过HynABC催化H₂氧化,将电子传递给甲基萘醌(E₀′ = -74 mV)[29],随后电子再传递至膜结合型甲基萘醌醇氧化酶。NAD(P)H的中点电位为-320 mV[29],这意味着在标准等摩尔条件下,电子从甲基萘醌醇传递至NAD(P)⁺(通过NADH脱氢酶)或传递至H⁺(通过HydLSH生成H₂)的过程,在热力学上并不有利。高H₂条件可驱动电子从甲基萘醌醇向NAD(P)H或H₂传递,但在低H₂条件下,以甲基萘醌为中间载体、依赖H₂生成NAD(P)H或H₂的膜上反应,其热力学驱动力会显著减弱。
热石营养脱硫杆菌HR11的NADH脱氢酶由14个亚基组成,其中11个亚基由一个操纵子(*nuoABCDHIJKLMN*)编码,另外3个亚基由另一个操纵子(*nuoEFG*)编码[23]。NuoAHJKLMN亚基嵌入膜中,负责催化甲基萘醌醇氧化;而复合物中的其余亚基(NuoBCDEFGI)朝向胞质侧,催化电子向NAD(P)⁺传递[30](图4)。本研究发现,与43 μM H₂条件相比,2 μM H₂条件下NuoEFG亚基的相对丰度显著降低,而其余亚基要么被检测到但未标记,要么在所有样本中均未检测到。此外,低H₂条件下HydLSH的丰度也会下降。因此,在H₂受限时,热石营养脱硫杆菌HR11的电子流向会偏离甲基萘醌醇氧化相关的NADH脱氢酶及[FeFe]氢化酶(图4)。
本研究的蛋白质组数据还表明,低H₂条件下,甲基萘醌醇携带的电子会通过还原性三羧酸循环(rTCA循环)向CO₂固定方向转移(图4)。延胡索酸/琥珀酸的中点电位为+30 mV[29],这使得延胡索酸成为甲基萘醌醇氧化反应中热力学上有利的电子受体。热石营养脱硫杆菌HR11含有两种膜结合型延胡索酸还原酶,且它们在2 μM H₂条件下的丰度高于43 μM H₂条件。此外,低H₂条件下rTCA循环相关蛋白(琥珀酰辅酶A合成酶、2-酮戊二酸氧化还原酶、异柠檬酸脱氢酶、乌头酸酶、ATP柠檬酸裂解酶)的丰度均显著升高,这表明当H₂受限时,热石营养脱硫杆菌会将末端电子接受过程转向rTCA循环介导的CO₂固定与碳同化,以此作为更有利的代谢途径(图4)。
目前,热石营养脱硫杆菌HR11的硫代硫酸盐还原机制尚不明确。其基因组中含有NAD(P)H依赖的硫氧还蛋白还原酶(*trxR*)[31]和NAD(P)H依赖的硫还原酶(*nsr*)[32]的同源基因,但缺乏其他硫代谢相关机制的同源基因,例如膜结合型钼蝶呤依赖的硫代硫酸盐/多硫化物还原酶(*sre*)[33]、异化亚硫酸盐还原酶(*dsr*)[34]、亚硫酸盐氧化酶(*sox*)[35]、膜结合型硫化物:醌还原酶(*sqr*)[32]以及膜结合型硫烷还原酶(*mbs*)[36]。本研究通过质谱检测到TrxR和Nsr两种蛋白,但它们的丰度在2 μM与43 μM H₂条件下无显著差异。
在近中性pH条件下,硫代硫酸盐可能在硫化物存在时发生非生物转化,生成可溶性多硫化物(Sₓ²⁻),反应式如下:2 S₂O₃²⁻ + 4 HS⁻ + 8 H⁺ → S₈⁰ + 6 H₂O,随后S₈⁰ + HS⁻ → *n*Sₓ²⁻ + H⁺[37,38]。TrxR和Nsr均定位于胞质[31,39],推测二者可将多硫化物还原为硫化物,但这一过程需要多硫化物转运进入细胞内。此外,低H₂条件下有两种推定的膜结合型c型细胞色素蛋白丰度升高,推测它们可能参与向多硫化物传递电子的过程。
低H₂条件下热石营养脱硫杆菌HR11的代谢向CO₂固定倾斜,且该菌株在仅添加CO₂作为末端电子受体时仍能生长[22],这引发了关于早期地球微生物代谢方式的思考。在太古代早期(4.0-3.2 Ga),热液喷口活动频繁,但全球海洋处于缺氧且富铁状态,末端电子受体的可利用性有限[40]。同位素证据表明,约3.5 Ga时已存在硫还原过程[41,42],但在光合产氧作用及大氧化事件发生之前[40,43,44],硫代硫酸盐、S₈⁰等中间硫形态的浓度仅为低微摩尔级别。因此,热液活动产生的H₂和CO₂可能在微生物代谢中发挥了关键作用,尤其是在热液喷口附近区域。尽管该环境中可能存在氢营养型产甲烷作用和产乙酸作用[40,45],但仅通过CO₂还原生成生物量的过程,也应被视为早期地球中一种可能的末端电子接受过程及能量产生机制。这一过程的具体机制为:氢化酶在膜上催化H₂氧化,同时伴随甲基萘醌还原;朝向胞外的氢化酶导致质子在细胞外积累;甲基萘醌介导的质子转运形成质子动力势;电子进入rTCA循环,通过延胡索酸还原酶催化CO₂还原(图4)。若环境中同时存在H₂和可还原硫,则硫还原过程可作为额外的电子库,为细胞提供更多能量。
综上,本研究结果有助于深入理解深海热液喷口环境中常见的嗜热硫代硫酸盐还原菌的代谢机制(尤其是H₂受限时的代谢适应)。热石营养脱硫杆菌HR11对H₂限制的适应能力,凸显了其在与其他氢营养菌竞争中的生存策略。本研究还揭示了该菌株的氢化酶如何协同响应环境变化,以及H₂在调控其代谢过程中的作用。未来研究将进一步探索H₂是否及如何调控热石营养脱硫杆菌HR11的基因表达,以及该菌株的硫代硫酸盐还原机制。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1509936.html?mobile=1
收藏

