哮喘(一种以Ⅱ型炎症为特征的常见非感染性慢性疾病)的特点包括气道高反应性、支气管收缩和气道重塑,最终导致广泛的气道狭窄。氢气已被证实具有抗氧化和抗炎特性,对多种疾病有益。本研究首先探究了吸入氢气对卵清蛋白(OVA)诱导的哮喘小鼠肺部炎症的改善作用。研究人员先通过卵清蛋白对小鼠进行致敏处理,随后让小鼠经气道吸入雾化的1%卵清蛋白,以建立哮喘模型。将连续7天吸入氢气作为治疗干预手段,检测各项指标的变化。
与对照处理相比,吸入氢气显著减轻了卵清蛋白诱导的气道高反应性和炎症反应:它可抑制免疫反应,降低白细胞介素-4(IL-4)、白细胞介素-5(IL-5)和白细胞介素-13(IL-13)的水平,并进一步上调调节性T细胞(Treg)相关细胞因子(即白细胞介素-10(IL-10)和转化生长因子-β1(TGF-β1))的mRNA表达水平,从而增强机体的抗炎机制。此外,吸入氢气还能降低血清总免疫球蛋白E(IgE)水平和丙二醛(MDA)的生成量,提高肺组织中超氧化物歧化酶(SOD)的分泌量。
Li, Hongchang, et al. "Hydrogen inhalation ameliorates lung inflammation in mice with asthma." European Journal of Medical Research 30.1 (2025): 1024.
肺组织组织学分析显示,卵清蛋白诱导小鼠肺泡壁出现明显的炎症细胞浸润和细胞增殖,而氢气处理组的这些症状显著改善,表明病理损伤有所减轻。这些研究结果表明,吸入氢气可有效抑制卵清蛋白诱导的哮喘,显著改善相关肺部炎症;且在未来的哮喘治疗策略中,吸入氢气可能是一种更具可行性的方法。引言
哮喘是一种常见的慢性气道疾病,以慢性炎症反应为主要特征,全球约有3亿人受其影响,每年死亡率高达25万[1,2]。哮喘的典型表现为反复发作且症状常呈波动性,如喘息、气促、胸闷和咳嗽,这些症状在夜间或体力活动时可能加重,严重影响患者生活质量并带来重大健康风险,进而成为全球范围内显著的健康、经济及社会负担[3,4]。
全球哮喘患病率呈上升趋势,这与城市化、生活方式改变及环境污染等因素相关[5]。在有哮喘家族史人群、合并过敏性鼻炎、过敏性结膜炎、湿疹等疾病的人群,以及肥胖和有吸烟习惯的人群中,这种患病率上升趋势尤为明显[6]。目前,哮喘管理采用多维度策略,包括药物干预、生活方式调整、心理支持、呼吸训练及免疫治疗等[7]。尽管药物干预是哮喘管理的重要组成部分,但这些方法的效果常受多种因素制约,例如长期用药的不良反应、患者依从性不佳以及环境触发因素的持续影响[8,9,10]。
氢气是一种无色气体,因其具有抗炎、抗氧化、抗凋亡等多种生物学效应而受到日益广泛的关注[11]。近年来,氢医学领域的研究进展推动了关于氢气在呼吸系统疾病(尤其是哮喘)管理中潜在作用的深入探索[12]。从抗炎角度来看,氢气(尤其是通过吸入方式给药时)在改善气道炎症方面展现出良好的治疗潜力[13]:它可减轻氧化应激,抑制炎症细胞因子释放,从而改善气道通畅度,缓解呼吸困难、咳嗽等症状[14]。此外,氢气还具有免疫调节作用,有助于平衡免疫反应并调控免疫细胞活性[15],这可能减少超敏反应,降低哮喘急性发作频率。
然而需注意的是,目前关于氢气治疗的研究仍以实验性研究为主,大部分证据来源于临床前研究和动物模型,这些研究结果的临床适用性尚不明确,且设计严谨的人体试验数量有限。此外,哮喘是一种高度异质性疾病,具有多样的内表型和表型,这可能导致患者对氢气治疗的反应存在差异。因此,未来研究应聚焦于阐明氢气在不同哮喘亚型中的作用机制,并在严格的临床环境中验证其疗效。氢气治疗在哮喘管理中的优势包括安全性高、给药便捷、成本效益好及耐受性佳。基于此,本研究旨在探究吸入氢气对卵清蛋白(OVA)诱导的哮喘小鼠肺部炎症的改善作用,并探讨其治疗价值。
材料与方法
实验动物
6-8周龄雌性C57BL/6小鼠购自吉林省长春市亿斯实验动物技术有限公司,饲养于无特定病原体(SPF)环境中,采用12小时光照/12小时黑暗的可控光照周期,小鼠可自由饮用无菌水并食用辐照饲料。所有实验干预开始前,对小鼠进行适应性饲养。本研究中所有实验操作均遵循动物伦理准则,伦理审批编号为QDU-AEC-2024595。
试剂与仪器
卵清蛋白(OVA)和明矾佐剂购自赛默飞世尔科技(Thermo Fisher Scientific);苏木精-伊红(H&E)染色试剂盒购自西格玛奥德里奇(Sigma-Aldrich);丙二醛(MDA)和超氧化物歧化酶(SOD)检测试剂盒购自碧云天生物技术有限公司(上海);白细胞介素-4(IL-4)、白细胞介素-5(IL-5)、白细胞介素-13(IL-13)及免疫球蛋白E(IgE)检测酶联免疫吸附试验(ELISA)试剂盒购自艾博抗生物技术有限公司(Abcam Biotechnology);医用氢气治疗仪器(型号QMK-98500Y)和压缩空气雾化器由深圳市量子氢生物技术有限公司生产。
动物实验方案
32只雌性C57BL/6小鼠随机分为4组,每组8只(原文“five groups”应为笔误,根据后续分组描述修正为4组):
1. 生理盐水对照组:小鼠采用生理盐水进行致敏和激发处理,并暴露于常规环境空气中;
2. 单纯15%氢气组:小鼠不进行致敏和激发处理,仅暴露于15%氢气环境中;
3. 哮喘模型组:小鼠采用卵清蛋白(OVA)进行致敏和激发处理,并暴露于常规环境空气中;
4. 卵清蛋白+15%氢气组:小鼠采用卵清蛋白(OVA)进行致敏和激发处理,并暴露于15%氢气环境中。
OVA处理组小鼠在实验第0天和第14天,通过腹腔注射100 μL乳化液(含20 μg OVA和50 μL明矾佐剂)进行致敏。第24-26天,所有OVA激发组小鼠采用超声雾化器产生1% OVA气溶胶,通过吸入方式进行气道激发,每次持续30分钟。氢气干预(空气含15%氢气)采用全身暴露方式:将小鼠置于密封舱内,以4 L/min的持续流速通入氢气,从第21天开始,每日干预1次,每次60分钟,直至第27天。对照组小鼠按照相同时间 schedule 给予生理盐水处理。第28天,对所有小鼠实施人道安乐死以收集样本:通过过量麻醉处死小鼠后,经腹主动脉采集血液,立即移入EDTA抗凝管以防止凝血;随后在4℃条件下以3000转/分钟(rpm)离心15分钟分离血浆,将血浆置于-80℃保存,以备后续分析。
气道反应性评估
采用Huang等人[12]所述方法进行气道阻力实验。具体而言,在未束缚、自主呼吸状态下,通过全身体积描记法评估小鼠在吸入不同浓度甲胆碱后的气道反应性:将小鼠置于体积描记舱内,首先吸入生理盐水雾化剂30秒作为对照;随后,每隔20分钟吸入一次浓度递增的甲胆碱雾化剂(5、10、15、20、25、30 mg/mL),每次持续30秒。在每次5分钟的激发过程中,通过压力体积描记法测量增强呼气间歇(enhanced pause,Penh),以此作为气道阻塞的评估指标。结果以各甲胆碱浓度下的Penh值相对于基线值的百分比表示。
支气管肺泡灌洗液(BALF)细胞因子及血清总IgE水平检测
结扎小鼠左主支气管和右肺叶,随后将注射器插入气管上段,进行单侧支气管肺泡灌洗以获取灌洗液(BALF)。具体操作:注入0.3 mL磷酸盐缓冲液(PBS),轻轻按摩小鼠胸部约1分钟以促进冲洗[17],该过程重复3次,收集所有灌洗液。将收集的灌洗液在4℃条件下以1500转/分钟(rpm)离心10分钟,沉淀用1 mL PBS重悬。
按照试剂盒说明书,采用ELISA法检测小鼠BALF上清液中哮喘关键指标(IL-4、IL-5、IL-13)的水平。支气管肺泡灌洗完成后,立即采集血液以分离血清,用于检测总IgE水平;同时取出左肺,将其分为三部分:一部分置于4%(质量体积比)甲醛溶液中,用于制作组织病理学切片;一部分用于提取RNA以检测相关mRNA表达水平;另一部分置于PBS中,用于评估肺组织中其他指标。
调节性T细胞(Treg)相关mRNA表达的实时荧光定量PCR(RT-qPCR)检测
本研究检测了调节性T细胞相关mRNA(包括IL-10和TGF-β1)的表达水平。对保存的肺组织进行如下处理:每100mg组织加入1mL TRIzol试剂,使用无菌匀浆器充分匀浆后,置于冰上孵育5分钟。随后向混合物中加入200μL氯仿,充分混匀并在冰上静置,确保核蛋白复合物完全解离。离心后,加入等体积预冷的异丙醇,析出白色RNA沉淀。用75%乙醇轻轻洗涤沉淀,室温晾干后,将其溶解于无RNase水中。最后,按照逆转录试剂盒说明书,将RNA逆转录为cDNA。使用赛默飞世尔科技(Thermo Fisher Scientific)提供的SYBR Green PCR试剂盒,在ABI-7500系统上进行实时荧光定量PCR。每个样本设置3个重复孔,采用2⁻ΔΔCT法计算目的基因的相对表达量[18]。甘油醛-3-磷酸脱氢酶(GAPDH)、IL-10和TGF-β1的特异性引物序列见表1[13,19]。
表1 小鼠IL-10和TGF-β1的引物序列
肺组织中丙二醛(MDA)含量及超氧化物歧化酶(SOD)活性检测
先测定肺组织重量,然后加入适量组织裂解液,通过研磨使组织充分匀浆。将匀浆液置于4℃孵育30分钟,确保组织充分裂解。随后离心,收集上清液,用于检测丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性。
肺组织病理学检查
为进行组织学分析,通过气管向肺内以恒定压力注入4%多聚甲醛进行膨胀固定,以维持肺泡结构,随后将肺组织浸泡于相同浓度的固定液中24小时,再进行石蜡包埋。具体步骤如下:
1. 组织处理:将组织依次置于不同浓度的乙醇溶液中脱水,去除组织内水分后,进行石蜡浸润处理;
2. 包埋:将脱水、透明后的组织放入约60℃的熔融石蜡中,完成包埋;
3.切片:使用切片机将石蜡块切成4-6μm的薄片;
4.贴片与染色前处理:染色前,将切片依次浸入二甲苯脱蜡、不同浓度乙醇复水;
5.苏木精-伊红(H&E)染色:按照试剂盒说明书进行H&E染色,观察肺组织的整体解剖结构及病理改变。
统计分析
采用GraphPad Prism软件对收集的数据进行综合分析,结果以“平均值±标准差”表示。采用单因素方差分析(one-way ANOVA)比较各组间差异的显著性。显著性水平标注如下:*P<0.05,**P<0.01,***P<0.001。
结果
吸入氢气降低哮喘小鼠的气道阻力
本研究采用卵清蛋白(OVA)诱导建立哮喘模型,实验方案如图1A所示。末次激发后24小时,通过检测增强呼气间歇(Penh)值评估气道反应性。结果显示,经OVA致敏和激发后,小鼠在吸入浓度为10、15、20、25、30mg/mL的甲胆碱(每次30秒)时,气道反应性显著升高;而吸入氢气后,这种升高趋势被显著抑制(图1B)。
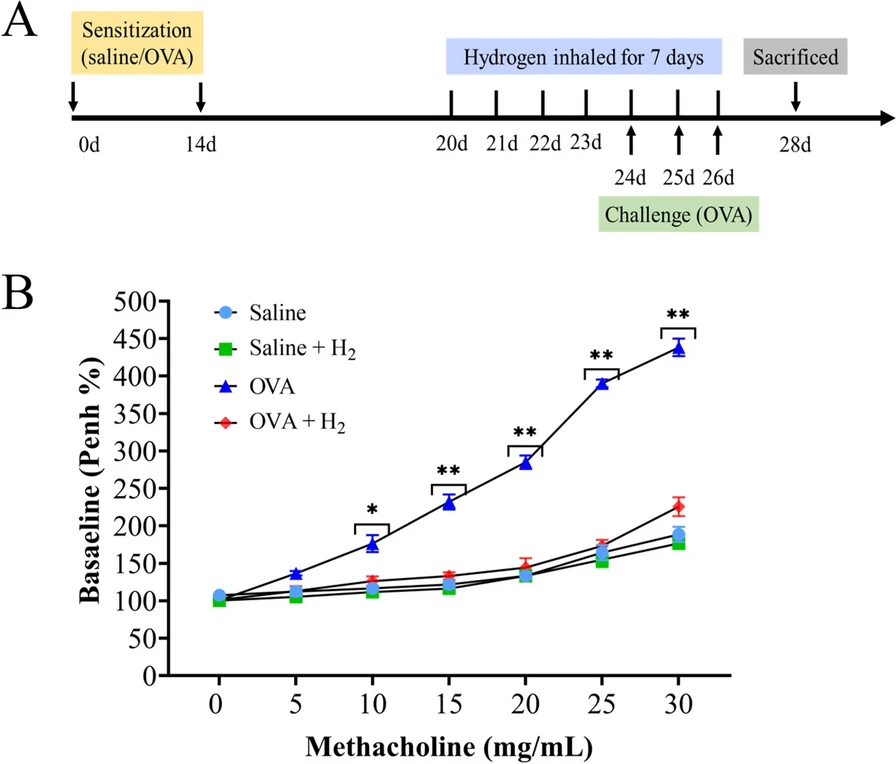
图1 动物实验设计及氢气对气道反应性的影响
A. 动物实验流程;B. 以Penh值评估气道反应性
吸入氢气减轻OVA诱导的Th2型免疫反应
哮喘是一种以Ⅱ型炎症为特征的常见非感染性慢性疾病,因此本研究检测了支气管肺泡灌洗液(BALF)中Th2相关细胞因子(IL-4、IL-5、IL-13)的水平及血清中免疫球蛋白E(IgE)的浓度。结果符合预期:暴露于OVA后,小鼠BALF中IL-4水平显著升高,而吸入氢气组的IL-4水平与对照组相近(图2A);与生理盐水组相比,OVA处理显著升高了BALF中IL-5的含量(图2B);IL-13水平的变化趋势与IL-5一致,吸入氢气对其产生有轻微的抑制作用(图2C)。此外,血清总IgE水平的变化与IL-4相似:OVA暴露显著升高血清总IgE水平,而吸入氢气则显著降低该水平(图2D)。
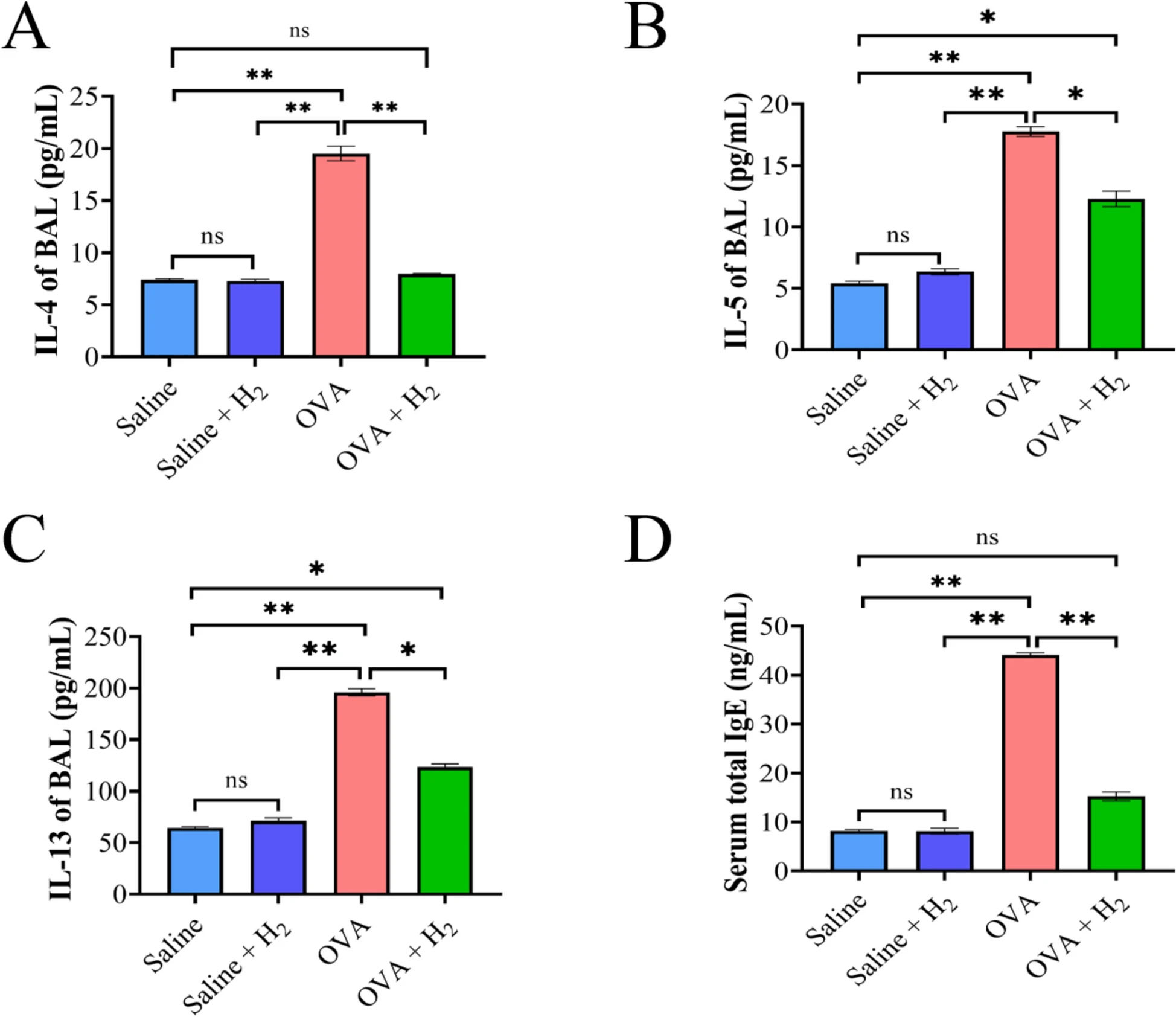
图2 吸入氢气对OVA诱导的Th2型细胞因子及血清IgE的影响
A. 支气管肺泡灌洗液上清中IL-4水平;B. 支气管肺泡灌洗液上清中IL-5水平;C. 支气管肺泡灌洗液上清中IL-13水平;D. 酶联免疫吸附试验(ELISA)检测血清总IgE水平(*P<0.05,**P<0.01)
实时荧光定量PCR检测调节性T细胞(Treg)相关指标(IL-10和TGF-β1)
通过实时荧光定量PCR进一步检测肺组织中调节性T细胞相关细胞因子的mRNA表达水平,结果显示出一致的趋势:与对照组相比,OVA诱导的哮喘小鼠肺组织中抗炎细胞因子IL-10和TGF-β1的mRNA表达水平升高;而吸入氢气显著上调了这些抗炎细胞因子的表达水平,表明吸入氢气可有效促进IL-10和TGF-β1的表达,进而增强机体的抗炎机制(图3)。
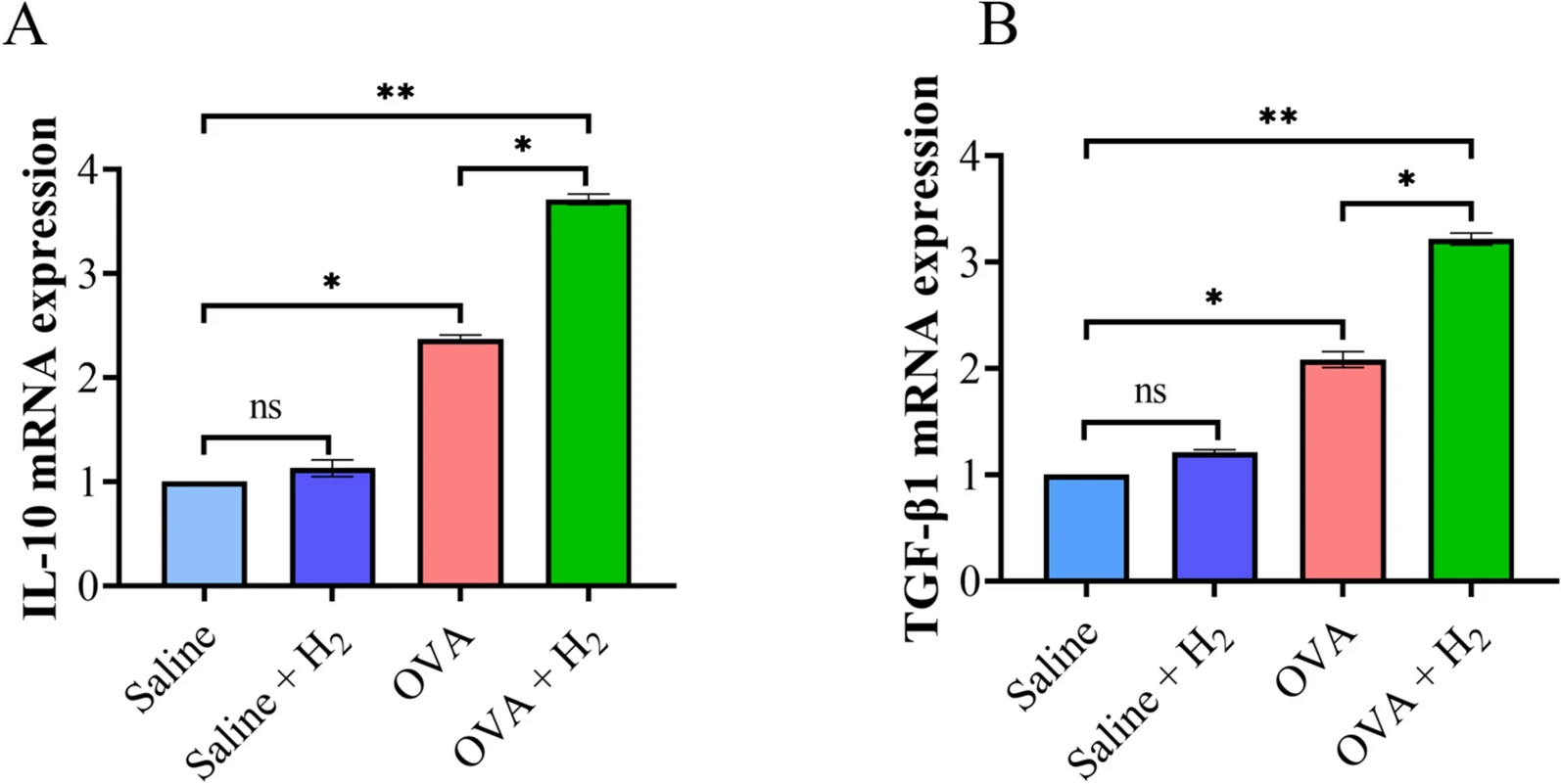
图3 小鼠肺组织中IL-10和TGF-β1的mRNA表达水平
A. IL-10表达水平检测;B. TGF-β1表达水平检测(*P<0.05,**P<0.01)
吸入氢气降低肺组织中MDA水平并提高SOD活性
为证实吸入氢气的保护作用与其抗氧化特性的关联,本研究检测了肺组织中MDA含量和SOD活性。结果显示:在OVA诱导的哮喘小鼠中,肺组织MDA水平显著升高,而吸入氢气后,MDA水平被抑制至接近对照组(生理盐水组或生理盐水+氢气组)的水平(图4A);同时,OVA致敏和激发导致小鼠肺组织SOD活性降低,与OVA组相比,吸入氢气治疗显著提高了SOD活性,且与对照组无显著差异(图4B)。这些结果表明,吸入氢气可保护OVA诱导的哮喘小鼠免受氧化损伤。
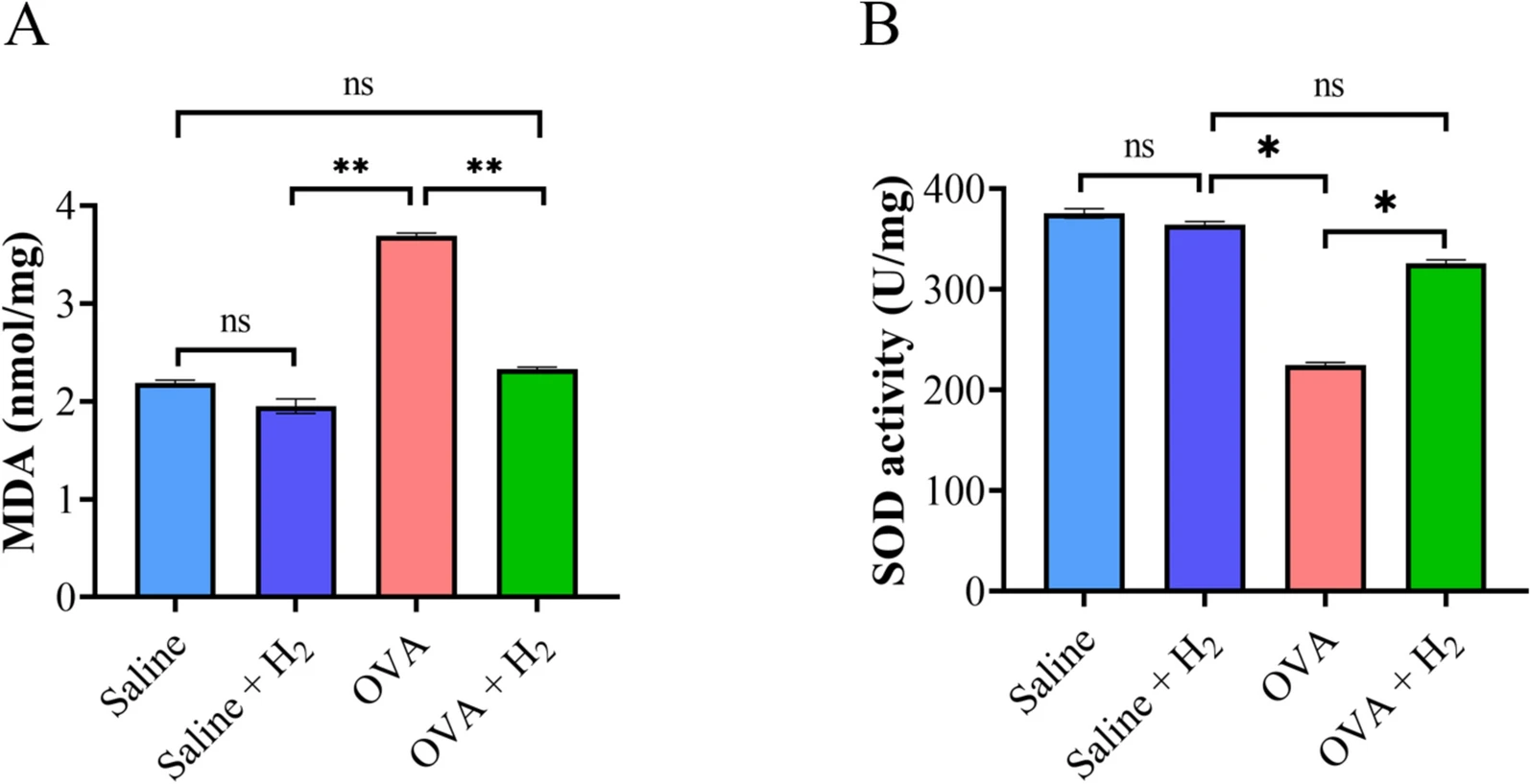
图4 吸入氢气对OVA诱导的小鼠肺组织中MDA水平和SOD活性的影响
A. 肺组织MDA浓度检测;B. 肺组织SOD活性检测(*P<0.05,**P<0.01)
吸入氢气减轻OVA诱导的肺炎症
将各组小鼠的肺组织进行石蜡包埋并进行苏木精-伊红染色,以直观评估吸入氢气对OVA诱导的小鼠哮喘模型肺炎症的缓解作用。结果显示:与对照组相比,OVA激发组小鼠的肺组织切片出现明显病理改变,包括细支气管和小支气管壁显著增厚、肺泡间隔增厚,同时伴随大量炎症细胞浸润;相反,吸入氢气的小鼠上述病理特征显著减轻——氢气处理减少了气道壁增厚程度,缓解了炎症细胞浸润,表明其对OVA诱导的肺部炎症具有保护作用(图5)。这些结果证实,吸入氢气对OVA诱导的哮喘小鼠肺损伤具有显著的改善作用。

图5 各组小鼠肺组织病理学特征
A. 生理盐水对照组肺组织;B. 单纯15%氢气组肺组织;C. 哮喘模型组肺组织;D. OVA+15%氢气组肺组织
讨论
哮喘是一种复杂的慢性非传染性疾病,其特征包括气道高反应性、支气管狭窄和结构改变,可导致广泛的气流阻塞和严重的呼吸问题[2,20]。这种炎症性疾病主要由Ⅱ型免疫介导,因其高患病率和高发病率,给全球医疗资源带来了巨大压力[16,21]。目前的治疗方法(包括支气管扩张剂和糖皮质激素)主要用于缓解症状和控制疾病进展,但常伴随不良反应,且治疗效果因人而异[22]。氢气具有抗氧化和抗炎特性,是一种新型治疗选择,在包括哮喘在内的多种疾病中展现出应用潜力[11,23]。本研究发现,吸入氢气显著减轻了OVA诱导的气道高反应性和炎症,提示其有望成为哮喘管理的辅助治疗手段。
OVA诱导的小鼠哮喘模型是对变应原驱动型哮喘的急性模拟,涵盖气道炎症、上皮化生等关键特征[24,25,26]。该模型可在受控条件下探索治疗干预措施,为研究作用机制和潜在治疗效果提供有价值的参考。在本研究中,选择气道高反应性、细胞因子浓度(IL-4、IL-5、IL-13)、IgE滴度及组织病理学检查作为评估指标,对验证氢气治疗的有效性至关重要。此外,吸入氢气显著上调了IL-10和TGF-β1等相关细胞因子的mRNA表达水平,进而增强机体的抗炎机制,这与此前的研究结果一致[27,28]。需注意的是,本研究仅在mRNA水平检测了细胞因子表达——IL-10和TGF-β1 mRNA的上调虽具有重要提示意义,但未来研究需进一步量化血清和肺组织中这些细胞因子的蛋白水平,并结合功能性T细胞检测,以确凿验证调节性T细胞活化在氢气抗炎作用中的角色。
本研究也存在局限性:氢气和OVA均以生理盐水为载体,尽管设置了生理盐水对照组(经生理盐水致敏和激发)以排除免疫和激发流程相关的干扰,但该设计无法完全区分生理盐水载体的非特异性作用与氢气的特异性生物学作用。更严谨的实验设计应增设单纯生理盐水对照组(仅给予生理盐水处理,不含任何活性成分),以更精确地分离氢气的作用机制。后续研究将纳入该对照组,以完善对氢气治疗机制的解读。
此外,气道高反应性是哮喘的标志性特征,可直接量化疾病严重程度;细胞因子谱和IgE滴度有助于了解免疫失调情况;组织病理学分析则能直观呈现组织损伤和炎症反应。哮喘诱导的肺部病理特征包括炎症细胞浸润、肺泡壁增厚和杯状细胞化生,这些改变均会导致气道狭窄和呼吸功能受损[29]。这些病理改变常伴随氧化应激增强,具体表现为脂质过氧化标志物丙二醛(MDA)水平升高[30];而超氧化物歧化酶(SOD)是清除超氧阴离子自由基、减轻氧化损伤的关键抗氧化酶[31,32]。本研究通过检测MDA和SOD水平,评估哮喘小鼠肺部的氧化应激状态及氢气治疗对该状态的影响——氢气处理组小鼠的MDA浓度显著降低、SOD活性显著升高,表明氢气可有效减轻氧化应激,进而发挥抗炎和保护作用。这些观察结果与此前在多种疾病模型中关于氢气抗氧化特性的研究结论一致[11,12,13]。
尽管本研究证实吸入氢气可同时改善氧化应激和炎症,但仍存在一个关键问题:这两种作用中哪种更为首要?我们认为,这些机制并非简单的因果关系,而是紧密关联的——氢气具有强效抗氧化能力,可选择性清除细胞毒性活性氧(ROS),直接灭活驱动促炎通路(如NF-κB通路)活化的关键信号分子。因此,观察到的抗炎效应既是氧化应激减轻的次级结果,也体现了氢气通过抗氧化作用介导的内在抗炎特性。此外,本研究发现调节性T细胞相关细胞因子表达增强,提示氢气可能具有免疫调节作用。我们推测,氢气吸入可改善对调节性T细胞功能有抑制作用的氧化和炎症微环境,为调节性T细胞介导的免疫调节创造有利条件;随后IL-10和TGF-β1分泌增加,可进一步抑制Th2型免疫反应,促进免疫耐受。尽管不能排除氢气对T细胞分化的直接作用(这一点仍需进一步研究),但抗氧化与免疫调节机制的相互关联可能形成正反馈循环,全面减轻过敏性气道炎症。
综上所述,本研究表明吸入氢气可有效抑制OVA诱导的小鼠哮喘,显著改善相关肺部炎症和病理损伤。通过减轻气道高反应性、降低Th2型免疫反应相关炎症细胞因子(IL-4、IL-5、IL-13)水平、增强调节性T细胞介导的免疫调节(IL-10、TGF-β1),氢气治疗有望成为哮喘管理的辅助策略。此外,氢气可降低MDA水平、提高SOD活性,表明其可减轻氧化应激,这也凸显了氢气作用机制的多面性。将氢气治疗纳入哮喘管理策略,或可为这种慢性、致残性疾病提供新的干预方向。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1508218.html?mobile=1
收藏

