溃疡性结肠炎(Ulcerative Colitis, UC)是一种发生于肠道表层的弥漫性慢性炎症。活性氧(Reactive Oxygen Species, ROS)的过度蓄积会导致结直肠组织损伤。由于抗炎治疗通常需持续至少3-5年,因此对药物的低毒性要求较高。然而,目前临床上使用的治疗方法常伴随难以避免的不良反应。氢气作为一种无毒的抗氧化剂,具有优异的生物膜渗透性,在溃疡性结肠炎治疗中展现出潜力。本研究构建了一种设计简洁的新型储氢颗粒——氢化镁(MgH₂)颗粒,其外层包裹钝化氧化镁(MgO)壳层,可实现氢气的安全、可控释放。研究表明,该氢化镁颗粒(MgH₂@MgO)能有效清除过量活性氧、缓解炎症,并通过抑制核因子-κB(NF-κB)信号通路逆转溃疡性结肠炎的进展,为溃疡性结肠炎的临床预防与治疗提供了实验依据。
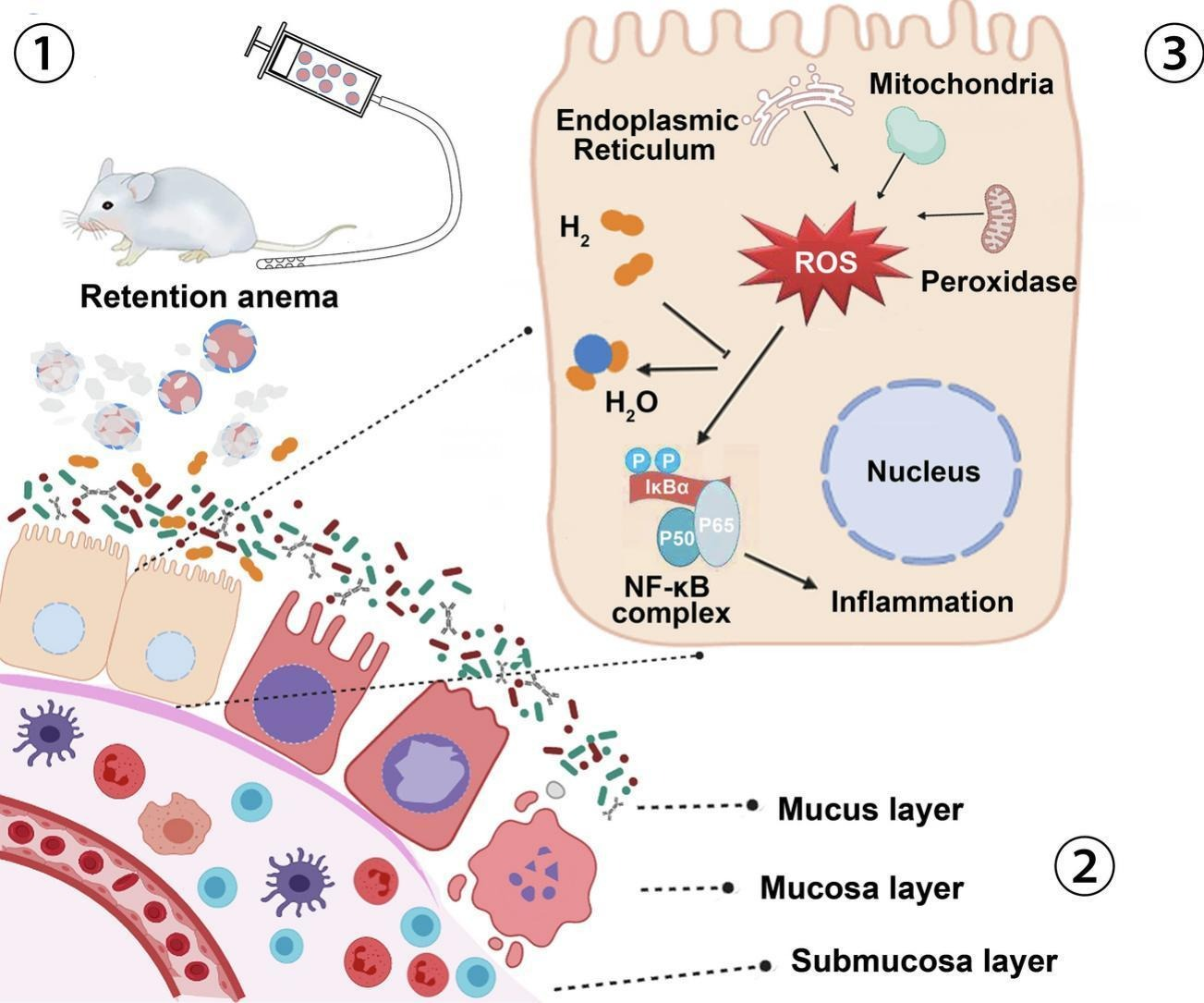
图文摘要
1. 储氢颗粒混悬液通过保留灌肠方式给药,颗粒发生水解反应,向肠腔内缓慢且持续地释放氢气;
2. 氢气以被动扩散方式穿过细胞膜;
3. 氢气中和活性氧(ROS),减轻溃疡性结肠炎中氧化应激导致的黏膜损伤。
1. 引言
溃疡性结肠炎(UC)是炎症性肠病(Inflammatory Bowel Diseases, IBD)的一种,病变涉及从直肠到升结肠的慢性炎症,其特征为活性氧(ROS)水平持续升高。溃疡性结肠炎的发病机制复杂,涉及多种因素,包括免疫反应失调、遗传易感性、肠道菌群紊乱、上皮屏障损伤及环境问题等(Le Berre 等,2023)。结直肠部位反复出现的弥漫性黏膜炎症和隐窝脓肿是溃疡性结肠炎的典型病理改变。对于确诊溃疡性结肠炎超过8年的患者,其患结直肠癌的风险是普通人群的2-4倍。黏膜病变的反复发生与修复在溃疡性结肠炎的病程进展及溃疡性结肠炎相关结直肠癌的发病机制中起着关键作用(Segal 等,2021)。
为有效缓解肠炎症状并预防复发,患者需持续接受抗炎治疗3-5年以上,部分患者甚至需终身用药。然而,长期服药可能导致肝功能损伤,严重时会对肝脏造成损害,进而严重威胁身体健康。因此,在溃疡性结肠炎的长期治疗中,如何降低药物副作用与治疗疾病本身同等重要。
特定浓度的氢气是一种无细胞毒性且生物膜渗透性优异的还原剂(Chuai 等,2012)。通常情况下,肠道定植菌群产生的氢气在维持肠道氧化还原稳态平衡中发挥重要作用。与其他抗氧化效率相当的抗氧化剂相比,氢气的还原活性温和,既能维持生理水平的氧化还原平衡,又不会对细胞产生明显副作用。作为电中性气体,氢气易溶于水,且能轻松穿透细胞膜和细胞器膜,从而高效中和氧自由基。多项研究证实,氢气治疗能有效清除肝脏、大脑、骨骼、肠道等多个器官中的活性氧蓄积,抑制炎症反应并阻止肿瘤生长(Le Berre 等,2023)。有研究报道,这种生理性气体可作为替代性还原剂,仅对处于炎症或癌变等氧化应激状态的细胞产生治疗作用,而对正常组织和细胞的影响极小(Dole 等,1975)。
Zhu 等研究发现,口服阿卡波糖可通过增加肠道菌群产生的氢气,减轻溃疡性结肠炎的氧化应激反应(Zhu 等,2013)。另一项研究表明,腹腔注射富氢盐水可通过降低大鼠体内血管内皮生长因子水平,缓解实验性溃疡性结肠炎(He 等,2013)。基于上述多效性作用,氢气被认为在炎症性肠病的临床治疗中具有良好前景(Le Berre 等,2023)。
金属氢化物是一类可控制储放氢的物质,其水解终产物为无污染的水,因此在绿色能源领域具有重要应用。金属及其氢化物水解产生的生物还原性氢气,在生理条件下可实现氢气的可控、持久、缓慢释放(Zhang 等,2019)。Zhao 等合成了PdH₀.₂纳米晶作为氢载体,通过氢气热疗协同作用治疗癌症(Kawai 等,2012)。然而,钯(Pd)元素对人体具有毒性。
从生理学角度来看,肠道吸收的镁(Mg)不仅是人体内骨盐的重要组成成分,还在离子通道调节、平滑肌兴奋性维持、细胞增殖调控等多种生理功能中发挥关键作用(Pelczyńska 等,2022)。值得注意的是,炎症性肠病患者常伴有低镁血症,而低镁血症会加重肠炎症状、增加肠黏膜细胞基因组不稳定性,并提高结直肠癌的发病风险(Pelczyńska 等,2022)。有研究报道,通过饮食补充镁可安全有效地缓解结肠炎症、恢复有益肠道菌群,并抑制结肠炎症相关癌变(Kuno 等,2013)。
基于镁离子丰富的生理功能和优异的生物相容性,本研究选用性能优良的产氢材料——氢化镁(MgH₂)作为氢气发生源(Zhao 等,2012)。氢化镁与水发生水解反应的方程式如下:(1)
其理论产氢量为1703 mL·g⁻1。然而,游离态氢化镁的释氢动力学过快,难以控制。为此,本研究设计并制备了一种新型储氢颗粒——外层包裹钝化氧化镁(MgO)壳层的氢化镁(MgH₂@MgO)颗粒,以实现氢气的安全、可控释放(图1)。

图1. MgH₂@MgO治疗溃疡性结肠炎的作用示意图
① 通过保留灌肠方式给予储氢颗粒混悬液,颗粒水解反应向肠道内持续、缓慢释放氢气;② 氢气以被动扩散方式穿过细胞膜;③ 氢气中和活性氧(ROS),减轻溃疡性结肠炎中氧化应激导致的黏膜损伤。
2. 材料与方法
2.1 实验动物与细胞
6周龄雄性BALB/C小鼠(体重18-20 g)购自南京医科大学动物中心。所有小鼠均饲养于无特定病原体(Specific Pathogen Free, SPF)环境中,光照周期为12小时光照/12小时黑暗,环境温度控制在21-23℃,饲养条件符合美国国立卫生研究院(National Institutes of Health, NIH)的动物使用指南。动物实验操作遵循南京医科大学伦理委员会批准的实验方案(伦理审批号:IACUC-2406018),实验过程中采取措施尽量减少动物痛苦,并控制实验动物数量。
人结直肠癌细胞系SW480培养于无菌的高糖DMEM培养基中,培养基中添加10%胎牛血清(Fetal Bovine Serum, FBS)和1%青霉素-链霉素溶液。细胞置于37℃、5% CO₂湿润培养箱中培养,每2天更换一次培养基(MTT实验除外)。
2.2 MgH₂@MgO颗粒的合成
镁粉原料(纯度99 wt%)购自唐山威豪镁粉有限公司,未经进一步纯化直接使用。采用氢化燃烧合成法(Hydriding Combustion Synthesis, HCS)制备氢化镁颗粒(MgH₂@MgO):将镁粉放入合成反应釜中,加热至580℃并保温2小时;随后让反应釜自然冷却至340℃,继续保温8小时;整个合成过程中,反应釜内氢气压力维持在2 MPa;最后将反应釜冷却至室温,得到MgH₂@MgO样品。
2.3 水解实验
水解实验参考本课题组先前的研究方法(Gan 等,2018)。水解反应在50 mL三颈烧瓶中进行:三颈分别作为氢气出口、密封塞接口和水解溶液注入口。在室温条件下,采用排水法测定MgH₂@MgO在去离子水中水解产生的氢气量。
2.4 表征分析
采用X射线衍射仪(Cu Kα辐射,管压40 kV,管流35 mA)分析样品的物相组成;使用扫描电子显微镜(JSM-6360LV)观察样品的形貌特征。
2.5 细胞活力检测(MTT法)
将MgH₂@MgO颗粒与DMEM培养基混合,制备成浓度分别为0、25、50、100、200、400、800 mg/L的工作混悬液。为避免颗粒沉淀和氢气损失,工作混悬液制备完成后立即使用。将细胞接种于96孔板中,经不同浓度混悬液处理24、48、72小时后,每孔加入10%的3-(4,5-二甲基-2-噻唑基)-2,5-二苯基-2-H-四氮唑溴化物(MTT)溶液,置于37℃培养箱中孵育4小时。随后弃去孔内溶液,每孔加入100 μL二甲基亚砜(DMSO),振荡10分钟。使用酶标仪(Bio-Rad,美国)测定570 nm波长处的吸光度值。细胞活力按3个复孔的平均值计算。
2.6 克隆形成实验
将人结直肠癌细胞系SW480以200个/孔的密度接种于6孔板中,分别加入浓度为0、25、50、100、200 mg/L的MgH₂@MgO混悬液进行培养,每2天轻柔更换一次培养基。培养7天后,用10%甲醛固定细胞,再用0.5%结晶紫染色10分钟。计数含30-50个细胞的孤立细胞团,即为一个克隆。
2.7 活性氧(ROS)生成检测
采用2,7-二氯荧光素二乙酸酯(DCFH-DA)检测细胞内氧化应激水平。体外实验中,采用脂多糖(LPS)诱导细胞炎症:先将SW480细胞用适宜浓度(20 mg/L)的LPS处理2小时,再与不同浓度的MgH₂@MgO混悬液(0、100、200 mg/L)共孵育4小时。随后,每组细胞加入10 μM DCFH-DA溶液,37℃孵育30分钟。通过激光共聚焦荧光显微镜观察细胞荧光图像,采用流式细胞仪检测细胞内绿色荧光强度。
2.8 线粒体膜电位(MMP)检测(JC-1法)
采用5,5',6,6'-四氯-1,1',3,3'-四乙基苯并咪唑基羰花青碘化物(JC-1)试剂盒检测线粒体膜电位。将SW480细胞用浓度为0、100、200 mg/L的MgH₂@MgO混悬液处理4小时后,按照试剂盒说明书加入JC-1溶液孵育,通过流式细胞仪检测JC-1的荧光强度。
2.9 体内实验
将雄性BALB/C小鼠随机分为3组(每组n=7只),包括健康对照组(羧甲基纤维素钠组,CAC组)、模型组(葡聚糖硫酸钠组,DSS组)和治疗组(MgH₂@MgO组)。CAC组小鼠仅饮用蒸馏水;为诱导急性溃疡性结肠炎,DSS组和MgH₂@MgO组小鼠先饮用含2.5% DSS的溶液5天,随后饮用蒸馏水4天(Chassaing等,2014)。将MgH₂@MgO混悬于0.5%羧甲基纤维素钠(CAC)溶液中,配制为浓度200 mg/L的混悬液,现配现用。MgH₂@MgO组从实验第4天开始接受治疗;健康对照组(CAC组)和DSS组小鼠则给予等体积的0.5% CAC溶液。所有药物均通过保留灌肠方式给药(每只小鼠50 μL),每日1次。灌肠后,将小鼠倒置10分钟,以确保药物和氢气在肠道内留存。治疗持续5天。
采用疾病活动指数(Disease Activity Index,DAI)动态评估结肠炎严重程度(Perera等,2018),评分标准如表1所示。每日记录小鼠体重和存活率。实验第9天,对所有小鼠实施安乐死,收集小鼠血液、粪便和结肠组织用于后续实验;按照试剂盒说明书,采用酶联免疫吸附试验(ELISA)检测粪便潜血和蛋白质水平。
表1 实验性结肠炎疾病活动评分评估标准**
| 评分 | 体重下降率(%) | 粪便性状 | 毛发状态 | 潜血试验 |
| ---- | ---- | ---- | ---- | ---- |
| 0 | 0 | 正常 | 无异常 | 阴性 |
| 1 | 1-5 | 稀便 | 毛发粗糙 | 阳性 |
| 2 | 6-10 | 腹泻 | - | 阳性 |
| 3 | 11-15 | 腹泻伴肛门脱垂 | - | 阳性 |
| 4 | >15 | 腹泻伴便血 | - | 阳性 |
2.10 苏木精-伊红(HE)染色与免疫组织化学染色
将结肠组织置于10%中性缓冲福尔马林溶液中固定24小时,随后经梯度乙醇-二甲苯脱水处理,再进行石蜡包埋。将包埋后的组织切成4 μm厚的切片,依次放入两份新鲜二甲苯中脱蜡(每份二甲苯中浸泡7分钟),再经梯度乙醇复水。之后用苏木精染液对细胞核染色6分钟,在0.3%酸性乙醇中分化,并用温自来水返蓝;接着用伊红-Y染液复染30秒,随后快速脱水、二甲苯透明,最后用合成树脂封片并加盖盖玻片。由两名病理医师通过光学显微镜(日本奥林巴斯)观察所有切片,通过HE染色切片观察结直肠组织形态学变化。
为实现抗原修复,将结直肠切片置于柠檬酸盐缓冲液中高压灭菌2分钟,随后用5%牛血清白蛋白封闭。将切片与抗白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、P65蛋白磷酸化(pi-P65)、8-羟基-2'-脱氧鸟苷(8-OHdG)、髓过氧化物酶(MPO)或甘油醛-3-磷酸脱氢酶(GAPDH)的一抗孵育,再按照说明书与二抗孵育。之后用二氨基联苯胺(DAB)显色,苏木精染液复染,由两名病理医师采用双盲法通过光学显微镜(日本奥林巴斯)观察所有切片。急性结肠炎病理评分标准如表2所示(Kim等,2012)。
表2 结肠炎病理评分评估标准**
| 评分 | 病变情况 |
| ---- | ---- |
| 0 | 正常 |
| 1 | 局灶性炎症 |
| 2 | 多灶性炎症或杯状细胞减少 |
| 3 | 多灶性炎症、肠上皮损伤或严重隐窝变形 |
| 4 | 多灶性炎症、溃疡或隐窝完全消失 |
2.11 统计学分析
实验结果以“平均值±标准差(Mean±SD)”表示。采用单因素方差分析(one-way ANOVA)验证组间差异的统计学意义;对多时间点数据采用重复测量双因素方差分析(two-way repeated measure ANOVA);对非分类变量采用Kruskal-Wallis检验。以P<0.05为差异具有统计学意义。所有统计分析均采用GraphPad Prism 9软件完成。
3 结果与讨论
3.1 MgH₂@MgO的表征分析
氧化镁包覆氢化镁颗粒(MgH₂@MgO)的表征结果如图2所示。
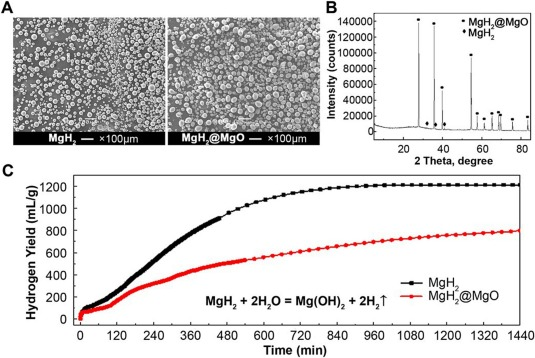
图2 MgH₂@MgO的表征结果**
(A)MgH₂与MgH₂@MgO的扫描电镜(SEM)图像;
(B)MgH₂与MgH₂@MgO的粒径统计;
(C)氢化燃烧合成产物的X射线衍射(XRD)图谱;
(D)MgH₂@MgO与游离MgH₂在去离子水中的释氢曲线。
SEM图像显示,原始MgH₂粉末呈球形,粒径约为26.7 μm(图2A);氢化处理后,由于晶格体积膨胀,MgH₂@MgO的平均粒径增至约32.8 μm(图2B)。图2C所示的MgH₂@MgO X射线衍射图谱表明,氢化燃烧合成(HCS)产物主要成分为MgH₂@MgO,仅含微量未氢化的Mg。Rietveld分析结果显示,MgH₂@MgO的物相纯度达99 wt%,体现出氢化燃烧合成法制备高纯度MgH₂的优势。
氢化镁(MgH₂)是典型的高化学反应活性金属氢化物,与水接触时会优先发生非酶促反应,生成氢氧化镁和氢气。该反应不依赖酶催化,在水相体系(如生物反应环境)中可快速进行。当MgH₂颗粒分散到水相中时,会与水剧烈反应并释放大量氢气;而经氧化镁(MgO)包覆钝化后,其水解速率显著降低。对于1 g MgH₂@MgO,24小时内可产生约763 mL氢气;在37℃条件下,所制备的MgH₂@MgO在去离子水中的水解速率相对缓慢,产氢量与反应时间大致呈正比。表面钝化处理实现了氢气的缓慢、稳定且持续释放。
3.2 MgH₂@MgO的体外细胞毒性及脂多糖(LPS)的影响
已知肠道菌群紊乱是溃疡性结肠炎(UC)的致病因素之一。脂多糖(LPS)作为革兰氏阴性菌细胞壁的标准成分,会促进UC的发生与发展(Candelli等,2021)。LPS作为强外源性刺激物,可升高活性氧(ROS)水平并诱导细胞损伤,常被用作结肠炎诱导剂构建疾病模型(Bao等,2023)。
图3A-B显示,在0~800 mg/L浓度范围内,MgH₂@MgO的细胞毒性较低。与同时间点的对照组相比,所有MgH₂@MgO处理组对细胞增殖的抑制率均低于20%。平板克隆形成实验也证实了MgH₂@MgO的这一特性(图3C)。肿瘤细胞的克隆形成能力是衡量药物细胞毒性的敏感指标(Le Berre等,2023)。本实验中,经最高浓度(200 mg/L)MgH₂@MgO处理后,细胞克隆形成率相对于对照组(0 mg/L MgH₂)降低至73.8%(图3D)。
此外,低浓度LPS(0~5 mg/L)对细胞增殖有轻微促进作用,而高浓度LPS则会导致细胞活力显著下降。Tomoaki Naito等研究指出,LPS对结肠黏膜具有双重作用:一方面通过诱导坏死性凋亡抑制细胞增殖,另一方面促进杯状细胞谱系分化(Naito等,2017)。本研究中,MgH₂@MgO处理组细胞活力的异常升高可能与其抑制氧化应激、保护细胞免受LPS诱导的细胞毒性有关。上述实验证实,MgH₂@MgO在结肠细胞中具有低毒性,且能以剂量依赖方式保护细胞免受炎症损伤。
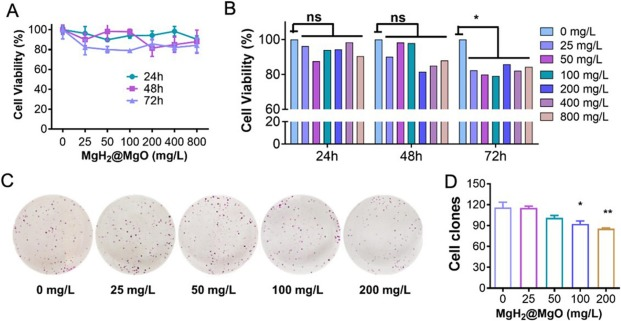
图3 MgH₂@MgO颗粒的细胞毒性检测**
(A)MgH₂@MgO处理后的细胞毒性结果;
(B)MgH₂@MgO处理后的细胞活力检测结果;
(C)MgH₂@MgO处理后的平板克隆形成实验结果;
(D)与图3C对应的细胞活力定量结果。
数据以“平均值±标准差”表示;与对照组相比,*P<0.05,**P<0.01,***P<0.001;每组实验均包含5个生物学重复,每个重复进行3次技术验证。
3.3 MgH₂@MgO有效抑制细胞氧化应激
氧化应激是诱导溃疡性结肠炎(UC)细胞损伤的主要病理机制之一(Blagov等,2023)。由上皮屏障损伤和中性粒细胞免疫功能紊乱产生的活性氧(ROS),是炎症组织中直接的调控因子和激活因子。抗氧化治疗被认为是UC治疗的潜在方向(Aviello和Knaus,2018)。
MgH₂是强还原性物质,而ROS(包括超氧阴离子O₂•−、过氧化氢H₂O₂和羟基自由基•OH)是氧化还原反应中典型的两性物质。当两者接触时,发生的并非简单水解反应:ROS会优先作为氧化剂,MgH₂作为还原剂,发生伴随明确电子转移的氧化还原反应。2,7-二氯二氢荧光素二乙酸酯(DCFH-DA)探针常被用作检测细胞内ROS生成的指示剂(Eruslanov和Kusmartsev,2010)。
图4A-B显示,LPS处理组细胞荧光强度最高,表明LPS显著升高了SW480细胞的ROS水平;而经MgH₂@MgO孵育后,ROS水平受到抑制。流式细胞术定量分析(图4C)表明,MgH₂@MgO可降低癌细胞固有的高ROS水平(P<0.05);对于LPS诱导的更高水平ROS,MgH₂@MgO能以剂量依赖方式将其显著降至低于肿瘤细胞常规ROS水平(P<0.05)。上述结果提示,MgH₂@MgO可能通过抑制细胞内氧化应激,对炎症状态下的细胞发挥保护作用。
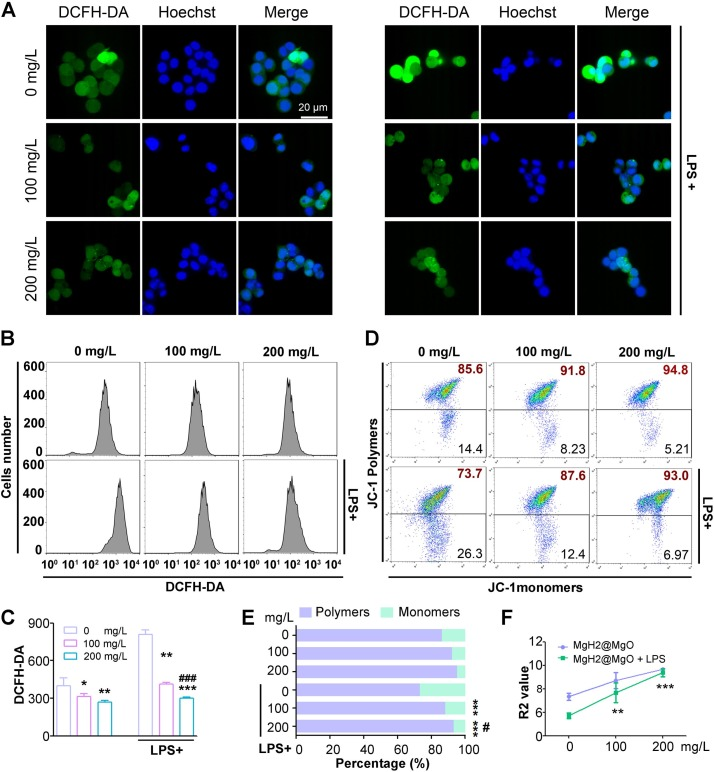
图4 MgH₂@MgO处理可降低细胞内活性氧(ROS)水平并保护细胞免受线粒体功能障碍损伤
(A)激光共聚焦荧光显微镜下细胞内ROS水平评估;
(B)有无脂多糖(LPS)处理时,MgH₂@MgO作用后的细胞内ROS水平;
(C)二氯荧光素(DCFH)荧光强度定量结果;
(D)JC-1聚合物与单体水平的流式细胞术分析;
(E)指示JC-1聚合物/单体比例的荧光强度比值(R2值);
(F)不同处理组细胞中JC-1聚合物/单体的荧光强度。
数据以“平均值±标准差(Mean±SD)”表示;与对照组相比,*P<0.05,**P<0.01,***P<0.001;与模型组相比,#P<0.05,#P<0.001;比例尺=20 μm;每组实验包含5个生物学重复,每个重复进行3次独立技术验证。
线粒体功能障碍是细胞内氧化损伤的早期反应,对氧化应激升高高度敏感,其最早出现的特征之一是线粒体膜电位(MMP)跨膜电化学梯度下降。JC-1探针是评估线粒体膜电位的灵敏指示剂:在正常细胞中,JC-1以聚合物形式存在于线粒体基质中,发出红色荧光,表明线粒体膜电位处于较高水平(Xu等,2025);而在氧化应激条件下,线粒体膜电位下降会诱导JC-1从聚合物解聚为单体,发出绿色荧光。红色/绿色荧光比值(R2值)可反映线粒体功能障碍程度。本研究中,LPS处理组小鼠的线粒体膜电位显著降低,而加入MgH₂@MgO处理后,可上调线粒体膜电位并逆转氧化损伤(图4D-F),且差异具有统计学意义(P<0.01)。
3.4 MgH₂@MgO通过NF-κB通路降低氧化应激
在特定低浓度下,脂多糖(LPS)可呈时间依赖性刺激细胞增殖,多项研究证实这一过程通过激活转录因子核因子κB(NF-κB)通路介导(Mao等,2025)。NF-κB通路是调控炎症反应的重要信号通路,参与维持肠道免疫系统稳态和上皮屏障功能[27,41],其信号级联反应是溃疡性结肠炎(UC)发病机制中的核心调控环节(Bahrami等,2024)。在肠道中,持续高水平的活性氧(ROS)会异常激活NF-κB的RelA/p65/p50异二聚体,进一步促进NF-κB核转位,并诱导下游基因(如肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)、白细胞介素-6(IL-6))表达(McDaniel等,2016)。研究发现,溃疡性结肠炎患者的肠道组织中NF-κB蛋白表达水平显著升高(Makaro等,2020)。无论是在体内还是体外实验中,降低细胞内氧化应激水平或阻断NF-κB通路均可有效抑制炎症反应(Zhao等,2024)。
为探究MgH₂@MgO治疗结肠炎的分子机制,本研究检测了NF-κB通路相关蛋白及炎症因子(IL-1、IL-6、TNF-α)的表达(图5A)。结果显示,MgH₂@MgO处理可下调炎症因子水平(图5C-E),同时抑制NF-κB信号通路的激活(图5B)。与对照组相比,LPS处理组中P65蛋白磷酸化比例(pi-P65/P65)升高至116.6%,表明结肠炎状态下NF-κB通路被激活;而MgH₂@MgO处理后,P65磷酸化受到抑制——200 mg/L MgH₂@MgO组的P65磷酸化比例为75.9%,LPS+200 mg/L MgH₂@MgO组为88.6%,且炎症因子表达呈剂量依赖性。
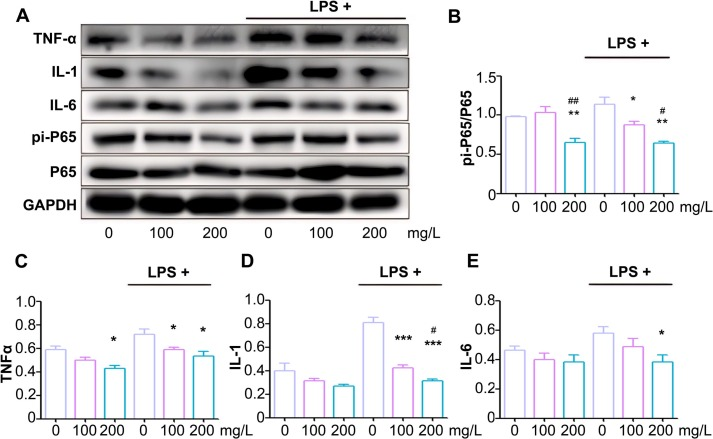
图5 MgH₂@MgO降低NF-κB通路相关蛋白表达
(A)结直肠组织中相关蛋白的表达情况;
(B)磷酸化P65蛋白与总P65蛋白的定量比值;
(C、D、E)肿瘤坏死因子-α(TNF-α,C)、白细胞介素-1(IL-1,D)、白细胞介素-6(IL-6,E)与甘油醛-3-磷酸脱氢酶(GAPDH)的蛋白表达比值。
数据以“平均值±标准差(Mean±SD)”表示;与对照组相比,*P<0.05,**P<0.01,***P<0.001;与模型组相比,#P<0.05,P<0.01;每组实验包含5个生物学重复,每个重复进行3次独立技术验证。
3.5 MgH₂@MgO处理保护小鼠免受DSS诱导的溃疡性结肠炎损伤
为进一步探究MgH₂@MgO的治疗效果,研究人员通过每日保留灌肠方式,向急性溃疡性结肠炎小鼠模型给予200 mg/L MgH₂@MgO混悬液(图6A)。
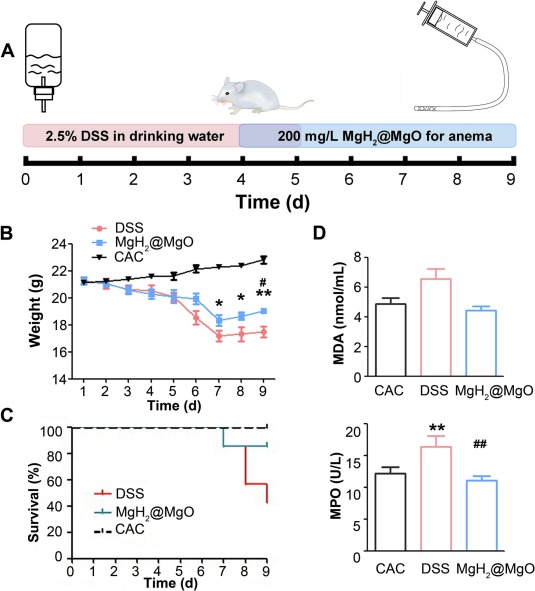
图6 MgH₂@MgO处理保护小鼠免受DSS诱导的溃疡性结肠炎损伤
(A)小鼠实验处理流程示意图;
(B)小鼠动态体重变化及实验终点体重;
(C)小鼠动态存活率;
(D)血液中氧化应激相关生物标志物水平。
数据以“平均值±标准差(Mean±SD)”表示,n=7;与对照组相比,**P<0.01;与模型组相比,#P<0.05,P<0.01。
保留灌肠是治疗轻中度溃疡性结肠炎的有效方法,可直接作用于黏膜并快速起效,且无全身副作用(Gordon等,2023)。然而,有研究报道口服镁盐会发挥容积性泻药作用(Di Palma等,2021)。本研究中,MgH₂@MgO水解的终产物为低水溶性氢氧化镁,难以形成有效浓度的游离镁离子;此外,口服MgH₂@MgO难以在结直肠部位达到足够治疗浓度,因此选择保留灌肠方式给药。其水解产物氢气可通过自然体腔及时排出,且与传统灌肠药物相比,氢气的自由扩散特性使MgH₂@MgO具有更广泛的治疗范围。
实验过程中,研究人员监测了小鼠的存活率、体重及疾病严重程度;实验终点时,通过酶联免疫吸附试验(ELISA)分析血液和结肠组织中的炎症标志物。结果显示,与结肠炎模型组(DSS组)相比,MgH₂@MgO处理组(MgH₂@MgO组)小鼠体重下降更缓慢,死亡率更低(图6B-C),差异具有统计学意义(P<0.05)。健康对照组(CAC组,给予CAC溶液灌肠)小鼠体重呈生理性增长,而DSS处理后小鼠体重明显下降;实验最后3天,DSS组和MgH₂@MgO组小鼠体重均略有回升,这可能与停止DSS处理后小鼠的自我修复能力及重症小鼠死亡有关。
研究人员还从血清中提取了炎症和氧化应激生物标志物:丙二醛(MDA)是脂质过氧化的终产物之一,广泛用于反映体内ROS系统失衡程度[47];髓过氧化物酶(MPO)是一种富含于髓系细胞的血红素酶,在抗感染过程中发挥重要作用,也是氧化应激和炎症损伤的常用指标。结果显示,DSS处理小鼠的MPO(P<0.05)和MDA水平显著升高,而MgH₂@MgO处理可抑制这一升高趋势(图6D)。
为更系统地评估结肠炎严重程度,研究采用结肠总长度和疾病活动指数(DAI)作为评价指标(DAI评分参照表1每日进行),同时分析了结肠组织的病理变化及脂质运载蛋白-2(LP-2)的表达。结肠长度与肠道炎症程度相关:图7A-B显示,DSS组小鼠结肠长度最短,表明其结肠炎最严重(P<0.05);相反,MgH₂@MgO处理可保护小鼠免受急性结肠炎损伤。CAC组小鼠在结肠炎诱导后,DAI评分持续显著升高(图7C),而规律的MgH₂@MgO保留灌肠可部分缓解小鼠结肠炎症状(P<0.05)。
脂质运载蛋白-2(LP-2,又称中性粒细胞明胶酶相关脂质运载蛋白)可通过激活NF-κB/NLRP3通路放大炎症反应并导致组织损伤,在溃疡性结肠炎患者的炎症性结肠上皮组织中,LP-2表达显著升高(Yang等,2024)。MgH₂@MgO组结肠组织中LP-2蛋白表达降低(图7D),证实其可缓解炎症反应(P<0.01)。
研究人员对结直肠组织进行苏木精-伊红(HE)染色,并由两名病理医师参照结肠炎病理评分标准(表2)进行独立评估。溃疡性结肠炎的典型病理形态学改变(图7E)包括肠上皮腺结构破坏、炎症细胞浸润(蓝色箭头)、出血(红色箭头),甚至隐窝脓肿(黄色箭头)。DSS组小鼠结肠组织可见弥漫性、严重的组织损伤,结直肠上皮结构破坏导致严重的肠屏障功能障碍;而MgH₂@MgO组仅出现轻微的腺体破坏和炎症浸润,表明MgH₂@MgO可改善肠屏障功能(P<0.05)。
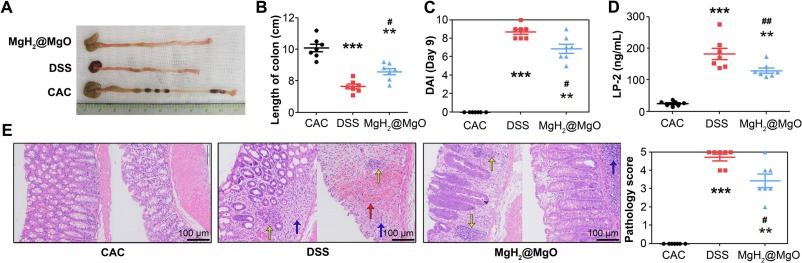
图7 MgH₂@MgO处理对结肠炎小鼠结肠病理变化的影响
(A)各组小鼠结肠长度实物图;
(B)治疗组(MgH₂@MgO)、模型组(DSS)与健康对照组(CAC)小鼠结肠长度定量分析;
(C)MgH₂@MgO组、DSS组与CAC组小鼠的疾病活动指数(DAI)变化;
(D)结肠组织中LP-2蛋白表达水平;
(E)结直肠组织HE染色图像及病理评分。
数据以“平均值±标准差(Mean±SD)”表示,n=7;与对照组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,P<0.01;比例尺=100 μm。
已有研究表明,活性氧(ROS)过量产生是溃疡性结肠炎(UC)的关键致病因素,氧自由基过载会导致细胞功能障碍和肠屏障破坏(Aviello和Knaus,2017)。NF-κB通路是调控结直肠炎症和氧化应激的主要通路之一,在溃疡性结肠炎中可同时检测到ROS蓄积和NF-κB通路激活,因此抑制ROS是一种有效的抗炎治疗策略(Blagov等,2023)。尽管目前已有多种抗氧化药物,但还原剂的不稳定性和副作用仍限制了其临床应用潜力(Zhang等,2022;Larabi等,2020)。
图8的免疫组化结果显示,DSS组小鼠结肠组织中炎症因子水平升高,而MgH₂@MgO处理可显著抑制这些蛋白的表达,表明其能有效抑制结直肠炎症。研究证实,氧化应激会对细胞膜、蛋白质及DNA脂质造成永久性损伤;8-羟基-2'-脱氧鸟苷(8-OHdG)被广泛用于评估自由基诱导的氧化损伤(Muro等,2024)。髓过氧化物酶(MPO)是主要由中性粒细胞产生的通用过氧化物酶,其局部表达可催化生成强效ROS,在溃疡性结肠炎患者黏膜中MPO蛋白表达也会升高,是氧化损伤的标志物之一(Atay和Canbakan,2025)。目前已有多项研究将MPO抑制剂作为多种慢性炎症的靶向治疗药物(Tangeten等,2022)。本研究中,MgH₂@MgO组可降低DSS结肠炎诱导的8-OHdG和MPO表达;同时,DSS组中pi-P65(磷酸化P65)过量表达,而MgH₂@MgO组中pi-P65表达受抑,这表明MgH₂@MgO的抗氧化和抗炎作用部分通过NF-κB通路实现。
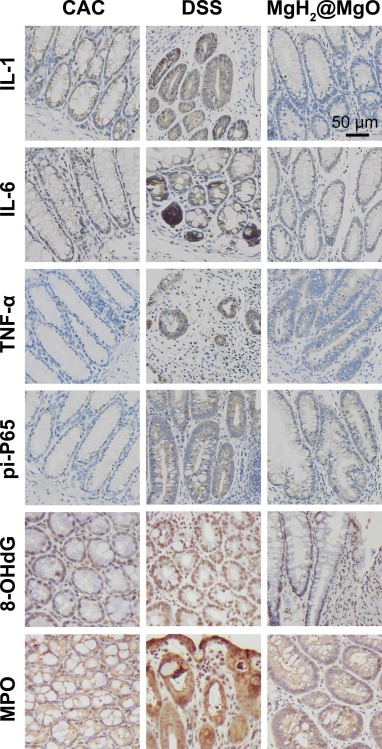
图8 结直肠组织中相关蛋白的表达(免疫组化染色)
比例尺=50 μm。
本研究采用SW480细胞系和小鼠模型探究溃疡性结肠炎相关机制,这些模型虽为结肠急性炎症研究提供了有价值的见解,但可能无法完全复现体内慢性炎症的复杂性。此外,本研究的另一关键局限性在于药物在肠道内的留存时间:肠道具有持续的生理蠕动,在小鼠模型中,研究人员通过给药后倒置小鼠10分钟来延缓药物排出。尽管存在这些局限性,本研究仍成功构建了一种新型抗氧化复合物MgH₂@MgO,其具有稳定储氢和可控释氢能力,在水中可缓慢释放氢气,且在体内外实验中均表现出持久的抗氧化效果。
在LPS诱导的炎症性结肠细胞中,MgH₂@MgO展现出不可或缺的抗炎作用;在溃疡性结肠炎小鼠中,MgH₂@MgO保留灌肠可显著减少结直肠自由基损伤、抑制结肠炎发展、缓解局部病理改变和全身反应,甚至降低死亡率。溃疡性结肠炎实验模型证实,MgH₂@MgO处理可抑制NF-κB通路的异常激活;此外,MgH₂的生物学特性分析表明,在合理剂量范围内其细胞毒性极低。综上,MgH₂@MgO作为一种生物相容性良好、氢释放可控的抗氧化剂,在溃疡性结肠炎的长期稳定治疗中具有临床应用潜力。
4 结论
综上所述,本研究构建了一种新型抗氧化复合物MgH₂@MgO,该复合物具有稳定的储氢能力和可控的释氢特性,在水中可缓慢释放氢气,且在体内外实验中均表现出持久的抗氧化效果。在脂多糖(LPS)诱导的炎症性结肠细胞中,MgH₂@MgO展现出显著的抗炎作用;在溃疡性结肠炎(UC)小鼠模型中,MgH₂@MgO保留灌肠可明显减少结直肠组织的自由基损伤、抑制结肠炎进展、缓解局部病理改变及全身反应,甚至降低小鼠死亡率。溃疡性结肠炎实验模型证实,MgH₂@MgO可抑制核因子κB(NF-κB)通路的异常激活;此外,生物学特性分析表明,在合理剂量范围内,MgH₂的细胞毒性极低。作为一种生物相容性良好且氢释放可控的抗氧化剂,MgH₂@MgO在溃疡性结肠炎的长期稳定治疗中具有临床应用潜力。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1508283.html?mobile=1
收藏

