富氢次氯酸水对肉鸡饮水细菌水平、生长性能、抗氧化能力及肠道环境的影响
在规模化养殖中,肉鸡饮水中的致病性微生物污染是导致疾病发生与传播的关键因素。有效的饮水质量管理对于保障肉鸡健康、优化生产性能至关重要。次氯酸水(HAW)、富氢水(HRW)等功能性添加剂常被应用于养殖场饮水系统:其中次氯酸水可抑制细菌生长,富氢水则能提升肉鸡的抗氧化能力。本研究旨在探究这两种功能性添加剂联合使用的效果,评估其对饮水系统中细菌与生物膜、肉鸡生产性能、抗氧化能力及肠道环境的影响。
试验共选取480只肉鸡,随机分为4组(每组120只),为期42天的饲养过程中分别供给不同水溶液:A组(自来水,对照组)、B组(次氯酸水,浓度0.3 mg/L)、C组(富氢水,浓度1200 ppb)、D组(次氯酸水与富氢水混合液,即富氢次氯酸水[HRHAW],浓度为0.3 mg/L + 1200 ppb)。
结果显示:经富氢次氯酸水干预后,饮水中浮游细菌的杀灭率超过99.90%,生物膜生物量减少62.85%;与对照组相比,富氢次氯酸水对料肉比无显著影响,但能显著改善鸡胸肉嫩度(提升39.15%)及肉鸡抗氧化能力(超氧化物歧化酶[SOD]活性提升6.52%~27.54%,谷胱甘肽过氧化物酶[GSH-PX]活性提升8.54%~50.97%);同时,该混合液可通过缓解氧化应激与发挥抗菌作用,改善肉鸡肠道健康。
综上,富氢次氯酸水成功整合了富氢水的抗氧化优势与次氯酸水的抗菌功效,能显著降低饮水中的细菌含量、提升肉鸡抗氧化能力,进而对肉鸡健康产生积极影响。
Li J, Liu C, Peng C, Wang Y, Li B, Yang L, Peng H, Zheng W. Effects of hydrogen-rich hypochlorous acid water on broiler drinking water bacterial level, growth performance, antioxidant capacity, and intestinal environment. Poult Sci. 2025 Oct 24;104(12):106009. doi: 10.1016/j.psj.2025.106009. Epub ahead of print. PMID: 41151446.
作者单位
1 中国农业大学水利与土木工程学院农业建筑与环境工程系;农业农村部农业工程结构与环境重点实验室;北京市畜禽健康环境工程技术研究中心。2 长沙湖南梵高科技有限公司。3 成都四川省畜牧科学研究院。4 中国农业大学水利与土木工程学院农业建筑与环境工程系;农业农村部农业工程结构与环境重点实验室;北京市畜禽健康环境工程技术研究中心。
引言
水是动物组织和细胞的重要组成部分,同时调控着关键生理过程。饮水的微生物安全性直接影响家禽的生长与健康,因为水是病原体传播的主要载体。例如,从养殖场水中分离出的肝弯曲杆菌(*Campylobacter hepaticus*)可引发斑点肝病,导致产蛋率下降25%、死亡率上升10%(Battersby等,2017;Petrovska等,2017;Phung等,2019)。具有强致病性的禽致病性大肠杆菌(avian pathogenic *Escherichia coli*)可引发原发性呼吸道感染,进而发展为全身性疾病(Dziva等,2008),并通过降低孵化率、减少产蛋量、抑制生长性能及提高死亡率,造成重大经济损失(Mol等,2019)。
家禽细菌感染带来双重危害:一方面损害动物健康与生产效率,造成经济损失;另一方面,人畜共患病原体可通过食物链传播给人类,这种传播可能促使病原体进化出适应人类的菌株,从而对家禽养殖系统和公共健康均构成威胁(Grace等,2024;Kuehn,2018;Song等,2022)。实证研究表明,将家禽屠体上弯曲杆菌(*Campylobacter*)的数量减少10至1000倍,可显著降低人类弯曲杆菌病的发病率(Hermans等,2011)。这一结果凸显了降低家禽肠道病原体载量对减少人类细菌感染的重要意义(Iwata等,2023)。
因此,在现代集约化养殖系统中,维生素、多糖等添加剂常通过饮水添加,以提升生产性能。然而,这种高有机物输入模式为微生物繁殖提供了丰富碳源,加速了饮水管道内壁生物膜的积累。
在家禽养殖场的管道输水过程中,由于消毒剂衰减和生物膜脱落,二次污染频繁发生,威胁饮水安全(Wan等,2021)。针对家禽养殖场的区域性调查显示,饮水系统的细菌污染问题普遍存在。北京一项研究发现,60.7%的受调查养殖场饮水消毒不规律,仅10.7%的水样符合细菌总数标准,且沿饮水管道从近端到远端,细菌载量逐渐增加;总大肠菌群合格率为50%,耐热大肠菌群和大肠杆菌合格率为82.1%(Wu等,2013)。对爱尔兰20个肉鸡舍的评估进一步发现,饮水中存在持续性弯曲杆菌污染(Battersby等,2017)。这些数据表明,饮水微生物安全仍是集约化家禽养殖中一个关键但常被忽视的生物安全环节。
有效的饮水消毒是阻断家禽养殖中病原体传播的关键。传统水处理方法主要依赖物理冲洗和氯基化学消毒剂:物理消毒虽操作简便,但存在效果有限、产生大量废水等明显缺陷;二氧化氯等化学消毒剂虽抗菌效果强,却会产生具有致癌性和致畸性的消毒副产物(Han等,2021)。因此,寻找安全有效的传统消毒剂替代品,是家禽饮水管理领域的重要挑战。
近年来,功能性添加剂技术作为可持续、环保的化学消毒剂替代品受到关注,其中次氯酸水(HAW)和富氢水(HRW)因其独特的生物功能展现出巨大潜力。
次氯酸水在清除饮水系统细菌方面效果显著。例如,凭借其缓释次氯酸的特性,次氯酸水对大肠杆菌的灭活率可达99.90%以上,且该方法被认为安全无有害残留。研究表明,与自来水相比,在蛋鸡饮水中添加0.3 mg/L次氯酸水,对细菌总数和大肠杆菌的灭活率均超过99.90%(Li等,2024);在生猪饮水系统中添加3%次氯酸水,可清除大肠杆菌并显著降低细菌总数(Hao等,2023)。
研究证实,分子氢(H₂)可减轻家禽的氧化损伤、修复肠道屏障并调节微生物代谢,从而缓解氧化应激导致的生长抑制。例如,饮用0.6 mmol/L富氢水可提升鸡胸肉品质(Zhu等,2025);在肠道健康方面,热应激条件下补充富氢水,可增加盲肠内容物中产丁酸菌的丰度,并提高空肠绒毛高度与隐窝深度的比值,表明其在维持肠道菌群稳态中发挥作用(Ji等,2019)。从生化机制来看,富氢水可正向调节家禽体内抗氧化酶的活性(Shin等,2016;Zhang等,2022)。
已有大量研究证实富氢水在抗氧化调节、次氯酸水在微生物控制方面的优势,但这些研究大多局限于单一功能性添加剂的效果评估,缺乏二者联合应用的观测数据,二者共用时可能产生的协同或拮抗效应尚不清楚,这一瓶颈制约了功能性添加剂技术的系统应用。
鉴于次氯酸水与富氢水联合应用可能存在的协同或拮抗作用尚不明确,本研究对肉鸡开展了为期42天的饮水干预试验,研究目的如下:(1)探究富氢次氯酸水中活性成分的相互作用,为其应用与储存制定实用指南;(2)评估富氢次氯酸水对肉鸡饮水中微生物的抑制效果,阐明富氢水与次氯酸水联用对抗菌性能的影响;(3)探究富氢次氯酸水对肉鸡抗氧化能力及肠道指标的作用,阐明富氢水与次氯酸水联用对抗氧化性能的影响。
材料与方法
伦理审批与参与同意
所有动物试验均严格遵循《实验动物饲养和使用指南》。试验方案已通过中国农业大学动物伦理委员会和机构生物安全委员会的审查与批准(批准号:AW80605202-6-02)。
试验动物与饲养管理
选取480只1日龄雄性大恒黄羽肉鸡,初始平均体重为38.78±0.49 g,随机分为4个处理组,每组6个重复,每个重复20只肉鸡。试验分为两个饲养阶段(1~21日龄和22~42日龄),期间对照组与试验组均饲喂相同的粉状基础日粮,基础日粮的组成及营养水平见表1和表2。
肉鸡采用笼养方式,自由采食和饮水。饲养前7天,鸡舍温度维持在33~35℃,之后每周逐渐降低3℃,直至稳定在22~25℃;相对湿度控制在50%~70%,光照制度为23小时光照、1小时黑暗。每周根据视觉观察调整乳头式饮水器高度,确保肉鸡饮水不受限。
在42天试验期内,每日记录每个重复的死亡率、淘汰鸡数量及采食量,核心生产性能指标为料肉比(F/G)。分别在1日龄和42日龄时,对肉鸡进行8小时禁食后测定体重。42日龄时,每个重复选取1只体重接近该重复平均体重的肉鸡进行采样,测定其生产性能、肉品质、抗氧化能力及肠道环境指标。
(表1:基础日粮组成)
试验设计
A组供给经输水系统输送的市政自来水(有效氯浓度[ACC]:0 mg/L);B组和C组分别供给不同的功能性水添加剂:B组为0.3 mg/L次氯酸水(使用“水神”HD-240L-V2型次氯酸发生器,上海富强王卫生用品有限公司生产),C组为1200 ppb富氢水(使用NB-X71A纳米气泡氢气吸入器,上海纳米气泡纳米科技有限公司生产);D组供给次氯酸水与富氢水的混合液(有效氯浓度:0.3 mg/L;溶解氢浓度:1200 ppb,湖南梵高科技有限公司生产)。
所有饮水管道均为新安装,使用前进行消毒处理(使用前处理:用150 mg/L次氯酸水浸泡24小时,随后用自来水彻底冲洗)。PVC管道(直径25 mm,每根长度12 m)上安装乳头式饮水器。每4天采集1次水样,测定可培养浮游细菌浓度;试验第30天,截取管道片段用于生物膜生物量评估。
水样采集与检测
在距离水箱2、4、6、8、10、12 m处的乳头式饮水器采集水样。采集前,用75%乙醇对乳头式饮水器及其30 cm范围内的管道进行消毒,防止水样污染。使用无菌采样瓶采集50 mL水样(需弃去前3管出水,避免水样中混入死水),带回实验室后立即进行微生物分析。
采用便携式氯度计(中国长春迈泰仪器有限公司ZNSK-100S1型,测量范围0~3 mg/L,精度±0.1 mg/L;日本埼玉原化学仪器株式会社RC-3F型,测量范围0~320 mg/L,精度±1 mg/L)测定有效氯浓度(ACC);采用便携式氢气检测仪(日本TRUSTLEX公司ENH-2000型氢气水质检测仪,测量范围0~3000 ppb,精度±1 ppb)测定溶解氢浓度。
微生物检测在实验室无菌环境下进行:取1 mL水样加入无菌培养皿(未消毒水样需进行梯度稀释),倒入约15 mL灭菌冷却后的营养琼脂或麦康凯琼脂(中国北京奥博星生物技术有限责任公司生产),充分混匀后,置于37℃恒温培养箱中培养48小时。计数每皿30~300个的菌落数,以此确定水样中可培养浮游细菌的总数。
饮水管道生物膜的采集与检测
试验第30天,截取管道片段进行生物膜采集与分析。截取前,先用自来水冲洗管道外表面,再用高浓度次氯酸水(150 mg/L)消毒,最后再次用自来水冲洗。使用割炬进行现场切割,每段管道的两端用保鲜膜包裹,以保持湿度并防止在运往实验室过程中受到污染。使用无菌毛刷和硅胶刮刀,从距离切割边缘至少10 cm处刮取生物膜及管道沉积物(面积>5 cm²),每个管道片段采集3份样本,将其放入磷酸盐缓冲液中。样本装入无菌采样瓶,于4℃冷藏保存,用于测定生物膜生物量和胞外聚合物(Liu等,2017)。
生物膜生物量通过在R2A培养基(北京奥博星生物技术有限责任公司)上培养异养菌来表征,采用异养平板计数法对生物膜生物量进行定量分析:将样本接种到灭菌的R2A培养基(北京奥博星)上,于25℃培养7天后进行菌落计数(Li等,2020);大肠杆菌密度通过在麦康凯琼脂上接种样本,于37℃培养48小时后测定。胞外聚合物(EPS)成分分析采用蒽酮-硫酸法(测定多糖)和福林-洛里法(测定蛋白质)(Cheng等,2018)。
生产性能测定
在试验第1天和第42天,对肉鸡进行8小时禁食后测定体重。每日记录死亡鸡数量和饲料消耗量,计算平均日增重(ADG)、平均日采食量(average daily feed intake)和料肉比(F/G)。
肉品质测定
试验结束后,采用颈椎脱位法对肉鸡实施人道安乐死,进行肉品质测定:
- pH值:在肉鸡死亡45分钟后,使用pH计(德国Meters公司pHSTAR型,pH测量范围0~9.9,总测量范围0~14,精度±0.1 pH)测定鸡胸肉pH值;
- 滴水损失:将鸡胸肉样本单独装入塑料袋,于4℃冷藏24小时,通过测定冷藏前后肉样的重量差计算滴水损失率;
- 蒸煮损失:取约30 g胸肌样本,装入密封塑料袋,在75℃水浴中加热30分钟;蒸煮后冷却,擦干表面水分并称重,计算蒸煮损失率;
- 剪切力:将煮熟的胸肌样本在25℃下平衡15分钟,沿肌纤维方向切取长约4~6 cm、横截面积约1×1 cm²的小方块,使用嫩度计测定剪切力(单位:牛顿,N)(Sosnówka-Czajka等,2023)。
抗氧化能力评估
试验结束时,每个重复随机选取1只肉鸡,通过臂静脉采血。取约5 mL血液注入无抗凝剂试管,在室温下静置30分钟使其凝固,然后以3500转/分钟(rpm)的速度离心10分钟。吸取1~2 mL上清血清,于-20℃保存,用于分析血液抗氧化指标。
使用无菌剪刀无菌分离肝脏组织样本,放入预冷的无菌离心管中,立即用液氮速冻,之后置于-20℃保存,用于肝脏抗氧化指标分析(参照Jiang等,2009年建立的方法)。
肠道分析
试验结束时,从4个试验组中各选取6只体重接近平均值的健康肉鸡,采用颈椎脱位法实施人道安乐死。通过无菌手术截取十二指肠、空肠和回肠各肠段相同部位约2 cm的组织,将其浸入含4%多聚甲醛的通用组织固定液中,室温保存,用于制作石蜡切片。
肠道组织经脱水、浸蜡、包埋、切片后,进行苏木精-伊红染色,随后在显微镜下观察并成像。使用Image-Pro-Plus软件测量小肠绒毛高度和隐窝深度,计算绒毛高度与隐窝深度的比值(绒毛高度/隐窝深度)。
同时,取适量盲肠内容物放入预先称重的2 mL无菌离心管中,用液氮保存后转入-80℃冰箱,通过16S rRNA技术分析肠道微生物(Zou等,2019)。
统计分析
所有样本均制备平行样本,结果以“平均值±标准误”表示。为使数据标准化,细菌浓度以可培养细菌浓度的对数值表示。使用GraphPad Prism 9软件(美国GraphPad Software公司)进行统计分析,采用F检验判断差异显著性。不同小写字母(a、b)表示组间差异具有统计学意义(P<0.05)。
结果与讨论
富氢次氯酸水(HRHAW)的储存及其活性成分的衰减
世界卫生组织(WHO)建议饮用水中余氯含量应保持在0.2~5.0 mg/L(Onyutha和Kwio-Tamale,2022)。已有研究表明,有效氯浓度(ACC)为0.3 mg/L的次氯酸水(HAW)可降低饮水中细菌数量,使其达到安全标准(Fan等,2021;Li等,2024;Obaid等,2025)。对于富氢水(HRW),溶解氢浓度达到四分之三饱和状态(0.6 mmol/L或1.2 ppm)即可产生生物效应。因此,本研究中将次氯酸水的有效氯浓度设定为0.3 mg/L,富氢水中的溶解氢含量维持在1200 ppb,以确保微生物安全性并提升动物生产性能。
在对富氢次氯酸水溶液进行测试前,需确认两种功能性添加剂的活性成分之间无相互干扰。如图1所示,在25℃、避光密封环境下进行的衰减试验结果显示:次氯酸水和富氢次氯酸水中的有效氯浓度衰减动力学一致,均在10小时内从0.3 mg/L降至检测不到的水平;同样,富氢水和富氢次氯酸水中的溶解氢浓度也遵循相同的时间轨迹,从1200 ppb降至基线水平。值得注意的是,另有研究报告显示,富氢水中的氢气在7小时内会完全耗尽(从1330 ppb降至检测不到)(Fan等,2021),这种加速衰减可能与环境变量和制备方法有关:氢气泡直径越小,分子氢在水溶液中的保留时间越长,而温度升高则会降低氢气的溶解度(Fan等,2021)。
对于次氯酸水,一项在30℃下进行的120小时研究显示,氯浓度从0.38 mg/L降至0.09 mg/L,衰减速度远慢于本研究观察到的结果。这种差异主要源于氯在输水管道中的消散,其衰减动力学受初始氯浓度、温度、暴露时间和管道材料影响(Obaid等,2025)。然而,上述平行衰减模式证实,混合溶液中的氯成分和氢成分在化学性质上相互独立,因此可联合用于后续试验。
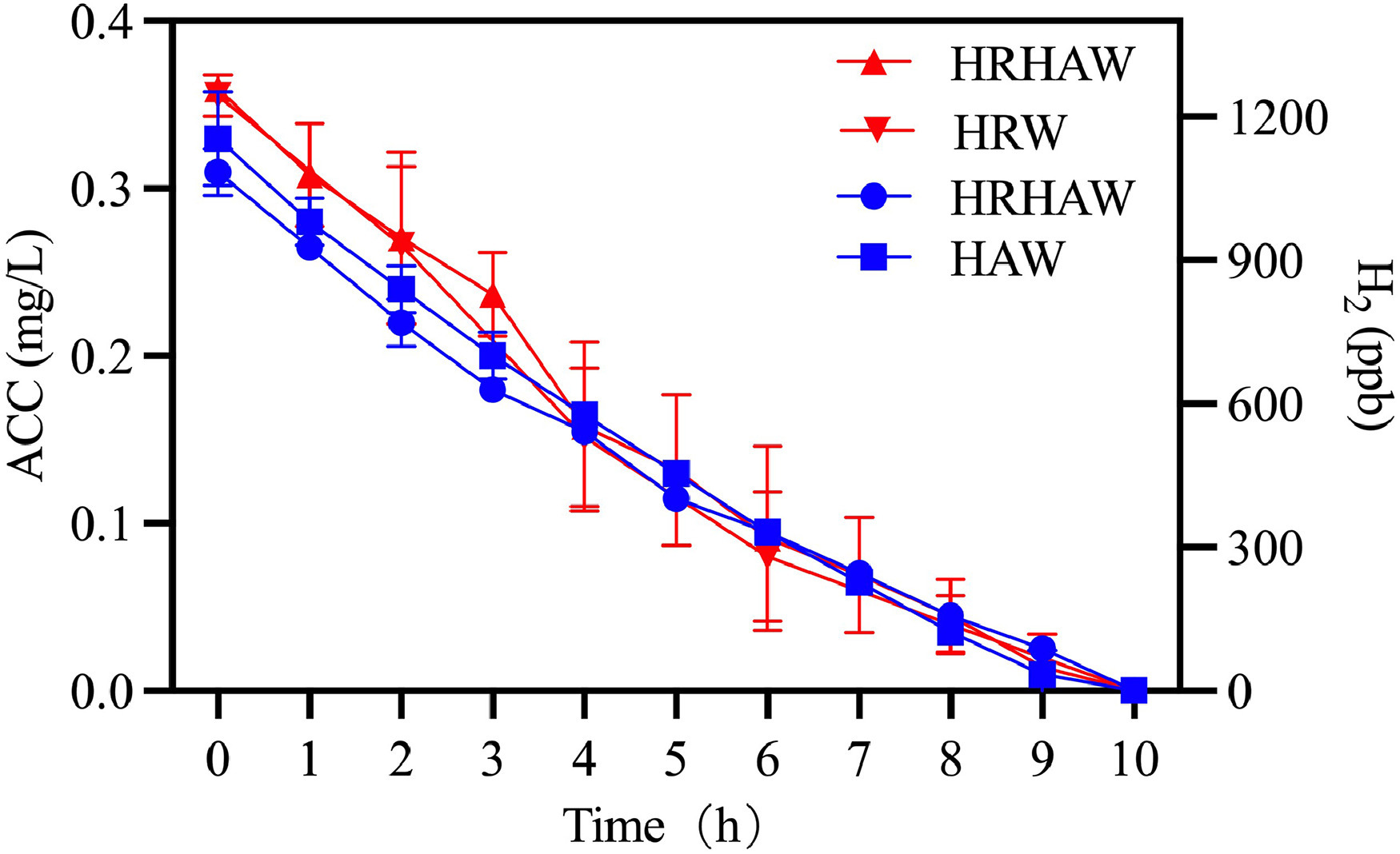
图1 富氢次氯酸水(HRHAW)及纯溶液(富氢水HRW、次氯酸水HAW)中活性成分随时间的变化规律**
为确保富氢次氯酸水在实际家禽饮水系统中的有效应用,本研究在不同储存条件(密封vs敞口、避光vs光照)、容器材料(塑料、玻璃、铝)和温度(5℃~45℃)下,评估了其活性成分(有效氯浓度ACC和溶解氢)的衰减动力学,结果如图2所示:
- 在密封避光条件下,有效氯浓度在9~10小时内从0.3 mg/L降至0 mg/L,溶解氢在相同时间内从1200 ppb降至0 ppb;
- 在敞口光照环境下,有效氯在3~4小时内衰减至0 mg/L,溶解氢在6~7小时内降至0 ppb;
- 储存在塑料、玻璃或铝制容器中时,有效氯和溶解氢均在9~10小时内衰减至0;
- 在45℃条件下,有效氯和溶解氢分别在3~4小时和9~10小时后降至0;在5℃条件下,有效氯在9~10小时内衰减至0,溶解氢在11~12小时后降至0。
这些结果表明,富氢次氯酸水在密封、避光、低温(5℃)条件下储存稳定性最佳,这与此前关于氯稳定性的研究结果一致(He等,2013)。无论使用何种容器材料,氢浓度均随时间稳步下降,这与早期研究结果相符;但本研究显示,氢浓度衰减与储存温度几乎无关(Zuo等,2025)。综上,为最大限度发挥富氢次氯酸水的功效,家禽养殖场应优先选择密封、避光、低温的条件储存该溶液。
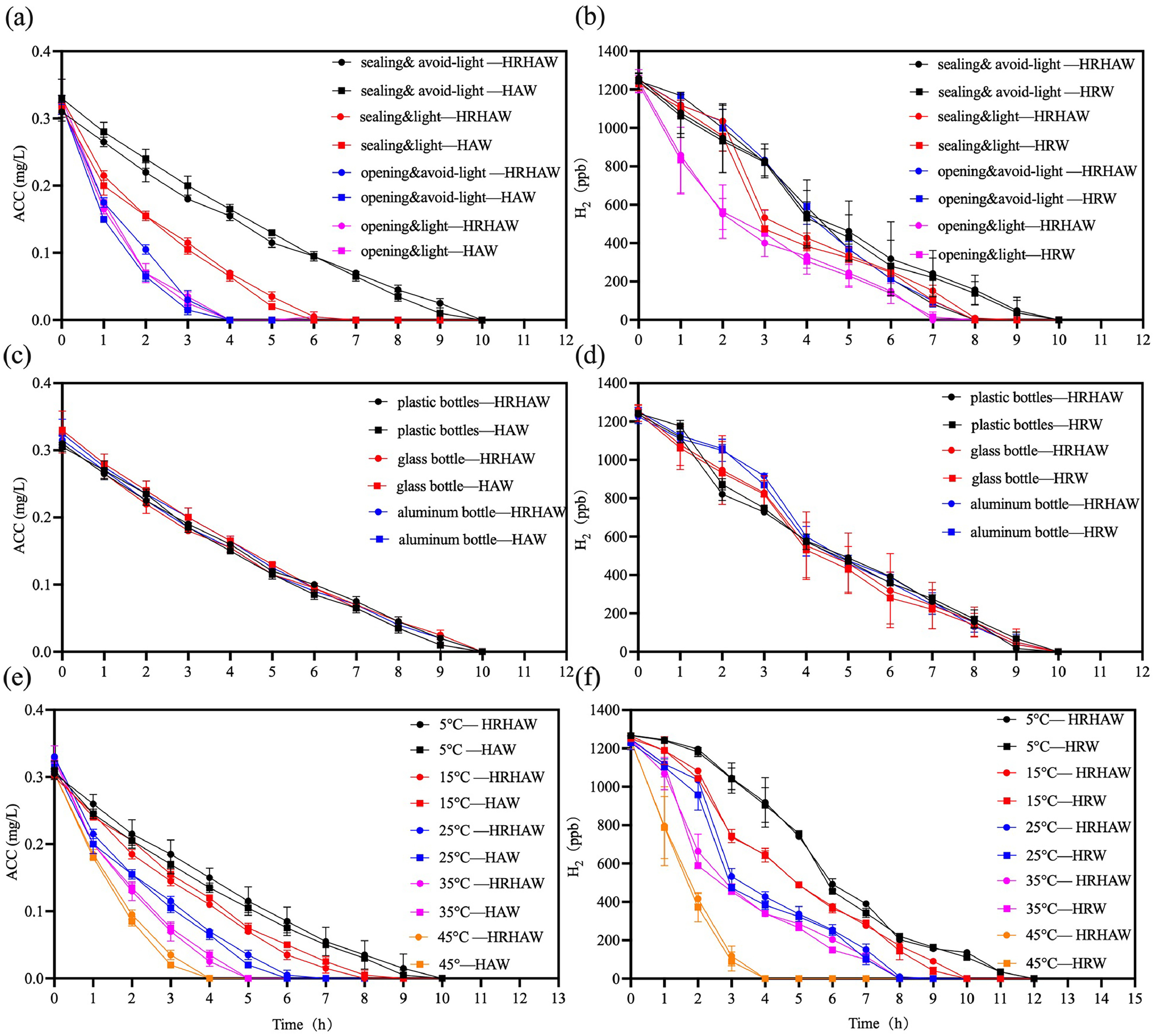
图2 富氢次氯酸水(HRHAW)不同储存条件对有效氯浓度(ACC)和氢浓度的影响:(a、b)储存状态,(c、d)容器材料,(e、f)储存温度
联合应用效果:富氢次氯酸水(HRHAW)的杀菌性能
富氢次氯酸水对浮游细菌的影响
图3显示了自来水、次氯酸水(HAW)、富氢水(HRW)和富氢次氯酸水(HRHAW)对鸡舍饮水中可培养浮游细菌总数的影响。值得注意的是,单独使用富氢水对可培养细菌总数无显著抑制作用,而次氯酸水和富氢次氯酸水均表现出强效杀菌活性:经次氯酸水和富氢次氯酸水处理后,细菌浓度分别从3.5 log CFU/mL降至1.7 log CFU/mL和1.8 log CFU/mL,杀菌率均>99.90%。
这些结果证实,次氯酸水的抗菌作用主要由其活性成分次氯酸(HClO)驱动。次氯酸可破坏细菌细胞膜,导致维持膜稳定性的关键离子(如K⁺、Ca²⁺、Mg²⁺)泄漏;离子流失会增加K⁺通透性,使跨膜通道蛋白变性,降低脱氢酶活性,并破坏细胞内酶系统,最终导致细菌细胞破裂死亡。这一结果与此前的研究结论一致(Rahman等,2016;Zhang等,2022;Zhao等,2021)。综上,富氢次氯酸水对饮水中的浮游细菌具有显著的杀菌效果。

图3 不同水处理方式对鸡舍饮水中可培养浮游细菌总数的影响
图3 自来水、次氯酸水(HAW)、富氢水(HRW)及富氢次氯酸水(HRHAW)对鸡舍饮水中可培养浮游细菌总数的影响
富氢次氯酸水对饮水管道生物膜的影响
从系统开始运行起,微生物会迅速在饮水管道内表面定殖并形成抗逆性强的生物膜(Hahne等,2022),其中与生物膜相关的细菌占饮水系统细菌总量的90%以上(Hall-Stoodley等,2004)。如图4所示,自来水组、次氯酸水组、富氢水组及富氢次氯酸水组测得的生物膜生物量分别为4.15±0.16、3.70±0.13、4.04±0.13和3.72 log CFU/cm。与自来水组相比,富氢水组的生物膜生物量无显著降低,这可能是因为富氢水缺乏直接抗菌活性,无法降解胞外聚合物(EPS),仅能通过抗氧化作用发挥功效。相反,次氯酸水组和富氢次氯酸水组的生物膜生物量较自来水组显著降低,这一效果可归因于次氯酸水中的有效氯——有效氯能有效杀灭游离细菌,并部分破坏胞外聚合物基质(ElKatcha等,2018;Liu等,2022)。尽管富氢次氯酸水联合处理的效果略逊于单独使用次氯酸水,但仍优于富氢水,这证实了在混合体系中次氯酸水是主要的抗菌成分。进一步分析表明,富氢水对生物膜控制的作用微乎其微,原因在于其本身不具备杀菌特性,且胞外聚合物屏障会对细菌起到保护作用。尽管富氢次氯酸水能借助氯的氧化能力降低生物膜生物量,但无法实现彻底清除,这体现了生物膜对消毒剂固有的耐受性。这种抗性可能源于生物膜的分层结构以及细菌群落内部协同的代谢适应性(Zhao等,2021;Zhu等,2021)。
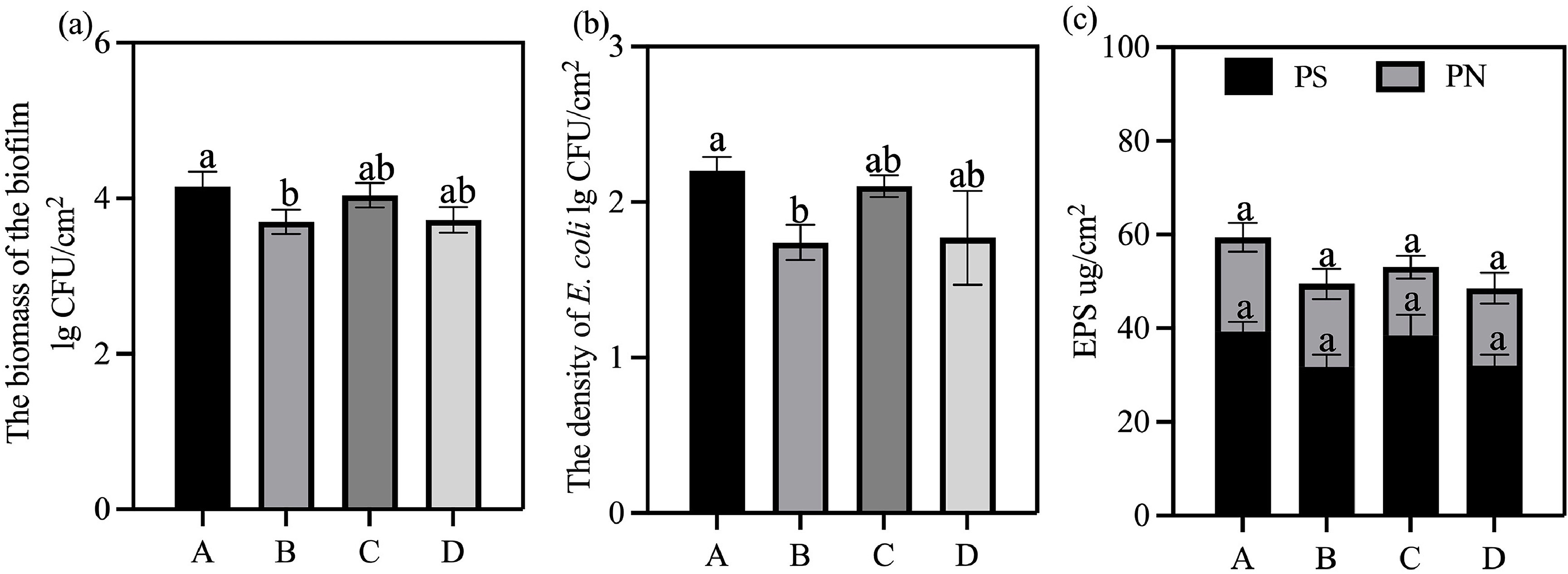
图4 次氯酸水(HAW)、富氢水(HRW)及富氢次氯酸水(HRHAW)对(a)生物膜生物量、(b)大肠杆菌密度及(c)胞外聚合物(EPS)含量的影响
富氢次氯酸水对肉鸡生产性能的影响
生产性能
研究通过42天试验评估了饮用自来水、次氯酸水、富氢水及富氢次氯酸水对肉鸡生产性能的影响。如图5所示,各组肉鸡的死亡率无显著差异;自来水组、次氯酸水组、富氢水组及富氢次氯酸水组的料肉比(F/G)分别为1.81、1.81、1.75和1.75,其中富氢次氯酸水对料肉比无统计学意义上的显著影响。这些结果与此前研究一致:富氢水可缓解热应激导致的体重下降和采食量减少,但在正常条件下对生长性能无显著影响;同样,次氯酸水对生产指标既无不利影响,也无有益作用(Fanxianzi等,2025;Lee等,2021)。

图5 次氯酸水(HAW)、富氢水(HRW)及富氢次氯酸水(HRHAW)对肉鸡生产性能的影响
肉品质
对饮用自来水、次氯酸水、富氢水及富氢次氯酸水的肉鸡,以pH值、滴水损失、蒸煮损失和剪切力为关键指标评估其肉品质。如图6所示,各组间的pH值、滴水损失和蒸煮损失均无显著差异;但A组(自来水组)、B组(次氯酸水组)、C组(富氢水组)和D组(富氢次氯酸水组)鸡胸肉的平均剪切力分别为39.41、33.66、28.36和23.98牛顿(N)。值得注意的是,C组和D组的剪切力显著低于自来水组,表明富氢水能显著改善鸡胸肉嫩度。这一结果与此前研究一致(Zhu等,2025):剪切力降低与富氢水的抗氧化特性相关,富氢水可能通过缓解肌纤维氧化应激或提高保水性来改善嫩度。尽管次氯酸水组的剪切力低于自来水组,但其效果弱于富氢水组和富氢次氯酸水组,且对鸡胸肉嫩度无统计学意义上的显著影响,这可能是因为次氯酸水的主要作用是抗菌,而非改善肉品质。
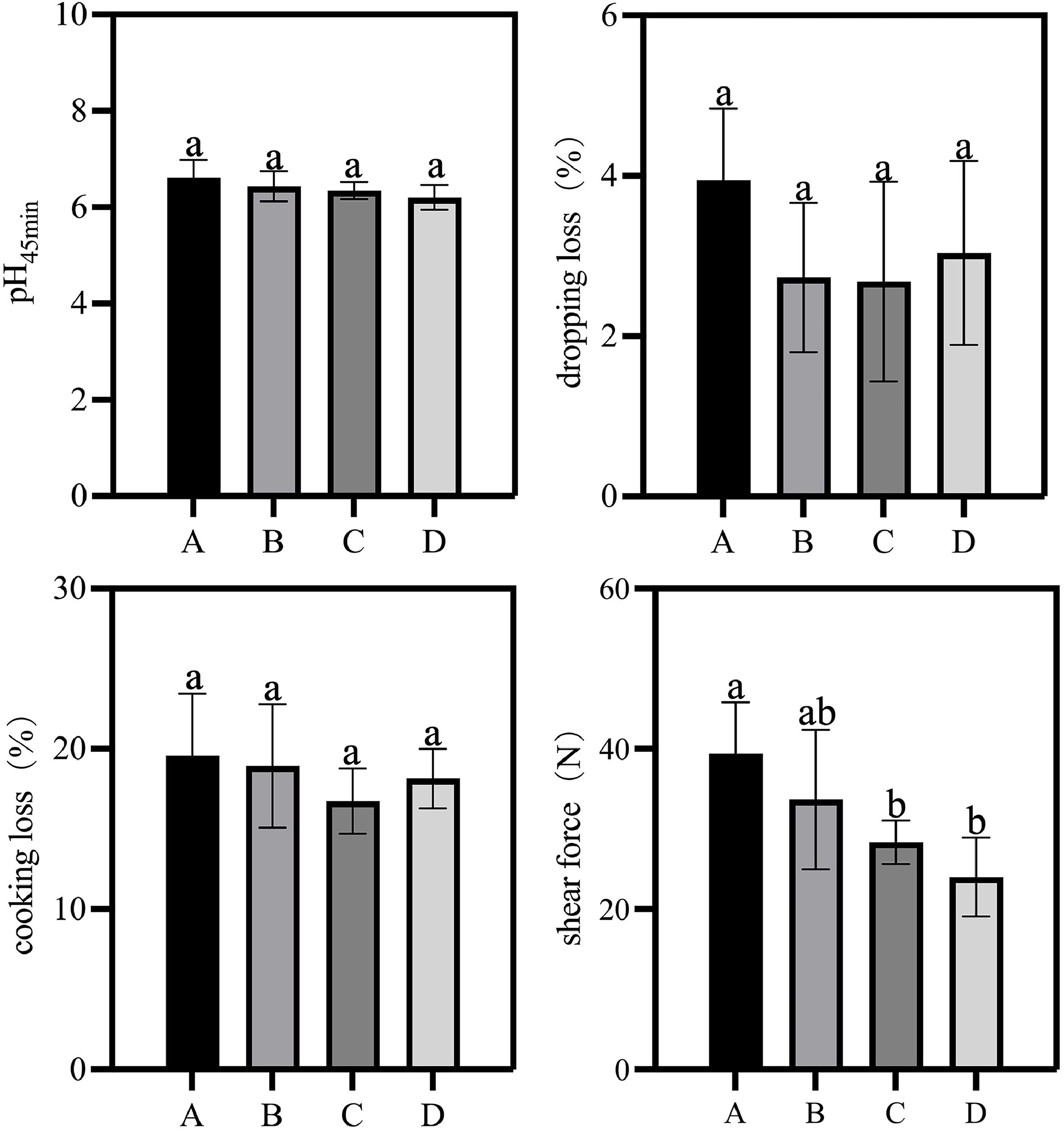
图6 次氯酸水(HAW)、富氢水(HRW)及富氢次氯酸水(HRHAW)对肉鸡肉品质的影响
抗氧化能力
研究评估了自来水、次氯酸水、富氢水及富氢次氯酸水对肉鸡肝脏和血液抗氧化指标的影响(图7)。
- 肝脏组织:自来水组、次氯酸水组、富氢水组、富氢次氯酸水组的超氧化物歧化酶(SOD)活性分别为12.62±0.43、13.48±0.90、14.56±10.53、16.10±1.96;谷胱甘肽过氧化物酶(GSH-PX)活性分别为23.07±2.34、25.80±1.52、27.03±1.93、28.87±1.22;总抗氧化能力(T-AOC)分别为1.28±0.15、1.26±0.13、1.26±0.05、1.25±0.17;丙二醛(MDA)含量分别为0.48±0.03、0.38±0.01、0.30±0.02、0.26±0.01 U/mg。与自来水组相比,次氯酸水组、富氢水组、富氢次氯酸水组的肝脏SOD活性分别提高6.81%、15.34%、27.54%,GSH-PX活性分别提高11.83%、17.17%、25.14%。
- 血液:上述四组的血液SOD活性分别为67.04±7.59、71.41±10.11、80.37±10.53、85.15±2.18;GSH-PX活性分别为134.72±18.09、146.22±20.99、155.98±38.95、203.38±60.21;T-AOC分别为10.97±0.59、9.89±0.62、10.98±0.91、10.86±0.72;MDA含量分别为3.98±0.82、3.03±0.37、2.68±0.18、2.18±0.27 nmol/mL。次氯酸水组、富氢水组、富氢次氯酸水组的血液SOD活性分别提高6.52%、19.89%、27.02%,GSH-PX活性分别提高8.54%、15.79%、50.97%。
总抗氧化能力(T-AOC)在各组间略有波动(变化率分别为-9.84%、+0.07%、-1.01%),但无显著组间差异,这可能是因为T-AOC作为综合指标,无法完全反映单一酶活性的变化。次氯酸水组、富氢水组、富氢次氯酸水组的血液MDA含量分别降低23.89%、32.61%、45.14%。富氢次氯酸水处理显著提高了SOD和GSH-PX的活性,同时显著降低了MDA含量,表明其抗氧化能力得到提升,这一效果主要归因于富氢水的抗氧化特性(Lee等,2021)。此外,富氢水与次氯酸水的联合处理进一步增强了这些抗氧化效果,表现为SOD和GSH-PX活性协同升高,同时MDA含量降低,这表明联合处理在缓解氧化应激、维持生理健康方面的能力更强。这些结果与此前研究一致,证实富氢水能改善家禽的抗氧化状态(Zhu等,2025)。SOD和GSH-PX是清除自由基的关键酶,其活性升高表明抗氧化防御系统得到强化(Borgstahl等,2018;Surai等,2019);而MDA含量降低则意味着脂质过氧化损伤减少(Bi等,2018)。值得注意的是,富氢次氯酸水组的GSH-PX活性提升尤为显著,这可能是因为次氯酸水的抗菌作用与富氢水的抗氧化作用产生了协同效应。综上,富氢水与次氯酸水的联合使用在增强抗氧化特性、促进机体健康方面具有显著潜力。
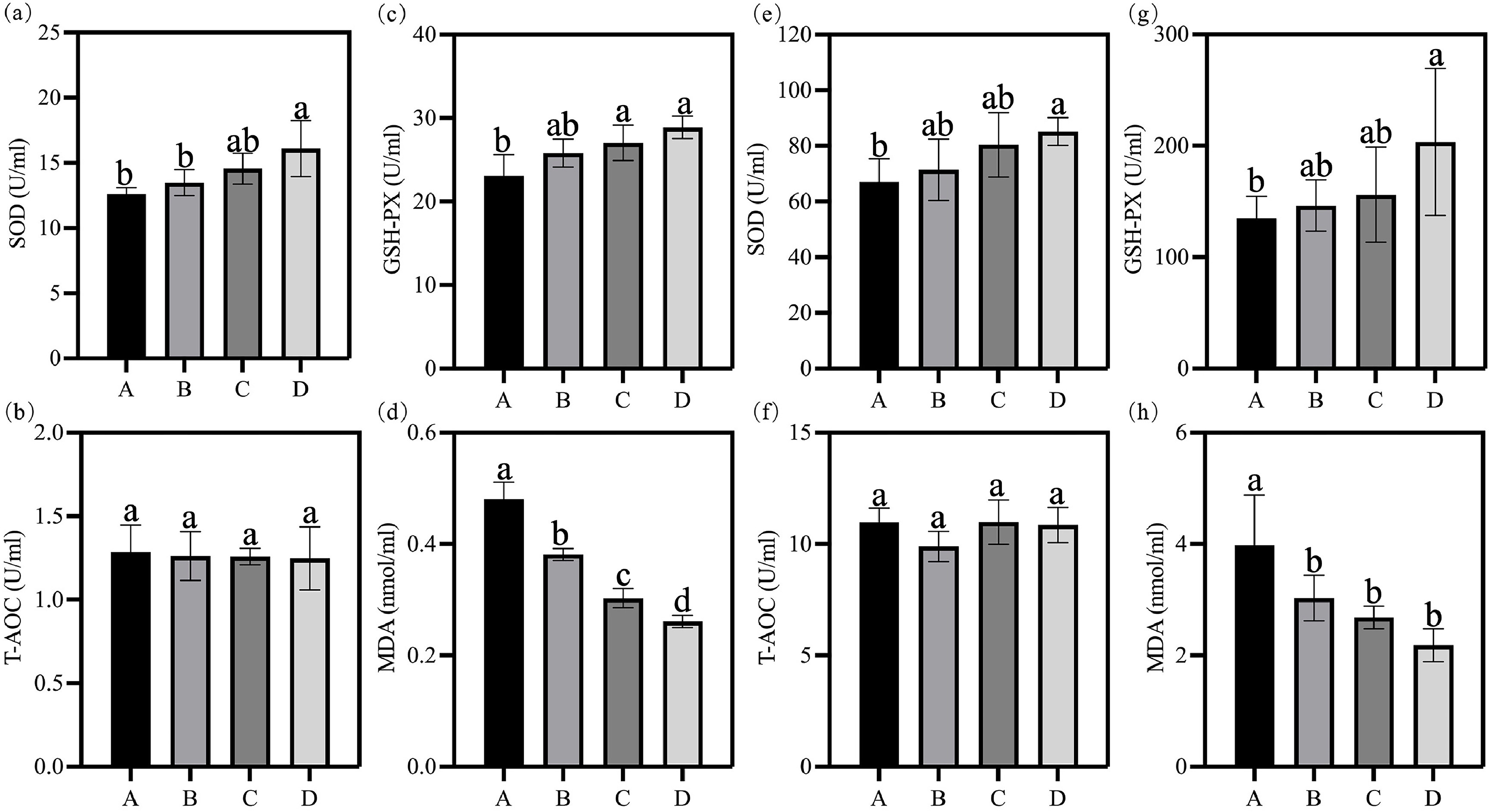
图7 次氯酸水(HAW)、富氢水(HRW)及富氢次氯酸水(HRHAW)对(a–d)肝脏和(e–h)血液抗氧化能力的影响
肠道形态
研究考察了饮用自来水、次氯酸水、富氢水及富氢次氯酸水对肉鸡肠道形态的影响(图8)。各组肉鸡的十二指肠、空肠和回肠黏膜表面均完整,可见黏膜皱襞,上皮和腺体结构正常,杯状细胞分布典型;隐窝、绒毛和黏膜层的形态均符合生理正常状态,无增生、水肿或出血迹象。值得注意的是,自来水组肉鸡的十二指肠和盲肠上皮及腺体存在少量点状损伤;相比之下,饮用富氢次氯酸水的肉鸡整体肠道形态优于自来水组。这一结果与此前针对仔猪的研究发现相似(Ji等,2019),进一步证实了富氢次氯酸水在维持肠道完整性方面的保护作用。

图8 次氯酸水(HAW)、富氢水(HRW)及富氢次氯酸水(HRHAW)对肉鸡十二指肠、空肠、回肠形态的影响:(a–c)自来水组,(d–f)次氯酸水组,(h–j)富氢水组,(k–m)富氢次氯酸水组
图9显示了自来水、次氯酸水、富氢水及富氢次氯酸水对肉鸡肠道杯状细胞阳性面积占比的影响。自来水组、次氯酸水组、富氢水组、富氢次氯酸水组的杯状细胞阳性面积分别为7.06±1.28、8.87±1.72、11.29±0.42、11.72±1.54。与自来水组相比,富氢次氯酸水组的杯状细胞数量显著增加约66%,这可能得益于富氢水的抗氧化作用(Lee等,2021;Sheng等,2013;Wu等,2017)——富氢水与次氯酸水的抗菌作用产生了协同效应。此外,杯状细胞分泌的黏液是肠道屏障的重要组成部分,其分泌量增加可通过降低氧化应激和致病菌载量来增强肠道保护作用(Xie等,2022)。富氢水组与富氢次氯酸水组的杯状细胞阳性面积相近,这表明富氢成分是促进杯状细胞增多的主要因素,而次氯酸水进一步优化了这一效果。
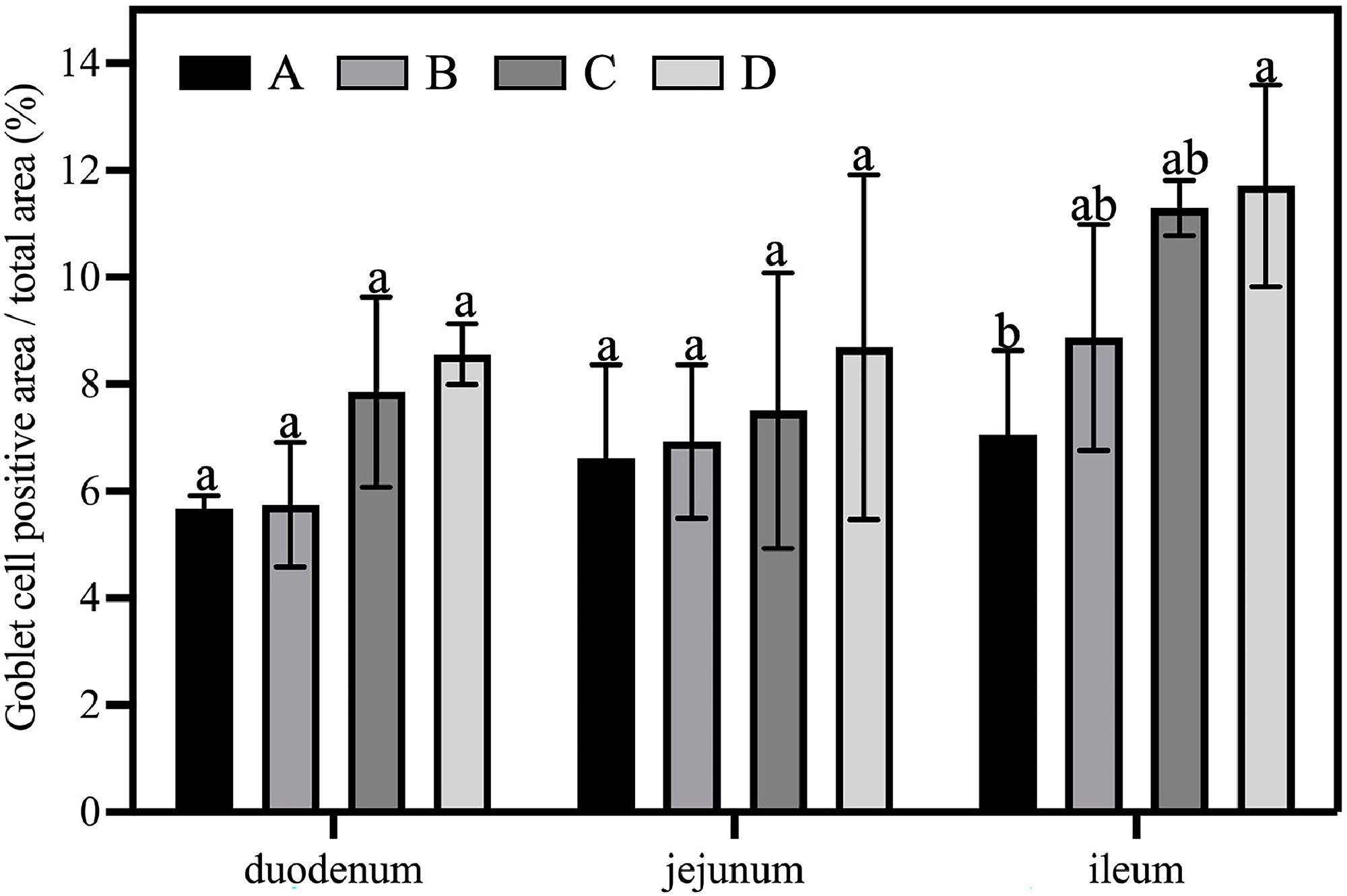
图9 次氯酸水(HAW)、富氢水(HRW)及富氢次氯酸水(HRHAW)对肉鸡肠道绒毛长度与隐窝深度比值及杯状细胞阳性面积的影响
富氢次氯酸水对肉鸡肠道微生物群的影响
研究分析了饮用自来水(A组)、次氯酸水(B组)、富氢水(C组)及富氢次氯酸水(D组)的肉鸡盲肠微生物在门水平和属水平的丰度(图10)。排除未分类细菌后:
- A组的优势菌门包括拟杆菌门(*Bacteroidota*)、厚壁菌门(*Firmicutes*)、脱硫菌门(*Desulfobacterota*)、互营菌门(*Synergistota*)、弯曲杆菌门(*Campylobacterota*)、变形菌门(*Proteobacteria*)、放线菌门(*Actinobacteriota*)和疣微菌门(*Verrucomicrobiota*);
- B组的优势菌门为拟杆菌门、厚壁菌门、脱硫菌门、互营菌门、弯曲杆菌门和变形菌门;
- C组的优势菌门为拟杆菌门、厚壁菌门、脱硫菌门、互营菌门、弯曲杆菌门、变形菌门、放线菌门和梭杆菌门(*Fusobacteriota*);
- D组的优势菌门为拟杆菌门、厚壁菌门、脱硫菌门、互营菌门、弯曲杆菌门和变形菌门。
四组肉鸡的肠道菌群中,拟杆菌门和厚壁菌门均占绝对优势,在A至D组中的占比分别为83.48%、80.00%、83.57%和86.21%。分析表明,各组间细菌在门水平的丰度无显著差异,这与此前研究结果一致(Dong等,2017;Lv等,2021)。对各组间共有优势属的进一步分析显示,属水平的相对丰度也无显著差异。这些结果表明,不同水处理方式对盲肠微生物群在门水平和属水平的结构影响有限。拟杆菌门和厚壁菌门的高丰度反映了盲肠发酵功能的稳定性,次氯酸水的抗菌作用和富氢水的抗氧化作用均未显著改变核心微生物的丰度;各组间优势属的高度重叠则表明肠道菌群的功能具有保守性。
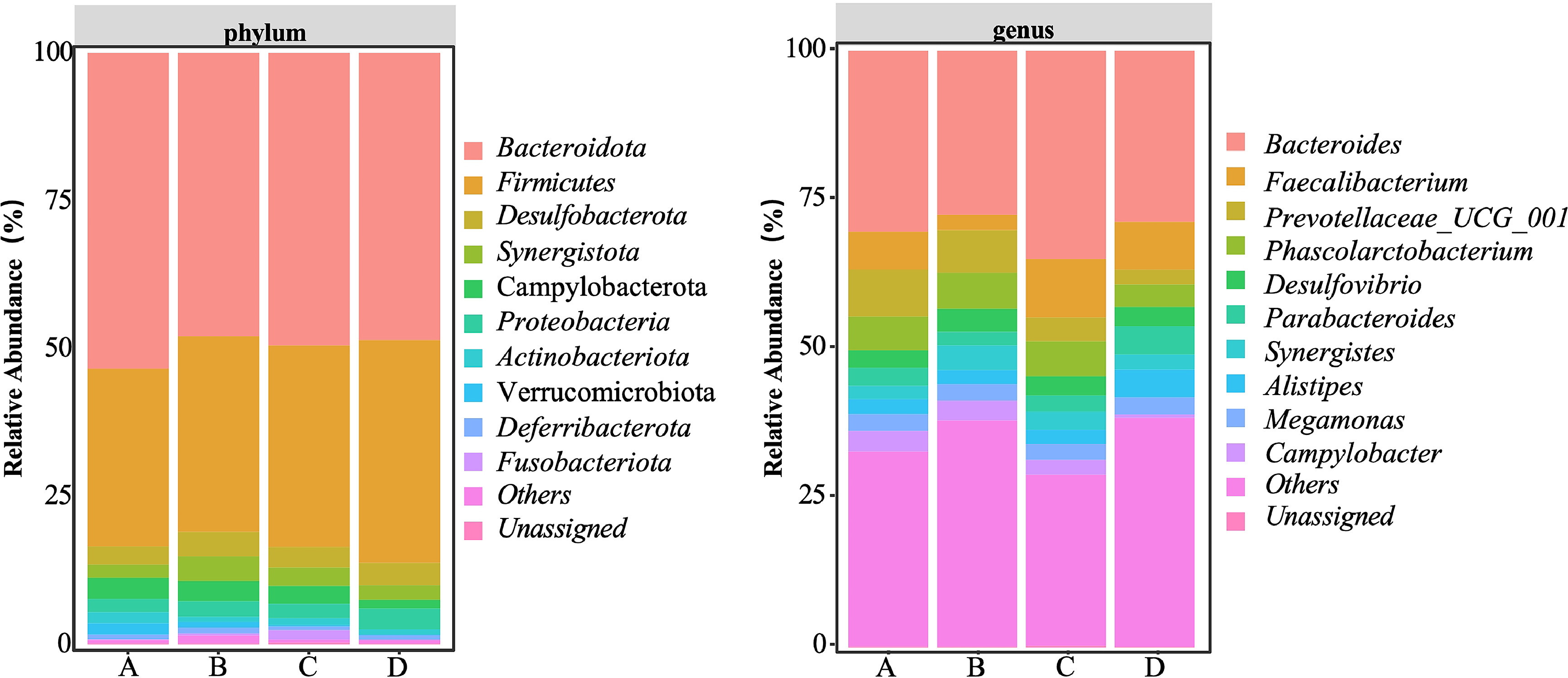
图10 次氯酸水(HAW)、富氢水(HRW)及富氢次氯酸水(HRHAW)对肉鸡盲肠微生物在门水平和属水平相对丰度的影响
如图11所示,对饮用自来水(A组)、次氯酸水(B组)、富氢水(C组)及富氢次氯酸水(D组)的肉鸡盲肠微生物群进行比较分析,发现其微生物生态结构存在显著差异:
- A组中,科里obacteriaceae科、弯曲杆菌属(*Campylobacter*)、弯曲杆菌科(*Campylobacteraceae*)、Nordella属和根瘤菌目未分类菌(*Rhizobiales Incertae Sedis*)显著富集;
- B组中,普雷沃菌属(*Prevotella*)、消化球菌科(*Peptococcaceae*)和草酸杆菌属(*Oxalobacter*)显著富集;
- C组中,肠杆菌属(*Enterobacter*)和Vicinamibacteria纲显著增多;
- D组中,螺杆菌属(*Helicobacter*)、螺杆菌科(*Helicobacteraceae*)、Faecalitalea属、丹毒丝菌目(*Erysipelotrichales*)、Lactonifactor属、Sellimonas属、鸡杆菌属(*Gallibacterium*)和巴斯德氏菌科(*Pasteurellaceae*)显著富集。
值得注意的是,A组中弯曲杆菌属的显著富集可能与机会性感染相关,这类感染可能引发肠道炎症。弯曲杆菌属是典型致病菌,也是与人类感染最相关的菌属。对于D组,富氢次氯酸水的两种成分(次氯酸水和富氢水)产生的协同效应可能促进了乳杆菌属(*Lactobacillus*)及产短链脂肪酸(SCFA)菌(如Faecalitalea属和Lactonifactor属)的富集。Faecalitalea属和Lactonifactor属可能通过影响短链脂肪酸的产生或增强肠道屏障功能发挥作用(Zhou等,2021),这与此前富氢次氯酸水改善肠道形态和肠道屏障完整性的研究结果一致。综上,不同水质处理通过其抗菌和抗氧化作用影响肠道屏障功能,从而显著改变盲肠菌群结构(Hao等,2023;Ji等,2019)。
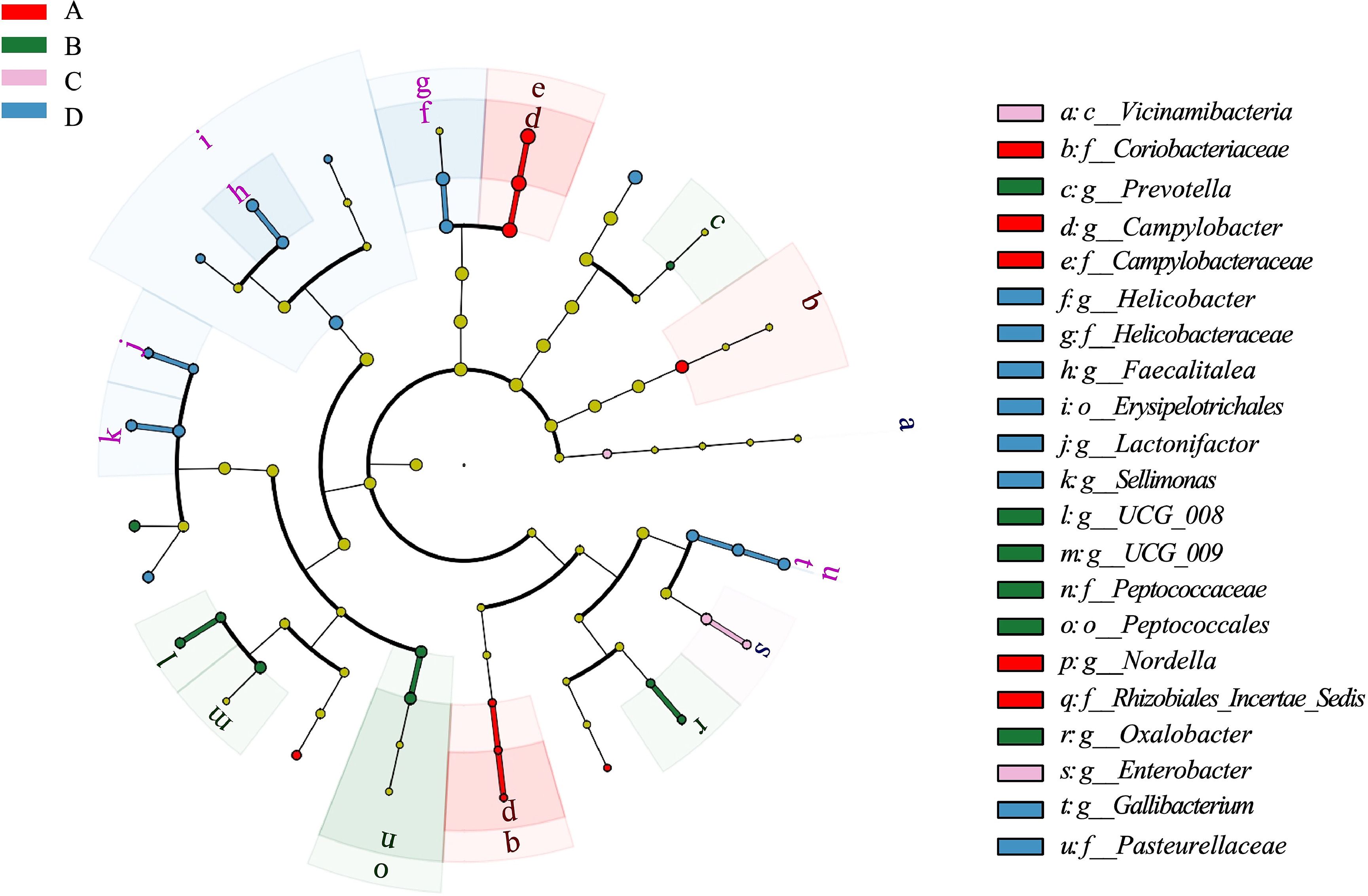
图11 次氯酸水(HAW)、富氢水(HRW)及富氢次氯酸水(HRHAW)处理对肉鸡盲肠微生物群的影响差异
结论
本研究表明,富氢次氯酸水(HRHAW)是一种安全有效的肉鸡饮水系统消毒剂,对饲料效率和死亡率无不良影响。具体而言,富氢次氯酸水可杀灭饮水中99.90%以上的病原体,减少管道生物膜生物量,并增强机体整体抗氧化能力;同时,其可能通过缓解肌纤维氧化应激改善肉嫩度。富氢水与次氯酸水的联合作用通过抗菌和抗氧化特性,改善了肉鸡肠道形态和屏障完整性,并重塑了盲肠微生物群。富氢次氯酸水的施用未引发任何毒理学或病理学变化,证实其在农业应用中的安全性。为实现最佳效果,建议富氢次氯酸水应避光储存,并在密封容器中于5℃条件下保存。这些研究结果证实了富氢次氯酸水在提升肉鸡健康水平和产品品质方面的应用价值。然而,未来仍需进一步研究微生物群调控对肠道稳态的潜在长期影响。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1508109.html?mobile=1
收藏

