氢水镇痛分子机制研究【同济+香港中文】
氢气镇痛最早第二军医大学第三附属医院麻醉科研究过,通过脊髓髓鞘内注射氢气生理盐水,发现能提高动物痛阈值6小时,言外之意就是氢水能镇痛6小时,后来天津医科大学于永浩教授团队进行过更多研究。最新研究作者来自同济大学和香港中文大学,立足于氢气本身具有麻醉作用,采用氢水给氢气的方法,发现其镇痛效应和胆汁酸 / 武田 G 蛋白偶联受体 5介导的细胞自噬有关,论文发表在国际著名期刊《pain》上。
氢气的健康医疗作用非常广泛,这一特点也备受质疑。但作为一种抗炎症抗氧化效应分子,具有广泛效应是一种必然的结果。氢气对疼痛的作用更强化了这一特点。因为疼痛是许多疾病的突出表现,如果疼痛能获得缓解,许多疾病可能给人一种药到病除的假象。所以氢气具有这样的效应,可解释氢气多效性的特点。
富氢水通过调控胆汁酸/武田G蛋白偶联受体5介导的自噬缓解神经病理性疼痛
神经病理性疼痛是一种慢性难治性疾病,其发病机制复杂。已有研究表明富氢水(HRW)可能具有镇痛作用,但其潜在机制仍不明确。为探究富氢水的作用,本研究在雄性和雌性小鼠中均采用了L4脊神经结扎(SNL)模型。通过机械缩足阈值、热缩足潜伏期和丙酮刺激反应测试,对小鼠的疼痛行为进行定量评估;采用16S rRNA测序分析粪便微生物群组成,通过液相色谱-质谱联用技术检测血清胆汁酸水平;借助生物化学实验检测脊髓、背根神经节和结肠中胆汁酸膜受体——武田G蛋白偶联受体5(TGR5)及自噬标志物的表达,并利用透射电子显微镜观察自噬结构。此外,本研究还通过雷帕霉素处理实验和TGR5基因敲除小鼠模型,验证了TGR5和自噬在神经病理性疼痛中的作用,同时检测了富氢水对肠屏障功能的影响。结果显示,富氢水可有效改善脊神经结扎诱导的神经病理性疼痛相关行为障碍;此外,在脊神经结扎小鼠中,富氢水还能促进受损肠屏障的修复、恢复紊乱的肠道微生物群,并调控胆汁酸代谢。猪去氧胆酸和去氧胆酸干预可产生与富氢水类似的镇痛效果;而武田G蛋白偶联受体5敲低则会逆转富氢水和雷帕霉素的治疗作用。从机制上看,富氢水通过调控与肠道微生物群相关的胆汁酸代谢产物,直接或间接激活脊髓、背根神经节和结肠中的TGR5,进而促进自噬,最终缓解神经病理性疼痛。
1. 引言
神经病理性疼痛是由神经系统原发性损伤或功能障碍引发的一种疼痛类型,其病理生理机制复杂,涉及多种分子机制,包括受损神经或邻近神经的异位放电、外周及中枢敏化、离子通道改变、免疫细胞激活以及表观遗传调控等[11,27]。流行病学研究表明,普通人群中神经病理性疼痛的患病率介于3.0%至17.0%之间[35]。目前,临床治疗主要依赖药物治疗、物理治疗、微创治疗及手术治疗等手段,但疗效仍欠佳,因此亟需发掘新的治疗靶点[11]。
氢医学已成为治疗多种疾病的潜在研究领域。研究表明,氢气可通过硫氧还蛋白1/凋亡信号调节激酶1/基质金属蛋白酶9信号通路缓解术后疼痛[20]。富氢水(HRW)是通过将氢气溶解于双蒸水(ddH₂O)中制备而成,与双蒸水的区别在于其含有额外的溶解氢分子。此外,已有研究提出富氢水可作为一种新型治疗手段,用于缓解小鼠慢性神经病理性疼痛相关的情感障碍[28]。
近年来,越来越多的研究强调肠道微生物群在主要系统性疾病发病机制中的重要作用[23,26]。宿主、肠道微生物群与其他组织之间的平衡互作,对于维持机体关键生理过程至关重要[2,30,33]。有证据表明,富氢水可通过调控肠道微生物群的多样性和结构,进而影响脂多糖(LPS)- Toll样受体4(TLR4)通路,从而缓解化疗诱导的神经病理性疼痛[24]。肠道微生物群在调节多种生理过程中发挥关键作用,其中尤以胆汁酸代谢调节最为重要。肝脏合成的初级胆汁酸进入肠道后,会在特定肠道微生物群(如拟杆菌、产气荚膜梭菌)的作用下,通过去结合反应和去羟基化反应转化为次级胆汁酸,这一过程会显著影响胆汁酸的生物活性[9]。反之,胆汁酸及其代谢产物可通过激活法尼醇X受体(FXR)、武田G蛋白偶联受体(TGR5)等受体通路,调控肠道微生态[9]。法尼醇X受体和武田G蛋白偶联受体是参与多种内分泌疾病、肝脏疾病和肠道疾病发生发展的两种主要胆汁酸受体。有研究显示,鞘内注射法尼醇X受体或武田G蛋白偶联受体激动剂,可有效缓解保留神经损伤(SNI)诱导的神经病理性疼痛[40],但仍需进一步研究其具体的下游机制。因此,此前尚未有研究探讨富氢水在调控神经病理性疼痛过程中对胆汁酸代谢的潜在影响。
鉴于此,本研究探究了富氢水对脊神经结扎(SNL)诱导的神经病理性疼痛的作用,并通过一系列分子生物学实验阐明其潜在机制。结果表明,富氢水可改善神经病理性疼痛,促进肠屏障修复,其机制可能是通过纠正肠道微生物群失衡,进而诱导胆汁酸代谢改变;其中,猪去氧胆酸(HDCA)、去氧胆酸(DCA)等特定次级胆汁酸可激活TGR5受体,而该受体的激活可促进脊髓背角和背根神经节中的自噬,从而产生镇痛效果。
2. 方法
2.1 实验动物
本实验遵循同济大学医学院动物实验中心制定的相关伦理原则(伦理审批号:TJBB07324111)。6-8周龄的雄性和雌性野生型C57BL/6J小鼠以及Gpbar1基因敲除(TGR5敲除,tgr5⁻/⁻)小鼠(货号:NM-KO-200576)均购自上海模式生物研究中心有限公司(中国上海)。小鼠饲养于无特定病原体(SPF)环境中,光照周期为12小时光照/12小时黑暗,环境温度维持在22-24℃,空气湿度为50%-60%,小鼠可自由摄食饮水。
2.2 手术与药物处理
脊神经结扎(SNL)手术参照既往研究方法进行:先对小鼠进行麻醉,随后通过背部切口暴露L4脊神经,对神经进行结扎后,缝合肌肉与皮肤。假手术(Sham)组小鼠接受相同的手术操作,但仅暴露脊神经而不进行结扎。
富氢水组的对照组采用蒸馏水干预:SNL+双蒸水(ddH₂O)组小鼠在脊神经结扎术后第1天开始,通过灌胃给予100μL双蒸水,持续至实验结束;SNL+富氢水组小鼠则在术后第1天开始,通过灌胃给予100μL富氢水(浓度分别为2ppm和3ppm),持续至实验结束。
猪去氧胆酸(HDCA)组、去氧胆酸(DCA)组和雷帕霉素组的对照组采用生理盐水干预:SNL+生理盐水组小鼠在术后第1天开始,通过灌胃给予100μL生理盐水,持续至实验结束;SNL+猪去氧胆酸组小鼠从术后第1天起,灌胃给予100μL猪去氧胆酸(剂量分别为10mg/kg/天和20mg/kg/天),持续至实验结束;SNL+去氧胆酸组小鼠从术后第1天起,灌胃给予100μL去氧胆酸(剂量分别为10mg/kg/天和20mg/kg/天),持续至实验结束;SNL+雷帕霉素组小鼠从术后第1天起,灌胃给予100μL雷帕霉素(剂量为5mg/kg/天),持续至实验结束。
富氢水制备方法:将双蒸水通入分子氢发生器中,启动产氢模式制备富氢水。每次制备完成后,使用分子氢检测仪对富氢水浓度进行3次检测,以确保浓度准确。猪去氧胆酸(货号:HY-N0169)、去氧胆酸(货号:HY-N0593)和雷帕霉素(货号:HY-10219)均购自MedChemExpress(MCE)公司,且均溶解于生理盐水中。
2.3 行为学测试
- 机械痛敏测试:采用冯·弗雷纤维丝(美国加利福尼亚州伍德兰希尔斯)评估小鼠机械痛敏程度。将小鼠单独置于测试框架内,适应30分钟后开始测试。使用不同粗细的纤维丝(初始为0.16g)刺激小鼠足底,当小鼠出现缩足、舔足或抬足动作时,记录为阳性反应。连续进行6次测试,并计算相应的机械缩足阈值(PWT)。
- 热痛敏测试:采用热板测痛仪测量小鼠热痛敏程度,刺激强度设定为30%,刺激时长设定为15秒。将热光束对准小鼠后爪底部进行热刺激,当小鼠出现缩足反应时,自动记录从开始加热到缩足的时间,即热缩足潜伏期(PWL)。每次测试间隔至少5分钟,连续测量3次,计算平均值。
- 冷痛敏测试:采用丙酮刺激法测试小鼠冷痛敏程度。测试前,将1滴丙酮滴于小鼠后爪底部,随后将小鼠放回饲养笼中,记录1分钟内小鼠抬足或舔足的次数。每次测试间隔至少5分钟,连续测量3次,计算平均值。
为确保测试结果的准确性和客观性,测试人员对实验分组情况采用盲法(即不知晓小鼠所属实验组别)。
2.4 16S rRNA测序
采用QIAamp DNA粪便微量提取试剂盒(QIAamp DNA Stool Mini Kit),严格按照制造商说明书从粪便样本中提取DNA。使用特异性引物(正向引物:5′-ACTCCTACGGGAGGCAGCAG-3′;反向引物:5′-GGACTACHVGGGTWTCTAAT-3′)对16S rRNA基因的V3-V4可变区进行扩增。扩增反应在热循环仪中进行,聚合酶链式反应(PCR)产物采用AMPure XP磁珠进行纯化。对纯化后的扩增子进行索引标记并混合,用于后续测序。测序在Illumina MiSeq平台上进行,采用双端测序模式。原始测序数据使用QIIME2软件进行质量过滤、修剪和去噪处理。按照97%的序列相似性对操作分类单元(OTU)进行聚类,并利用Greengenes数据库进行物种分类注释。数据分析包括多样性分析(含α多样性和β多样性指标)以及微生物群落的物种组成分析。
2.5 液相色谱-质谱联用分析
液相色谱-质谱联用(LC-MS)分析采用高效液相色谱系统与质谱仪联用的方式进行。样本制备过程如下:使用适宜溶剂提取样本中的代谢物,提取物经过滤后注入液相色谱系统,在C18色谱柱上进行分离;流动相由含0.1%甲酸的水和乙腈组成,采用梯度洗脱方式;流速维持在0.3 mL/min,柱温设定为30℃。质谱分析同时采用正离子和负离子电离模式,通过全扫描和数据依赖采集模式检测代谢物。采集到的数据使用专用软件进行峰识别和定量分析,从而实现对样本中代谢物的组成分析。
2.6 免疫组织化学染色
收集小鼠结肠组织,立即用福尔马林固定3天。固定后,组织经梯度酒精脱水、二甲苯透明处理,随后包埋于石蜡中。将石蜡块切成3 μm厚的切片,在65℃下烘烤1小时,接着经二甲苯脱蜡、梯度酒精复水。根据一抗的说明书要求,选择柠檬酸钠或EDTA溶液作为抗原修复液,在120℃高压条件下进行抗原修复。加入一抗(TGR5:1:500稀释,Abcam公司,英国剑桥,货号ab72608;NOD样受体蛋白3(NLRP3):1:500稀释,Immunoway公司,美国得克萨斯州普莱诺,货号YT5382;白细胞介素6(IL-6):1:500稀释,WL公司,中国,货号WL02841;IL-18:1:500稀释,WL公司,中国,货号WL01127;肿瘤坏死因子α(TNF-α):1:500稀释,WL公司,中国,货号WL01896),在4℃下孵育过夜,之后加入二抗孵育。最后,使用3,3'-二氨基联苯胺(DAB)对组织切片进行染色以显示阳性信号;随后用苏木素对细胞核进行染色,切片经系列酒精脱水、二甲苯透明处理后,用中性树胶封片,待干燥后观察。
2.7 阿尔辛蓝染色
阿尔辛蓝染色试剂盒(货号:G1560)购自Solarbio公司,严格按照试剂盒说明书进行染色操作。
2.8 阿尔辛蓝-过碘酸雪夫染色
阿尔辛蓝-过碘酸雪夫(AB-PAS)染色试剂盒(货号:BBL-0214)购自Biossci公司,严格按照试剂盒说明书进行染色操作。
2.9 蛋白质印迹分析(Western blotting)
组织样本储存于-80℃环境中。使用含蛋白酶抑制剂和磷酸酶抑制剂的裂解液从组织中提取蛋白质。蛋白质样本经7.5%~12.5%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离后,转移至聚偏氟乙烯(PVDF)膜(Millipore公司,美国马萨诸塞州贝德福德)上。将膜在含5%脱脂牛奶的封闭液中于室温下封闭1小时,随后加入一抗(闭合小环蛋白1(ZO1):1:1000稀释,Affinity公司,中国江苏,货号AF5145;黏蛋白2(Mucin-2):1:1000稀释,Abcam公司,货号ab272692;闭合蛋白(occludin):1:1000稀释,Proteintech公司,中国湖北武汉,货号27260-1-AP;紧密连接蛋白1(claudin-1):1:1000稀释,WL公司,中国,货号WL03073;NLRP3:1:1000稀释,Immunoway公司,货号YT5382;IL-6:1:1000稀释,WL公司,中国,货号WL02841;TNF-α:1:1000稀释,WL公司,中国,货号WL01581;TGR5:1:1000稀释,Abcam公司,货号ab72608;微管相关蛋白轻链3B(LC3B):1:1000稀释,Abcam公司,货号ab192890;P62蛋白:1:1000稀释,Abcam公司,货号ab109012;自噬相关蛋白Beclin1:1:1000稀释,Abcam公司,货号ab62557;甘油醛-3-磷酸脱氢酶(GAPDH):1:5000稀释,Proteintech公司,货号60004-1-Ig),在4℃下孵育过夜。加入二抗孵育1小时后,使用增强化学发光(ECL)蛋白质印迹检测系统检测信号,并用化学发光成像系统(Bio-Rad公司,美国加利福尼亚州赫拉克勒斯)采集图像。
2.10 免疫荧光染色
分别采用6 μm厚的结肠切片和25 μm厚的脊髓切片进行特异性抗体染色。切片首先用驴血清或山羊血清封闭30分钟,随后加入一抗(神经元特异性核蛋白(NeuN):1:500稀释,Abcam公司,货号ab104224;离子钙结合适配分子1(IBA1):1:500稀释,Abcam公司,货号ab5076;胶质纤维酸性蛋白(GFAP):1:500稀释,Millipore公司,美国马萨诸塞州伯灵顿,货号MAB360;β-微管蛋白Ⅲ(TUJ1):1:500稀释,Sigma-Aldrich公司,美国密苏里州圣路易斯,货号ab9354;分化簇86(CD86):1:200稀释,CST公司,美国马萨诸塞州丹弗斯,货号#91882;TGR5:1:200稀释,Abcam公司,货号ab72608;LC3B:1:200稀释,Abcam公司,货号ab192890;P62:1:200稀释,Abcam公司,货号ab109012;Beclin1:1:200稀释,Abcam公司,货号ab62557),在4℃下孵育过夜。之后,切片在室温下与二抗孵育1小时,再用含4',6-二脒基-2-苯基吲哚(DAPI)的封闭剂进行封闭。最后,使用荧光显微镜或共聚焦显微镜采集荧光图像。
2.11 实时定量聚合酶链式反应分析
采用Trizol试剂提取总RNA,随后用寡聚胸苷酸(oligo (dT))引物进行逆转录,合成互补DNA(cDNA)。实时定量聚合酶链式反应(qRT-PCR)分析在实时荧光检测系统上进行,使用SYBR Green I荧光染料(Takara公司)。各基因的特异性引物序列如下:自噬相关蛋白12(atg12):正向引物GGCCTCGGAACAGTTGTTTA,反向引物CAGCACCGAAATGTCTCTGA;atg7:正向引物TCTGGGAAGCCATAAAGTCAGG,反向引物GCGAAGGTCAGGAGCAGAA;atg5:正向引物TGTGCTTCGAGATGTGTGGTT,反向引物ACCAACGTCAAATAGCTGACTC;微管相关蛋白轻链3(lc3):正向引物CGCTTGCAGCTCAATGCTAAC,反向引物CTCGTACACTTCGGAGATGGG;Beclin1:正向引物ATGGAGGCGTCTAAGGCGTC,反向引物TGGGCTGTGGTAAGTAATGGA;P62:正向引物GATGAAGGCGGCTGGCTCAC,反向引物CACAATGGTGGAGGGTGCTTCG。
2.12 透射电子显微镜观察
透射电子显微镜(TEM)分析步骤如下:首先将组织样本置于含2.5%戊二醛的磷酸盐缓冲液(PBS)中,在4℃下固定4小时;固定后,用PBS清洗样本,随后在室温下用1%四氧化锇进行后固定1小时;样本经梯度乙醇脱水、环氧树脂渗透处理后,在60℃下聚合48小时;使用超薄切片机将聚合后的样本切成70 nm厚的超薄切片,置于铜网上;用醋酸铀和柠檬酸铅对切片进行染色以增强对比度;在日本电子株式会社(JEOL)的JEOL 1400 Plus透射电子显微镜下,以80 kV加速电压获取图像,并在不同放大倍数下分析样本的结构特征并拍照。
2.13 统计学分析
所有统计学分析均采用GraphPad Prism 10软件进行。连续变量以“均值±均值标准误(SEM)”表示。行为学实验数据采用双向重复测量方差分析(2-way repeated-measures ANOVA),随后进行Bonferroni事后检验,比较各组间差异;免疫组织化学染色、免疫荧光染色、实时定量聚合酶链式反应、胆汁酸定量及菌落丰度分析采用单向方差分析(1-way ANOVA)结合Tukey事后检验,或非配对Student t检验;主坐标分析(PCoA)采用ANOSIM检验;α多样性分析采用经假发现率(FDR)校正的Kruskal-Wallis检验和经FDR校正的Wilcoxon检验。P<0.05被认为差异具有统计学意义。
3 结果
3.1 富氢水改善神经病理性疼痛相关行为学指标
为探究富氢水(HRW)治疗神经病理性疼痛的机制,本研究在雄性小鼠脊神经结扎(SNL)诱导的神经病理性疼痛模型中,评估了不同浓度富氢水灌胃的镇痛效果(图1A)。结果显示,对SNL模型小鼠灌胃富氢水后,其机械缩足阈值(PWT)和热缩足潜伏期(PWL)呈剂量依赖性升高,同时丙酮刺激反应降低(图1B~D)。值得注意的是,3 ppm浓度的富氢水对小鼠行为学指标的改善效果最为显著,因此后续所有实验均采用该浓度。此外,在雌性小鼠中也观察到类似结果,进一步验证了上述发现(补充图S1A~C)。
此外,富氢水可减轻SNL模型小鼠脊髓背角的小胶质细胞活化,并抑制该区域CD86阳性细胞的分化(图1E~H);在背根神经节中,富氢水干预也可缓解SNL诱导的小胶质细胞活化(图1I、J)。同时,富氢水还能降低SNL模型小鼠脊髓中升高的炎症介质(NLRP3、IL-6、TNF-α)的表达水平(图1K、L)。上述结果表明,灌胃富氢水可通过调控小胶质细胞活化及发挥抗炎作用,改善神经病理性疼痛相关行为。

图1 富氢水缓解神经病理性疼痛
(A)富氢水给药方案;(B)采用冯·弗雷纤维丝测试评估机械缩足阈值(PWT)变化,每组n=6;(C)采用热板镇痛测试评估热缩足潜伏期(PWL)变化,每组n=6;(D)采用丙酮刺激测试评估小鼠对冷刺激的反应变化,每组n=6;(E)脊髓背角离子钙结合适配分子1(IBA1)阳性细胞的免疫荧光染色(比例尺:100 μm);(F)脊髓背角IBA1阳性细胞数量统计,每组n=6;(G)脊髓背角CD86阳性细胞数量统计,每组n=6;(H)脊髓背角CD86阳性细胞的免疫荧光染色(比例尺:25 μm);(I)背根神经节IBA1阳性细胞的免疫荧光染色(比例尺:100 μm);(J)背根神经节IBA1阳性细胞数量定量分析,每组n=6;(K)脊髓中NLRP3、IL-6、TNF-α蛋白的蛋白质印迹代表条带;(L)脊髓中NLRP3、IL-6、TNF-α蛋白的相对定量分析,每组n=6。
注:行为学数据采用双向重复测量方差分析结合Bonferroni事后检验,*P<0.05,**P<0.01,***P<0.001,****P<0.0001,#P<0.05,##P<0.01,###P<0.001;(F)(G)(J)(L)采用单向方差分析结合Tukey事后检验,*P<0.05,**P<0.01,***P<0.001;数据以“均值±均值标准误(SEM)”表示。
3.2 富氢水改善神经病理性损伤相关的肠屏障功能受损
既往研究表明,慢性疼痛常与胃肠功能障碍相关[10,15]。为探究富氢水干预是否可改善神经病理性疼痛中的肠屏障功能受损,本研究进行了结肠阿尔辛蓝染色、阿尔辛蓝-过碘酸雪夫染色及透射电子显微镜观察。结果显示,富氢水可显著增加SNL模型小鼠结肠中减少的杯状细胞数量、促进黏液分泌、改善微绒毛生长,并修复上皮细胞间的紧密连接(图2A~D)。
免疫荧光染色结果进一步显示,富氢水可上调结肠紧密连接蛋白(ZO1、claudin1)及黏蛋白2(MUC2)的表达(图2E~J);蛋白质印迹结果证实,富氢水可增加SNL模型小鼠结肠屏障蛋白(ZO1、MUC2、occludin)的蛋白表达水平(图2K、L)。免疫组织化学染色结果表明,富氢水可减轻SNL诱导的结肠炎症,降低TNF-α、NLRP3、IL-18、IL-6等炎症因子的释放(图2M、N)。综上,这些结果提示富氢水可有效改善神经病理性损伤导致的肠屏障功能受损。

图2 富氢水减轻神经病理性损伤诱导的肠屏障损伤
(A)结肠阿尔辛蓝染色、阿尔辛蓝-过碘酸雪夫(AB-PAS)染色(比例尺:100 μm)及透射电子显微镜观察(比例尺:1 μm)的代表性图像;(B)阿尔辛蓝阳性区域百分比定量分析,每组n=6;(C)结肠黏液层厚度定量分析,每组n=6;(D)结肠微绒毛长度测量,每组n=4;(E)结肠闭合小环蛋白1(ZO1)、(F)黏蛋白2(MUC2)、(G)紧密连接蛋白1(claudin1)免疫荧光染色的代表性图像(比例尺:100 μm),及(H-J)相应平均荧光强度的定量分析,每组n=6;(K)结肠ZO1、MUC2、闭合蛋白(occludin)蛋白质印迹的代表性条带,及(L)相对定量分析,每组n=6;(M)结肠肿瘤坏死因子α(TNF-α)、NOD样受体蛋白3(NLRP3)、白细胞介素18(IL-18)、白细胞介素6(IL-6)免疫组织化学染色的代表性图像(比例尺:100 μm),及(N)相应相对定量分析,每组n=6。
注:采用单向方差分析结合Tukey事后检验,*P<0.05,**P<0.01,***P<0.001,****P<0.0001;数据以“均值±均值标准误(SEM)”表示。
(ABPAS:阿尔辛蓝-过碘酸雪夫染色;HRW:富氢水;IL:白细胞介素;MUC2:黏蛋白2;NLRP3:NOD样受体蛋白3;TNF-α:肿瘤坏死因子α;ZO1:闭合小环蛋白1)
3.3 富氢水调控神经病理性损伤中的肠道微生物群功能紊乱
本研究进一步通过16S rRNA基因测序发现,脊神经结扎(SNL)可诱导肠道微生物多样性及群落结构发生改变。韦恩图显示了假手术(Sham)组、SNL+双蒸水(ddH₂O)组、SNL+富氢水(HRW)组这3个样本组中独特及共有微生物特征的数量(图3A)。
在粪便α多样性方面,Chao1指数显示假手术组与SNL+双蒸水组、SNL+富氢水组均存在显著差异(图3B);但采用Shannon指数和Simpson指数评估时,3组间未观察到统计学差异(图3C、D)。主坐标分析(PCoA)显示3组的微生物群落结构存在显著差异,其中SNL组与假手术组的群落结构差异明显(图3E),而富氢水组的群落结构与假手术组部分重叠(图3E)。
线性判别分析效应大小(LEfSe)分析的线性判别分析(LDA)得分直方图显示,假手术组中乳杆菌属(Lactobacillus)显著富集,提示其可能是对照组中的核心共生菌;SNL组中邓坎氏菌属(Duncaniella)、穆里巴杆菌属(Muribaculum)、放线菌门(Actinobacteriota)等类群显著富集,这些类群可能与炎症或肠屏障损伤相关;与之相反,富氢水组中厚壁菌门A(Firmicutes_A)、梭菌纲(Clostridia)、毛螺菌科(Lachnospiraceae)、毛螺菌目(Lachnospirales)等类群富集,这些类群可能与维持肠屏障完整性及免疫系统健康相关(图3F)。
此外,在科水平上,神经损伤后穆里巴杆菌科(Muribaculaceae,有益菌)丰度降低,而螺杆菌科(Helicobacteraceae,潜在致病菌)丰度升高,提示肠道菌群失调;富氢干预可使乳杆菌科(Lactobacillaceae,益生菌)丰度显著升高,螺杆菌科丰度降低,表明氢气可能通过调控特定微生物种群减轻神经损伤相关炎症(图3G)。在属水平上,假手术组和富氢水组中乳杆菌属丰度较高,而SNL组中该菌属丰度较低(图3H);热图进一步证实,乳杆菌属在假手术组和富氢水组中丰度更高,在SNL组中则显著降低(图3I)。
综上,富氢水可有效缓解SNL诱导的肠道菌群失调,这可能是其发挥镇痛作用的关键机制之一。
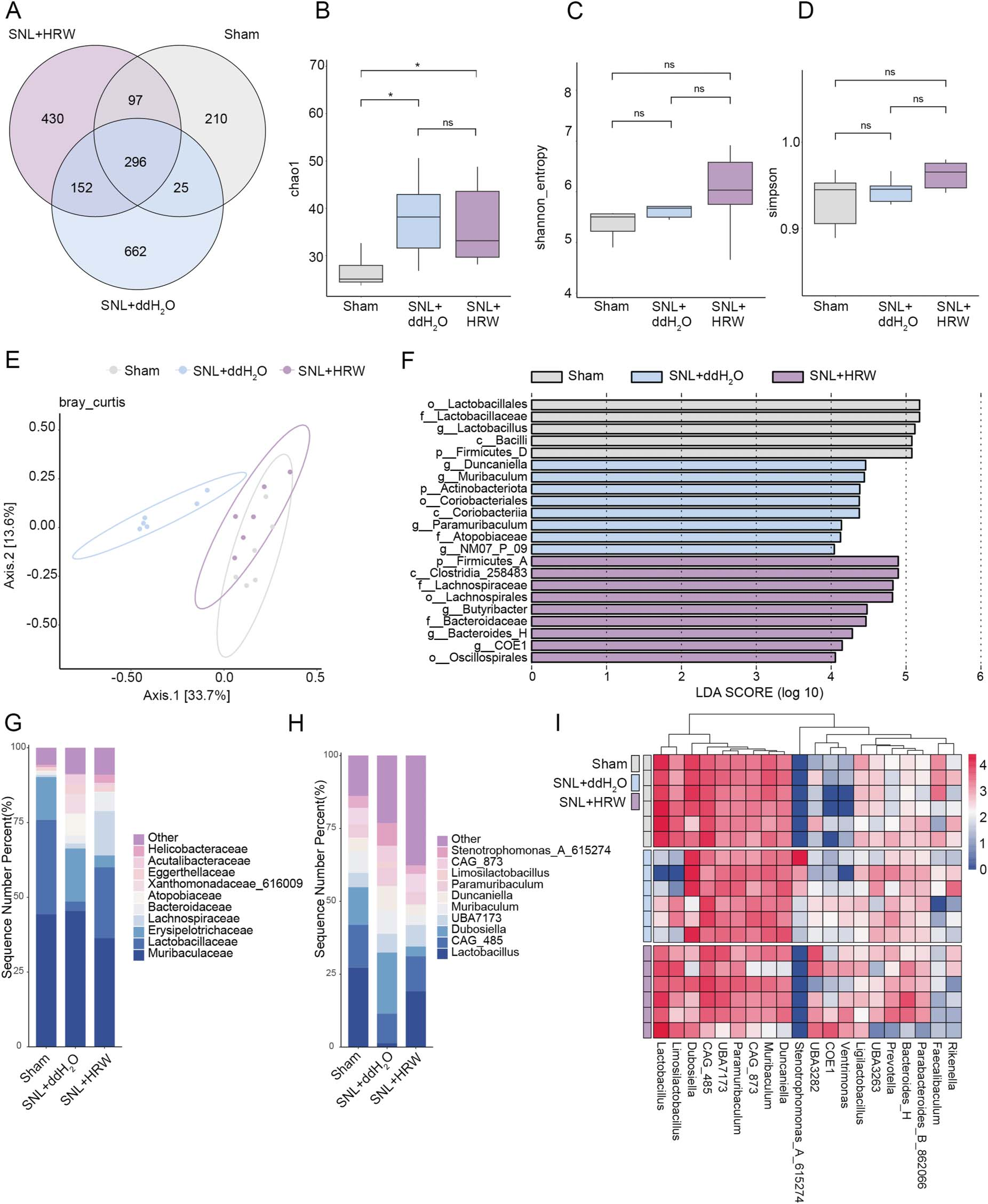
图3 富氢水调控神经病理性损伤中的肠道菌群
(A)韦恩图显示假手术(Sham)组、SNL+双蒸水(ddH₂O)组、SNL+富氢水(HRW)组3个样本组中独特及共有微生物特征的数量,每组n=6;(B-D)采用Chao1指数、Shannon指数、Simpson指数评估的粪便菌群α多样性分析,每组n=6;(E)显示粪便菌群β多样性的主坐标分析(PCoA)图,每组n=6;(F)3个样本组间线性判别分析效应大小(LEfSe)分析的线性判别分析(LDA)得分直方图,每组n=6;(G)按总丰度排序的科水平前10位微生物特征及其在不同亚组中的相对百分比分布,每组n=6;(H)按总丰度排序的属水平前10位微生物特征及其在不同亚组中的相对百分比分布,每组n=6;(I)不同样本中微生物群落丰度分布热图,每组n=6。
注:α多样性分析采用经假发现率(FDR)校正的Kruskal-Wallis检验,*P<0.05,ns(无统计学意义);主坐标分析采用ANOSIM检验;数据以“均值±均值标准误(SEM)”表示。
(FDR:假发现率;HRW:富氢水;SNL:脊神经结扎)
3.4 富氢水通过胆汁酸代谢相关机制缓解神经病理性疼痛
既往研究发现乳杆菌科与胆汁酸代谢密切相关[25,38]。为进一步探究富氢水(HRW)在神经病理性疼痛中的镇痛作用是否与调控胆汁酸代谢相关,本研究采用液相色谱-质谱联用(LC-MS)技术检测了血清胆汁酸靶向代谢组(图4A-P)。热图显示了富氢水对SNL模型中胆汁酸代谢物组成变化的影响,结果表明,SNL可诱导多种胆汁酸代谢物水平改变,其中猪去氧胆酸(HDCA)、去氧胆酸(DCA)等次级胆汁酸水平显著降低,而富氢水处理可恢复这些胆汁酸的水平。
在后续实验中,对SNL小鼠给予不同浓度的猪去氧胆酸和去氧胆酸,行为学检测显示这两种胆汁酸均能有效抑制疼痛相关行为的进展(图4Q-X)。上述结果提示,富氢水的镇痛作用与调控胆汁酸代谢密切相关。
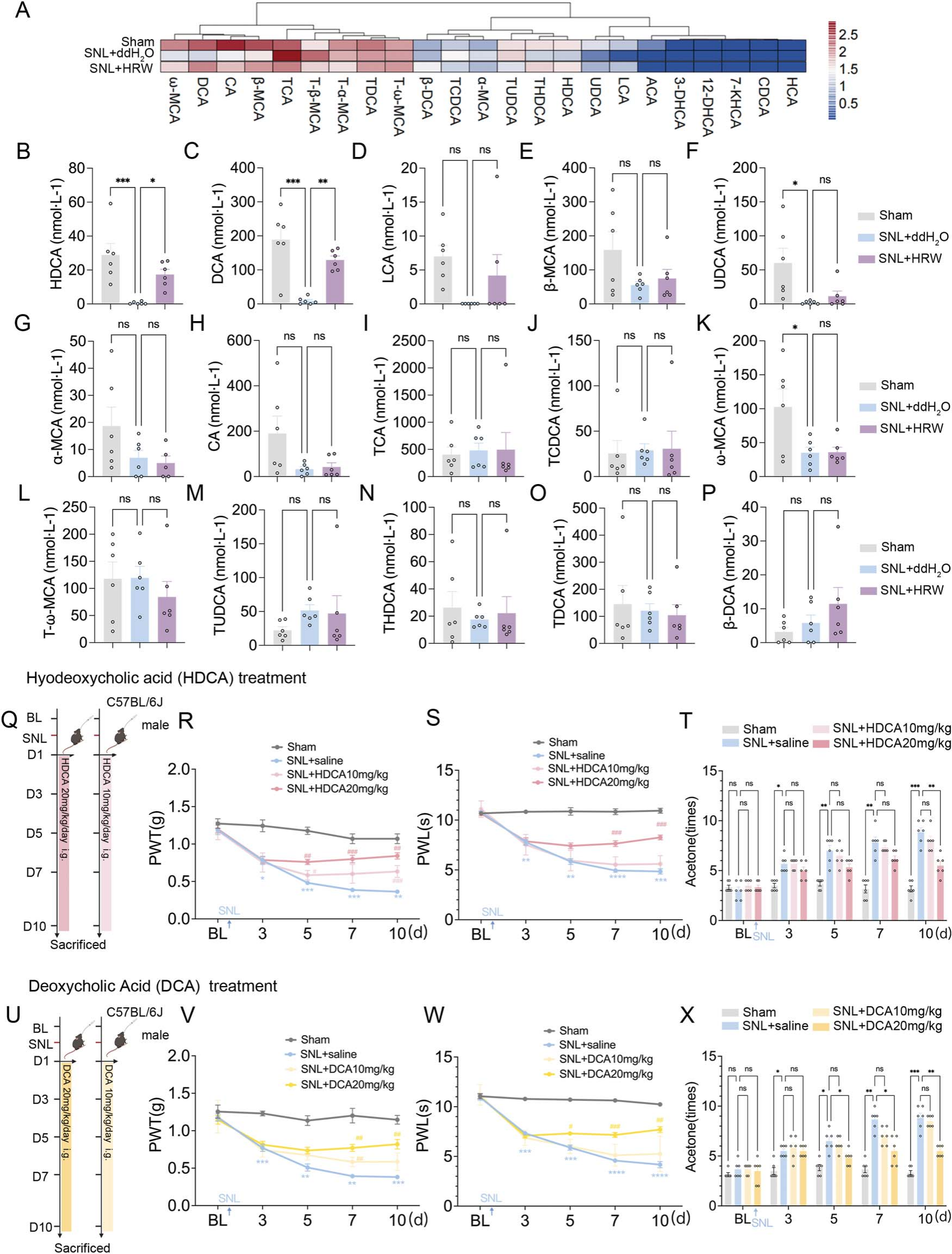
图4 富氢水通过胆汁酸代谢相关机制缓解神经病理性疼痛
(A)血清胆汁酸组成的热图聚类分析,每组n=6;(B-P)各血清胆汁酸的定量分析,每组n=6;(Q)猪去氧胆酸(HDCA)给药方案;(R)猪去氧胆酸干预后机械缩足阈值(PWT)变化,每组n=6;(S)猪去氧胆酸干预后热缩足潜伏期(PWL)变化,每组n=6;(T)猪去氧胆酸干预后丙酮刺激反应变化,每组n=6;(U)去氧胆酸(DCA)给药方案;(V)去氧胆酸干预后机械缩足阈值变化,每组n=6;(W)去氧胆酸干预后热缩足潜伏期变化,每组n=6;(X)去氧胆酸干预后丙酮刺激反应变化,每组n=6。
注:胆汁酸定量分析采用单向方差分析结合Tukey事后检验,*P<0.05,**P<0.01,***P<0.001,****P<0.0001;行为学数据采用双向重复测量方差分析结合Bonferroni事后检验,*P<0.05,**P<0.01,***P<0.001,****P<0.0001,#P<0.05,##P<0.01,###P<0.001;数据以“均值±均值标准误(SEM)”表示。
(DCA:去氧胆酸;HDCA:猪去氧胆酸;HRW:富氢水;PWL:热缩足潜伏期;PWT:机械缩足阈值)
3.5 富氢水通过激活胆汁酸受体——武田G蛋白偶联受体5缓解神经病理性疼痛
已知猪去氧胆酸(HDCA)和去氧胆酸(DCA)均是胆汁酸膜受体——武田G蛋白偶联受体5(TGR5)的激动剂[19,39]。为进一步探究富氢水(HRW)的镇痛作用与胆汁酸代谢的关联,本研究检测了SNL模型小鼠脊髓和结肠中TGR5的蛋白及mRNA表达水平,结果显示,富氢水可逆转SNL诱导的上述组织中TGR5蛋白及mRNA表达的降低(图5A-D);在雌性小鼠脊髓中也观察到类似趋势(补充图S1D、E,链接:https://links.lww.com/PAIN/C400)。结肠免疫组织化学染色和脊髓免疫荧光染色结果进一步验证了这一发现(图5E-H)。
此外,将TGR5与神经元标志物神经元特异性核蛋白(Neun)、小胶质细胞标志物离子钙结合适配分子1(IBA1)、星形胶质细胞标志物胶质纤维酸性蛋白(GFAP)进行共染色发现,TGR5主要在神经元上表达,而非小胶质细胞或星形胶质细胞(图5I);在背根神经节中,TGR5主要与神经元标志物β-微管蛋白Ⅲ(TUJ1)共定位,且富氢水可显著上调SNL损伤后TGR5的表达(图5H、J)。
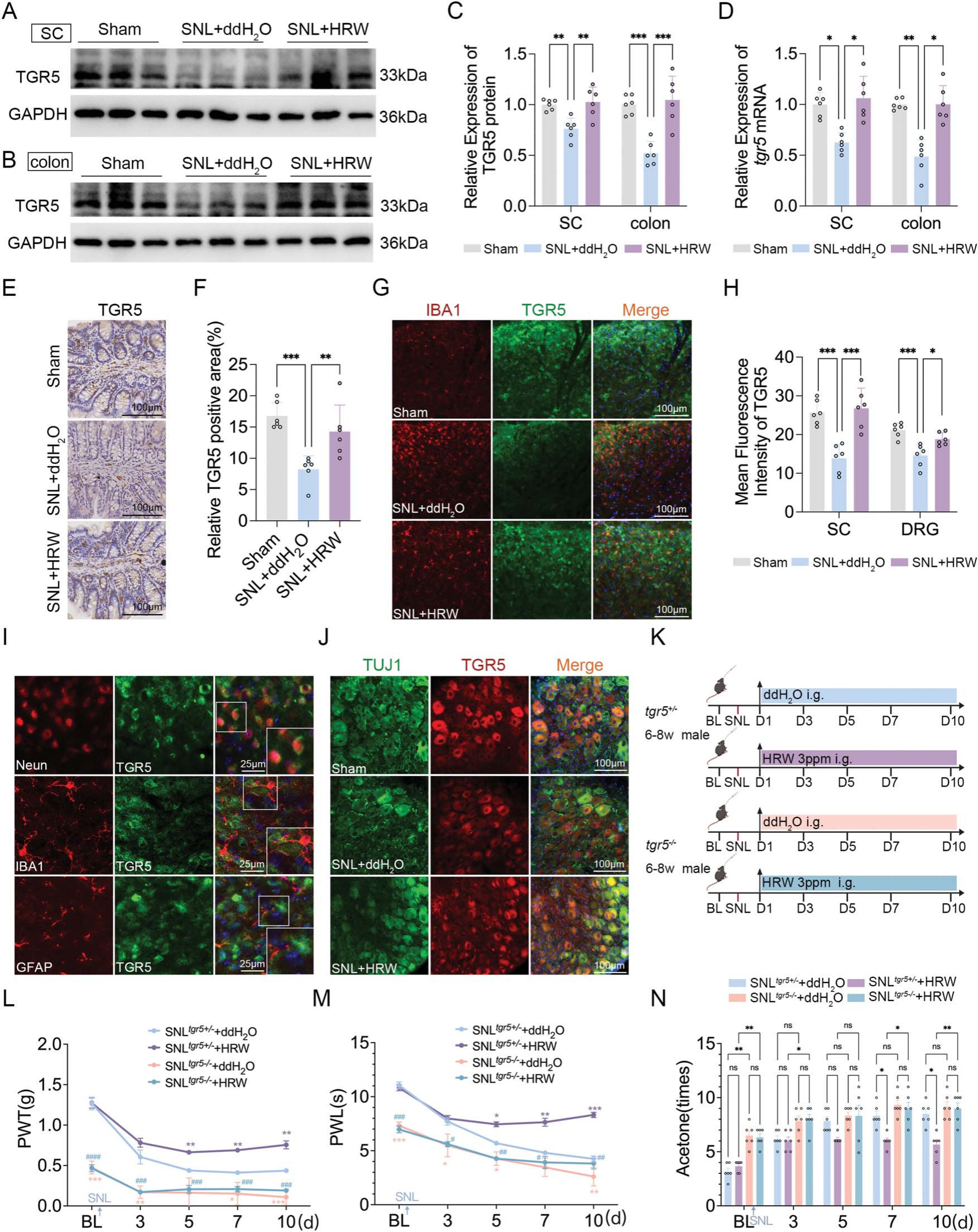
图5 富氢水通过激活武田G蛋白偶联受体5发挥镇痛作用
(A)脊髓武田G蛋白偶联受体5(TGR5)表达的蛋白质印迹代表性图像;(B)结肠TGR5表达的蛋白质印迹代表性图像;(C)脊髓和结肠TGR5蛋白水平的相对定量分析,每组n=6;(D)脊髓和结肠tgr5 mRNA的相对定量表达,每组n=6;(E)结肠TGR5免疫组织化学染色代表性图像及(F)相对定量分析,每组n=6;(G)脊髓背角IBA1与TGR5免疫荧光染色代表性图像(比例尺:100 μm),每组n=6;(H)脊髓和背根神经节中TGR5免疫荧光染色的定量分析,每组n=6;(I)脊髓背角TGR5分别与Neun、IBA1、GFAP的共定位分析(比例尺:25 μm);(J)背根神经节中TUJ1与TGR5免疫荧光染色代表性图像(比例尺:100 μm),每组n=6;(K)SNL模型中TGR5野生型(tgr5⁺/⁻)和敲除型(tgr5⁻/⁻)小鼠灌胃富氢水的给药方案;(L)机械缩足阈值(PWT)变化,每组n=6;(M)热缩足潜伏期(PWL)变化,每组n=6;(N)丙酮刺激反应变化,每组n=6。
注:蛋白及mRNA定量分析采用单向方差分析结合Tukey事后检验,*P<0.05,**P<0.01,***P<0.001;行为学数据采用双向重复测量方差分析结合Bonferroni事后检验,*P<0.05,**P<0.01,***P<0.001,****P<0.0001,#P<0.05,##P<0.01,###P<0.001;数据以“均值±均值标准误(SEM)”表示。
(GFAP:胶质纤维酸性蛋白;HRW:富氢水;IBA1:离子钙结合适配分子1;PWL:热缩足潜伏期;PWT:机械缩足阈值;SNL:脊神经结扎;TGR5:武田G蛋白偶联受体5;TUJ1:β-微管蛋白Ⅲ)
为明确武田G蛋白偶联受体5(TGR5)是否参与富氢水(HRW)的镇痛作用,本研究对SNL术后的TGR5敲除(tgr5⁻/⁻)小鼠进行富氢水灌胃处理,并评估其疼痛行为(图5K)。结果显示,与SNL模型中的TGR5野生型(tgr5⁺/⁻)小鼠相比,tgr5⁻/⁻小鼠的机械缩足阈值(PWT)和热缩足潜伏期(PWL)更低,丙酮刺激反应更高;且富氢水干预无法缓解SNL后tgr5⁻/⁻小鼠的疼痛行为(图5L-N);在雌性小鼠中也观察到类似趋势(补充图S1F-H,链接:https://links.lww.com/PAIN/C400)。综上,这些结果提示TGR5在富氢水的镇痛作用中发挥关键作用。
3.6 富氢水激活神经病理性损伤中受损的自噬
本研究观察到,在SNL诱导的神经病理性疼痛进展过程中,脊髓背角自噬相关蛋白Beclin1和微管相关蛋白轻链3B(LC3B)的阳性荧光染色表达降低,而P62表达升高,其中术后第10天的变化最为显著(补充图S2A-F,链接:https://links.lww.com/PAIN/C400);对脊髓和结肠组织的蛋白质印迹分析也显示,Beclin1和LC3BⅡ/Ⅰ蛋白表达降低,同时P62蛋白表达升高(补充图S2G-N,链接:https://links.lww.com/PAIN/C400)。这些结果与既往文献中“自噬功能障碍参与神经病理性疼痛发病机制”的结论一致[17,21]。
鉴于已知富氢水(HRW)具有调控自噬的作用,本研究进一步探究了其在SNL模型中对自噬的影响。对脊髓(图6A、B)和结肠组织(补充图S3A、B,链接:https://links.lww.com/PAIN/C400)的蛋白定量分析显示,富氢水可恢复SNL模型中降低的LC3BⅡ/Ⅰ和Beclin1表达,并降低P62表达;脊髓和背根神经节的免疫荧光染色结果进一步验证了这一发现(图6C-F、补充图S3C-F,链接:https://links.lww.com/PAIN/C400)。
此外,共定位研究显示,Beclin1主要与Neun共定位,与GFAP的共定位较少,与IBA1几乎无共定位;P62几乎仅与Neun共定位,与IBA1和GFAP的共定位极少;而LC3B主要与Neun和IBA1共定位,与GFAP几乎无共定位(图6G-I),这提示脊髓自噬可能主要发生在神经元中。
透射电子显微镜分析显示,SNL模型中脊髓背角神经元(图6J)和结肠上皮细胞(补充图S3G,链接:https://links.lww.com/PAIN/C400)的自噬体、溶酶体、自噬溶酶体数量减少,同时线粒体结构受损(包括线粒体嵴溶解、线粒体空泡化);而富氢水干预可改善这些改变,并增强自噬活性。此外,富氢水处理还可调控SNL模型中自噬相关基因的表达(图6K)。
综上,这些结果提示富氢水与自噬功能障碍的恢复显著相关,有助于减轻神经病理性损伤引起的神经病理性疼痛。
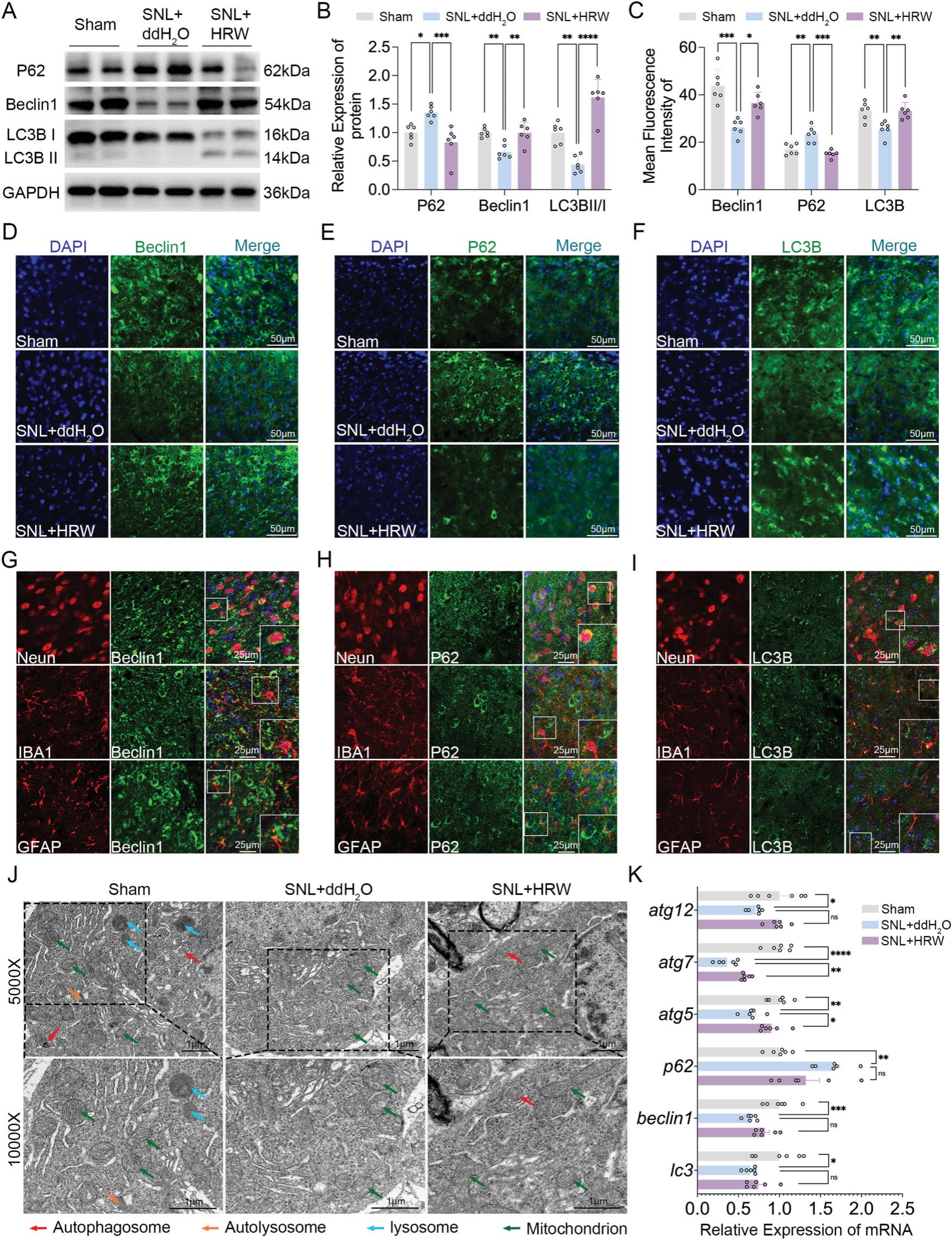
图6 富氢水激活神经病理性损伤中的脊髓自噬
(A)脊髓P62、Beclin1、微管相关蛋白轻链3BⅡ/Ⅰ(LC3BⅡ/Ⅰ)蛋白的蛋白质印迹代表性图像,及(B)相应相对定量分析,每组n=6;(D)脊髓背角Beclin1、(E)P62、(F)LC3B免疫荧光染色的代表性图像(比例尺:50 μm),及(C)相应相对定量分析,每组n=6;(G)Beclin1分别与神经元特异性核蛋白(Neun)、离子钙结合适配分子1(IBA1)、胶质纤维酸性蛋白(GFAP)共定位染色的共聚焦图像(比例尺:25 μm);(H)P62分别与Neun、IBA1、GFAP共定位染色的共聚焦图像(比例尺:25 μm);(I)LC3B分别与Neun、IBA1、GFAP共定位染色的共聚焦图像(比例尺:25 μm);(J)脊髓背角神经元的透射电子显微镜(TEM)图像(比例尺:1 μm);(K)脊髓自噬相关基因(atg12、atg5、atg7、p62、beclin1、lc3)mRNA表达的相对定量分析,每组n=6。
注:采用单向方差分析结合Tukey事后检验,*P<0.05,**P<0.01,***P<0.001,ns(无统计学意义);数据以“均值±均值标准误(SEM)”表示。
(GFAP:胶质纤维酸性蛋白;HRW:富氢水;IBA1:离子钙结合适配分子1;Neun:神经元特异性核蛋白;TEM:透射电子显微镜)
3.7 神经病理性损伤中富氢水激活的自噬依赖于武田G蛋白偶联受体5
为探究武田G蛋白偶联受体5(TGR5)与自噬在疼痛相关行为中的因果作用,本研究评估了无论是否进行脊神经结扎(SNL)手术,TGR5敲除小鼠的自噬水平和行为是否存在改变(补充图S4A,链接:https://links.lww.com/PAIN/C400)。结果显示,单独敲除TGR5即可导致机械缩足阈值(PWT)降低、热缩足潜伏期(PWL)缩短,同时丙酮刺激反应增强(补充图S4B-D,链接:https://links.lww.com/PAIN/C400);但与SNL诱导的行为改变相比,这些变化无统计学意义。对脊髓组织的蛋白质印迹和免疫荧光染色分析显示,TGR5敲除(tgr5⁻/⁻)小鼠存在自噬功能障碍(补充图S4E-J,链接:https://links.lww.com/PAIN/C400)。
随后,本研究进一步探究在TGR5敲除的情况下,富氢水(HRW)是否仍能逆转SNL诱导的自噬功能障碍。脊髓蛋白质印迹分析显示,对于tgr5⁻/⁻小鼠,富氢水无法逆转SNL诱导的P62蛋白水平升高,也不能恢复Beclin1和LC3BⅡ/Ⅰ蛋白的降低(图7A-D);在雌性小鼠中也观察到类似结果(补充图S5A-D,链接:https://links.lww.com/PAIN/C400)。免疫荧光染色进一步证实,富氢水无法恢复SNL处理的tgr5⁻/⁻小鼠脊髓中异常的自噬流(图7E-J)。此外,TGR5敲除后,富氢水也无法缓解SNL诱导的结肠自噬功能障碍和肠屏障损伤(补充图S5E-J,链接:https://links.lww.com/PAIN/C400)。综上,这些结果提示,TGR5介导的自噬在富氢水缓解神经病理性疼痛的机制中发挥关键作用。

图7 武田G蛋白偶联受体5敲除可逆转富氢水在神经病理性疼痛中对自噬的激活作用
(A)脊髓P62、Beclin1、LC3BⅡ/Ⅰ蛋白的蛋白质印迹代表性图像,及(B-D)相应相对定量分析,每组n=6;(H-J)脊髓背角P62、Beclin1、LC3B免疫荧光染色的代表性图像(比例尺:50 μm),及(E-G)相应相对定量分析,每组n=6。
注:采用双向重复测量方差分析结合Bonferroni事后检验,*P<0.05,**P<0.01,***P<0.001,ns(无统计学意义);数据以“均值±均值标准误(SEM)”表示。
(HRW:富氢水;TGR5:武田G蛋白偶联受体5)
3.8 武田G蛋白偶联受体5介导的自噬在神经病理性疼痛治疗中起关键作用
为进一步探究TGR5介导的自噬是否可作为神经病理性疼痛的治疗靶点,本研究在SNL模型小鼠中给予自噬激动剂雷帕霉素(图8A)。行为学检测显示,雷帕霉素可有效缓解神经病理性疼痛;但TGR5敲除后,其镇痛作用消失(图8B-D)。此外,TGR5敲除还逆转了雷帕霉素对脊髓背角小胶质细胞活化的抑制作用(图8E-F)。对脊髓蛋白的定量分析和免疫荧光染色进一步显示,雷帕霉素可激活SNL模型中的自噬,而这一效应在TGR5敲除后被减弱(图8G-N)。这些结果提示,TGR5介导的自噬可能是神经病理性疼痛的潜在治疗靶点。

图8 武田G蛋白偶联受体5介导的自噬激活在神经病理性疼痛治疗中发挥作用
(A)雷帕霉素给药方案,每组n=6;(B-D)雷帕霉素干预后SNL模型的行为学评估;(E-F)脊髓背角IBA1免疫荧光染色及相应相对定量分析(比例尺:100 μm),每组n=6;(G-H)脊髓P62、Beclin1、LC3BⅡ/Ⅰ蛋白的蛋白质印迹代表性图像及相对定量分析,每组n=6;(I-K)脊髓背角P62、Beclin1、LC3B免疫荧光染色的代表性图像(比例尺:50 μm),及(L-N)相应相对定量分析,每组n=6。
注:行为学数据采用双向重复测量方差分析结合Bonferroni事后检验,*P<0.05,**P<0.01,***P<0.001,****P<0.0001,#P<0.05,##P<0.01,###P<0.001,^P<0.05,^^P<0.01,^^^P<0.001,^^^^P<0.0001,ns(无统计学意义);其余分析采用单向方差分析结合Tukey事后检验,*P<0.05,**P<0.01,***P<0.001,****P<0.0001;数据以“均值±均值标准误(SEM)”表示。
(IBA1:离子钙结合适配分子1;SNL:脊神经结扎;TGR5:武田G蛋白偶联受体5)
4 讨论
本研究探究了富氢水(HRW)缓解雄性和雌性小鼠神经病理性疼痛的潜在机制。结果显示,富氢水可改善神经病理性损伤相关的肠屏障破坏,并提高肠道微生物群多样性;这些变化随后导致胆汁酸代谢物丰度改变,进而直接或间接激活胆汁酸受体——武田G蛋白偶联受体5(TGR5)的表达;该受体激活有助于恢复自噬功能障碍、减轻神经炎症并降低痛觉敏感性。这些结果深化了我们对宿主、肠道微生物群与胆汁酸代谢在疼痛调控中复杂关系的理解,为慢性疼痛管理提供了新的治疗靶点。
富氢水是通过膜电解等物理或化学方法将氢气溶解于双蒸水(ddH₂O)中制备而成的饮用水,已有研究表明其具有强效抗氧化、抗炎和抗凋亡作用。本研究发现,富氢水可有效减轻SNL诱导的肠屏障破坏。肠道微生物群在维持肠黏膜屏障完整性中发挥关键作用,而肠道菌群失调会导致屏障损伤,进而参与炎症性肠病、肝肾疾病等多种疾病的发病过程[1,31]。因此,本研究进一步探究了富氢水对SNL模型小鼠肠道微生物群组成的影响,结果发现富氢水可降低丹毒丝菌科(Erysipelotrichaceae)等有害菌的丰度[6],同时显著提高乳杆菌科(Lactobacillaceae)等有益菌的丰度[18,29]。既往研究表明,乳杆菌科可通过酶促活性调控胆汁酸代谢[13,14];肠道微生物群可通过去羟基化、氧化、脱硫、酯化等多种修饰方式增加胆汁酸池的多样性,从而调控胆汁酸代谢[9]。例如,次级胆汁酸的代谢需要胆盐水解酶先水解氨基酸部分,随后才能进行进一步修饰[16]。
脑源性胆汁酸可直接激活膜受体和核受体,或调控神经递质受体的激活;而外周胆汁酸则可能通过法尼醇X受体(FXR)依赖的成纤维细胞生长因子15/19(FGF15/19)信号通路间接影响中枢神经系统(CNS)[4,32]。血清液相色谱-质谱联用(LC-MS)分析显示,富氢水可改变SNL小鼠体内初级和次级胆汁酸的水平,其中次级胆汁酸(猪去氧胆酸HDCA、去氧胆酸DCA)的变化最为显著。随后,本研究在SNL模型中给予这两种胆汁酸,发现它们均能改善小鼠的疼痛行为。值得注意的是,猪去氧胆酸和去氧胆酸均为TGR5受体的激动剂,且既往研究已证实鞘内注射TGR5激动剂具有镇痛作用,与本研究结果一致[34]。
TGR5是一种在人类和动物体内广泛表达的G蛋白偶联受体,在多种系统性疾病中发挥重要作用:它可通过促进内分泌细胞释放胰高血糖素样肽-1(GLP-1)调控糖代谢[37];通过调控肾上皮钠通道中组蛋白H3K4甲基化减轻醋酸脱氧皮质酮-盐敏感性高血压[41];还可通过外侧下丘脑-背侧CA3区-背侧隔核神经环路调控雄性小鼠的抑郁样行为[22]。本研究首次发现,TGR5敲除会诱导小鼠出现神经病理性疼痛样行为表型,并削弱富氢水的镇痛作用。
此外,本研究还指出了当前对TGR5下游信号通路理解的不足。在神经系统中,TGR5同时表达于神经元和非神经元细胞;而本研究发现,TGR5主要定位于脊髓背角和背根神经节的神经元中,提示其可能参与神经元稳态和兴奋性的调控。有研究报道,鞘内注射富氢盐水可通过自噬介导的炎性小体失活,减轻神经病理性疼痛大鼠的伤害性痛觉过敏和小胶质细胞活化[5]。本研究发现,富氢水可在神经病理性疼痛模型中促进自噬,而这一效应在TGR5敲除后消失;此外,tgr5⁻/⁻小鼠脊髓背角的自噬活性显著降低,这可能是导致其痛阈改变的原因之一。雷帕霉素可通过抑制mTORC1促进自噬过程,进而增强细胞损伤修复能力,近年来被发现参与免疫调控、代谢稳态维持、延缓衰老及抗肿瘤等过程。本研究观察到,雷帕霉素可显著缓解SNL诱导的神经病理性疼痛,而TGR5敲除后这一效应被部分逆转;同时发现,脊髓背角和背根神经节的自噬主要发生于神经元中,与TGR5的定位重叠。这些结果凸显了TGR5在神经病理性疼痛自噬调控中的关键作用。由于调控自噬的两条经典通路(PI3K通路和mTOR通路)均参与TGR5信号传导[3,43],因此我们推测,TGR5介导的自噬调控可能与这些通路存在交叉。
肠道自噬对维持肠屏障完整性至关重要[12],可能在富氢水修复肠屏障、进而减少结肠炎性浸润的过程中发挥重要作用。此外,脊髓和背根神经节神经元的自噬功能障碍会导致毒性细胞器和代谢废物(包括结构受损的蛋白质)无法有效降解,破坏神经元和突触稳态[36,42];这种调控异常可能进一步增加小胶质细胞和星形胶质细胞的活化易感性,导致多种炎症介质释放[7],进而为神经元营造有害的生存环境,加剧稳态失衡[8]。
本研究存在一定局限性:首先,未开展TGR5过表达实验,而该实验有助于明确TGR5激活是否可直接调控疼痛(尽管既往研究已证实TGR5激活可缓解SNL和保留神经损伤(SNI)诱导的神经病理性疼痛);其次,需进一步开展细胞和动物水平的研究,以阐明TGR5调控自噬过程的具体机制及其在疼痛调控中的潜在作用;再次,粪便微生物群移植实验对于验证SNL模型中肠道微生物群与胆汁酸代谢的关系至关重要;最后,本研究未探究富氢水激活TGR5的效应在雌雄小鼠间的差异,未来研究可进一步探讨慢性疼痛的性别相关差异是否与TGR5的差异表达有关。
5 结论
本研究从“肠道-脊髓轴”视角出发,证实富氢水可通过调控“肠道微生物群-胆汁酸-TGR5-自噬”通路,缓解雄性和雌性小鼠的神经病理性疼痛。该研究不仅深化了我们对氢医学(尤其是富氢水)在疼痛管理中治疗机制的理解,还阐明了胆汁酸受体在神经病理性疼痛病理生理过程中的作用,为慢性疼痛的临床管理提供了新的潜在治疗靶点。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1507753.html?mobile=1
收藏

