氢气作为一种已知的抗氧化剂,已被证实可用于治疗压疮。然而,传统氢气给药方式在氢气摄入量及摄入持续性方面存在局限性。本研究在小鼠在体模型中,评估了一种新型含硅(Si)制剂的疗效,该制剂可产生大量氢气,用于治疗压疮。
方法
使用磁铁对小鼠背部皮肤及皮下组织施加压迫12小时。将饲喂普通饲料的小鼠(对照组)与饲喂含2.5重量百分比硅基制剂饲料的小鼠(硅组)进行对比,分析压迫解除后溃疡面积的变化、组织学特征、细胞凋亡程度,以及氧化应激标志物和炎症相关细胞因子的表达水平。
结果
与对照组相比,硅组小鼠的溃疡面积显著更小,愈合周期显著更短。此外,硅组小鼠溃疡组织内的炎症反应、凋亡活性及氧化应激水平均得到显著抑制。
结论
口服硅基制剂可通过调控细胞凋亡、氧化应激及炎症反应,在压疮的治疗和预防中发挥潜在作用。
1. 引言
压疮不仅是患者及其照护者面临的重大问题,也可能加重医疗体系的负担[1]。尽管各年龄段人群均可能受其影响,但压疮在活动能力较弱的老年人群中更为高发。在老龄化社会背景下,建立有效的压疮预防和治疗方法变得愈发重要。
研究表明,压疮的发病与恶化不仅与机械负荷和缺血损伤相关,还涉及缺血再灌注损伤(IRI)及炎症反应[1,2]。缺血再灌注损伤的发生机制被认为与血流中断及后续再灌注过程中产生的活性氧所引发的组织氧化应激有关[3]。抑制缺血再灌注损伤已被证实可有效改善压疮病情,为此,众多研究聚焦于具有抗炎、抗氧化及抗凋亡活性的治疗制剂。例如,已有体外或体内研究报道了维生素E[4]、褪黑素[5]、坎地沙坦[6]、橄榄油[7]、咖啡酸苯乙酯[8]、去铁胺[9]、得林钠[10]、丙酮酸钠[11]、锌[12]、磷脂组分[13]、富马酸二甲酯[14]、黄芩苷[15]及色胺酮[16]在压疮治疗中的潜在疗效。此外,锌、精氨酸和维生素C作为具有抗氧化特性的代表性成分,已被证实具有临床疗效[17]。这些物质虽可相对安全地使用,但过量使用相关的副作用风险仍不容忽视[18,19]。尤其对于作为压疮主要发病人群的、伴有基础疾病的老年患者,其发生更严重并发症的风险更高[20,21,22]。因此,谨慎调整剂量并进行全面监测至关重要。
氢气是一种极具潜力的抗氧化剂,可通过选择性中和羟自由基来减轻组织氧化应激[23],其在压疮治疗中的潜在有效性此前已有报道[24,25]。为减轻氧化损伤,研究人员已探索了多种氢气递送方式,如饮用富氢水和吸入氢气。然而,大多数传统研究采用的富氢水或氢气存在氢气摄入量及摄入持续性方面的局限性。富氢水通常通过向水中通入氢气或电解水制备,但氢气在水中的溶解度较低(饱和浓度为1.6 ppm),且由于氢分子会快速扩散到大气中,富氢水暴露于空气后,其氢气浓度易随时间降低。此外,持续吸入氢气在实际操作中并不可行。这些局限性带来了重大挑战,尤其对于压疮这类慢性疾病而言[26]。
为克服上述局限性,研究人员开发了一种新型硅基制剂,该制剂经口服后可在肠道环境中持续释放氢气分子。口服该硅基制剂后24小时内,每克制剂可产生超过400毫升的氢气,相当于超过22升完全饱和的富氢水所含的氢气量。该制剂在常规条件下性质稳定,且在体内可实现持续、高效的氢气释放。这种递送方式在氢气剂量控制、稳定性及摄入持续性方面具有优势,而这些优势是传统富氢水饮用或氢气吸入方式难以实现的[26]。已有研究表明,该制剂在多种氧化应激相关疾病及缺血再灌注损伤的动物模型中均展现出治疗效果[27,28,29,30,31]。本研究旨在通过小鼠模型评估该制剂在压疮预防和治疗中的作用。
2. 材料与方法
2.1 动物模型
大阪大学动物伦理委员会审核并批准了本研究的动物实验方案(批准号:04-005-002,批准日期:2022年4月8日)。实验所用27只6周龄雄性C57BL/6J小鼠购自日本杰克逊实验室(日本神奈川县)。实验期间,小鼠饲养于受控实验室环境中(12小时光照/12小时黑暗,温度22-25°C),可自由饮水和进食。参考既往研究[13,29],本研究遵循3R原则(替代、减少、优化),将实验动物数量控制在最低水平以满足统计学有效性要求。实验所用普通饲料为AIN-93M(日本东京 Oriental Yeast 株式会社)[32]。根据已建立的方法[26,33,34],制备特殊饲料:将普通饲料中2.5重量百分比的玉米淀粉替换为硅基制剂。
2.2 研究设计与动物压疮模型建立
将小鼠随机分为3个实验组:对照组、硅预处理组(pre-Si组)和硅后处理组(post-Si组),每组9只。对照组在整个研究期间均饲喂AIN-93M普通饲料;硅预处理组从施加压迫前3天开始至研究终点,均饲喂含硅基制剂的特殊饲料;硅后处理组则在压迫解除后开始饲喂含硅基制剂的特殊饲料,并持续至研究终点。硅基制剂的给药时间和时长参考既往研究确定。
采用已报道的方法建立小鼠压疮模型[12,13,14]:通过吸入异氟烷对小鼠进行麻醉后,去除其背部毛发;提起小鼠背部皮肤,将其夹在两个圆形铁氧体磁盘之间(直径12毫米,厚度5毫米,磁力1180高斯;日本东京 NeoMag 株式会社),确保受压组织包含真皮、表皮、疏松结缔组织和皮下脂肪,但不涉及肌肉(图1)。背部皮肤被夹持12小时后移除磁盘。整个压迫过程中未进行额外麻醉或固定。每只小鼠会形成2处独立的溃疡,溃疡之间由未受影响的皮肤分隔。
为分析溃疡面积的时间变化趋势,每组选取5只小鼠(共10处溃疡),对溃疡进行拍照,并使用ImageJ软件(2.9.0/1.53t版本)[35]评估溃疡面积。压疮形成后第3天,通过吸入二氧化碳对其余小鼠(每组8处溃疡)实施安乐死,随后收集组织样本:溃疡中心部位的组织用4%多聚甲醛(日本大阪富士胶片和光纯药株式会社)固定,用于组织学染色;溃疡邻近部位的组织则储存于-80°C,以备后续实验使用。所有评估均由对分组情况不知情的研究人员完成(结局评估者设盲)。
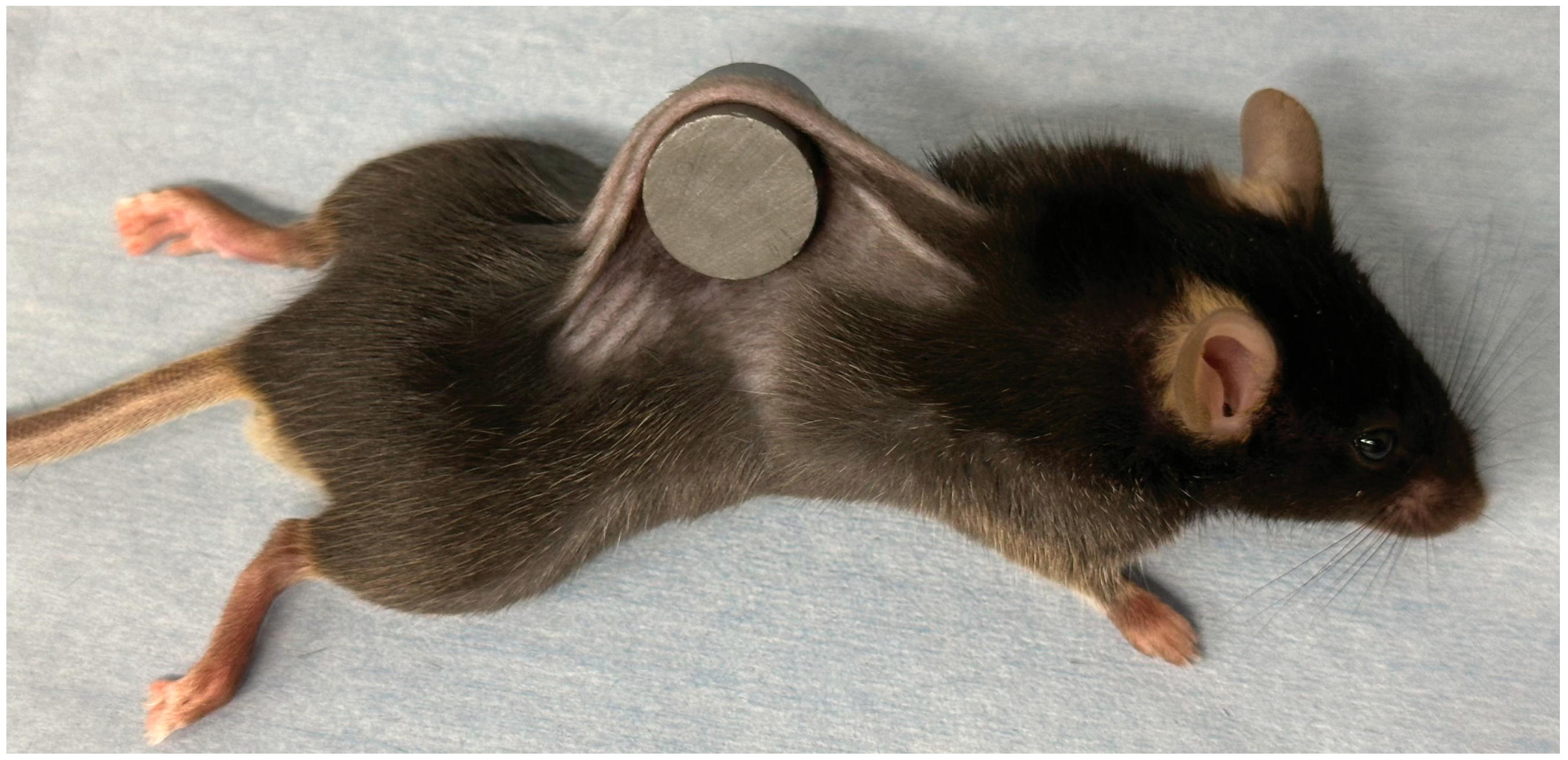
图1 小鼠压疮模型
通过使用两块磁性板对小鼠背部皮肤施加12小时压迫,建立压疮模型。
2.3 组织学检测
将样本包埋于石蜡中,随后切成4微米厚的切片。对切片进行末端脱氧核苷酸转移酶dUTP缺口末端标记(TUNEL)染色和苏木精-伊红(HE)染色。
- HE染色:每个样本制备1张切片,对每张切片的3个不同区域进行组织病理学评估。评估参照已确立的评分标准[6,36],具体基于溃疡中心周围3层皮肤的完整性及组织缺损深度判定组织损伤程度,评分标准如下:
- 0分:表皮、真皮及皮下组织均无组织学改变;
- 1分:3层皮肤结构完整,但可见表皮改变及纤维断裂;
- 2分:可见表皮缺损,且伴随坏死区域;
- 3分:可见真皮缺损,且伴随坏死区域;
- 4分:可见深度真皮缺损。
- TUNEL染色:依据试剂盒说明书,使用凋亡检测试剂盒(日本滋贺县TaKaRa Bio株式会社)通过TUNEL染色原位评估细胞凋亡情况。采用含DAPI的Fluoro-KEEPER抗荧光淬灭非硬化封片剂(日本京都奈良先端科学技术大学院大学)对切片进行封片。参照既往研究报道[14,29,31],将“TUNEL阳性细胞数/DAPI阳性细胞核数”的比值定义为凋亡指数。
- 显微成像与定量分析:使用BZ-X800显微镜(日本大阪府基恩士公司)获取显微图像,并结合ImageJ软件(2.9.0/1.53t版本)进行定量分析。
2.4 凋亡相关蛋白检测
参照既往方法[13],采用蛋白质印迹法(Western blot)检测凋亡相关蛋白的表达水平。具体步骤如下:
1. 将冷冻组织样本在冰上切碎,使用EzRIPA裂解试剂盒(日本东京都ATTO株式会社)结合匀浆器裂解样本,随后进行离心处理;
2. 取上清液,用EzApply试剂(日本东京都ATTO株式会社)使蛋白变性,每泳道上样10微克蛋白;
3. 使用e-PAGEL HR凝胶(日本东京都ATTO株式会社)进行电泳分离,再通过iBlot 2干式转膜系统(美国加利福尼亚州卡尔斯巴德市赛默飞世尔科技公司)将蛋白转移至聚偏氟乙烯(PVDF)膜上;
4. 将膜浸泡在封闭液(含5%脱脂牛奶的TBST缓冲液)中30分钟,随后在4°C条件下与一抗孵育过夜。所用一抗包括兔多克隆抗Bax抗体(货号50599-2-Ig,稀释比例1:5000)、抗Bcl-2抗体(货号26593-1-AP,稀释比例1:1000)及抗β-肌动蛋白(β-actin)抗体(货号20536-1-AP,稀释比例1:1000);
5. 清洗膜后,在室温下与辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗(货号SA00001-2,稀释比例1:2000)孵育2小时(所有抗体均购自美国伊利诺伊州罗斯蒙特市Proteintech集团);
6. 使用EzWestLumi plus发光试剂(日本东京都ATTO株式会社)进行信号检测,通过ChemiDoc Touch成像系统(美国加利福尼亚州赫拉克勒斯市伯乐生命医学产品有限公司)获取图像。
以β-肌动蛋白作为内参,通过促凋亡因子Bax与抑凋亡因子Bcl-2的比值评估组织凋亡程度。
2.5 氧化应激检测
参照既往报道的方法[29,31],通过分别检测8-羟基-2-脱氧鸟苷(8-OHdG)和丙二醛(MDA)的水平,评估DNA氧化损伤和脂质过氧化程度,以反映氧化应激状态。具体步骤如下:
- MDA检测 :使用OxiSelect硫代巴比妥酸反应底物(TBARS)检测试剂盒(美国加利福尼亚州圣地亚哥市Cell Biolabs公司)测定MDA水平;同时使用DC蛋白检测试剂盒(美国加利福尼亚州赫拉克勒斯市伯乐生命医学产品有限公司)测定总蛋白含量。
- **8-OHdG检测**:使用DNA提取试剂盒TIS(日本大阪府富士胶片和光纯药株式会社)提取DNA,再通过8-OHdG检测制备试剂盒(日本大阪府富士胶片和光纯药株式会社)对DNA进行水解;使用NanoDrop One分光光度计(美国马萨诸塞州沃尔瑟姆市赛默飞世尔科技公司)测定DNA浓度;采用高精度酶联免疫吸附试验(ELISA)试剂盒(日本静冈县日本老化控制研究所、日研SEIL株式会社)定量检测8-OHdG水平,并使用SH-9000Lab酶标仪(日本东京都日立公司)读取吸光度值。
所有检测数据均分别以总蛋白含量或DNA含量进行标准化:8-OHdG的结果以“纳克/毫克DNA”(ng/mg DNA)表示,MDA的结果以“纳摩尔/毫克蛋白”(nmol/mg protein)表示。
2.6 炎症细胞因子基因表达检测
参照既往方法[15,29,31],采用实时定量逆转录聚合酶链式反应(RT-qPCR)检测促炎细胞因子的mRNA表达水平。具体步骤如下:
1. 使用miTotal RNA提取微量制备系统(中国台湾省台北市维真生物科技有限公司)提取总RNA;
2. 使用ReverTra Ace qPCR逆转录大师 mix(日本大阪府东洋纺株式会社)将RNA逆转录为互补DNA(cDNA);
3. 采用TaqMan基因表达检测试剂盒(美国马萨诸塞州沃尔瑟姆市赛默飞世尔科技公司),对肿瘤坏死因子-α(TNF-α,货号Mm00443258_m1)、白细胞介素-6(IL-6,货号Mm00446190_m1)、白细胞介素-1β(IL-1β,货号Mm00434228_m1)及内参基因β-肌动蛋白(β-actin,货号Mm02619580_g1)的表达水平进行检测;
4. 使用THUNDERBIRD探针qPCR mix(日本大阪府东洋纺株式会社),在QuantStudio 7 Flex实时PCR系统(美国马萨诸塞州沃尔瑟姆市赛默飞世尔科技公司)上进行qPCR反应。
采用2⁻ΔΔCT法,以β-肌动蛋白为内参基因对目标基因的相对mRNA表达水平进行标准化和定量分析。
2.7 统计学分析
使用JMP® Pro 17软件(美国北卡罗来纳州卡里市SAS研究所),采用图基诚实显著性差异检验(Tukey’s Honestly Significant Difference test)进行统计学分析。通过夏皮罗-威尔克检验(Shapiro–Wilk test)评估数据分布的正态性。当P值<0.05时,认为差异具有统计学意义。所有数据均以“平均值±均值标准误”(mean ± standard error of the mean)表示。
3 结果
# 3.1 大体观察结果
所有小鼠均形成压疮,无小鼠被排除于分析之外。损伤后约第3天,所有组别的溃疡面积均达到最大值,随后逐渐缩小。
- 第2天时,硅预处理组(pre-Si组)小鼠的溃疡面积显著小于对照组(P<0.05);
- 从第6天开始,硅后处理组(post-Si组)小鼠的溃疡面积也显著小于对照组(图2)。
与上述结果一致,硅处理组小鼠的溃疡愈合速度更快:对照组的平均愈合时间为13.0±0.2天,硅预处理组为11.8±0.3天,硅后处理组为12.0±0.3天;两个硅处理组的愈合时间均显著短于对照组(P<0.05)。
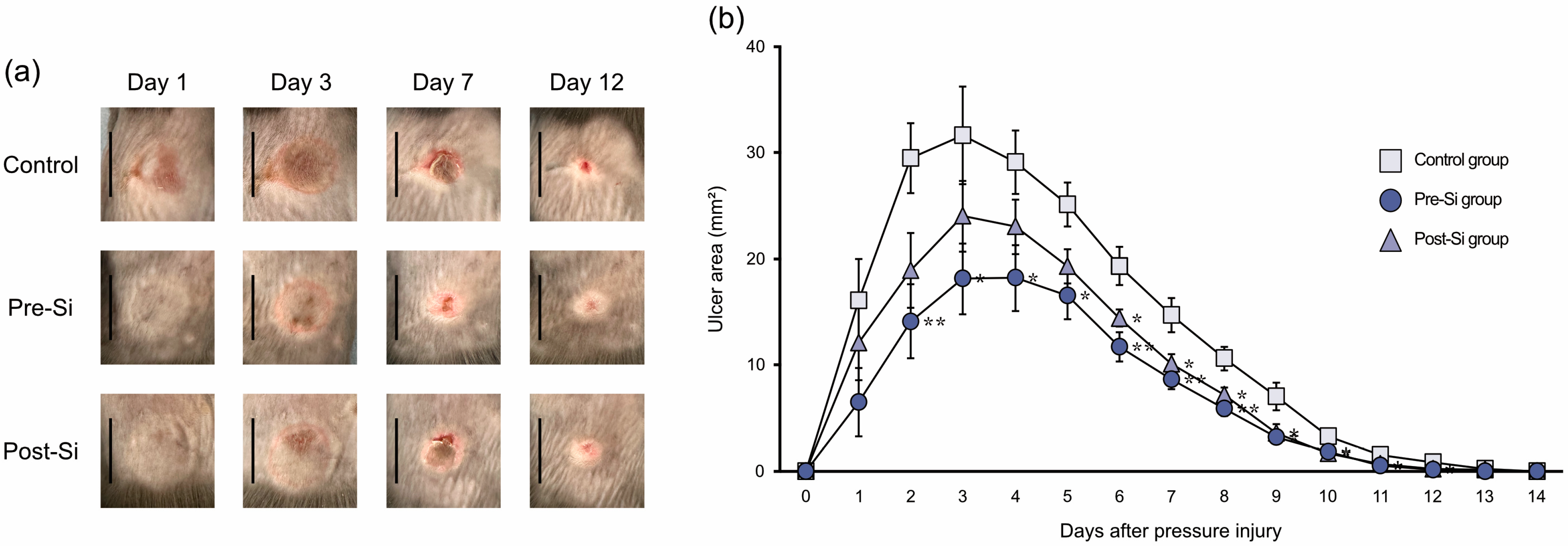
图2
(a)压疮大体观察结果的时间变化趋势(比例尺=10毫米)。(b)压疮形成后溃疡面积的变化(**p<0.01,*p<0.05;误差线表示均值标准误;采用图基诚实显著性差异检验;样本量n=10)。
3.2 组织学观察结果
压疮形成后第3天,对照组溃疡组织出现表皮与真皮深度坏死,且伴随大量炎症细胞浸润;而硅预处理组(pre-Si组)和硅后处理组(post-Si组)小鼠的组织损伤程度更轻(图3a)。对HE染色切片的定量评分结果显示,与对照组相比,两个硅处理组的组织损伤评分均显著更低(p<0.05)(图3b),这表明硅基制剂可减轻压疮组织的病理学损伤。
图3
(a)各实验组小鼠在(压疮形成后)第3天的代表性HE染色切片(比例尺=500微米)。(b)各组的组织损伤评分(*p<0.05;误差线表示均值标准误;采用图基诚实显著性差异检验;样本量n=8)。
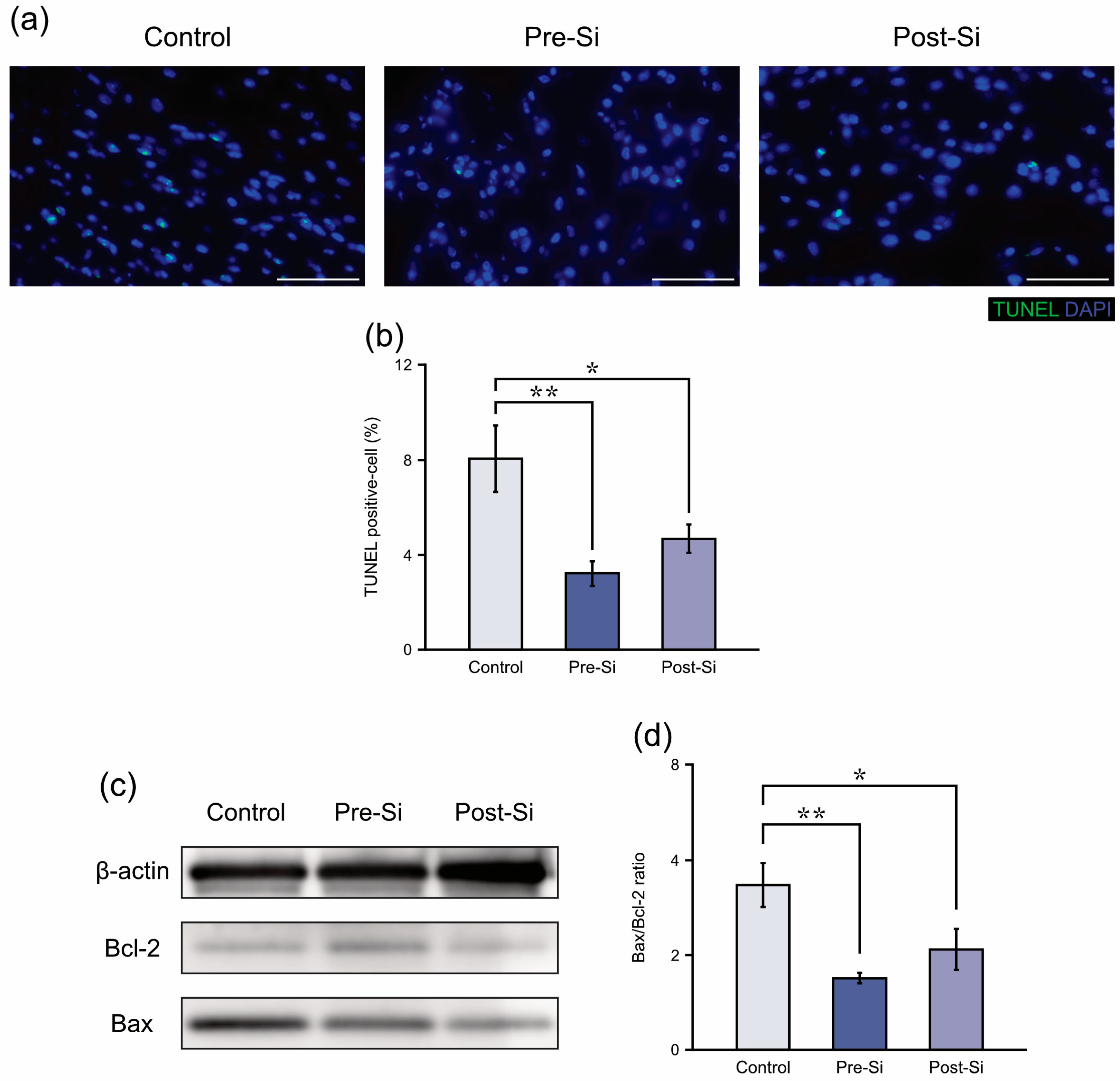
3.3 细胞凋亡相关检测结果
TUNEL染色结果显示,对照组小鼠溃疡组织中凋亡细胞占细胞核总数的比例为8.1±1.4%,而硅预处理组(pre-Si组)和硅后处理组(post-Si组)分别为3.2±0.5%和4.7±0.6%。与对照组相比,两个硅处理组的凋亡细胞数量均显著减少(硅后处理组:p<0.05,硅预处理组:p<0.01)(图4b)。
同样,蛋白质印迹法(Western blot)检测结果显示,与对照组相比,硅预处理组和硅后处理组的Bax/Bcl-2蛋白比值均显著降低(硅后处理组:p<0.05,硅预处理组:p<0.01)(图4d)。上述结果表明,硅基制剂可减少压疮组织中的细胞凋亡。
图4
(a)各实验组小鼠在(压疮形成后)第3天的代表性TUNEL染色切片(比例尺=50微米)。(b)各实验组小鼠的(凋亡细胞)比例(TUNEL阳性细胞数占DAPI阳性细胞核数的百分比)(**p<0.01,*p<0.05;误差线表示均值标准误;采用图基诚实显著性差异检验;样本量n=8)。(c)各实验组的代表性蛋白质印迹(Western blot)图像。(d)各实验组小鼠在第3天的相对Bax/Bcl-2比值(**p<0.01,*p<0.05;误差线表示均值标准误;采用图基诚实显著性差异检验;样本量n=8)。
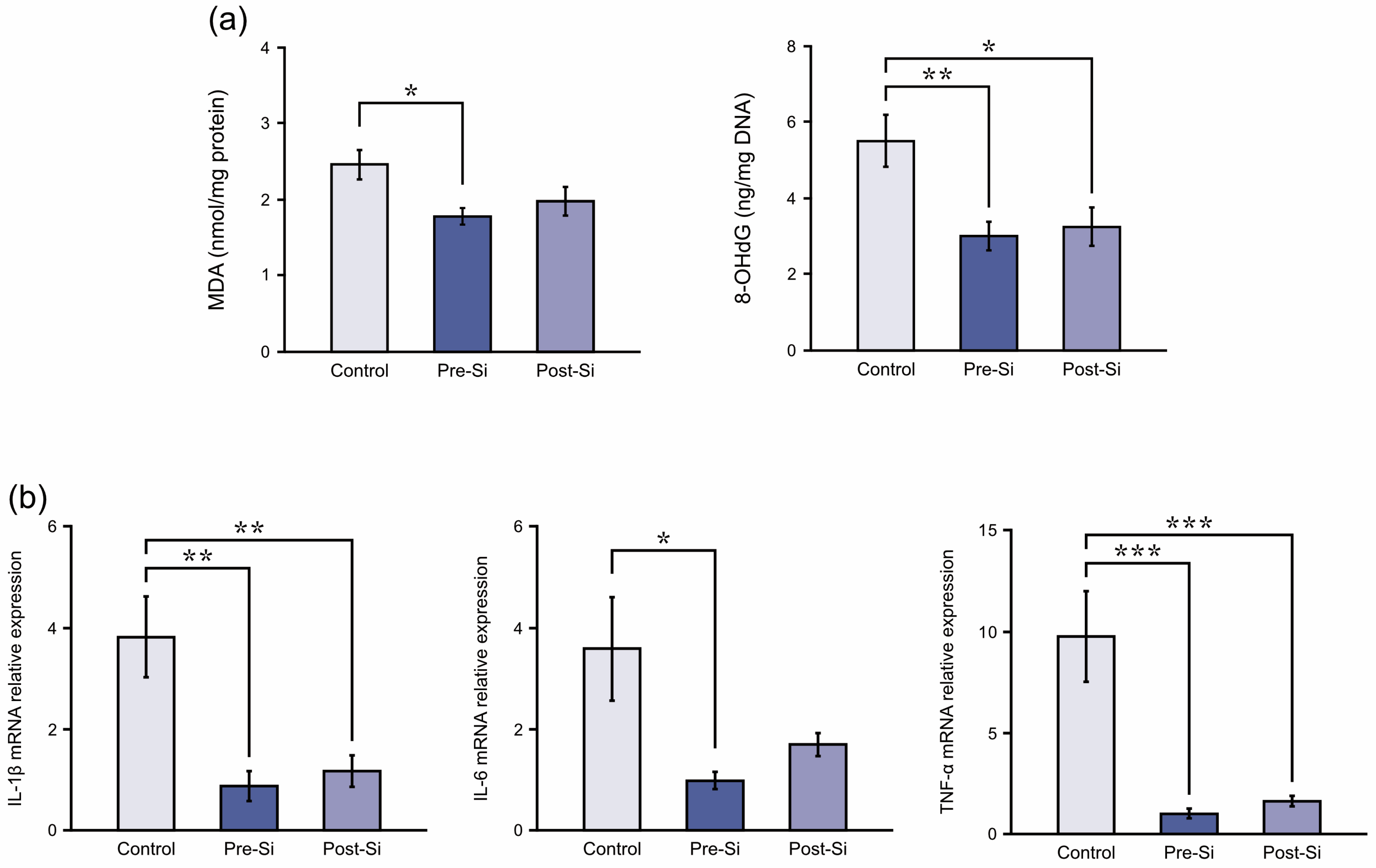
3.4 氧化应激检测结果
硅处理组小鼠的氧化应激标志物水平降低(图5a)。具体数据如下:
- **丙二醛(MDA)水平**(单位:nmol/mg蛋白):对照组为2.5±0.2,硅预处理组(pre-Si组)为1.8±0.1,硅后处理组(post-Si组)为2.0±0.2;其中硅预处理组的MDA水平显著低于对照组(p<0.05)。
- **8-羟基-2-脱氧鸟苷(8-OHdG)水平**(单位:ng/mg DNA):对照组为5.5±0.7,硅预处理组为3.0±0.4,硅后处理组为3.3±0.5;两个硅处理组的8-OHdG水平均显著低于对照组(p<0.05)。
图5
(a)各实验组小鼠在(压疮形成后)第3天的氧化应激标志物(丙二醛[MDA]和8-羟基-2-脱氧鸟苷[8-OHdG])水平(**p<0.01,*p<0.05;误差线表示均值标准误;采用图基诚实显著性差异检验;样本量n=8)。(b)各实验组小鼠在第3天的促炎细胞因子相对mRNA表达水平(***p<0.001,**p<0.01,*p<0.05;误差线表示均值标准误;采用图基诚实显著性差异检验;样本量n=8)。
3.5 炎症相关检测结果
在促炎细胞因子方面,硅基制剂处理可降低其相对mRNA表达水平(图5b)。具体而言:
- 与对照组相比,硅预处理组(pre-Si组)小鼠的白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)水平均显著降低(分别为p<0.01、p<0.05、p<0.001);
- 硅后处理组(post-Si组)小鼠的IL-1β和TNF-α水平也显著降低(分别为p<0.01、p<0.001),但IL-6水平的降低未达到统计学显著性。
上述结果表明,硅基制剂可减少溃疡组织中炎症细胞因子的表达,且预处理条件下的效果最为显著。
4 讨论
本研究结果表明,摄入硅基制剂可有效减轻压疮中的氧化应激、炎症反应及细胞凋亡活性,进而缩小溃疡面积并促进伤口早期愈合。此外,无论在施加压迫前还是压迫解除后开始口服该制剂,均能观察到上述效果——尽管硅预处理组的效果总体更明显,但两组间无统计学显著性差异。这一结果支持硅基制剂在压疮预防和治疗中的潜在有效性。
已有研究报道,氢气具有抗氧化、抗炎及抗凋亡作用[37]。此外,由于氢气扩散速度快且无毒性,即使过量给药,其产生不良反应的风险也极低[38]。这一特性使氢气相较于其他治疗制剂更具优势。近年来的研究显示,氢气对多器官的缺血再灌注损伤(IRI)[39]及压疮均具有保护作用:通过管饲富氢水,可缩小住院老年重症压疮患者的伤口面积并加速愈合[24];而吸入氢气则可抑制小鼠压疮的形成[25]。然而,采用富氢水或氢气为患者给药的方式,在剂量控制和摄入持续性方面存在问题。因此,研究人员一直致力于寻找更便捷、高效的氢气给药方法。
硅基制剂已在多种疾病的动物模型中展现出治疗效果,包括帕金森病、肾功能不全[26]、溃疡性结肠炎[33]、间质性肺炎[34]等慢性疾病,以及肾脏[28]、皮肤[29]、肠道[30]缺血再灌注损伤等急性氧化应激相关疾病。此外,对于脂肪移植[31]等需要长期治疗的疾病,传统氢气给药方式难以满足需求,而基于硅基制剂的氢气疗法被认为是可行方案。因此,对于压疮这类兼具“压迫后早期缺血再灌注损伤”与“长期慢性炎症”特征的疾病,硅基制剂可能是理想的预防和治疗药物。此外,压疮在老年人群中更为常见,口服给药的便捷性无疑是一大优势;且硅基制剂本身不被人体吸收,因过量导致副作用的担忧极小。事实上,既往研究已通过多项实验证实其安全性,包括91天重复剂量口服毒性试验(每日2000毫克/千克)、埃姆斯试验(基因突变检测)、染色体畸变试验及微核试验[26,31]。但需注意的是,目前关于硅基制剂的所有报道均基于动物研究,未来仍需开展人体临床试验。
除本研究关注的压疮外,其他难愈性溃疡(如放射性皮炎、糖尿病溃疡、烧伤溃疡、静脉淤血性溃疡)的发病机制中,也常涉及氧化应激与慢性炎症[40,41,42,43]。已有报道提示氢气疗法对压疮和放射性皮炎可能有效[44,45];尽管目前尚无氢气对其他慢性溃疡直接治疗效果的报道,但凭借其抗氧化和抗炎特性,氢气疗法仍有望对这些疾病发挥作用。而基于硅基制剂的治疗方式,能够克服传统氢气疗法在持续性方面的固有局限,为需要长期治疗的慢性疾病提供有效的氢气给药途径。未来研究应进一步评估硅基制剂在这些疾病治疗中的疗效。
本研究存在一定局限性:首先,未探讨压迫时间或硅基制剂剂量对其预防及治疗效果的影响;其次,无法直接定量摄入硅基制剂后产生的氢气量及其递送至皮肤组织的实际量。本研究中小鼠模型的压迫时间(12小时)参考了既往研究[12,13,14],但该制剂在长期或反复压迫条件下的有效性仍有待阐明。此外,本研究中硅基制剂的饲料添加浓度基于既往报道[26,33,34]确定,而已有研究表明该制剂的疗效具有剂量依赖性[33],因此仍需开展更多研究,以确定其在不同疾病模型中的最佳剂量。
5 结论
在小鼠压疮模型中,硅基制剂可有效减轻溃疡组织中的细胞凋亡、炎症反应及氧化应激。该制剂通过简单口服即可预防压疮并促进其早期愈合,且副作用极少,在未来临床应用中具有重要价值。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1506404.html?mobile=1
收藏