高效主动氢递送非药治疗放射性肠炎
放射性肠炎影响着超过90%的盆腔/腹部放疗患者,其主要诱因是辐射诱导产生的活性氧和活性氮(RONS)。具有广谱RONS清除能力的活性氢虽展现出辐射防护潜力,但受肠道黏液屏障阻碍及自身寿命较短的影响,其递送效率面临挑战。本研究制备了可口服的自热泳驱动型海藻酸钠/壳寡糖包覆氢化氧化钼纳米机器(HxMoO3@SA@COSs),该纳米机器具有近红外(NIR)驱动的定向运动能力及持续释放活性氢的特性。在雄性小鼠放射性肠炎模型中,HxMoO3@SA@COSs能够突破黏液屏障、延长肠道滞留时间,并将活性氢递送至损伤部位,实现精准的肠炎治疗。除清除RONS外,释放的活性氢还可诱导巨噬细胞向抗炎表型极化、增加杯状细胞数量并调节肠道菌群,从而促进肠道修复。这种基于活性氢的无药治疗策略在放射性肠炎治疗中展现出优异疗效。
(我的理解是,本研究将氢原子作为递送目标,实现抗氧化目的,这没有问题。但问题是用氢气的作用作为前提进行探讨,感觉不够切题。)
Yin X, Bi C, Chen Y, Hu X, Shi G, Li S, Zhang W, Ma L, Fan S, Liu L. Efficient active hydrogen delivery for drug-free radiation enteritis therapy in mice. Nat Commun. 2025 Oct 17;16(1):9229.
引言
放射治疗是癌症治疗的核心手段,超过50%的癌症患者可从中获益[1,2,3,4,5]。高能电离辐射(IR)能有效杀伤癌细胞,但也会对周围健康组织造成附带损伤[6,7,8]。这种损伤主要源于大量散射辐射以及电离过程中过量产生的活性氧和活性氮(RONS)。RONS会对核酸、脂质和蛋白质造成广泛损伤,最终引发炎症反应[9,10,11]。由于肠道上皮细胞增殖更新速度快,肠道对辐射损伤尤为敏感[12,13]。几乎所有接受盆腔或腹部放疗的患者都会出现不同程度的肠道功能障碍,表现为腹痛、腹泻、便血,严重时甚至会出现黏膜溃疡、糜烂和出血[14]。临床实践中不仅缺乏安全高效的治疗药物,广泛存在的黏液屏障也极大地阻碍了药物递送[15,16,17]。因此,放射性肠炎的治疗仍是一项重大临床挑战。
氢气(H₂)已被证实能显著缓解多种辐射诱导的病理损伤[18,19,20,21],包括胃肠道系统[22]、神经系统[23,24]、造血系统[25]损伤以及脑损伤和皮肤损伤[26,27]。这种保护作用主要归因于H₂对RONS(·OH和ONOO⁻)的选择性清除能力,进而减轻氧化应激、激活内源性抗氧化系统并缓解炎症[19,28]。此外,H₂还具有生物安全性高、组织扩散性强的特点,能够穿透至细胞及亚细胞器内部[29]。然而,作为一种惰性生理气体,H₂发挥辐射防护作用的机制仍未完全明确。近期研究表明,线粒体可能是H₂的关键作用靶点:氢分子可与铁卟啉相互作用以中和RONS[30,31]。铁卟啉作为生物催化剂,其作用类似于铂、钯等贵金属,能催化H₂转化为活性氢原子[32,33,34]。这些活性氢原子具有较低的还原电位(H⁺/H·),具备广谱RONS清除能力[35,36],这提示其在辐射损伤无药治疗中具有潜在应用价值。尽管如此,受肠道黏液屏障及活性氢寿命较短的限制[37,38],将活性氢递送至损伤部位仍极具挑战。
微/纳米马达在突破生理屏障(如黏膜屏障、上皮屏障、黏液屏障)方面展现出良好前景,可实现更高效的药物递送[39,40,41,42,43]。这种能力源于其独特的运动性能,该性能由超声、光、磁场等外部刺激驱动[44,45,46,47]。我们此前的研究表明,近红外光诱导的非对称热梯度介导热泳驱动纳米马达,凭借其强大的定向运动能力及近红外光的时空可控性,能够高效穿透生理屏障[48]。非对称热梯度的形成通常依赖于Janus结构[49,50,51],而这类结构的制备往往需要真空沉积、模板电沉积或溅射等复杂耗时的方法,导致产量低且可控性差[52,53,54]。幸运的是,热场模拟显示,在近红外激光照射下,简单的球形纳米结构也能产生非对称热梯度,从而克服了热泳驱动纳米马达在制备方面的局限性。
本研究通过湿化学法制备了可口服的球形自热泳驱动型氢化氧化钼纳米机器(HxMoO3@SA@COSs),该纳米机器表面包覆海藻酸钠和壳寡糖,具有优异的活性氢储存与高效递送能力。HxMoO3@SA@COSs具备近红外(NIR)光驱动的优异定向运动能力,且能自发、持续释放活性氢,可用于急性放射性肠炎治疗(图1)。由于活性氢具有较低的氧化还原电位(H⁺/H·,相对于标准氢电极(NHE)为-0.34 V),HxMoO3@SA@COSs展现出广谱RONS清除能力。此外,活性氢的引入显著降低了MoO3组分的禁带宽度,使其在808 nm波长下的近红外吸收增强,光热转换效率优异,可达约46.5%。体外和体内研究均表明,在808 nm近红外光照射下,HxMoO3@SA@COSs运动性能优异,能够高效穿透黏液屏障并延长在肠道内的滞留时间。令人意外的是,除高效清除细胞毒性RONS外,释放的活性氢还能诱导巨噬细胞向抗炎表型极化、增加杯状细胞数量并调节肠道菌群。总体而言,经胃内给予HxMoO3@SA@COSs后,小鼠的氧化应激和炎症水平显著降低,存活率提高且未观察到明显副作用。这些结果表明,活性氢有望成为一种优良的辐射防护剂,而HxMoO3@SA@COSs则为包括放射性肠炎在内的炎症性肠病治疗提供了新途径。
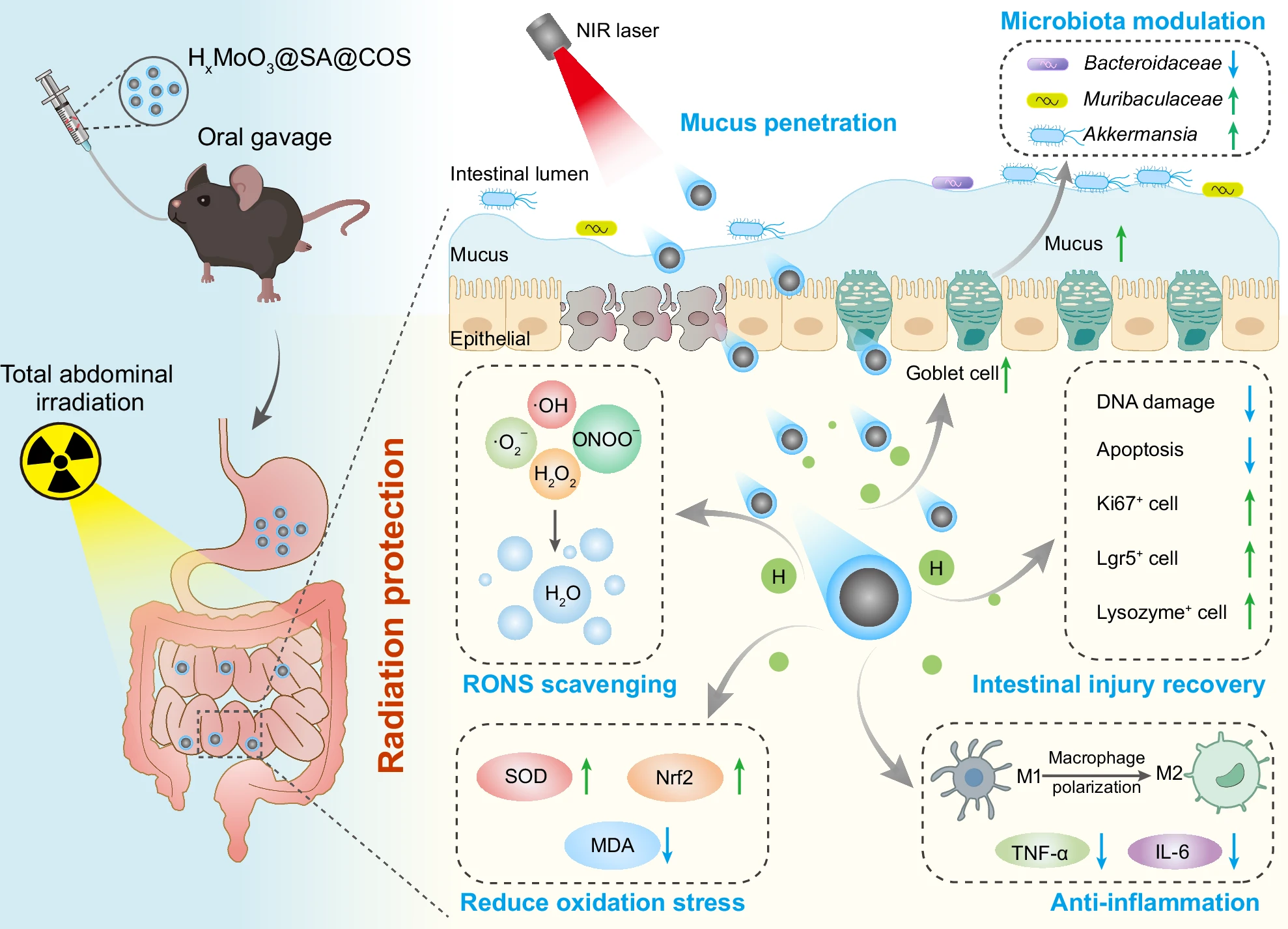
图1:近红外驱动口服HxMoO3@SA@COS纳米机器突破黏液屏障递送活性氢治疗辐射诱导急性肠炎的示意图
HxMoO3@SA@COS纳米机器不仅能高效清除RONS以减轻氧化应激,还可通过诱导巨噬细胞极化、增加杯状细胞数量及调节肠道菌群来缓解炎症,最终实现肠道修复与恢复。
结果
HxMoO3@SA@COS纳米机器的制备与表征
为构建HxMoO3@SA@COS纳米机器,首先通过柠檬酸盐辅助水热法合成了直径约200 nm的MoO3纳米球(图2a),随后参照已有方案[55,56]向MoO3纳米球中负载活性氢原子。负载氢后的MoO3(HxMoO3)纳米颗粒仍保持原始MoO3纳米球的球形结构(图2b)。高分辨率透射电子显微镜(HRTEM)图像显示,负载氢后MoO3的晶格间距从0.2 nm显著增大至0.27 nm(图2a插图、图2b插图、补充图1)。此外,MoO3水分散液在氢化后由白色变为黑色,表明氢掺杂成功(图2a插图、图2b插图)。为提高生物相容性,我们在HxMoO3纳米球表面包覆海藻酸钠(SA)和壳寡糖(COS),得到HxMoO3@SA@COS纳米材料。透射电子显微镜(TEM)图像证实生物聚合物已成功包覆在HxMoO3纳米球表面(图2c、补充图2a)。HxMoO3与HxMoO3@SA@COS的水动力学尺寸差异显著,这主要归因于聚合物涂层厚度、聚合物链伸展、静电水合诱导溶胀及HxMoO3@SA@COS纳米机器的适度组装。
zeta电位分析表明,氢化对MoO3组分的电位影响极小,提示质子与电子是成对引入的。经带负电的海藻酸钠修饰后,带负电的肠道上皮细胞对该纳米材料的摄取受到抑制。为解决这一问题,研究人员进一步在其表面修饰带正电的壳寡糖,以促进细胞摄取(补充图2b、c)。同时,为保留生物相容性良好、非特异性相互作用弱的固有优势(相较于强正电颗粒,可降低毒性风险),本研究选择略呈负电的HxMoO3@SA@COS(zeta电位为-6 mV)作为活性氢递送纳米机器。
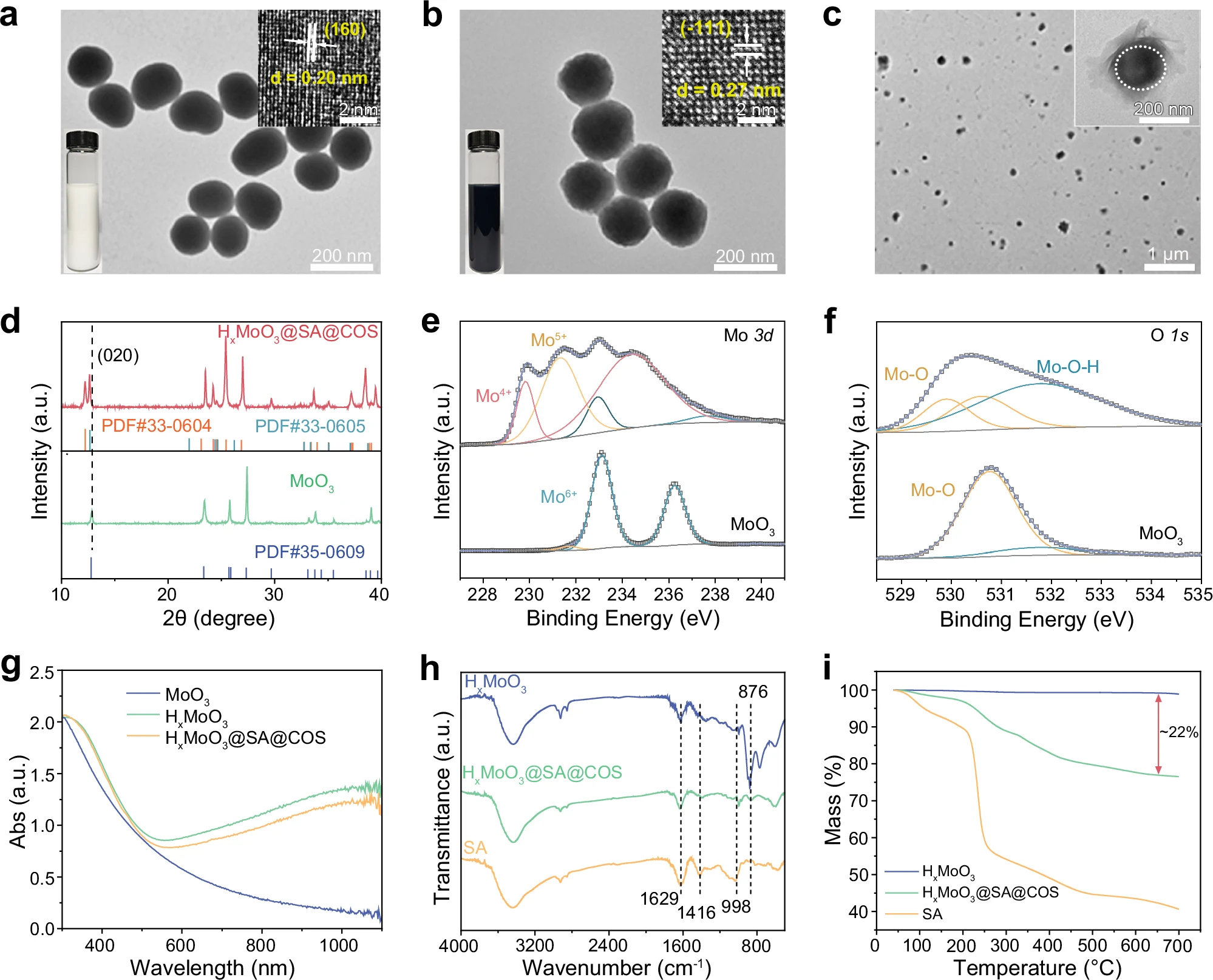
图2:HxMoO3@SA@COS纳米机器的合成与表征
a-c:合成的MoO3(a)、HxMoO3(b)和HxMoO3@SA@COS(c)的TEM图像;插图分别为三者的高分辨率TEM图像;实验独立重复三次,结果相似。d:MoO3和HxMoO3@SA@COS的X射线衍射(XRD)图谱。e、f:MoO3和HxMoO3的Mo 3d(e)和O 1s(f)轨道X射线光电子能谱(XPS)。g:MoO3、HxMoO3和HxMoO3@SA@COS水分散液的紫外-可见-近红外(UV-vis-NIR)吸收光谱。h:HxMoO3、HxMoO3@SA@COS和SA的傅里叶变换红外(FTIR)光谱。i:MoO3、HxMoO3和HxMoO3@SA@COS的热重分析(TGA)曲线。数据来源详见源数据文件。
X射线粉末衍射(XRD)证实已成功合成高结晶度的MoO3。氢化后,其衍射峰与氢掺杂氧化钼(H1.68MoO3,PDF#35-0604;H0.93MoO3,PDF#36-0605)的标准衍射峰匹配。值得注意的是,MoO3的(020)衍射峰出现轻微蓝移和峰分裂,这是由氢插入引起的晶格膨胀所致(图2d)。X射线光电子能谱(XPS)进一步显示MoO3发生部分还原,出现Mo⁴⁺和Mo⁵⁺价态(图2e、补充图3a)。氢化还使MoO3的价带向费米能级偏移,表明其电子能级发生改变(补充图3b)。O 1s光谱证实Mo-O-H键形成,验证了HxMoO3的成功制备(图2f)。固态1H核磁共振(NMR)光谱进一步证实了氢的掺入与释放:氢化后的HxMoO3出现尖锐的氢峰,与亚甲蓝(MB)完全反应后该峰消失,信号强度恢复至与原始MoO3相近水平(补充图7a)。
氢化显著增强了HxMoO3纳米球在500 nm以上波长的光吸收能力,而SA和COS包覆对其吸光度无明显影响(图2g)。傅里叶变换红外(FTIR)分析证实HxMoO3纳米球表面已成功修饰SA:在HxMoO3@SA@COS的FTIR光谱中,1629 cm⁻1、1416 cm⁻1和998 cm⁻1处出现特征峰,分别对应-COOH基团的不对称伸缩振动、对称伸缩振动和伸缩振动(图2h)。zeta电位的逐步变化表明HxMoO3纳米球已成功通过层层组装实现SA和COS修饰(补充图2b、c)。此外,热重分析(TGA)结果显示,HxMoO3@SA@COS中SA和COS的总含量约为22%(图2i)。
对于口服给药治疗肠道辐射损伤而言,纳米材料在不同胃肠道pH环境中的稳定性至关重要。研究表明,HxMoO3@SA@COS在磷酸盐缓冲液(PBS,pH 7.4)和细胞培养基中具有优异的胶体稳定性,无聚集现象(补充图4)。更重要的是,其在pH 1.2的PBS中表现出较强的耐酸性。相比之下,在pH 7.4的PBS或肠道黏膜环境(pH 6.8)中,由于碱性条件下会形成MoO₄2⁻,HxMoO3@SA@COS在24小时内会逐渐降解(补充图5、6)。这种pH响应性降解特性可避免纳米机器在体内长期蓄积,确保其在生物医学应用中的良好生物安全性。
HxMoO3@SA@COS纳米机器的RONS清除性能
具有典型层状结构的MoO3纳米球能够负载活性氢。由于活性氢具有较低的还原电位(H⁺/H·(活性氢),相对于标准氢电极(NHE)为-0.34 V),其能高效清除多种细胞毒性RONS,包括·OH、H₂O₂、·O₂⁻和ONOO⁻(图3a、b、补充图7b、补充表1)。为证实活性氢的存在及其还原能力,研究选用亚甲蓝(MB)作为探针:MB接受电子后可被还原为无色的隐色亚甲蓝(LMB),而暴露于H₂O₂时又可重新氧化为蓝色(图3c)。以MB和辅酶Q10(CoQ10)为试剂,定量分析得出HxMoO3@SA@COS中活性氢含量为1.59 μmol/g(补充图7c-j)。值得注意的是,单纯H₂无法使MB发生这种颜色变化,但引入铂纳米颗粒(Pt NPs)后,由于Pt NPs可产生活性氢,能催化MB还原为LMB[57,58]。本研究中观察到,HxMoO3@SA@COS可快速将MB还原为LMB,使溶液颜色从深蓝色变为黑色(图3d、补充视频1);加入H₂O₂后,溶液又逐渐恢复蓝色,这表明HxMoO3@SA@COS能够储存和释放活性氢,其还原活性与H₂和Pt NPs催化体系相似。紫外-可见-近红外吸收光谱中观察到的MB-LMB-MB可逆变化,进一步证实了HxMoO3@SA@COS的还原能力(图3e)。
为验证MB还原是由活性氢而非Mo价态变化驱动,研究人员合成了缺陷型MoO3-x(含Mo⁴⁺和Mo⁵⁺)(补充图7k),并通过MB脱色实验评估其作用。结果显示,MoO3-x对MB吸光度无显著影响(补充图7l),表明Mo价态变化并非MB还原的原因,进一步证实了活性氢在该过程中的关键作用。此外,研究还利用MB探针对HxMoO3@SA@COS在模拟胃液(SGF)中孵育2小时及模拟肠液(SIF)中孵育8小时后的还原活性进行评估。正如预期,HxMoO3@SA在SGF中孵育2小时和SIF中孵育8小时后,仍保持较强的还原活性(补充图8)。

图3:HxMoO3@SA@COS的RONS清除机制与效能
a HxMoO3@SA@COS清除活性氧和活性氮(RONS)的示意图。b RONS、分子氢及氢原子的标准氧化还原电位。c 亚甲蓝(MB)分子在氧化还原反应中可逆转化的示意图。d、e 照片(d)和紫外-可见-近红外光谱(e)显示,在HxMoO3@SA@COS和过氧化氢(H₂O₂)的作用下,氧化态蓝色MB与还原态无色隐色亚甲蓝(LMB)之间的转化过程。f−k 氧化钼(MoO3)和HxMoO3@SA@COS对羟基自由基(·OH)(f)、过氧化氢(H₂O₂)(g)、超氧阴离子(·O₂⁻)(h)、过氧亚硝基阴离子(ONOO⁻)(i)、自由基(j)的清除能力,以及相应的雷达对比图(k)。数据以平均值±标准差(mean±SD)表示,n=3次生物学独立实验。数据来源详见源数据文件。
HxMoO3@SA@COS具有优异且持续的还原性,能有效清除·OH、H₂O₂、·O₂⁻、ONOO⁻等RONS(图3f-i、补充图9-12)。电子自旋共振(ESR)结果进一步证实了其对·OH和·O₂⁻的清除作用(补充图6m、n)。此外,ESR光谱显示在此过程中五价钼(Mo⁵⁺)消失,这是因为氢插入后形成了Mo-OH键,羟基的吸电子效应导致钼的氧化态降低;当与RONS完全反应后,氢的脱除使钼的氧化态恢复。钼氧化态的变化趋势与氢的变化趋势一致,表明钼价态变化是由氢的插入与释放引发的(补充图6o)。
另外,通过ABTS法检测可知,HxMoO3@SA@COS具有较强的总抗氧化能力(图3j、补充图13)。对比HxMoO3@SA@COS与MoO3抗氧化能力的雷达图显示,HxMoO3@SA@COS具备广谱RONS清除能力(图3k)。此外,在磷酸盐缓冲液(PBS)中未检测到HxMoO3@SA体系释放氢气,表明其作用源于活性氢(补充图14)。
研究人员在不同温度(25℃和-20℃)下,对9天内HxMoO3@SA@COS降解MB的能力进行了监测(补充图15)。结果显示,在两种温度下放置9天后,HxMoO3@SA@COS仍保留约80%的还原活性。综上,HxMoO3@SA@COS优异、稳定且长效的还原性使其具备出色的RONS清除能力,在缓解氧化应激方面极具应用前景。
HxMoO3@SA@COS纳米机器的光热性能与运动能力
通过Tauc法计算可知,氢掺杂后HxMoO3@SA@COS的禁带宽度从2.55 eV显著降至0.52 eV,表明其在近红外(NIR)区域的光吸收能力增强(图4a),这与氢掺杂前后样品的紫外-可见-近红外吸收光谱结果高度一致(图2g)。
将浓度为0.2 mg/mL的HxMoO3@SA@COS水分散液置于808 nm激光(功率密度1 W·cm⁻2)下照射,10分钟内体系温度升高32℃,展现出优异的光热性能(图4b)。与其他光热剂类似,HxMoO3@SA@COS的光热性能对浓度和光功率具有显著依赖性(补充图16)。根据加热-冷却曲线的冷却阶段计算得出,HxMoO3@SA@COS的光热转换效率约为46.5%(图4c)。此外,经过5次加热-冷却循环后,HxMoO3@SA@COS的光热性能仍保持稳定,体现出卓越的光热稳定性(图4d)。
研究人员以不同厚度的鸡胸肉组织为屏障,通过红外热成像评估近红外光的组织穿透深度(图4e)。此前研究已证实,波长在650-950 nm范围内的近红外光在组织中的最大穿透深度约为10 mm[59,60]。与此一致的是,808 nm激光可穿透5 mm厚的鸡胸肉组织并使体系温度升高约10℃(图4f、g),表明808 nm近红外光具有优异的组织穿透性,适用于体内生物医学应用。
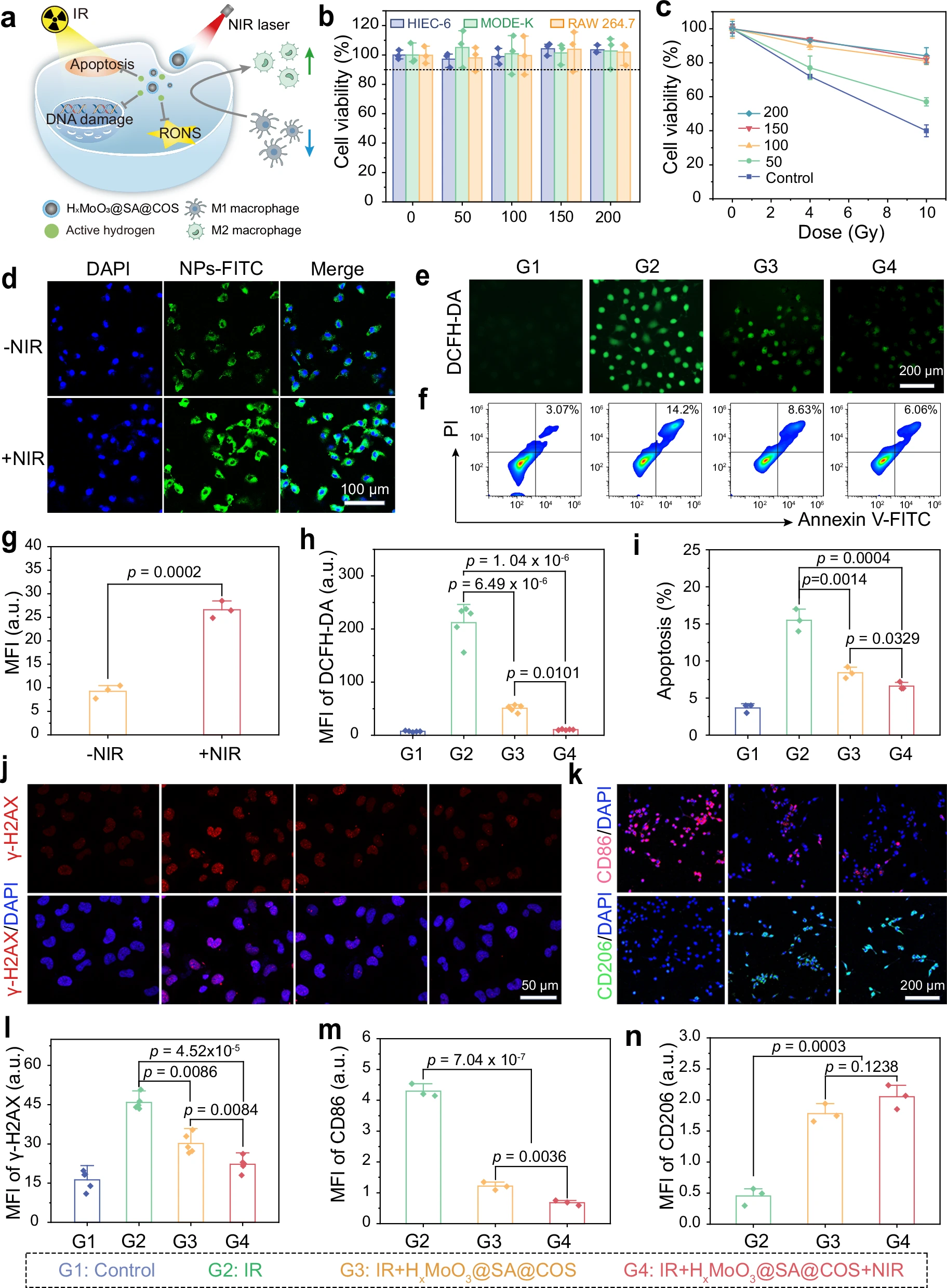
图4:HxMoO3@SA@COS纳米机器的光热性能与运动能力
a MoO3和HxMoO3@SA@COS的Tauc图(用于测定禁带宽度)。b 去离子水、MoO3和HxMoO3@SA@COS(浓度200 μg/mL)在808 nm激光(1 W·cm⁻2)照射下的温度变化曲线。c 808 nm激光(1 W·cm⁻2)照射下HxMoO3@SA@COS光热转换效率(η)的计算过程。d HxMoO3@SA@COS(200 μg/mL)在多次808 nm激光开启/关闭循环中的光热稳定性。e 808 nm光穿透不同厚度组织后诱导温度升高的示意图。f、g 不同组织厚度下,HxMoO3@SA@COS水分散液在808 nm激光照射下的红外热成像图(f)及相应温度变化(g)。h HxMoO3@SA@COS温度分布的模拟图。i 近红外光诱导HxMoO3@SA@COS纳米机器自热泳运动的示意图。j 以MB为指示剂观察近红外光驱动HxMoO3@SA@COS运动的代表性照片。k 琼脂糖凝胶浓度与黏度的关系曲线,误差棒表示标准差,n=3次独立重复实验。l 不同黏度琼脂糖凝胶中,近红外光驱动HxMoO3@SA@COS纳米机器运动的照片。数据来源详见源数据文件。
鉴于HxMoO3@SA@COS优异的光热性能,研究人员进一步分析了其在808 nm光驱动下的体外运动能力。有限元模拟显示,808 nm光照射可在200 nm的HxMoO3纳米球表面形成非对称热场(图4h),这表明除非对称纳米结构外,球形HxMoO3纳米颗粒也可通过自热泳实现强推进运动(图4i)。
研究人员将HxMoO3@SA@COS注入比色皿底部,以MB为指示剂评估其在808 nm光下的定向运动能力。有趣的是,近红外光照射下,HxMoO3@SA@COS呈现出弹道式运动轨迹,运动速度可达约2058 μm/s(图4j、补充视频2、补充图17)。近红外光照射6分钟后,体系的蓝色完全褪去,这主要是因为纳米机器运动过程中释放的活性氢对MB分子的还原速率显著提升。这种运动能力不仅使HxMoO3@SA@COS能够突破肠道屏障,还能大幅加速RONS清除过程。
研究人员以琼脂糖凝胶模拟肠道黏液,探究了808 nm光驱动下HxMoO3@SA在不同黏度溶液中的运动能力。结果显示,HxMoO3@SA@COS纳米机器在琼脂糖凝胶中的运动速度(mm/s)与凝胶黏度呈反比(补充图18)。图4k展示了黏度与浓度的关系,已有研究报道小肠黏膜黏度范围为10-19 mPa·s[61]。值得注意的是,在黏度为26.5 mPa·s的琼脂糖凝胶中,近红外光照射3分钟内,HxMoO3@SA@COS仍能实现优异的定向运动,运动距离约为23 mm(图4l、补充图19、补充视频3)。这种强大的机械运动能力使HxMoO3@SA@COS能够有效穿透肠道黏液屏障,将活性氢递送至难以触及的损伤部位。
综上,结构简单的球形HxMoO3@SA@COS纳米机器展现出优异的近红外光驱动运动能力,可与已报道的Janus结构自热泳驱动微/纳米马达相媲美,这显著提升了其实际应用潜力。作为概念验证,本实验采用了文献中广泛使用的808 nm激光;考虑到HxMoO3@SA@COS在近红外区域具有宽吸收特性,为进一步探索其在深层组织中的应用潜力,研究人员还采用1064 nm和1550 nm激光驱动HxMoO3@SA@COS运动。结果显示,1064 nm和1550 nm激光均可驱动HxMoO3@SA@COS快速运动,进一步证明其在深层组织应用中的潜力(补充图20、补充视频4)。
HxMoO3@SA@COS纳米机器的体外辐射防护作用
HxMoO3@SA@COS纳米机器具备出色的RONS清除能力和优异的运动性能,是肠道辐射防护的理想候选材料。为在细胞水平进一步探究其辐射防护效果及作用机制,研究人员对其RONS清除能力、细胞凋亡抑制作用、DNA损伤保护作用及巨噬细胞极化调节作用进行了评估(图5a)。
通过CCK-8法检测细胞毒性发现,HxMoO3@SA@COS在HIEC-6(人小肠上皮细胞)、MODE-K(小鼠小肠上皮细胞)和RAW264.7(小鼠巨噬细胞)三种细胞系中均表现出优异的生物相容性,即使在高浓度下,细胞存活率仍超过90%(图5b)。
值得注意的是,CCK-8法检测结果显示,HxMoO3@SA@COS对HIEC-6细胞的急性辐射损伤具有显著防护作用(图5c):经4 Gy或10 Gy辐射后,细胞存活率显著下降,而经HxMoO3@SA@COS处理的细胞存活率更高,表明其能有效保护细胞免受辐射诱导的凋亡。此外,近红外光驱动的HxMoO3@SA@COS运动可增强其穿透细胞膜的能力,进而提高细胞内吞效率(图5d、g、补充图21)。通过电感耦合等离子体质谱(ICP-MS)进行的定量内吞分析显示,得益于纳米机器的运动能力,细胞对其摄取量提升了2.3倍(补充图22)。这种内吞效率的提升将显著增强RONS清除效果,并更好地抑制细胞凋亡。
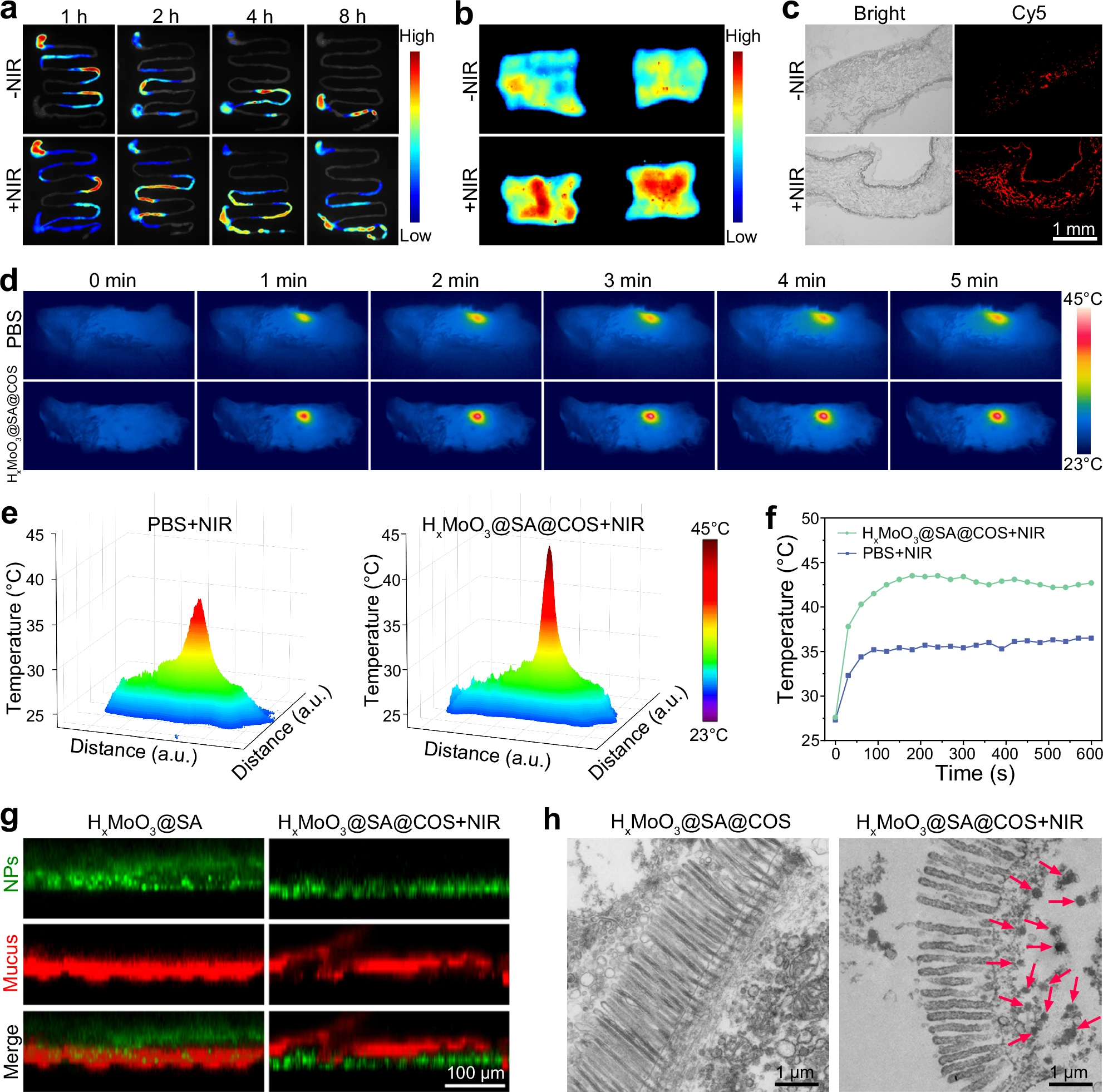
图5:HxMoO3@SA@COS纳米机器的体外辐射防护效果及机制
a HxMoO3@SA@COS纳米机器辐射防护机制的示意图。b 不同浓度HxMoO3@SA@COS处理后,HIEC-6、MODE-K和RAW264.7细胞的存活率。c 不同辐射剂量下,HxMoO3@SA@COS对HIEC-6细胞的辐射防护效果,与对照组相比具有统计学显著性。d−i 代表性荧光图像显示HxMoO3@SA@COS的细胞摄取情况(d)和不同处理条件下HIEC-6细胞内活性氧(ROS)水平(e);通过Annexin V-FITC/PI染色流式细胞术分析(f)评估细胞凋亡和坏死情况,并对FITC平均荧光强度(MFI)(g)、DCFH-DA平均荧光强度(h)及细胞凋亡率(i)进行定量分析。实验独立重复三次(d)或五次(e),结果相似。j、l γ-H2AX免疫荧光图像显示DNA双链断裂情况(j)及相应定量结果(l)。k−n 巨噬细胞极化情况:通过CD86(M1型巨噬细胞标志物)和CD206(M2型巨噬细胞标志物)的表达进行观察(k),并对结果进行定量分析(m、n)。n=3次(b−n)或n=5次(h、l)生物学独立重复实验,数据以平均值±标准差(mean±SD)表示,采用单因素方差分析(one way ANOVA)和Tukey多重比较检验进行统计分析。数据来源详见源数据文件。
研究人员采用DCFH-DA荧光探针评估HxMoO3@SA@COS的细胞内RONS清除能力(图5e、h)。经4 Gy辐射后,细胞内绿色荧光信号显著增强,表明RONS水平升高;而预先用HxMoO3@SA@COS处理可显著降低荧光信号,证明其能有效清除过量产生的RONS。值得注意的是,“辐射+HxMoO3@SA@COS+近红外光”组的荧光强度显著低于“辐射+HxMoO3@SA@COS”组,且接近对照组水平,这表明近红外光驱动的HxMoO3@SA@COS运动可通过增强细胞内吞效率,进一步提升RONS清除效果。
此外,辐射会诱导细胞产生氧化应激,进而引发凋亡、铁死亡等多种形式的细胞死亡。Annexin V-FITC/PI流式细胞术结果显示,HxMoO3@SA@COS可显著减少辐射诱导的细胞凋亡,且“辐射+HxMoO3@SA@COS+近红外光”组对细胞凋亡的抑制效果优于“辐射+HxMoO3@SA@COS”组(图5f、i、补充图23)。通过检测与铁死亡相关的脂质过氧化标志物(如丙二醛MDA和4-羟基壬烯醛4-HNE)发现,辐射会导致这些标志物水平显著升高,而经HxMoO3@SA@COS处理的组中,标志物水平与对照组相近(补充图24a、b),这表明HxMoO3@SA@COS可能在缓解辐射诱导的铁死亡方面具有潜在作用。
对对照组、辐射组和“辐射+HxMoO3@SA@COS”组细胞切片的观察发现,辐射组细胞的线粒体出现明显空泡化和损伤,而“辐射+HxMoO3@SA@COS”组细胞的线粒体则相对完整,这进一步证实辐射会诱导铁死亡,且HxMoO3@SA@COS可缓解该效应(补充图24c)。
在4 Gy辐射剂量下的γ-H2AX免疫荧光染色结果(图5j、l)证实,HxMoO3@SA@COS可显著减轻DNA损伤,其中“辐射+HxMoO3@SA@COS+近红外光”组对DNA损伤的保护效果最佳。
令人意外的是,研究人员发现活性氢可促进巨噬细胞从促炎的M1型向抗炎的M2型极化——这是放射性肠炎治疗中减轻炎症的关键机制。通过对M1型标志物CD86和M2型标志物CD206进行免疫荧光染色,研究人员评估了巨噬细胞的极化情况(图5k、m、n):辐射后可检测到强CD86信号,表明大部分RAW264.7细胞为M1型,这与炎症水平升高相关;而经HxMoO3@SA@COS处理后,CD86信号显著减弱,CD206信号显著增强,表明HxMoO3@SA@COS释放的活性氢在免疫调节中发挥关键作用。
已有研究表明,热可诱导巨噬细胞从M1型向M2型转化[62]。因此,在“辐射+HxMoO3@SA@COS+近红外光”组中,近红外光照射进一步降低了CD86的表达,并增强了CD206的表达。对其他M2型标志物(CD163、Arg1)的免疫荧光染色结果也进一步支持这一结论(补充图25)。
为探究HxMoO3@SA@COS的长期防护作用,研究人员进行了集落形成实验。细胞形成集落的能力依赖于正常的增殖能力,这在一定程度上可反映DNA损伤情况和长期防护效果。实验结果显示,辐射后细胞的集落形成能力显著下降,而经HxMoO3@SA@COS保护的细胞,其集落形成能力显著提升(补充图26),表明HxMoO3@SA@COS可提供全面的辐射防护,有效缓解辐射对细胞增殖的抑制作用。
综上,HxMoO3@SA@COS纳米机器通过结合优异的RONS清除能力、强效的免疫调节作用以及运动增强的细胞内吞效率,可减轻氧化应激、抑制细胞凋亡并减少辐射诱导的DNA损伤,从而对放射性肠炎发挥显著的防护作用。
HxMoO3@SA@COS纳米机器在体内的运动增强穿透作用
图4展示了HxMoO3@SA@COS纳米机器在近红外光(NIR)照射下优异的光热性能和体外定向运动能力。为进一步探究其在体内的运动增强穿透效果,我们以C57BL/6J小鼠为研究对象开展实验。给小鼠口服Cy5标记的HxMoO3@SA@COS后1小时,对其进行3轮808nm近红外光照射(每轮照射10分钟,间隔10分钟,功率密度为1.0 W·cm⁻2)。在不同时间点提取小鼠肠道,利用活体成像系统进行成像。结果显示,与未接受近红外光照射的小鼠相比,接受近红外光照射的小鼠肠道内HxMoO3@SA@COS的滞留量显著更高(图6a)。
为定量分析近红外光对HxMoO3@SA@COS滞留的增强作用,我们开展了更详细的实验:小鼠口服HxMoO3@SA@COS后2小时进行近红外光照射,分别在2、4、8小时时采集小鼠肠道荧光图像(n=4)。通过成像软件对小肠内总荧光强度进行定量分析发现,4小时和8小时的“+近红外光”组荧光信号显著高于相应的“-近红外光”组,进一步证实近红外光可增强HxMoO3@SA@COS在肠道内的滞留(补充图27)。在近红外光照射下,HxMoO3@SA@COS在小肠内的滞留时间最长可达8小时,且在其他器官中的蓄积量极少(补充图28)。用HEPES缓冲液彻底冲洗后,对部分肠段进行成像,结果显示近红外光照射组的荧光强度显著高于未照射组(图6b、补充图29)。这些观察结果证实,近红外光照射可显著增强HxMoO3@SA@COS在肠道内的滞留。此外,在给药后8小时获取的小肠冰冻切片进一步验证了这一发现:近红外光照射组的荧光强度明显强于未照射组(图6c)。上述结果表明,在近红外光刺激下,HxMoO3@SA@COS的定向运动能力可有效延长其在肠道内的滞留时间,从而提升活性氢在放射性肠炎治疗中的疗效。
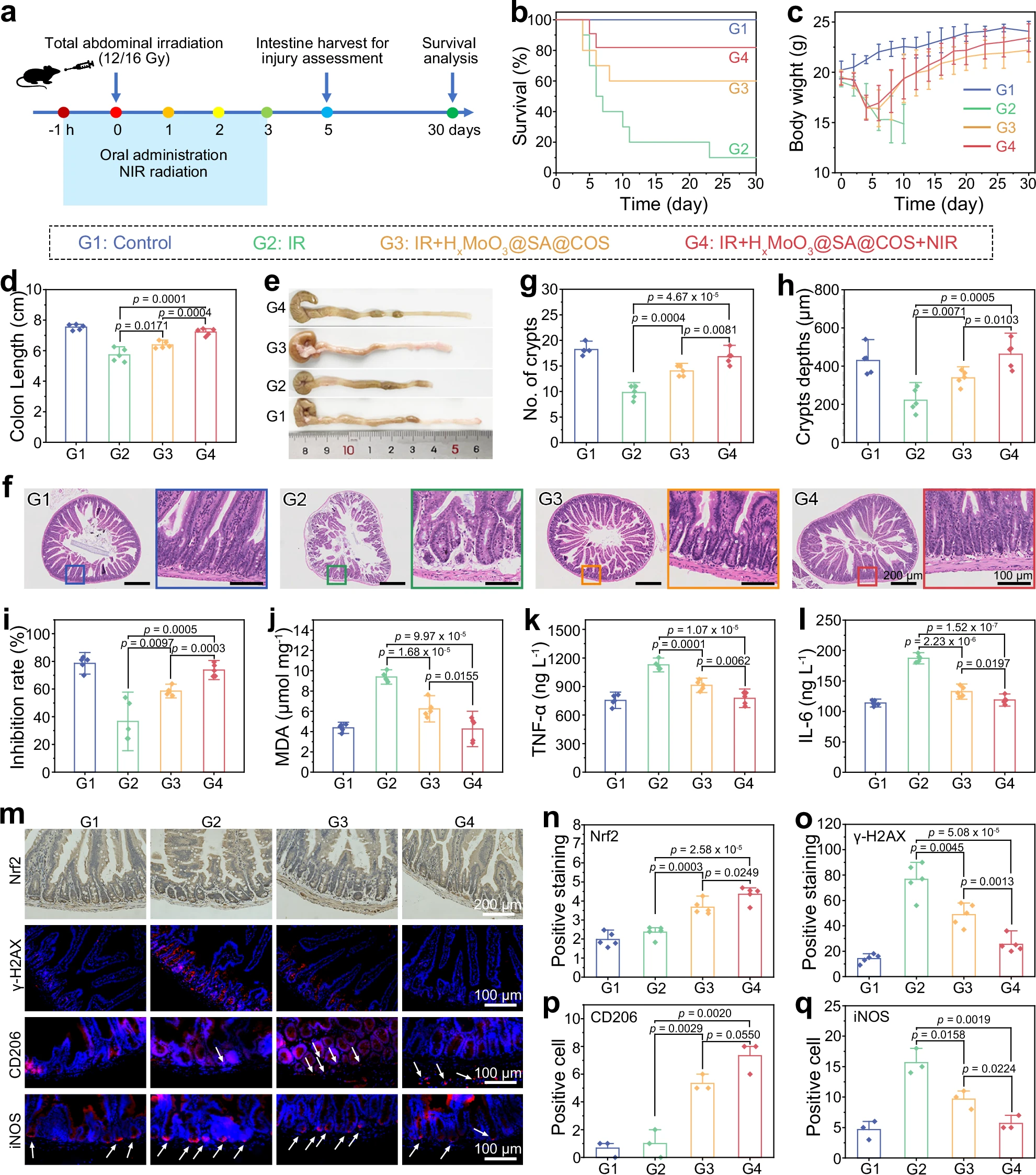
图6:体内运动增强的肠道屏障穿透作用
a、b 灌胃后不同时间点,HxMoO3@SA@COS在有无近红外光照射下于胃肠道(a)及冲洗后肠组织(b)中的荧光成像。c 小鼠灌胃HxMoO3@SA@COS后8小时小肠冰冻切片的荧光图像。d−f 口服HxMoO3@SA@COS或PBS的C57BL/6J小鼠在808nm激光照射下的红外热成像(d)、相应的3D热图(e)及温度变化曲线(f)。g 有无近红外光照射时,HxMoO3@SA@COS穿透肠黏液的荧光图像。h HxMoO3@SA@COS在肠袢和绒毛中的透射电子显微镜(TEM)图像,近红外光照射可增强其穿透能力(红色箭头指示HxMoO3@SA@COS)。实验(c−h)独立重复三次,结果相似。数据来源详见源数据文件。
为验证808nm光能否在小鼠肠道内驱动HxMoO3@SA@COS纳米机器运动,我们在小鼠口服HxMoO3@SA@COS后1小时,利用红外热像仪监测其腹部温度变化。正如预期,HxMoO3@SA@COS组的腹部温度明显高于PBS组,这表明808nm光能够穿透机体组织,并被肠道内的HxMoO3@SA@COS吸收(图6d、e)。HxMoO3@SA@COS组的最高温度可达约42.5℃,而PBS组约为35.0℃,两者相差7.5℃,温差显著(图6f)。该结果证实,体外施加的808nm光可有效驱动HxMoO3@SA@COS纳米机器穿透肠黏液屏障,从而将活性氢靶向递送至原本难以触及的损伤部位。
我们还探究了HxMoO3@SA@COS在离体肠组织中的穿透能力:将HxMoO3@SA@COS纳米机器置于肠组织表面,随后进行近红外光照射。利用FITC标记的HxMoO3@SA@COS和罗丹明标记的麦胚凝集素对肠黏液进行染色,激光共聚焦扫描显微镜(CLSM)图像清晰显示,在近红外光驱动下,HxMoO3@SA@COS的定向运动使其成功穿透黏液屏障(图6g)。透射电子显微镜(TEM)结果进一步证实,在近红外光驱动下,这些纳米机器可穿透黏液层并进入肠上皮细胞;而未接受近红外光照射的HxMoO3@SA@COS,大部分在冲洗过程中被清除(图6h)。这种独特的运动能力为肠道疾病治疗提供了极具前景的方案,因为它不仅能提高纳米机器在肠道内的滞留量,还有助于突破胃肠道黏液屏障。
HxMoO3@SA@COS纳米机器对放射性肠炎的体内保护作用
在胃肠道肿瘤患者的放射治疗中,癌细胞和正常细胞都可能受到辐射损伤。为验证辐射造成的DNA损伤,我们对结直肠癌细胞(CT26)和肠上皮细胞(HIEC-6)进行了彗星实验。结果显示,CT26细胞和HIEC-6细胞均形成了清晰的彗星图像,表明辐射会同时诱导癌细胞和正常细胞发生DNA损伤(补充图30)。
对HIEC-6细胞中免疫原性细胞死亡(ICD)标志物的进一步分析发现,辐射处理后,与对照组相比,发生ICD的辐射组细胞中,细胞核内高迁移率族蛋白1(HMGB1)表达降低,细胞质中HMGB1表达升高;同时,细胞质中钙网蛋白(CRT)表达显著增加(补充图31a、b)。对受辐射小鼠小肠组织中HMGB1和CRT的免疫组化(IHC)检测结果进一步证实了这一现象(补充图31c、d)。这些结果表明,在放射治疗过程中,辐射不仅会诱导正常细胞发生DNA损伤,还会引发免疫原性细胞死亡,这可能是辐射对正常组织产生严重副作用的原因之一。
鉴于HxMoO3@SA@COS纳米机器具有优异的辐射防护效果、延长的肠道滞留时间及增强的黏液屏障穿透能力,我们进一步探究了其对C57BL/6J小鼠急性放射性肠炎的保护作用。为评估HxMoO3@SA@COS的口服安全性,我们给小鼠连续3天每日口服40mg/kg的HxMoO3@SA@COS。在14天的观察期内,小鼠体重增长趋势与对照组相近(补充图32);14天时对主要器官的组织学评估和血液检测均未发现明显异常,表明口服HxMoO3@SA@COS对小鼠血液学指标及肝肾功能无不良影响(补充图33、34)。
实验采用16Gy γ射线全腹照射(TAI)的致死剂量来评估小鼠存活率,采用12Gy γ射线全腹照射构建急性肠损伤模型。将C57BL/6J小鼠分为4组:对照组、辐射组(IR)、辐射+HxMoO3@SA@COS组(IR+HxMoO3@SA@COS)、辐射+HxMoO3@SA@COS+近红外光组(IR+HxMoO3@SA@COS+NIR),每组10只小鼠。小鼠在γ射线照射前口服40mg/kg的HxMoO3@SA@COS,随后继续治疗3天;在每次治疗后1小时进行近红外光照射,每轮照射10分钟,共3轮(图7a)。
结果如图7b所示:辐射组小鼠30天存活率仅为10%;辐射+HxMoO3@SA@COS组存活率显著提高,达46.5%;辐射+HxMoO3@SA@COS+近红外光组的辐射防护效果最佳,存活率高达80%,这与体外实验结果一致。体重监测显示,辐射组小鼠体重急剧下降,而辐射+HxMoO3@SA@COS组和辐射+HxMoO3@SA@COS+近红外光组从第6天开始体重持续增长,表明接受治疗的小鼠已开始恢复(图7c)。
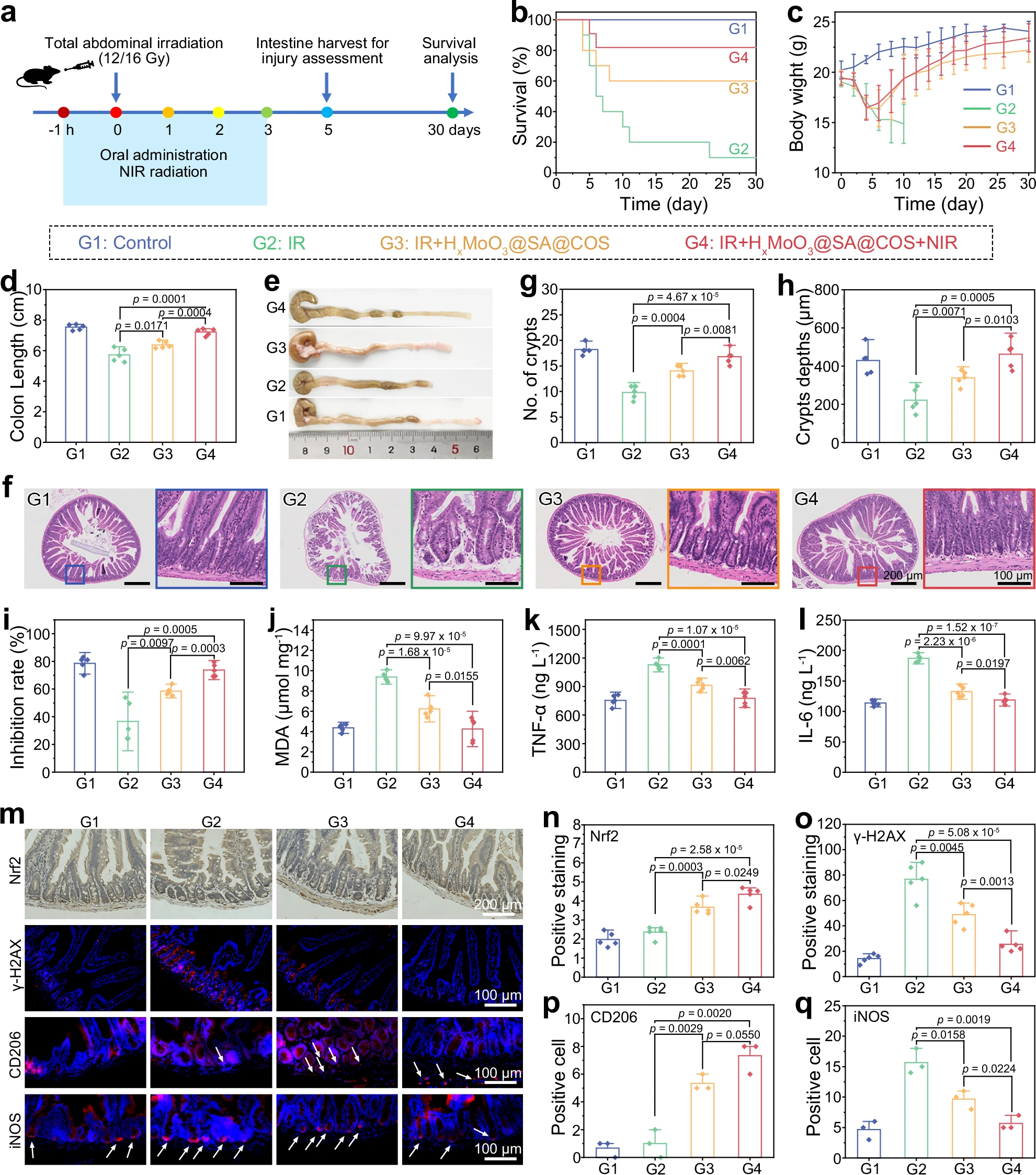
图7:对放射性肠炎的体内辐射防护作用
a 体内辐射防护效果评估的示意图。b、c C57BL/6J小鼠在30天内不同处理组的存活率(b)和体重变化(c)(16Gy照射,n=10)。数据以平均值±标准差(mean±SD)表示,n=3次独立实验。d−f 治疗后5天结肠组织的HE染色照片(d),及隐窝数量(e)和隐窝深度(f)的定量分析。g−j 不同处理组肠道超氧化物歧化酶(SOD)活性(g)、丙二醛(MDA)水平(h)及细胞因子肿瘤坏死因子-α(TNF-α)(i)、白细胞介素-6(IL-6)(j)的分析结果。k−o 免疫组化(IHC)和免疫荧光(IF)分析:包括肠组织的代表性染色图像(k),以及核因子E2相关因子2(Nrf2)(l)、γ-H2AX(m)、CD206(n)、诱导型一氧化氮合酶(iNOS)(o)的定量检测结果。n=3次(p、q)或n=5次(d−o)生物学独立重复实验,数据以平均值±标准差(mean±SD)表示,采用单因素方差分析(one way ANOVA)和Tukey多重比较检验进行统计分析。数据来源详见源数据文件。
我们系统探究了HxMoO3@SA@COS对12Gy γ射线全腹照射小鼠急性辐射损伤的防护作用。以结肠长度作为肠道炎症的标志物:与对照组相比,辐射组小鼠结肠显著缩短;而HxMoO3@SA@COS处理组小鼠结肠长度得以恢复,其中近红外光照射组效果最佳,这表明近红外光介导的运动发挥了关键作用(图7d、e)。
对小肠组织的HE染色分析进一步显示,辐射组小鼠小肠出现绒毛萎缩、结构紊乱及明显的炎症细胞浸润(图7f−h);而辐射+HxMoO3@SA@COS组和辐射+HxMoO3@SA@COS+近红外光组小鼠肠道绒毛结构保留完整,黏膜损伤轻微,隐窝结构排列整齐,且隐窝数量和深度均恢复良好,体现出强大的肠道保护作用。
我们还探究了HxMoO3@SA@COS在体内的抗氧化和抗炎特性:以超氧化物歧化酶(SOD)活性和丙二醛(MDA)水平作为氧化应激指标。结果显示,辐射组小鼠抗氧化能力显著下降;而HxMoO3@SA@COS处理组由于其强大的RONS清除能力和免疫调节作用,SOD活性明显恢复,MDA水平降低(图7i、j)。为进一步探究肠道内的抗氧化环境,我们采用ELISA试剂盒检测小肠和大肠中氧化应激标志物3-硝基酪氨酸(3-NT)和4-羟基壬烯醛(4-HNE)的水平。结果显示,辐射会导致小肠和大肠中3-NT和4-HNE水平升高,而HxMoO3@SA@COS处理可降低二者的表达,进一步证实其能改善肠道内的抗氧化环境(补充图35)。
酶联免疫吸附实验(ELISA)结果表明,HxMoO3@SA@COS处理可显著降低辐射损伤肠组织中炎症细胞因子TNF-α和IL-6的表达(图7k、l)。其中,辐射+HxMoO3@SA@COS+近红外光组的抗氧化和抗炎效果优于辐射+HxMoO3@SA@COS组,这是因为近红外光驱动的运动增强了活性氢向损伤部位的精准递送。综上,HxMoO3@SA@COS纳米机器对C57BL/6J小鼠急性辐射诱导的肠损伤具有优异的治疗效果,而近红外光增强的运动能力进一步提升了其疗效,为利用活性氢和精准递送疗法治疗放射性肠炎提供了一种极具前景的无药策略。
我们对小鼠小肠组织进行了免疫组化(IHC)和免疫荧光(IF)分析,以评估HxMoO3@SA@COS的辐射防护作用,重点关注其抗氧化应激反应、抗DNA损伤能力及对巨噬细胞极化的影响:
- 抗氧化通路关键调控因子Nrf2:对照组中Nrf2表达较低;辐射后Nrf2水平略有升高,表明机体启动了氧化应激反应;而辐射+HxMoO3@SA@COS组和辐射+HxMoO3@SA@COS+近红外光组中Nrf2表达显著升高,提示HxMoO3@SA@COS可进一步激活Nrf2通路,以对抗辐射诱导的氧化应激。
- DNA损伤标志物γ-H2AX:辐射组中γ-H2AX水平较高,表明存在严重的DNA损伤;而辐射+HxMoO3@SA@COS组和辐射+HxMoO3@SA@COS+近红外光组中γ-H2AX水平显著降低,这可能是由于HxMoO3@SA@COS的广谱RONS清除能力减轻了RONS诱导的DNA损伤。
- 巨噬细胞极化标志物:免疫荧光染色显示,辐射组中促炎M1型巨噬细胞标志物iNOS信号增强;而辐射+HxMoO3@SA@COS组和辐射+HxMoO3@SA@COS+近红外光组中iNOS表达显著降低。此外,HxMoO3@SA@COS处理可显著上调抗炎M2型巨噬细胞标志物CD206的表达,其中辐射+HxMoO3@SA@COS+近红外光组CD206表达最高、iNOS信号最低,表明HxMoO3@SA@COS可促进巨噬细胞向抗炎M2型极化,而近红外光起到了协同增强作用。
上述结果与体外实验结果(图5m−q)一致,凸显了活性氢诱导的免疫调节在抗炎过程中的创新性作用。此外,对转化生长因子-β(TGF-β)的免疫组化结果显示,HxMoO3@SA@COS可显著下调辐射诱导的TGF-β表达升高(补充图36),表明其有助于预防肠组织纤维化。这些结果充分证明了HxMoO3@SA@COS纳米机器在辐射防护方面的巨大潜力。
对急性放射性肠炎小鼠模型的小肠组织进行免疫组化(IHC)染色,以评估不同处理方式下的肠道修复情况。
TUNEL染色结果显示,12 Gy高剂量γ射线全腹照射(TAI)会诱导肠上皮细胞发生严重凋亡,而使用HxMoO3@SA@COS纳米机器可显著抑制细胞凋亡(图8a-b)。值得注意的是,“辐射+HxMoO3@SA@COS+近红外光”组的辐射防护效果最佳,与上述结果(图7)高度一致。过碘酸-希夫(PAS)染色结果表明,辐射会大幅减少杯状细胞的数量(杯状细胞负责在肠绒毛中分泌黏蛋白);而经HxMoO3@SA@COS或“HxMoO3@SA@COS+近红外光”处理后,杯状细胞数量显著恢复,进而促进黏蛋白分泌并保护上皮层(图8c-d)。杯状细胞对重建肠黏液屏障、防止细菌入侵至关重要:辐射组中杯状细胞数量的轻微增加可能与疼痛感受器释放神经递质有关,这种递质或可促进杯状细胞分化[63];而“辐射+HxMoO3@SA@COS”组和“辐射+HxMoO3@SA@COS+近红外光”组中杯状细胞的显著增多,可能是活性氢或热刺激对疼痛感受器产生调节作用的结果。
Lgr5(小肠干细胞标志物)和Ki67(细胞增殖标志物)染色结果显示,辐射会严重损伤肠隐窝,阻碍上皮细胞的增殖与分化(图8e-h);而经HxMoO3@SA@COS或“HxMoO3@SA@COS+近红外光”处理后,上皮细胞的增殖能力得到有效恢复,有助于损伤后的肠道再生。尤其值得注意的是,“辐射+HxMoO3@SA@COS+近红外光”组的恢复程度几乎与对照组相当。此外,潘氏细胞(肠道分泌细胞)数量的增加,进一步表明HxMoO3@SA@COS处理后肠道修复过程正在持续进行(图8i-j)。综上,这些结果证实了HxMoO3@SA@COS纳米机器在减轻辐射诱导肠损伤方面具有优异的辐射防护效果,凸显了其良好的临床应用潜力。
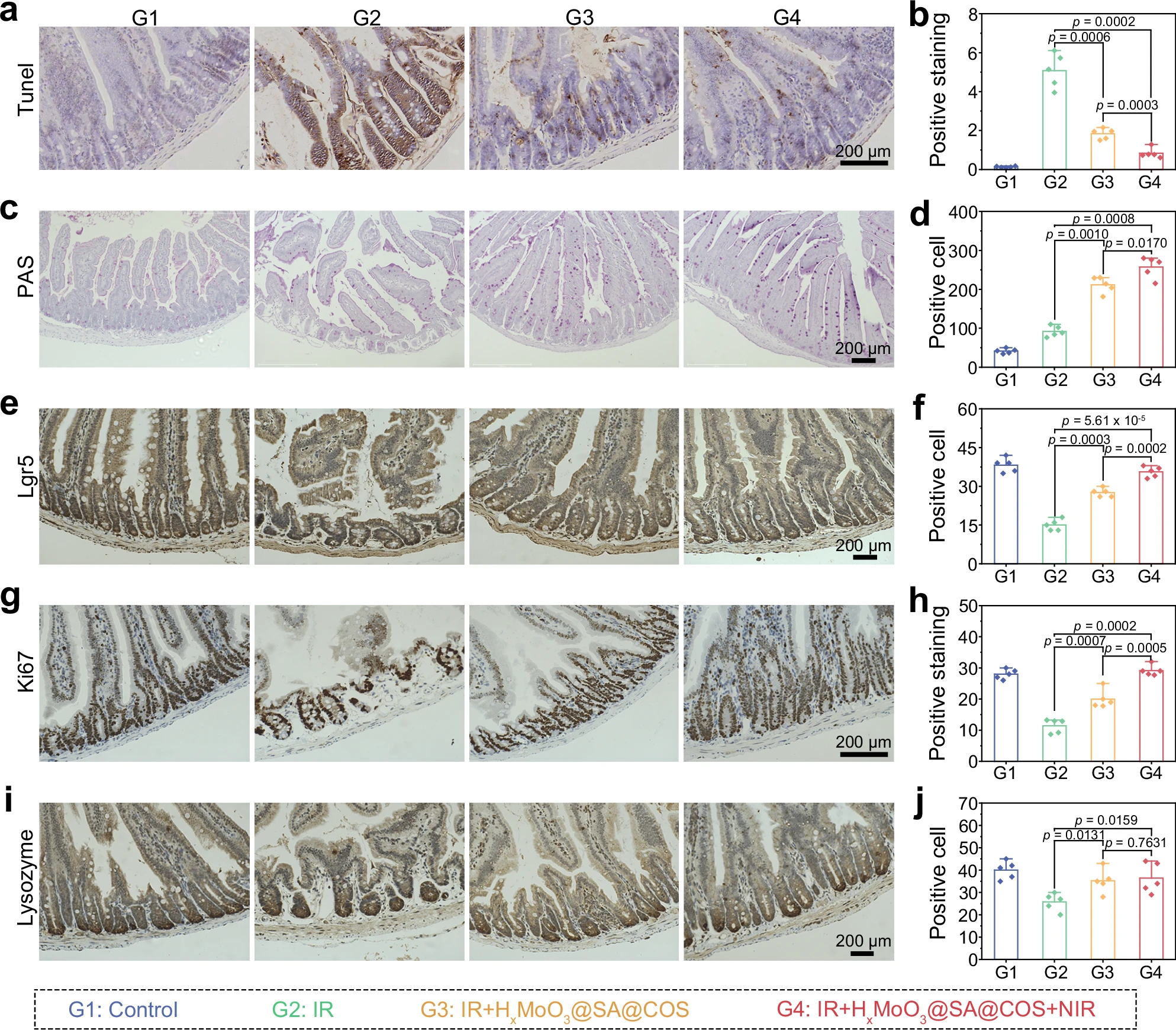
图8:肠道修复情况分析
a−j 不同处理方式下,急性放射性肠炎小鼠模型(12 Gy TAI)肠组织的免疫组化染色结果。染色类型包括TUNEL(a)、PAS(c)、Lgr5+(e)、Ki67+(g)和溶菌酶+(i),及相应的定量分析结果(b−j)。其中,TUNEL染色用于指示细胞凋亡;PAS染色用于标记杯状细胞;Lgr5标记小肠干细胞;Ki67+用于表示细胞增殖活性;溶菌酶+用于标记肠道分泌细胞。数据以平均值±标准差(mean±SD)表示,采用单因素方差分析(one way ANOVA)和Tukey多重比较检验进行统计分析。n=5次生物学独立重复实验。数据来源详见源数据文件。
为评估HxMoO3@SA@COS对肠道的长期安全性和保护作用,我们以存活超过6个月的小鼠为研究对象开展实验。
对主要器官的苏木精-伊红(H&E)染色结果显示,HxMoO3@SA@COS处理组未出现明显病理损伤(补充图37-41),且血液学指标正常(补充图42),这表明活性氢暴露不会对小鼠健康造成风险。此外,我们收集了辐射组和“辐射+HxMoO3@SA@COS”组中长期存活小鼠的小肠隐窝细胞进行彗星实验。结果显示,即使在辐射后长期存活的小鼠中,其肠道隐窝细胞大多仍呈现彗星尾,表明存在显著DNA损伤;而HxMoO3@SA@COS处理组中出现彗星尾的隐窝细胞比例较低,提示HxMoO3@SA@COS处理可减轻DNA损伤并提供长效保护(补充图43)。
HxMoO3@SA@COS纳米机器对肠道菌群的调节作用
肠道菌群在维持肠道健康中起着关键作用。本研究通过16S rRNA基因测序,探究HxMoO3@SA@COS对肠道菌群的调节效果。结果显示,辐射组(n=4)小鼠的Chao1指数(菌群丰富度指标)和Shannon指数(菌群多样性指标)均降低,表明其菌群多样性下降;而经HxMoO3@SA@COS处理后,小鼠的菌群丰富度和多样性均得到恢复(图9a-b)。主坐标分析(PCoA)结果显示,辐射组与健康对照组的菌群群落结构存在显著差异(图9c)。
在门水平上(图9d-e),辐射组小鼠的变形菌门(Proteobacteria)丰度增加、厚壁菌门(Firmicutes)丰度减少,这是辐射诱导菌群失调的典型特征;而经HxMoO3@SA@COS或“HxMoO3@SA@COS+近红外光”处理后,这种菌群失衡状态得到逆转,表明HxMoO3@SA@COS对肠道菌群具有调节作用。通过线性判别分析效应量(Lefse)进一步分析驱动菌群差异的关键类群:LDA得分和进化分支图显示,“辐射+HxMoO3@SA@COS+近红外光”组中疣微菌门(Verrucomicrobia)丰度显著增加,且与辐射组相比,疣微菌门也是“HxMoO3@SA@COS”组中的关键差异菌门(图9f-g、补充图43)。此外,观察到疣微菌门中一种降解黏蛋白的细菌—— Akkermansia(阿克曼氏菌)的丰度显著升高(图9h)。Akkermansia被认为是下一代益生菌[64],已知其可改善代谢紊乱、减轻炎症并增强肠道屏障功能。
推测HxMoO3@SA@COS和“HxMoO3@SA@COS+近红外光”处理可能通过增加Akkermansia的丰度来促进肠道恢复——Akkermansia可利用肠黏液层中的黏蛋白生长。值得注意的是,两种处理方式均使黏蛋白的主要产生细胞(杯状细胞)数量增加,这提示Akkermansia丰度的升高与杯状细胞数量的增加之间可能存在关联[65],但这一关系仍需进一步实验验证。
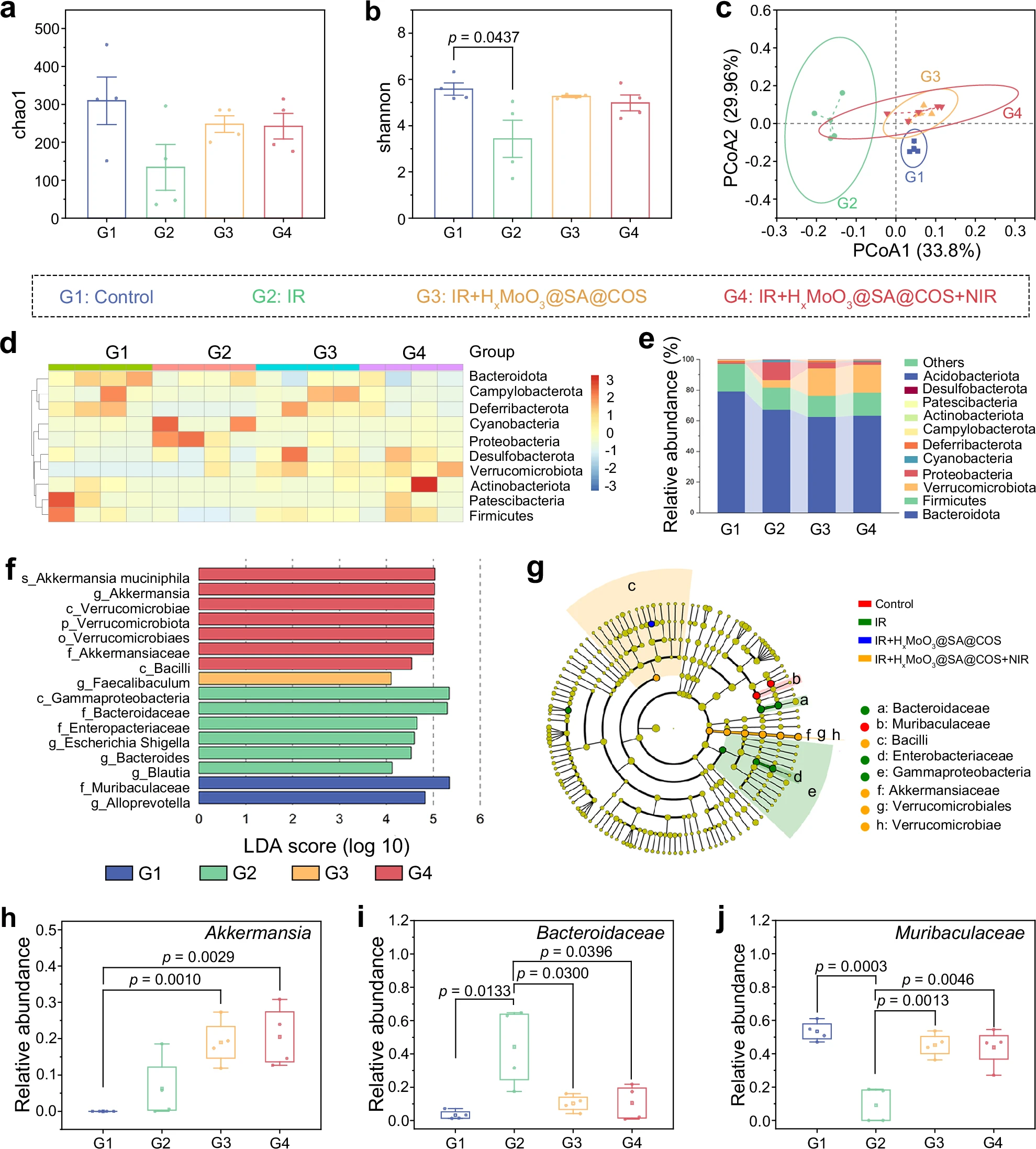
图9:不同处理方式下急性放射性肠炎小鼠模型肠道菌群的16S rRNA基因测序分析
a、b 阿尔法多样性箱线图:Chao1指数(a)反映菌群丰富度,Shannon指数(b)反映菌群多样性。c 基于Bray-Curtis距离的主坐标分析(PCoA)得分图,反映贝塔多样性。d 门水平微生物丰度的标准化Z分数热图。e 门水平肠道共生微生物的相对丰度。f、g Lefse分类进化分支图,显示各组间的微生物分类关系。h−j 关键属的相对丰度:Akkermansia(h)、拟杆菌科(Bacteroidaceae)(i)、Muribaculaceae科(j)。在h−j中,箱线图的上下边界分别代表第25和第75百分位数,须代表最小值和最大值。n=4次(a−j)生物学独立重复实验,数据以平均值±标准差(mean±SD)表示,采用单因素方差分析(one way ANOVA)和Tukey多重比较检验进行统计分析。数据来源详见源数据文件。
HxMoO3@SA@COS和“HxMoO3@SA@COS+近红外光”处理显著增加了有益益生菌的丰度,同时抑制了致病菌的丰度(图9i-j),表明其对肠道菌群具有正向调节作用。值得注意的是,Muribaculaceae科细菌的丰度有所增加——该科细菌可分泌丙酸盐(一种具有辐射防护作用的短链脂肪酸),有助于辐射损伤后的肠道恢复。研究表明丙酸盐还可诱导杯状细胞分化,这与我们之前观察到的杯状细胞数量增加的结果一致[66]。综上,HxMoO3@SA@COS纳米机器通过提高菌群多样性、减少致病菌数量、促进肠道健康,在恢复肠道菌群平衡中发挥重要作用;其中Akkermansia等有益菌丰度的增加,对放射性肠炎的辐射防护和恢复具有显著促进作用。
讨论
放射性肠炎严重影响盆腔和腹部放疗患者的生活质量,目前尚无有效治疗方法。电离辐射会在肠道内产生大量活性氧和活性氮(RONS),导致组织持续损伤和严重炎症反应。因此,清除过量RONS、减轻辐射诱导的炎症反应,是辐射防护的核心策略。氢气具有优异的生物安全性,可选择性清除羟基自由基(·OH)、过氧亚硝基阴离子(ONOO⁻)等关键RONS,从而减轻氧化应激、激活内源性抗氧化系统并缓解炎症——这些特性使氢气成为一种极具潜力的辐射防护剂。然而,作为一种惰性生理气体,氢气在放射治疗中的作用机制仍未完全明确。近期研究发现,氢气可能通过与主要存在于线粒体中的内源性催化剂(铁卟啉)相互作用来清除RONS。我们推测,铁卟啉可催化氢气产生活性氢,进而清除RONS。氢原子具有极低的还原电位(H⁺/H·,相对于标准氢电极(NHE)为-0.34 V),具备广谱RONS清除能力。重要的是,活性氢在急性辐射防护中具有巨大潜力。
迄今为止,尚未有研究探索活性氢在辐射防护中的应用,这可能是因为缺乏有效的递送方法将其靶向至损伤组织——尤其是肠道,其受到坚固黏液屏障的保护。本研究报道了一种通过湿化学法合成的可口服球形自热泳驱动型HxMoO3@SA@COS纳米机器,用于治疗急性放射性肠炎。经氢化处理后,制备的HxMoO3@SA@COS在近红外光区域具有强吸收能力,且在808 nm光照射下的光热转换效率高达约46.5%。值得注意的是,热场模拟显示,近红外激光照射可在球形纳米结构表面产生非对称热梯度,从而驱动其定向运动。这种独特的运动能力不仅使HxMoO3@SA@COS能够突破肠道屏障、实现高效氢气递送,还能增强细胞内吞效率并延长滞留时间。
体外和体内研究表明,HxMoO3@SA@COS可有效减轻辐射诱导的DNA损伤、清除RONS、减少细胞凋亡、促进巨噬细胞向抗炎表型极化、调节肠道菌群并修复肠上皮组织。在16 Gy TAI诱导的致死性辐射损伤小鼠模型中,存活率实验显示:经HxMoO3@SA@COS联合近红外光处理后,小鼠30天内的存活率从10%显著提升至80%。这种基于氢气的无药治疗策略,结合精准自主的递送方式,展现出优异的生物安全性和对辐射诱导肠炎的强效保护作用,这些良好结果表明该方法具有重要的临床应用潜力。
本研究证实,氢气可通过清除RONS、恢复氧化还原稳态,对肠道组织发挥辐射防护作用[67]。然而,其对DNA损伤反应(DDR)-炎症-免疫调节轴的全身性调控作用,仍需在不同辐射模式下进行全面的机制研究。尽管γ射线实验证实了该方法的基础有效性,但要推动其转化应用,还需在临床级质子和碳离子照射条件下进行严格评估,以应对复杂的DNA损伤模式和组织特异性免疫重塑问题。此外,为进一步提升HxMoO3@SA@COS的临床实用性,我们提出采用体内植入式近红外光源,在原位驱动纳米机器运动,从而确保其在深层肠道组织中持续发挥治疗效果。这些改进将对完善基于活性氢的辐射防护策略、拓展其在精准放射性肠炎治疗中的应用潜力起到关键作用。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1506439.html?mobile=1
收藏

