氢气疗法对宫颈癌同步放化疗患者急性放射性肠炎及炎症反应的临床疗效
过去许多基础和临床研究提示,氢气可能对癌症治疗有作用,但本研究并没有发现这种作用,是氢气没有效果吗?真的未必,一是时间非常短,二是在放疗这种特别有效的背景下。氢气不太可能在传统治疗背景下能凸显出更多效果。另外研究针对放疗导致的胃肠道炎症,可能饮用氢水的效果会更好一些。吸入氢气虽然量大,但肠道问题还是肠道解决。
研究目的
急性放射性肠炎(Acute Radiation Enteritis, ARE)是宫颈癌同步放化疗(Concurrent Chemoradiation Therapy, CCRT)患者常见的毒性炎症反应。分子氢作为一种新型抗氧化剂和抗炎剂,或可减轻治疗相关毒性。本研究旨在评估氢气吸入对预防急性放射性肠炎及调节全身性炎症的疗效。
研究方法
前瞻性纳入符合标准的宫颈癌同步放化疗患者,采用随机分组方式将其分为实验组(n=28)和对照组(n=30)。实验组在每次放疗当日接受氢氧混合气体(含66.6%氢气、33.3%氧气,流速3升/分钟,每日2小时)吸入治疗。在治疗期间,对以下指标进行监测:炎症生物标志物(包括C反应蛋白、中性粒细胞与淋巴细胞比值、血小板与淋巴细胞比值、白细胞介素6)、血常规参数、粪便潜血、晚期正常组织效应工作组主观-客观-管理-分析评分(Late Effects Normal Tissue Task Force-Subjective, Objective, Management, and Analytic Score, LENT-SOMA评分)、患者主观整体评估评分(Patient-Generated Subjective Global Assessment Score, PG-SGA评分)、肿瘤放射治疗协作组肠炎分级(Radiation Therapy Oncology Group Enteritis Grade),以及实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)评分。
研究结果
两组患者的基线特征(年龄、肿瘤分期、病理类型、手术史)均衡可比(P>0.05)。与对照组相比,实验组的C反应蛋白水平、中性粒细胞与淋巴细胞比值、白细胞介素6水平及粪便潜血阳性率均显著更低(P<0.05)。临床评估结果亦显示,氢气治疗组的LENT-SOMA评分、PG-SGA评分更低,肿瘤放射治疗协作组肠炎分级更轻微(P<0.05)。重要的是,根据实体瘤疗效评价标准,两组患者的肿瘤应答无显著差异,表明氢气疗法未干扰同步放化疗的抗肿瘤疗效。研究期间未报告与氢气吸入相关的不良事件。(特别提醒:研究结果也并没有发现氢气对肿瘤的治疗效果)
研究结论
氢气吸入是一种安全有效的辅助治疗手段,可显著减轻接受同步放化疗的宫颈癌患者的炎症反应,缓解急性放射性肠炎的临床症状,且不会影响抗肿瘤治疗效果。
参考原文信息:
Liu B, Bao Y, Ma J, Wang X, Feng Y. Clinical Efficacy of Hydrogen Therapy on Acute Radiation Enteritis and Inflammatory Response in Patients with Cervical Cancer Undergoing Concurrent Chemoradiation Therapy. Adv Radiat Oncol. 2025 Aug 19;10(11):101879.
本文作者单位:
a 中国湖南省长沙市芙蓉区,中南大学湘雅二医院肿瘤科b 中国甘肃省兰州市城关区,兰州大学第二医院普通外科c 中国甘肃省兰州市城关区,兰州大学第二临床医学院。
引言
宫颈癌是全球女性中第四大常见癌症,也是癌症相关死亡的主要原因之一[1]。同步放化疗(CCRT)被公认为局部晚期宫颈癌患者的标准治疗方案。与单纯放疗(RT)相比,同步放化疗可将患者的5年总生存率和无进展生存率显著提高10%至15%[2]。尽管疗效明确,但同步放化疗常伴随严重的治疗相关毒性,其中急性放射性肠炎(ARE)尤为突出——该病由放疗诱导的肠黏膜损伤引发,发生率高达60%至80%,临床表现包括腹泻、腹痛、便血等[3]。这些症状不仅严重影响患者的生活质量(QoL),还可能导致治疗中断[4]。
急性放射性肠炎的病理生理机制具有多因素性,涉及氧化应激、炎症信号通路激活及微血管损伤等,这些因素共同导致肠黏膜损伤[5]。目前的预防策略包括饮食调整、益生菌使用及抗炎药物应用等[6],但这些疗法疗效有限,且常伴随免疫抑制、胃肠道不适等严重副作用[6,7]。因此,迫切需要研发能有效预防或缓解急性放射性肠炎、且不影响同步放化疗抗肿瘤疗效的新型治疗方法[7,8]。
近年来,氢气疗法凭借其独特的生物学特性,成为一种极具潜力的抗炎、抗氧化干预手段[9]。氢气是一种天然、有效的活性氧(ROS)清除剂和抗炎剂,而活性氧正是急性放射性肠炎中氧化应激和组织损伤的关键诱因[10,11]。临床前研究表明,氢气可通过调节细胞因子表达、促进组织修复,减轻包括胃肠道在内的多种组织的氧化应激和炎症反应[10]。既往研究还发现,富氢水可显著减轻大鼠的放射性肠损伤,并降低促炎细胞因子水平[12];另有研究显示,氢气吸入能减少小鼠肺组织的氧化应激和细胞凋亡,从而缓解放射性肺损伤[13]。
尽管氢气疗法在放射性肠炎中的临床数据仍较有限,但其高安全性已在多项研究中得到证实。高浓度氢气疗法耐受性良好,甚至被推荐作为新型冠状病毒肺炎(COVID-19)患者的辅助治疗方案[9,14]。这些研究结果共同提示,氢气疗法可能是一种安全且潜在有效的策略,可用于接受同步放化疗的宫颈癌患者急性放射性肠炎的预防和管理。
关键的临床及炎症生物标志物已成为评估癌症患者全身性炎症反应和预后的重要指标。中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)可反映肿瘤相关炎症与抗肿瘤免疫监视之间的平衡,是监测治疗应答和疾病进展的有效工具[15]。多项研究表明,NLR和PLR升高与宫颈癌患者预后不良、治疗应答不佳显著相关[16],且这些指标与急性放射性肠炎的发生率呈正相关[17,18]。
白细胞介素6(IL-6)作为一种促炎细胞因子,在炎症级联反应中发挥关键作用[19]。IL-6水平持续升高提示慢性炎症状态,这种状态不仅会促进肿瘤进展,还会加重治疗期间正常组织的损伤,从而增加急性放射性肠炎等严重并发症的发生风险[20]。在宫颈癌患者接受同步放化疗期间,肠道损伤可能导致营养摄入不足、吸收障碍及体重下降[21]。患者主观整体评估(PG-SGA)是经验证的肿瘤患者营养状况评估工具,涵盖体重变化、饮食摄入、胃肠道症状(如腹泻、便血、腹痛)、功能状态及代谢应激等参数[22]。PG-SGA评分越高,表明营养状况越差,且与宫颈癌患者治疗耐受性下降、急性放射性肠炎发生风险升高独立相关[23,24]。
基于氢气独特的抗炎和抗氧化特性,本前瞻性临床研究旨在系统评估其在预防和缓解急性放射性肠炎中的治疗潜力,具体探究氢气吸入对接受同步放化疗的宫颈癌患者炎症生物标志物(NLR、PLR、IL-6)、营养状况(PG-SGA评分)、患者报告的胃肠道症状及整体生活质量的影响。
材料与方法
研究对象
本前瞻性研究纳入2023年2月至2023年12月期间在A医院肿瘤科接受同步放化疗、经病理确诊为宫颈癌的患者。
纳入标准:(1)经病理确诊为宫颈癌(包括鳞状细胞癌、腺癌、腺鳞癌),且根据《美国国家综合癌症网络宫颈癌临床实践指南》[25]符合同步放化疗适应证;(2)年龄18-75岁;(3)无肿瘤转移、无其他恶性肿瘤病史、无炎症性胃肠道疾病病史、无胃肠道手术史;(4)东部肿瘤协作组体能状态评分(Eastern Cooperative Oncology Group Performance Status Score)为0-2分。
排除标准:(1)存在精神障碍,影响治疗依从性;(2)患有活动性感染性疾病;(3)妊娠或哺乳期女性;(4)因无法耐受疾病或非实验性干预措施而退出治疗;(5)因个人原因拒绝继续参与或退出研究。
采用随机数字表法将受试者分为实验组(n=28)和对照组(n=30)。本研究经A医院伦理委员会批准(批准号:20240101;批准日期:2024年10月15日),所有受试者在入组前均签署书面知情同意书。
同步放化疗方案
所有患者均接受同步放化疗。化疗方案参照《美国国家综合癌症网络宫颈癌临床实践指南(2023年第1版)》及《中国临床肿瘤学会宫颈癌诊疗指南(2023年)》[25,26]:鳞状细胞癌、腺癌、腺鳞癌患者均采用紫杉类药物联合铂类药物方案,具体为紫杉醇135-175毫克/平方米(第1天给药)联合顺铂50毫克/平方米(第1-2天给药),每3周为1个周期,周期数根据患者肿瘤分期及手术情况确定。
放疗方案如下:术后需辅助治疗(阴道切缘距离>0.5厘米)的患者,采用调强放疗技术进行盆腔外照射,总剂量45-50戈瑞(Gy),分25次完成(每周5次,周末休息),总疗程5周;未接受手术或术后阴道切缘距离≤0.5厘米的患者,接受腔内后装放疗,每次剂量6戈瑞,共5次;盆腔或腹腔淋巴结阳性的患者,可额外增加10-15戈瑞剂量。
治疗方法
实验组在放疗第1-25天同步接受氢气吸入治疗:每次放疗当日(放疗前或放疗后),通过鼻导管吸入氢氧混合气体(体积比:66.6%氢气、33.3%氧气),每次治疗持续2小时,流速3升/分钟。氢氧混合气体由氢氧雾化机以纯净水为原料,通过电解水生成;每周治疗5次,与外照射放疗同步进行,总疗程25次。所用氢氧雾化机为上海潓美医疗公司的AMS-H-03型。对照组在放疗期间不接受额外气体吸入治疗。
根据肿瘤放射治疗协作组(RTOG)/欧洲癌症研究与治疗组织(EORTC)标准,发生2级放射性肠炎的患者接受“蒙脱石散,1袋/次,每日3次”或“洛哌丁胺,初始剂量2粒,之后每次腹泻后服用1粒”治疗[27];必要时给予补液、纠正电解质紊乱、肠外营养等支持治疗[27]。
评价指标
放疗期间,定期采集患者样本送至A医院实验室检测相关指标,检测时间点为放疗第0、5、10、15、20、25天,检测项目包括血红蛋白水平、血小板计数、中性粒细胞计数、淋巴细胞计数、C反应蛋白(CRP)水平、白细胞介素6(IL-6)水平及粪便潜血。
在放疗第0、5、10、15、20、25天,采用晚期正常组织效应工作组主观-客观-管理-分析(LENT-SOMA)量表[28]评估放射损伤,采用患者主观整体评估(PG-SGA)量表评估营养状况。其中,LENT-SOMA量表用于评估放疗后正常组织的晚期不良反应,涵盖主观、客观、管理、分析四个维度,有助于识别并量化潜在晚期不良反应的严重程度;PG-SGA量表通过患者自我报告与医护人员评估相结合的方式,综合评价营养状况,评分范围涵盖“营养良好”至“严重营养不良”,评分≥9分的患者需紧急进行症状管理和/或营养干预。
放疗第25天,采用肿瘤放射治疗协作组(RTOG)急性放射损伤分级标准评估肠道反应,具体分级为:0级(无明显不适)、1级(排便次数增多或排便习惯改变,无需药物治疗)、2级(腹泻、腹痛,需对症治疗)、3级(腹胀,影像学检查提示肠扩张,需肠外营养支持)、4级(肠梗阻、肠穿孔、肠瘘或大量出血,需输血治疗),并比较两组患者急性肠炎的严重程度。
放疗第25天,采用实体瘤疗效评价标准(RECIST)评估肿瘤应答,具体分为完全缓解(CR:所有靶病灶消失)、部分缓解(PR:靶病灶直径之和减少≥30%)、疾病稳定(SD:靶病灶直径之和无明显变化)、疾病进展(PD:靶病灶直径之和增加≥20%或出现新病灶)。通过比较两组患者的治疗应答,评估氢气疗法对肿瘤控制的影响。
统计学分析
采用SPSS 25.0版本软件(IBM公司)进行统计学分析。符合正态分布的连续变量以“均数±标准差”(mean±SD)表示,组间比较采用独立样本t检验;非正态分布数据采用Wilcoxon秩和检验。分类变量以“例数(百分比)”(n,%)表示,组间比较采用χ²检验;当理论频数T≤1或样本量n<40时,采用Fisher精确检验。为评估放疗期间时间、组别及其交互作用对重复测量指标的影响,采用广义估计方程(generalized estimating equations)分析。所有统计学检验均为双侧检验,P<0.05认为差异具有统计学意义。
研究结果
基线特征与安全性
本研究最初共纳入66例患者,排除脱落病例后,最终纳入实验组28例、对照组30例进行统计分析。由表1可知,两组患者在年龄、体重指数(kg/m²)、肿瘤分期、肿瘤直径、病理类型及手术史方面的差异均无统计学意义,提示两组基线特征具有可比性。血常规检查显示,两组患者的指标变化趋势相近,且实验组未出现额外的血液毒性(见表E1),这一结果支持氢气疗法的安全性。在整个治疗过程中,未观察到与氢气相关的不良反应,证实了氢氧吸入疗法的安全性;腹痛、腹泻、恶心等常见不良反应均通过对症治疗得到缓解。
表1 实验组与对照组患者的基线特征
Characteristic | Experimental group (n = 28) | Control group (n = 30) | t/x2 value | P | |
Age, y (n [%]) | <60 | 21 (75.0) | 23 (76.7) | 0.02 | .88 |
≥60 | 7 (25.0) | 7 (23.3) | |||
BMI kg/m2 (n [%]) | <23.9 | 17 (60.7) | 20 (66.7) | 0.22 | .63 |
≥23.9 | 11 (39.3) | 10 (33.3) | |||
FIGO2018 stages | II | 10 (35.7) | 13 (43.3) | 0.49 | .78 |
III | 18 (64.3) | 17 (56.7) | |||
Tumor diameter (cm) | 4.56 ± 1.55 | 3.95 ± 1.15 | 1.69 | .095 | |
Pathologic differentiation (n [%]) | Well | 5 (17.9) | 0 (0.0) | 8.09 | .064 |
Moderately | 15 (53.6) | 24 (80.0) | |||
Poorly | 8 (28.5) | 6 (20.0) | |||
Pathology (n [%]) | Squamous cell carcinoma | 24 (85.7) | 25 (83.3) | 0.06 | .8 |
Adenocarcinoma | 4 (14.3) | 5 (16.7) | |||
Surgery (n [%]) | No | 21 (75.0) | 20 (66.7) | 0.48 | .48 |
Yes | 7 (25.0) | 10 (33.3) | |||
缩略词:BMI = 体重指数;FIGO 2018 = 2018年国际妇产科联盟(International Federation of Gynecology and Obstetrics 2018)
氢气疗法减轻炎症反应及放射性肠损伤
放射性炎症反应在急性放射性肠炎(ARE)的发病机制中起关键作用。本研究采用一组全面的生物标志物(包括C反应蛋白(CRP)、白细胞介素6(IL-6)、中性粒细胞与淋巴细胞比值(NLR)、血小板与淋巴细胞比值(PLR)、粪便潜血阳性率、晚期正常组织效应工作组主观-客观-管理-分析(LENT-SOMA)评分、患者主观整体评估(PG-SGA)评分及肿瘤放射治疗协作组(RTOG)评分),评估炎症反应及放射性肠损伤情况。
C反应蛋白(CRP):全身性炎症标志物
CRP是一种敏感的急性期反应蛋白,是评估全身性炎症的可靠标志物[29]。由图1A可见,在放疗期间,两组患者的CRP水平均逐渐升高;但从放疗第15天开始,接受氢气治疗的患者CRP浓度显著更低。具体而言,放疗第15天,氢气治疗组的平均CRP水平为10.02±4.12 mg/L,而对照组为15.63±3.39 mg/L(P=0.0002);这一差异在第20天(13.32±4.04 mg/L vs 21.26±5.69 mg/L,P<0.0001)和第25天(14.45±5.01 mg/L vs 26.77±10.73 mg/L,P<0.0001)进一步扩大。上述结果表明,氢气疗法在减轻放疗诱导的全身性炎症方面具有强效抗炎作用。
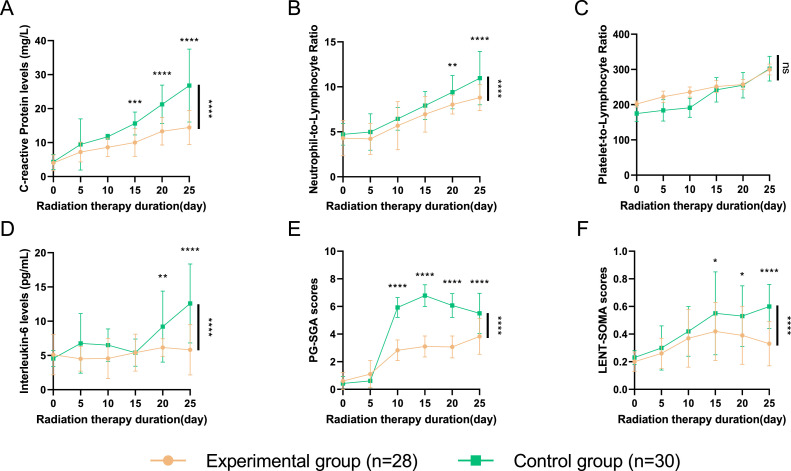
图1 放疗期间实验组与对照组炎症生物标志物及临床评估评分的变化
(A)C反应蛋白(CRP)水平;(B)中性粒细胞与淋巴细胞比值(NLR);(C)血小板与淋巴细胞比值(PLR);(D)白细胞介素6(IL-6)水平;(E)患者主观整体评估(PG-SGA)评分;(F)晚期正常组织效应工作组主观-客观-管理-分析(LENT-SOMA)评分。数据以“均数±标准差”(mean±SD)表示。在每个时间点对组间差异进行统计学分析,*P<0.05,P<0.01,*P<0.001,P<0.0001。
中性粒细胞与淋巴细胞比值(NLR)及血小板与淋巴细胞比值(PLR):复合血液炎症标志物
NLR是公认的全身性炎症标志物,可反映固有免疫激活(中性粒细胞)与适应性免疫功能(淋巴细胞)之间的动态平衡[16]。由图1B可见,放疗期间两组患者的NLR值均逐渐升高,这与放疗诱导的炎症应激状态一致;但实验组NLR值的升高幅度显著降低。放疗第0天至第15天,两组间NLR值无显著差异(均P>0.05);到第20天,氢气治疗组的NLR值显著低于对照组(8.03±1.05 vs 9.40±1.86,P=0.0362);且这一差异在第25天进一步加剧(8.80±1.44 vs 10.97±2.96,P<0.0001)。这些结果提示,氢气吸入可有效减轻同步放化疗(CCRT)诱导的全身性炎症负荷。
PLR是另一种与免疫失调及内皮激活相关的血液炎症标志物[16]。由图1C可见,治疗期间两组患者的PLR值均呈上升趋势。尽管实验组在各个时间点的PLR值均低于对照组,但差异未达到统计学意义。放疗第25天,氢气治疗组的PLR值为339.77±81.62,对照组为392.10±94.11(P=0.0501);对所有时间点的整体组间比较显示,差异接近统计学意义(P=0.0511),提示氢气疗法可能对血小板相关的炎症活性具有调节作用。
白细胞介素6(IL-6):急性放射性肠炎(ARE)中的关键细胞因子
IL-6是一种关键的促炎细胞因子,与放射性组织损伤及黏膜屏障破坏密切相关[19]。由图1D可见,放疗期间,氢气治疗组的IL-6水平保持相对稳定,而对照组则显著升高。基线时(第0天),两组IL-6水平无显著差异(5.11±2.94 pg/mL vs 4.56±1.15 pg/mL,P=0.9904);第5天至第15天,两组IL-6水平虽出现轻微波动,但组间差异无统计学意义(均P>0.05)。值得注意的是,第20天对照组的IL-6水平显著高于氢气治疗组(9.21±5.19 pg/mL vs 6.16±1.29 pg/mL,P=0.0037);这一差异在第25天更为显著,对照组IL-6浓度明显更高(12.59±5.77 pg/mL vs 5.83±3.68 pg/mL,P<0.0001)。整体趋势分析证实,组间差异具有统计学意义(P<0.0001),表明氢气吸入可抑制放疗诱导的IL-6水平升高及全身性细胞因子释放。
粪便潜血阳性率:肠黏膜完整性指标
粪便潜血阳性是评估放射性肠黏膜损伤及微量出血的无创指标[30],与急性放射性肠炎的严重程度相关。由表2可知,随着治疗进展,两组患者的粪便潜血阳性率均逐渐升高,但氢气治疗组的阳性病例比例始终更低。基线时(第0天),两组无显著差异;第5天,氢气治疗组的阳性率显著更低(10.71% vs 30.00%,P=0.0375),提示氢气对肠黏膜具有早期保护作用;第20天(32.14% vs 60.00%,P=0.009)和第25天(42.86% vs 66.67%,P=0.016),两组差异均具有统计学意义。对整个放疗周期的累积分析显示,氢气治疗组的粪便潜血阳性率显著降低(χ²=16.278,P<0.001),进一步证实氢气疗法对肠黏膜完整性具有保护作用。
表2 实验组与对照组放疗期间粪便潜血阳性率(%,n)
RT period | Experimental group (n = 28) | Control group (n = 30) | χ2 value | P value |
Day 0 | 17.86% (5) | 23.33% (7) | 0.613 | .43369 |
Day 5 | 10.71% (3) | 30.00% (9) | 4.327 | .0375 |
Day 10 | 42.86% (12) | 56.67% (17) | 2.486 | .11488 |
Day 15 | 39.29% (11) | 43.33% (13) | 0.569 | .451 |
Day 20 | 32.14% (9) | 60.00% (18) | 6.842 | .009 |
Day 25 | 42.86% (12) | 66.67% (20) | 5.784 | .016 |
Intergroup comparison | 16.278 | 0 | ||
注:“ns”表示组间差异无统计学意义。
晚期正常组织效应工作组主观-客观-管理-分析(LENT-SOMA)评分:放射性肠毒性的综合评估
LENT-SOMA评分系统是经验证的、由临床医师评估胃肠道毒性的工具,尤其适用于评价放射性肠损伤[28]。由图1E可见,放疗期间两组患者的LENT-SOMA评分均逐渐升高,但接受氢气治疗的患者症状进展显著更轻微。基线时(第0天),两组的LENT-SOMA评分无显著差异;第5天至第10天,尽管两组评分均有上升,但组间差异仍无统计学意义(P>0.05)。到第15天,实验组评分(0.42±0.21)显著低于对照组(0.55±0.30,P=0.0332),且这一差异在第20天持续存在(0.39±0.21 vs 0.53±0.22,P=0.0308)。放疗结束时(第25天),两组差异最为显著:氢气治疗组评分为0.33±0.16,对照组为0.60±0.16(P<0.0001)。纵向整体分析证实,氢气疗法可显著减缓放射性肠毒性的进展(P<0.0001)。
患者主观整体评估(PG-SGA)评分:急性放射性肠炎(ARE)对营养状况的影响
PG-SGA评分是评估营养状况及影响进食症状的工具,广泛应用于肿瘤支持治疗领域[22]。由图1F可见,两组患者的PG-SGA评分均稳步升高,反映出营养状况逐渐恶化;但氢气治疗组这一恶化趋势显著减缓。基线时,两组评分无显著差异(0.60±0.62 vs 0.43±0.50,P=0.975);第5天至第10天,对照组评分急剧上升,到第10天达到5.93±0.72,显著高于氢气治疗组(2.83±0.75,P<0.0001)。在第15天(6.79±0.79 vs 3.10±0.76)、第20天(6.07±0.86 vs 3.07±0.79)和第25天(5.50±1.45 vs 3.83±1.29),两组差异进一步扩大,所有时间点的比较均满足P<0.0001。这一持续性差异证实,氢气疗法可有效维持患者的营养状况,并缓解急性放射性肠炎相关的胃肠道症状。
肿瘤放射治疗协作组(RTOG)毒性分级:急性放射性肠炎的总体临床严重程度
研究采用RTOG标准,基于临床医师观察到的胃肠道毒性反应对急性放射性肠炎的严重程度进行分级[27]。由表3可见,氢气治疗组的大多数患者仅表现出0-1级毒性反应。具体而言,放疗结束时,实验组64.29%的患者出现1级毒性反应,而对照组仅为30.00%;相反,对照组2级毒性反应的发生率(63.33%)显著高于实验组(28.57%)。两组中高级别毒性反应(3级)均较为罕见,但对照组发生率(6.67%)仍高于实验组(3.57%)。统计学分析显示,组间差异具有统计学意义(χ²=9.516,P=0.023),表明氢气吸入可有效降低放射性胃肠道损伤的严重程度。
表3 实验组与对照组在放疗不同时间点的肿瘤放射治疗协作组(RTOG)评分
RT period | Experimental group (n = 28) | Control group (n = 30) | χ2 value | P value |
Grade 0 | 3 (10.71%) | 0 (0.00%) | ||
Grade 1 | 18 (64.29%) | 9 (30.00%) | ||
Grade 2 | 8 (28.57%) | 19 (63.33%) | ||
Grade 3 | 1 (3.57%) | 2 (6.67%) | ||
Intergroup comparison | 9.516 | .023 | ||
氢气吸入不影响肿瘤应答效果
支持性治疗中一个关键问题在于,这类治疗是否会干扰放疗与化疗的疗效[31]。本研究采用实体瘤疗效评价标准(RECIST)评估肿瘤应答情况,该标准为评估治疗的影像学应答效果提供了标准化依据。由表4可知,实验组的完全缓解(CR)率(71.43%)与对照组(80.00%)相当;实验组部分缓解(PR)率为17.86%,对照组为10.00%;两组的疾病稳定(SD)和疾病进展(PD)发生率均较低(疾病稳定:3.57% vs 0.00%;疾病进展:7.14% vs 10.00%)。重要的是,两组患者的总体肿瘤应答分布无统计学差异(χ²=1.997,P=0.573),这表明氢气疗法未削弱同步放化疗(CCRT)的抗肿瘤疗效。该结果进一步证实,氢气吸入作为辅助支持性治疗具有肿瘤学安全性。
表4 实验组与对照组在放疗不同时间点的实体瘤疗效评价标准(RECIST)评分
RT period | Experimental group (n = 28) | Control group (n = 30) | χ2 value | P value |
Complete response | 20 (71.43%) | 24 (80.00%) | ||
Partial response | 5 (17.86%) | 3 (10.00%) | ||
Stable disease | 1 (3.57%) | 0 (0.00%) | ||
Progressive disease | 2 (7.14%) | 3 (10.00%) | ||
Intergroup comparison | 1.997 | .573 | ||
支持性治疗(Supportive Care)是医疗体系中围绕“改善患者整体健康状态、提升治疗耐受性与生活质量”展开的综合性干预手段,核心目标并非直接针对疾病(如肿瘤、感染等)的病因进行治疗,而是通过管理疾病或治疗相关的生理、心理及社会层面问题,帮助患者更好地耐受主要治疗(如放化疗、手术等),减少并发症,同时缓解痛苦、维护尊严。其具体作用可从以下多个维度展开:
1. 管理治疗相关毒性与并发症,保障主要治疗顺利进行
这是支持性治疗最核心的作用之一。许多疾病的核心治疗(如肿瘤的放化疗、感染的抗生素治疗、慢性病的长期用药等)常伴随明确的毒性反应,若不及时干预可能导致治疗中断或剂量降低,进而影响疗效。
- 生理毒性管理:例如在本研究中,宫颈癌同步放化疗(CCRT)易引发急性放射性肠炎(ARE,表现为腹泻、便血、腹痛),氢气吸入作为支持性治疗可减轻这类肠道毒性;此外,放化疗常见的恶心呕吐、骨髓抑制(白细胞/血小板降低导致的感染、出血风险)、口腔溃疡等,也需通过止吐药、升白细胞/血小板药物、黏膜保护剂等支持性手段干预,避免治疗被迫暂停。
- 器官功能保护:如肿瘤治疗中使用保肝药预防药物性肝损伤、用心肌保护剂减少化疗药对心脏的毒性,确保主要治疗能按计划完成。
2. 缓解疾病本身引发的症状,改善患者生活质量
除了治疗相关问题,疾病本身也可能导致持续不适,这些症状会严重影响患者的日常活动与心理状态,支持性治疗可针对性缓解:
- 疼痛管理:如癌症晚期患者的癌痛、关节炎患者的关节痛,通过阶梯式镇痛药物(从非甾体抗炎药到阿片类药物)或非药物手段(理疗、心理干预)控制疼痛,帮助患者维持基本活动能力。
- 其他症状干预:如慢性阻塞性肺疾病(COPD)患者的呼吸困难(通过氧疗、支气管扩张剂缓解)、晚期肿瘤患者的乏力(通过营养支持、适度运动调整)、抑郁症患者的情绪低落(通过心理咨询或辅助药物改善)等,均属于支持性治疗范畴。
3. 维护营养与代谢平衡,增强患者身体耐受能力
疾病或治疗常导致患者营养摄入不足、吸收障碍(如本研究中ARE引发的肠道吸收问题),而营养不良会进一步削弱免疫力,增加感染风险,降低对治疗的耐受性。支持性治疗通过以下方式改善营养状态:
- 营养评估与干预:使用如本研究中的“患者主观整体评估(PG-SGA)”等工具监测营养状况,对轻度营养不良者调整饮食结构(如增加高蛋白、高热量食物),对严重者给予肠内营养(如鼻饲)或肠外营养(静脉输注营养素)。
- 代谢调节:如糖尿病患者在治疗期间的血糖控制、慢性肾病患者的电解质平衡管理,避免因代谢紊乱加重病情或影响治疗。
4. 关注心理与社会支持,减少精神层面负担
疾病不仅影响生理健康,还常引发焦虑、抑郁、恐惧等心理问题,部分患者还可能面临经济压力、家庭角色变化等社会层面困扰,这些因素会间接影响治疗依从性与康复效果。支持性治疗的心理社会支持维度包括:
- 心理干预:通过心理咨询、认知行为疗法(CBT)帮助患者调整对疾病的认知,缓解负面情绪;对家属进行心理疏导,增强家庭支持系统的作用。
- 社会资源链接:如为经济困难患者提供医疗救助信息、为康复期患者对接社区康复服务,帮助患者回归正常生活。
5. 保障治疗安全性,降低不良事件风险
支持性治疗通过密切监测患者身体状态、及时干预潜在风险,减少严重不良事件的发生:
- 监测与预警:如放化疗期间定期检查血常规、肝肾功能,早期发现骨髓抑制或器官损伤,及时调整治疗方案;术后监测生命体征,预防出血、感染等并发症。
- 安全用药管理:如老年人或多基础病患者的药物相互作用评估、剂量调整,避免药物不良反应叠加。
总结:支持性治疗的核心价值——“以患者为中心”的综合保障
支持性治疗并非“辅助性”的次要手段,而是与“病因治疗”同等重要的医疗组成部分。它通过覆盖“生理-心理-社会”全维度的干预,既为主要治疗(如抗肿瘤、抗感染)“保驾护航”,确保疗效不被毒性反应削弱;又通过缓解痛苦、维护生活质量,帮助患者在疾病治疗过程中保持尊严与希望。正如本研究中氢气吸入疗法的作用——不干扰同步放化疗的抗肿瘤效果,却能减轻肠道毒性与炎症反应,正是支持性治疗“安全、有效、不影响核心疗效”的典型体现。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1504959.html?mobile=1
收藏

