 精选
精选
氢气:影响生物氧化还原电势的关键因素
提醒:本文原文题目是新因素,但新因素的说法不恰当,因为这种因素一直都存在,只能说是新发现的因素。根据本文的意思,我修改为氢气是关键因素。
细胞内氧化还原(redox)电位是调控细胞内多种生理现象的关键因素。因此,监测该电位变化对于理解细胞生理稳态具有重要意义。本文提出一种实时、无创评估氧化还原电位的新方法,该电位会影响生物代谢及活性氧(reactive oxygen species, ROS)的生成。酶尤其是氧化还原酶在催化氧化还原反应中发挥关键作用,其通过促进分子间电子与氢原子的转移实现这一功能。底物(如烟酰胺腺嘌呤二核苷酸)的氧化还原电位由其氧化型与还原型的比例决定;而酶(如琥珀酸脱氢酶)的氧化还原电位则通过蛋白膜伏安法中的参比电极进行测定。
尽管标准条件下标准氢电极电位被定义为零,但作为参比电极,可逆氢电极的电极电位会根据生物流体中氢离子(H⁺)与氢气(H₂)的比例发生变化。动脉血的 pH 值维持在 7.4±0.1,临床上可通过检测呼气末气体中肠道菌群产生的 H₂进行诊断。由于全身循环作用,在肺部气体交换过程中,呼气末气体中的 H₂会与动脉血达到平衡,且该平衡状态会延伸至全身组织。
本研究中,通过对比环境气体与大气中 H₂的含量可实现对 H₂的检测;H₂或可作为评估氧化还原酶氧化还原电位变化的新型指标,而这类电位变化会影响生物代谢及活性氧的生成。
原文:
Environmental Hydrogen Concentration as a Novel Factor Determining Changes in Redox Potential
1. 引言
电子传递的能量学特征由有机辅因子与无机辅因子的氧化还原(redox)电位决定,而这些辅因子的电位又受蛋白质环境影响 [1]。例如,在有氧呼吸过程中,氧气(O₂)作为最终电子受体被还原为水(H₂O);在无氧呼吸过程中,氢离子(H⁺)作为最终电子受体,胃肠道菌群中的部分微生物可产生氢气(H₂)[2]。氧化还原酶能催化至少两种底物的氧化与还原反应偶联,其活性既依赖于底物浓度,也依赖于酶催化反应及电子传递过程中的电化学电位 [3]。由于酶活性中心的辅因子(如铁、血红素、铜)可被蛋白质包裹,除反应底物与产物外,其他氧化还原底物对酶活性的影响十分有限。在蛋白膜伏安法中,部分酶可与电极连接,且根据电化学驱动力的方向,酶能催化反应向正向或反向进行(图 1)[4]。
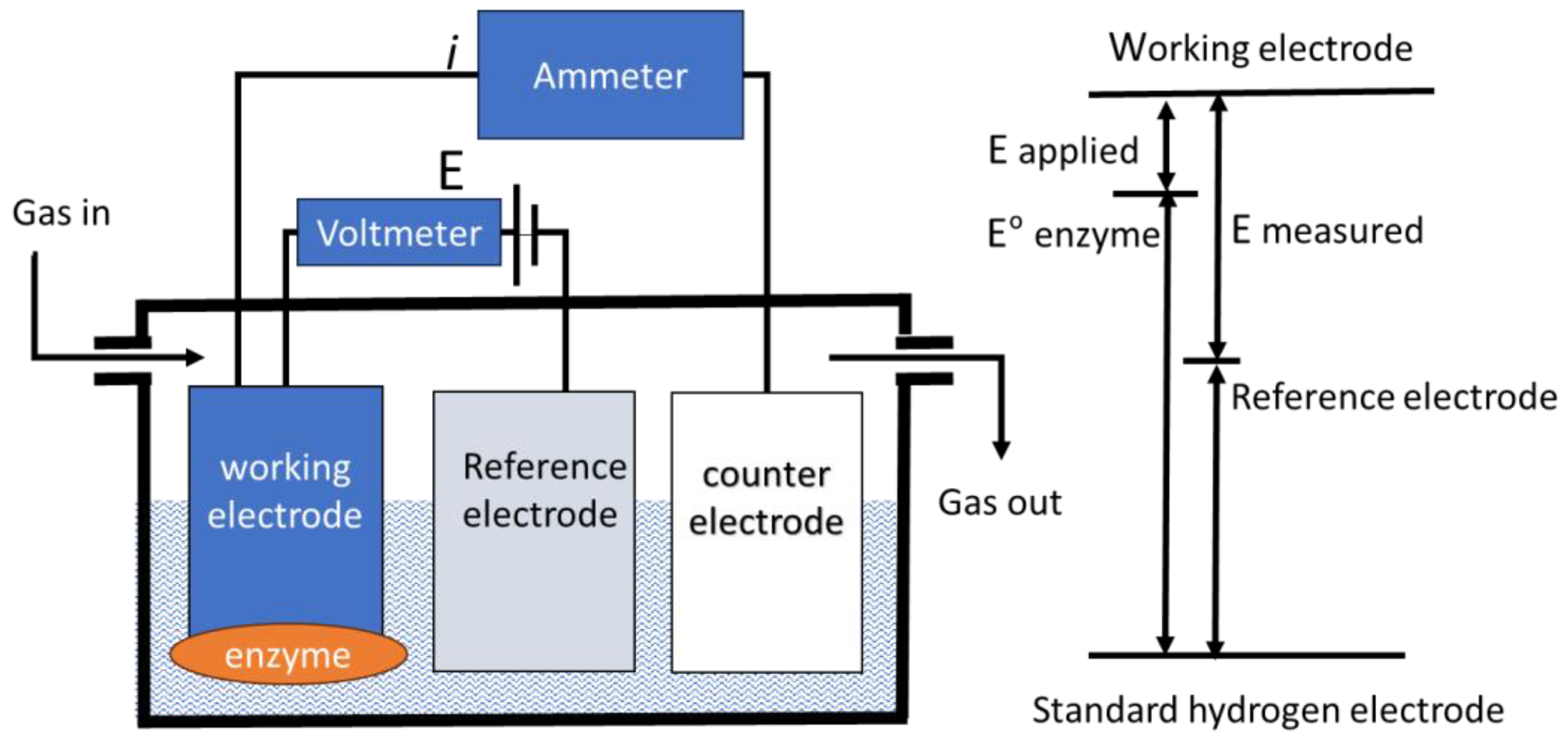
图 1 蛋白膜电化学实验装置示意图
将带有氧化还原酶膜的工作电极置于盛有溶液的电化学池中,再加入参比电极与对电极,即构成标准电化学测量中常用的三电极系统。在工作电极与参比电极之间施加电位,电流通过对电极形成回路。实验中可对气体流量(如 O₂和 CO₂浓度)进行控制。
热力学仅能预测开路电位(open circuit potential, OCP)的数值,此时电流(i)=0,反应正向与反向进行的速率完全相等(图 2)[5]。
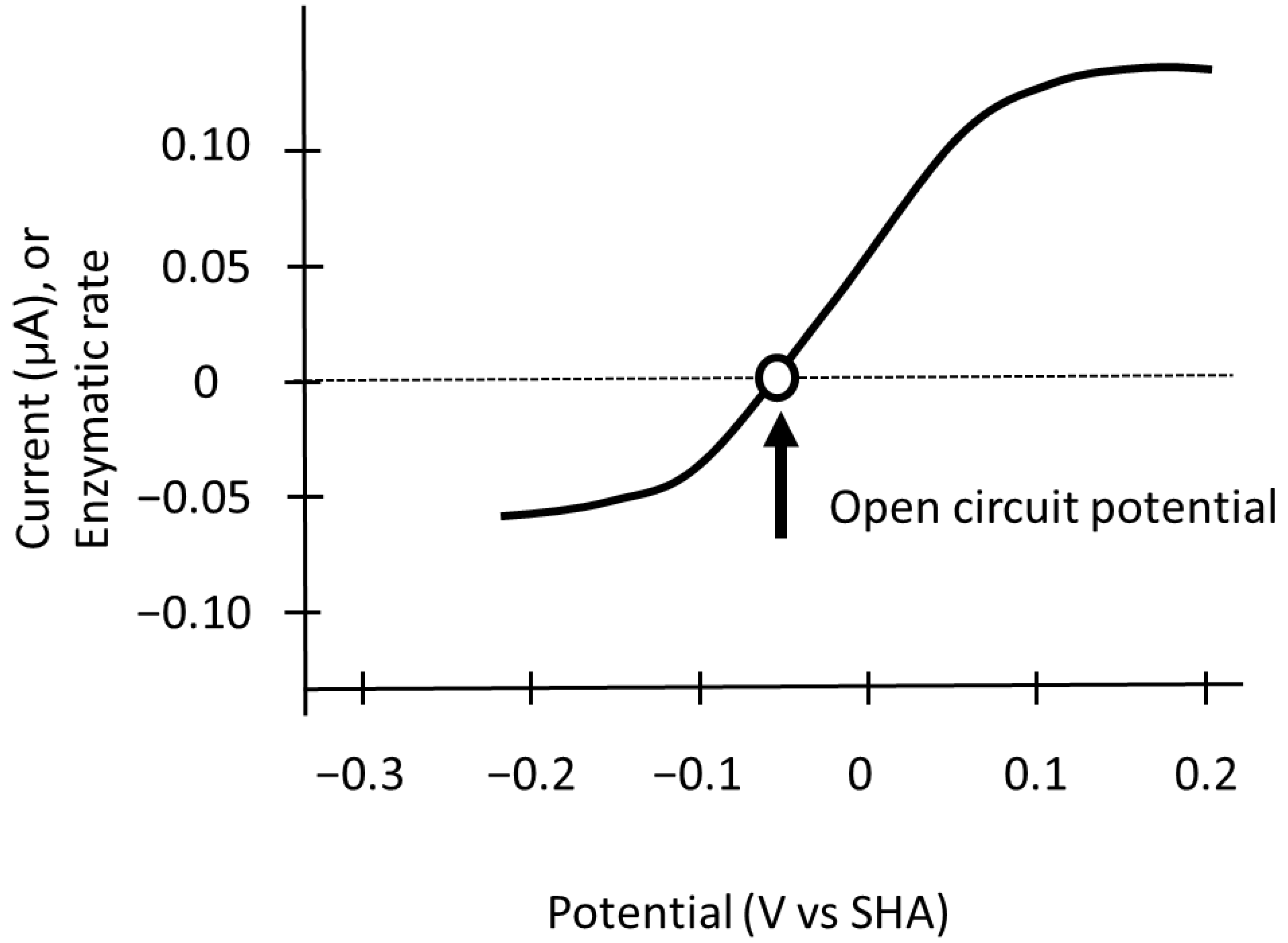
图 2 可逆氧化还原催化反应的理想电位 - 电流响应曲线
在可逆氧化还原催化反应中,理想的电位 - 电流响应呈现单条 S 型曲线:曲线在开路电位(OCP,以空心圆标记)处穿过零电流轴,在较高过电位下达到与电位无关的极限电流。当电极电位高于开路电位时,发生正向反应(即氧化反应),反应速率(电流)与电极电位呈正比;当电极电位低于开路电位时,发生反向反应(即还原反应),电流同样与电极电位呈正比。此外,与简单电化学过程类似,在电催化过程中,当过电位较高时,最终会出现一个与电位无关的速率限制步骤。
该开路电位与底物 / 产物组合的形式还原电位相等,利用能斯特方程(Nernst equation)和已发表的参数,可计算任意浓度比下的形式还原电位 [6]。即使在含有多种氧化还原物质的细胞内液中,氧化还原酶活性中心的氧化还原电位相对于标准氢电极(standard hydrogen electrode, SHE)仍保持恒定 —— 这是因为氧化还原酶的底物特异性可阻止其与其他溶质发生反应,且底物与产物处于平衡状态。以呼吸链复合体 Ⅱ 中的琥珀酸脱氢酶(succinate dehydrogenase, SDH)为例:随着电极电位升高,琥珀酸氧化活性的电位 - 电流曲线呈 S 型上升;而随着电极电位降低,延胡索酸还原反应的电位 - 电流曲线则呈下降趋势 [7]。由此可见,氧化还原酶催化反应的方向与速率,取决于其活性中心电极电位的变化。琥珀酸脱氢酶的氧化还原电位受 pH 影响较小(每变化 1 个 pH 单位,电位变化 10 mV),而底物 / 产物对的氧化还原电位受 pH 影响更大(每变化 1 个 pH 单位,电位降低 60 mV)[8]。然而,目前尚无用于检测体内氧化还原酶电位变化的指标,且氧化还原酶的电化学电位是否具有生理意义仍不明确。
2. 作为氧化还原酶所处环境的水相氧化还原电位
活生物体及培养细胞所处的环境呈中性且有氧。水会与气态氧(O₂)和 / 或氢气(H₂)发生平衡,同时也会与氧还原反应及氢离子还原反应产生的氢离子(H⁺)发生平衡 [9],相关反应如下:
4H⁺(水溶液) + O₂(气态) + 4e⁻ ⇄ 2H₂O (1)
2H⁺(水溶液) + 2e⁻ ⇄ H₂(气态) (2)
当电极电位较高时,会发生析氧反应;当电极电位较低时,会发生析氢反应。该电化学电位的变化范围被称为电化学窗口。能斯特方程将电极的平衡电位(E)与其标准电位(E⁰)、特定温度(T)下反应组分的浓度或压力关联起来,方程如下:

其中,n 为转移的电子数,F 为法拉第常数,R 为通用气体常数。O₂和 / 或 H⁺浓度升高时,其电化学电位会升高;H₂浓度升高时,其电化学电位会降低。根据能斯特方程,可计算水相的氧化还原电位:在 pH=7、温度为 25℃的条件下,当 O₂分压为 1 bar 时,E=+0.815 V;当 H₂分压为 1 bar 时,E=-0.414 V。因此,平衡溶液上方气态 O₂和 H₂的分压可通过能斯特方程决定溶液的电化学电位,该原理可用于克拉克电极(带渗透膜)检测溶解气体的分压 [10]。在 37℃条件下,纯水中 O₂/H₂O 体系的氧化还原电位变化与溶解氧张力(dissolved oxygen tension, DOT)及 H⁺活度的关系,可通过能斯特方程表示为 [11]:
ΔE = +15.4×Δlog (DOT) − 61.5×ΔpH(单位:mV) (4)
无细胞培养基的氧化还原电位与溶解氧张力的对数值呈正比,其斜率为 + 21.7~+34.7 mV/Δlog (DOT),高于能斯特方程预测的纯水中 15.4 mV 的斜率。有研究报道,在溶解氧张力恒定(3%~300%)的条件下,处于指数生长期和汇合期的杂交瘤细胞,其氧化还原电位在还原态与氧化态条件下的变化范围为 - 130~+70 mV [12]。不同的 O₂浓度不仅会影响氧化还原电位的绝对值,还会导致蛋白质氧化及硫醇等还原剂的生成。O₂是有氧代谢的必需物质,临床上可通过检测动脉血氧张力诊断呼吸和 / 或循环系统功能。
细胞并非处于平衡状态,且不同氧化还原对之间的偶联作用较弱,这导致细胞内共存的氧化还原对可形成不同的氧化还原电位 [13]。电化学最常见的应用之一是检测溶液中的氢离子浓度,但 pH 值与氢离子活度的关联性强于其与氢离子浓度的关联性,相关关系如下:

其中,aH⁺为氢离子活度,f 为活度系数,[H⁺] 为氢离子浓度。然而,由于 pH 的定义基于无法通过热力学有效方法测量的物理量,因此方程(4)仅为 pH 的名义定义 [14]。美国国家标准与技术研究院(NIST)根据特定标准电极在指定溶液中产生的电动势定义 pH 值,对于样品溶液(X)和标准 pH 溶液(S),其 pH 值关系如下:

该方程基于氢电极的半反应(方程 2),并符合能斯特方程。能斯特斜率(z)的计算公式如下:

其中,R 为气体常数(R=8.314 J・K⁻1・mol⁻1),T 为温度(单位:K),F 为法拉第常数(F=9.6485×10⁴ C・mol⁻1)。对 H⁺敏感的玻璃电极是化学及相关领域中最常用的传感器。1906 年,克雷默(Cremer)首次观察到薄玻璃膜与溶液接触时会产生电位差(类似氢电极的作用);1909 年,哈伯(Haber)和克莱门谢维奇(Klemensiewicz)利用这一现象研制出可测量溶液酸度的装置 [15]。实际上,玻璃电极属于半电池,其膜结构与另一半电池(Ag|AgCl;KCl | 玻璃膜)形成接触。
为维持稳态,人体会通过多种生理调节机制实现内环境稳定,维持酸碱平衡便是其中之一 [16]。血液中,H⁺(pH=7.4 时浓度为 40 nM)与磷酸盐(2 mM)、碳酸氢盐(25 mM)及血红蛋白(15 g/dL)处于平衡状态。溶解氧的稳态调节受到严格控制,且主要依赖血红蛋白:血浆中仅溶解约 2% 的 O₂,其余约 98% 的 O₂由红细胞中的血红蛋白携带 [17]。因此,由于这些缓冲系统的存在,无法将 pH 值或溶解氧作为评估人体内电化学电位的指标。
氢气(H₂)相关电化学特性及氧化还原酶电极电势研究
由于哺乳动物细胞中缺乏氢化酶,因此氢气(H₂)在哺乳动物细胞内属于惰性气体。在纯水中,氢气不易解离为氢离子(H⁺);但在催化剂(如铂)存在的条件下,氢气可与水发生反应[18]。尽管pH值与氧化还原电势存在比例关系,但在氢气分压为1至约6×10⁻⁴标准大气压(atm)的条件下,金电极上氢离子/氢气(H⁺/H₂)电对的平衡行为已得到验证[19]。一级pH标准值可通过无迁移电池的电化学数据推导得出,该类电池采用氢气电极,即哈恩德电池(Harned cell)[14]。因此,在pH值被缓冲的溶液中,环境中氢气的分压似乎是氢气电极的一个特定于氧化还原电势且灵敏度较高的影响因素。研究推测,环境中的氢气浓度是决定水溶液氧化还原电势变化的一个新因素。
3. 可逆氢电极电势作为参比电极的测量
标准氢电极(SHE)是电化学装置中的基础参比元件[20]。它由铂电极和质子(H⁺)活度为1(pH=0)的酸性溶液组成,逸度为1.00巴(bar,fH₂=1.00 bar)的氢气(H₂(g))以微小气泡的理想形式通入溶液中。然而,若上述参数中至少有一个不为1,则标准氢电极会转变为可逆氢电极(RHE),其电势也会偏离标准氢电极的电势。氢电极的工作原理基于氧化还原半反应(式(2))。电极电势可通过能斯特方程(Nernst equation),由氢离子活度和氢气逸度计算得出,具体公式如下:
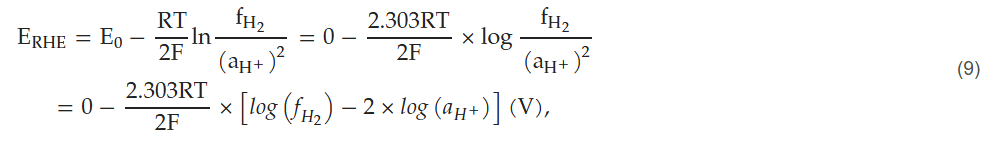
式中,aH+ 为氢离子活度,fH2为氢气逸度。能斯特斜率(2.303RT/2F)在25°C(T=297.15 K)条件下的计算过程如下:
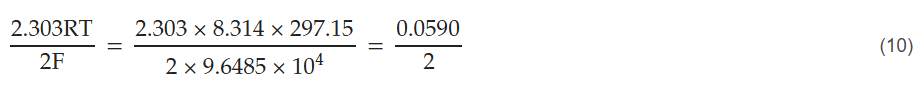
在液体混合物中,各组分的逸度与其在气液平衡状态下对应气相组分的逸度相等。氢气是一种痕量气体,在大气中的占比极低,其混合比约为0.530±0.006 ppm(10⁻⁶),且存在季节性变化[21]。全球海洋表层水体中的氢气通常处于过饱和状态,饱和度一般为大气中氢气的2至5倍(最高可达15倍),这些氢气主要由蓝细菌的固氮作用产生[22]。哺乳动物细胞中缺乏功能性氢化酶基因,但肠道微生物组可通过发酵产生氢气,部分氢气会经体循环后从肺部呼出[23]。肺泡空气中的氢气可使机体各器官和组织达到饱和状态[24]。健康日本人群呼气中的平均氢气浓度为13 ppm,是大气中氢气浓度的20倍[25]。pH=7.4时,氢离子浓度为40 nM;而根据亨利定律常数(Hcp=7.8×10⁻⁴ mol/(L·bar))计算,与13 ppm氢气平衡的溶液中,溶解态氢气的浓度为10 nM。
利用能斯特方程可分两个阶段解释氢离子(H⁺(aq))活度和氢气(H₂(g))逸度对氢电极电势的影响:
1. 第一阶段:假设氢气逸度为1,氢离子活度在10⁻1⁴至1.00 M之间变化。根据式(2)和式(8),可逆氢电极的电势可计算为:

负对数函数可将极小数值转化为更易处理的数值。任何溶液中氢离子浓度的范围为1 mol/L至10⁻1⁴ mol/L,对应的pH值范围为0.00至14.00。pH值的定义为:通过比较电极与标准pH溶液的电势差,对水溶液的酸度或碱度进行定量测量[17]。
2. 第二阶段:假设氢离子活度为1,氢气逸度在0.53×10⁻⁶(大气环境下)至1.00 bar之间变化。低压条件下,氢气的逸度等于其分压(P_H₂)与标准压力(P₀=1.00 bar)的比值(P_H₂/P₀),也等于其在海平面以上大气中的浓度(C_H₂)。此时可逆氢电极的电势可计算为:
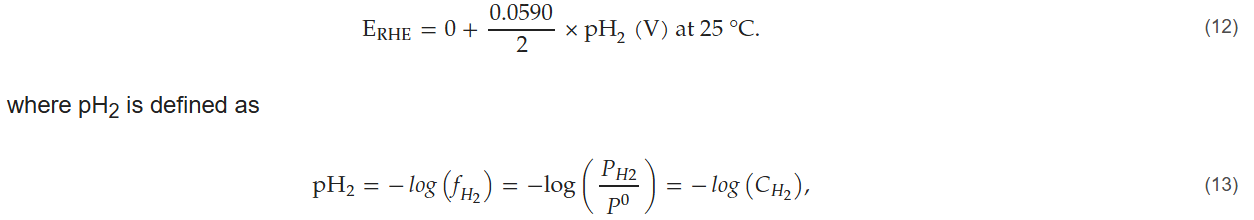
且pH₂的范围为0.00至6.28。
可逆氢电极的电势需结合溶液的pH值,以及通过氢气传感器测量的、与溶液平衡的气相氢气浓度所对应的pH₂值进行计算。若氢气逸度和氢离子活度均不为1,则根据式(11)和式(12),可逆氢电极的电势可计算为:

标准氢电极作为参比电极时,需向酸性溶液中持续通入氢气;而可逆氢电极则是一种半电池,其电极电势定义明确且重现性高,可替代标准氢电极使用[26]。
4. 氧化还原酶活性位点电极电势的变化
氧化还原中心的重要成员包括细胞色素(含血红素)和铜蓝蛋白(含蓝铜中心)。这些中心共同覆盖了生物体内氧化还原电势的全部范围,即电化学窗口[27]。溶液的氧化还原电势代表其混合电势。相互关联的氧化还原电对(如生物流体、细胞器、细胞或组织中存在的电对)所构成的氧化还原环境,由体系中所有相关氧化还原电对的还原电势与还原能力的乘积之和决定[28]。历史上,科研人员已开发出多种方法,用于估算作为溶质的氧化型/还原型烟酰胺腺嘌呤二核苷酸(NAD⁺/NADH)和谷胱甘肽/氧化型谷胱甘肽(GSH/GSSG)比值对应的实际细胞还原电势,并判断特定物质是否发生还原或氧化反应[29,30]。细胞内液中含有多种氧化还原物质,同时溶解有氧气(O₂)、氢气(H₂)和氢离子(H⁺,即pH值)(图3)。
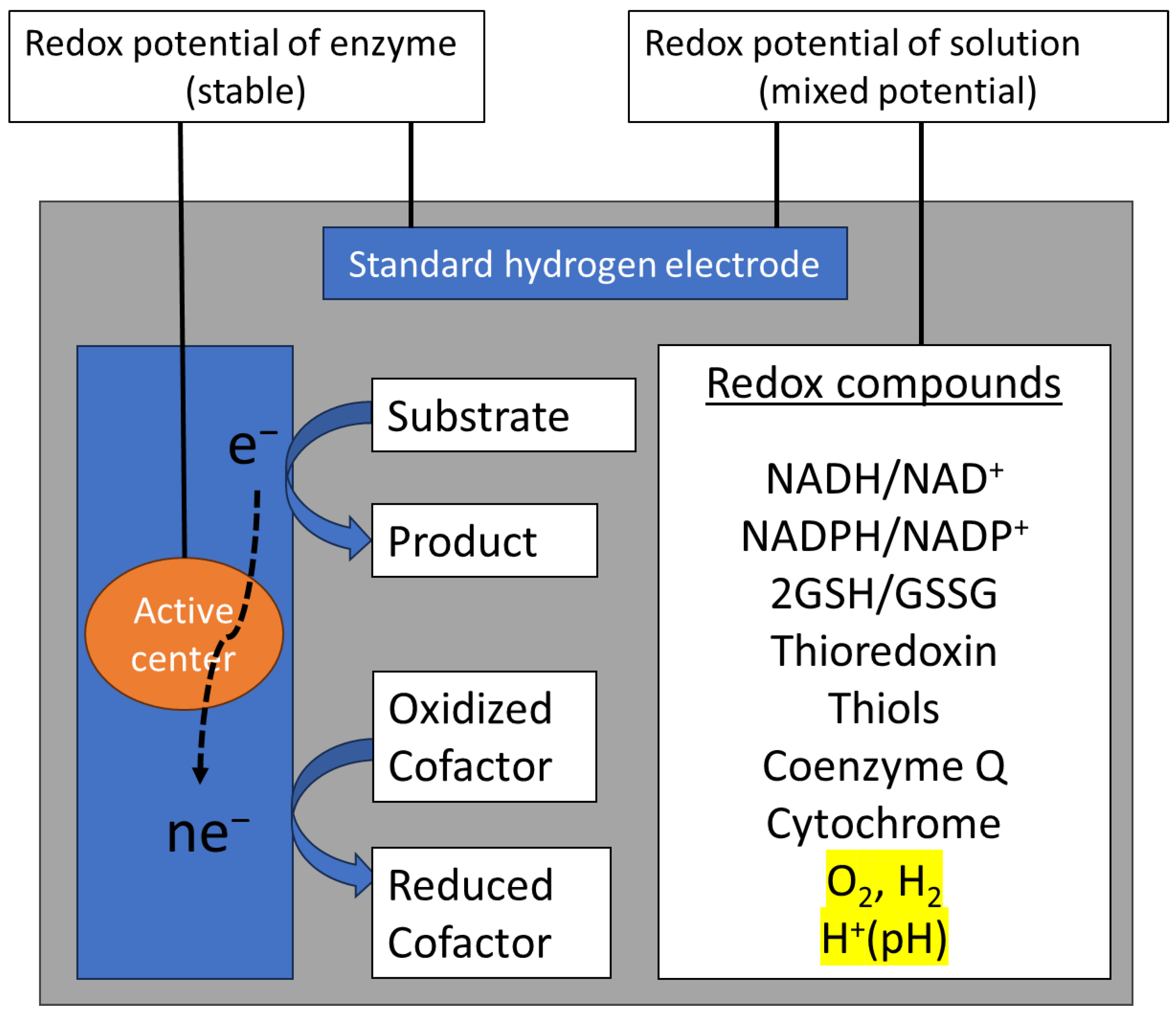
图3. 酶与溶液的氧化还原电势
氧化还原酶分子量大,且其大部分体积具有电子绝缘性,这使得即使底物/产物比值不恒定,酶活性中心的氧化还原电势相对于标准氢电极仍能保持稳定。溶液中存在多种具有不同氧化还原电势的氧化还原对(如烟酰胺腺嘌呤二核苷酸、谷胱甘肽、硫醇等),同时还含有氧气和氢气。溶液的氧化还原电势代表其混合电势。
电极电势可定义为固体导体(金属)中某点与电解质溶液中某点之间的电势差[31]。在实际测量中,需引入另一电极(即参比电极),以相对值的形式测定电极电势。例如,可使用带渗透膜的克拉克电极(Clark electrode)测量溶解氧(O₂)浓度[32],使用玻璃电极测量pH值(即H⁺浓度)。每种氧化还原酶活性位点相对于标准氢电极都具有特定的固有氧化还原电势(E°)[33]。氧化还原中心的电势(E°′)具有稳定性,这既源于酶的底物特异性,也与底物/产物的平衡状态有关。该电势的计算依据是其与水的氧化还原电势(E_water)的差值,而非基于氧化型/还原型电对的比值。在溶液中,以水为溶剂(即混合电势条件下),每个氧化还原中心的电化学电势均有所不同(图4)。

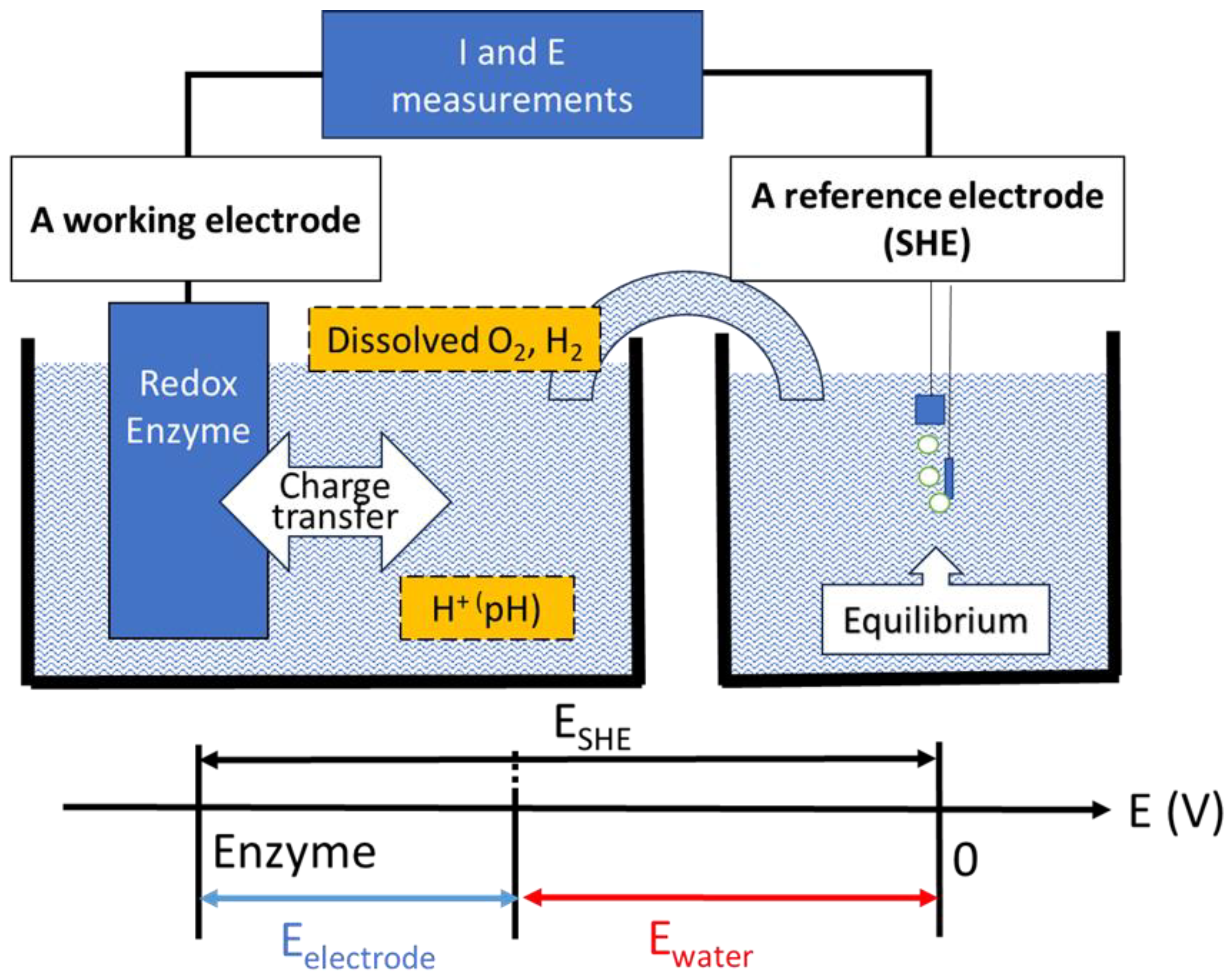
图4. 工作电极(氧化还原酶)与参比电极(标准氢电极,SHE)的关系
电极电势是固体导体(氧化还原酶)中某点与电解质溶液中某点之间的电势差(即伽伐尼电势)。在实际测量中,需引入另一电极(参比电极),以相对值的形式测定电极电势。例如,可通过该方法测量含有溶解氧、氢气和氢离子(pH值)的水溶液的电势,并结合电势-pH图判断某物质是否发生还原或氧化反应。氧化还原酶的电极电势由其活性中心与水的氧化还原电势差决定。
水的氧化还原电势由氧气和氢气的相对浓度决定:当氧气因消耗而导致氧分压降低,环境流体处于还原状态时,氧化还原酶的电极电势会升高;当外源氧气供应导致氧分压升高,环境流体处于氧化状态时,氧化还原酶的电极电势会降低。在杂交瘤细胞培养中,还原条件下细胞存活率、单克隆抗体浓度和硫醇产量均达到最高[12];而氧化条件则对所有培养参数均产生不利影响,不仅会提高葡萄糖、谷氨酰胺和氧气的比消耗速率,还会诱导细胞凋亡过程。
任何氧化还原酶的标准电势均应以标准氢电极为参比进行报告。可逆氢电极与标准氢电极的电势值可通过以下公式轻松换算:

式中,E°为以标准氢电极为参比测得的电势;E°′为以可逆氢电极为参比测得的电势;E_RHE为可逆氢电极相对于标准氢电极的电势(图5)。当在其他氢气压力条件下进行测量时,酶的电极电势(E°′)与可逆氢电极电势(E_RHE)之和,等于该条件下酶的电极电势(E°″)与可逆氢电极电势(E′_RHE)之和。

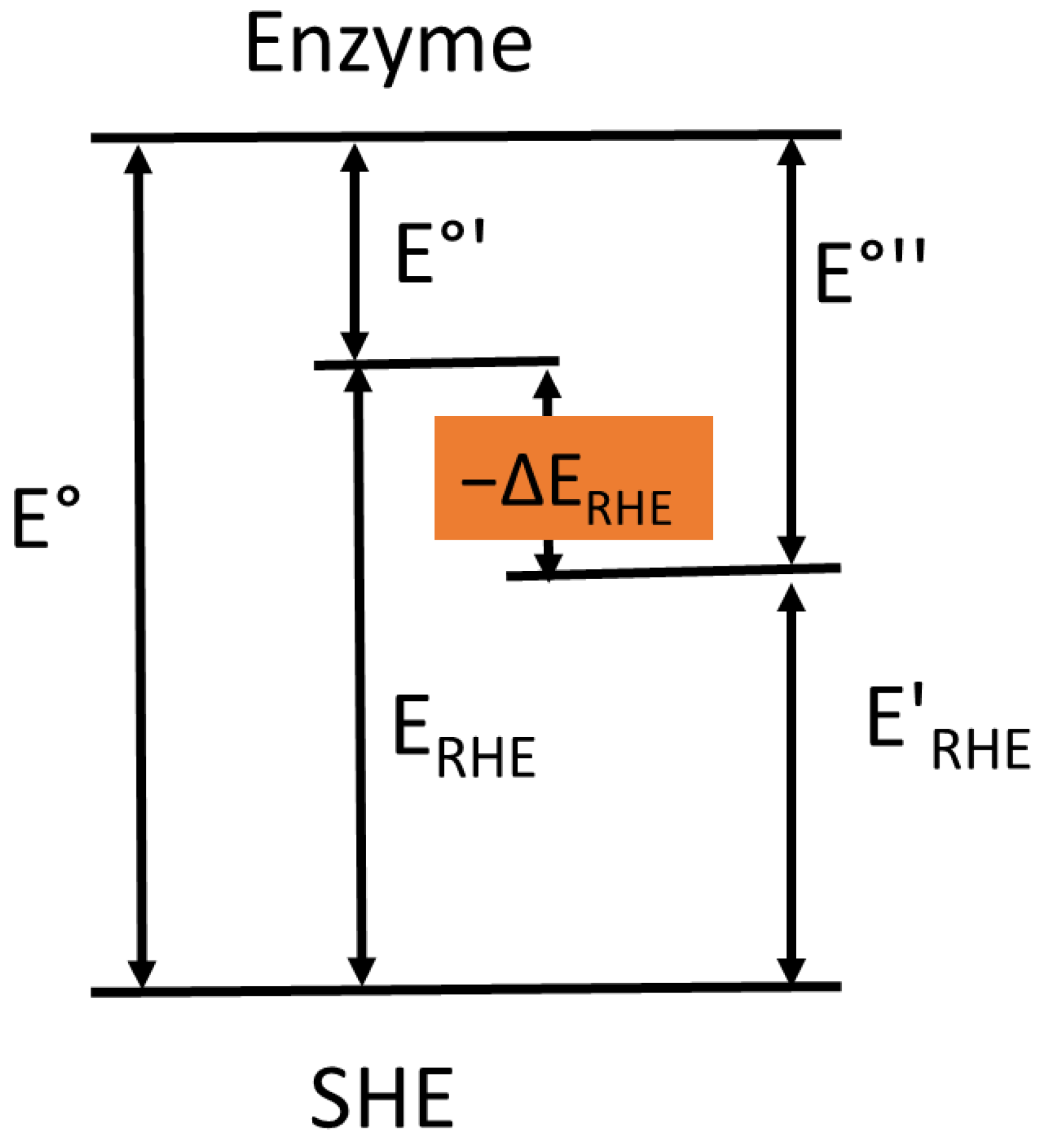
图5. 酶与可逆氢电极(RHE)的氧化还原电势
氧化还原酶电极电势的变化由可逆氢电极电势的变化引发,具体关系如下:

可逆氢电极的电势取决于溶液pH值和氢气压力,因此在实验中常被广泛用作参比电极。当可逆氢电极电势随pH值和氢气压力发生变化时,电极电势差($Delta E$)由可逆氢电极电势的这些变化(Delta E)决定。
即便存在pH缓冲体系,当环境中氢气分压升高且环境流体处于还原状态时,需考虑氧化还原酶的电极电势变化。研究表明,根据能斯特方程,氢气分压(环境浓度)的升高会降低磷酸盐缓冲溶液的氧化还原电势[25]。
 氢气分压升高会导致氧化还原酶的电极电势升高。在pH值被缓冲的任何体系中,电极电势的变化均可通过以下公式计算:
氢气分压升高会导致氧化还原酶的电极电势升高。在pH值被缓冲的任何体系中,电极电势的变化均可通过以下公式计算:
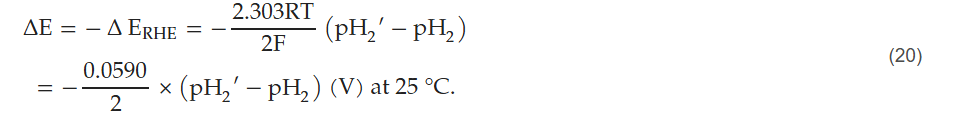 因此,在有氧条件下,氢气浓度的下限为大气中的氢气浓度;氢气浓度升高/pH₂降低会导致氧化还原酶的电极电势升高,在37°C(310.15 K)条件下,具体关系如下(图6):
因此,在有氧条件下,氢气浓度的下限为大气中的氢气浓度;氢气浓度升高/pH₂降低会导致氧化还原酶的电极电势升高,在37°C(310.15 K)条件下,具体关系如下(图6):
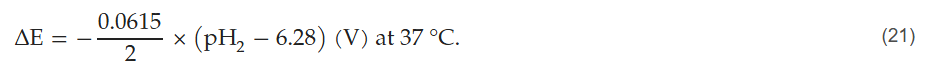
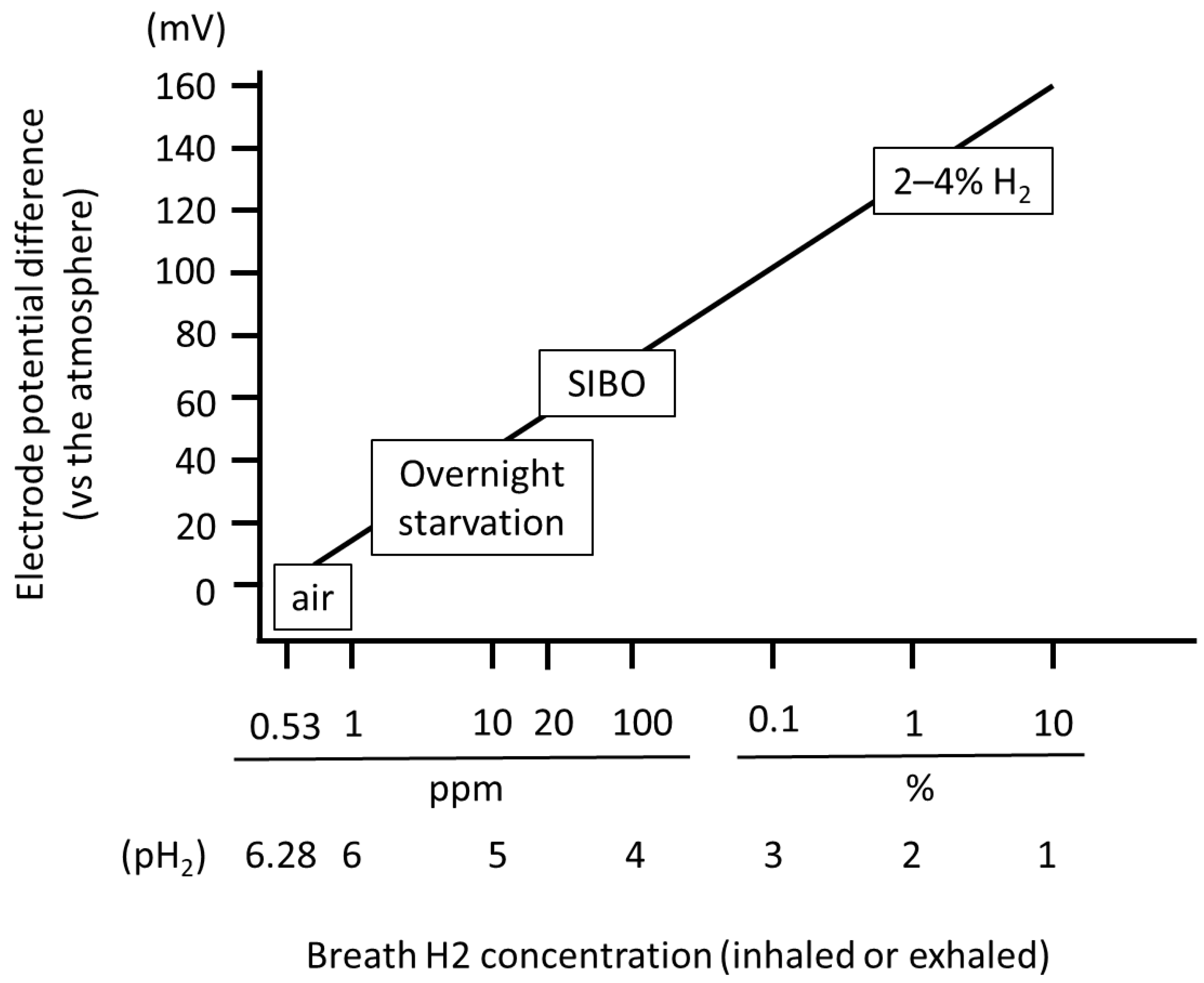
图6. 相对于大气的电极电势差(Delta E)与呼气中氢气浓度的关系
呼入/呼出气体中的氢气浓度范围为0.53 ppm至4%,对应的pH₂(氢气浓度的负对数)范围为6.28至1.4。相对于大气的电极电势差与pH₂呈正比关系。
5. 环境中氧气(O₂)和/或氢气(H₂)水平改变氧化还原反应方向与活性氧(ROS)生成
血液中约98%的氧气与红细胞(RBC)中的血红蛋白结合,而血浆和红细胞内水中溶解的氧气仅占总量的2%左右[17]。氧气的溶解度极低(在氧分压为100 mmHg时,溶解度为0.3体积%),且氧气会在线粒体呼吸链的复合物IV处被消耗。在动物模型中,给予100%氧气会使皮下和大肠壁内的氧分压翻倍,并使小肠内的氧分压升高至40%[34]。在高压氧条件下,通过磁共振成像(MRI)测得的脑内细胞外氧分压显著低于动脉血氧分压(pO₂),但略高于脑静脉血氧分压[35]。即使在3.5绝对大气压(ATA)的高压氧环境(2660 mmHg)下,脑静脉血仍未完全饱和(氧分压低于100 mmHg)[36]。这是因为血浆中溶解的氧气被快速消耗,红细胞中的血红蛋白会释放氧气,最终导致静脉血氧分压低于100 mmHg。研究发现,4.8 ATA的高压氧会迅速导致人肺细胞内生物能量代谢紊乱,并引发氧中毒[37]。
体外研究表明,外源性低氧条件(0.2% O₂)会降低线粒体中的氧气浓度和活性氧(ROS)水平,而外源性高氧条件(40% O₂,300 mmHg)则会升高线粒体中的氧气浓度和ROS水平[38]。缺血再灌注损伤是指缺血或缺氧后血液重新供应至组织时,由ROS引发的组织损伤。研究显示,在缺血过程中,大鼠肝脏线粒体的平均氧分压从约30-40 mmHg降至约10 mmHg[39]。再灌注15分钟后,线粒体氧分压分布发生彻底改变,与基线状态相比整体呈平缓趋势;线粒体氧分压直方图显示,低氧区域和高氧区域的分布更为显著,且再灌注过程中部分区域的氧分压向更高水平发展。血液中高于正常水平的氧气会增加ROS的生成,可能加剧再灌注损伤[40]。澳大利亚开展的“心肌梗死中空气与氧气对比(AVOID)试验”为这一负面影响提供了证据,该试验表明,与未接受氧气治疗的患者相比,ST段抬高型心肌梗死(STEMI)患者接受氧气治疗后,梗死面积更大[41]。
ROS主要由呼吸链的复合物I和复合物III通过反向电子传递产生[42]。由于电子传递方向取决于电势梯度,线粒体中相对较高的氧分压会影响复合物I和复合物III中活性中心的氧化还原电势。在1升生物反应器中,通过自动控制进气组成以维持恒定的溶解氧分压,可分别维持体系处于还原状态和氧化状态[12]。研究观察到,随着培养体系氧化还原电势的升高,活细胞最大浓度、单克隆抗体浓度和硫醇浓度呈线性下降,而各类营养物质的消耗速率则呈上升趋势。这一现象表明,氧化性更强的环境对培养体系的性能具有不利影响。除了控制进气氧分压外,还可通过调控其他独立变量(如pH值)或添加不同抗氧化剂来控制培养体系的氧化还原电势[43]。
长期以来,氢气被认为是“生物惰性气体”,在常压下无法与生物分子发生反应。与氧气相比,人们对氢气生物学效应的了解仍十分有限。有趣的是,有研究报道称,在大鼠模型中,吸入氢气可降低氧化应激水平,减小脑梗死体积和心肌梗死面积[44,45]。当向从A549细胞中分离出的线粒体中添加氢气时,琥珀酸驱动的电子传递会从反向转为正向,且主要由呼吸过程产生的ROS会被抑制[46]。在复合物I中,环境中的氢气会影响电子传递方向和ROS生成:氢气可使线粒体膜电位降低11%,而线粒体膜电位的下降会抑制复合物III中ROS的生成[47]。此外,为预防缺血再灌注损伤,需在损伤发生前吸入2-4%的氢气。由于大气中氢气浓度低于百万分之一,吸入2-4%的氢气可抵消缺血再灌注过程中线粒体氧分压从0-10 mmHg升至30-40 mmHg所引发的氧化还原电势波动。
6. 环境中氢气浓度波动与代谢
在健康人体中,氢气由肠道微生物群产生,并根据氢气分压梯度从肺部呼出。有研究报道,年轻女性呼气中的氢气浓度存在明显的昼夜节律:早晨升高,16:00左右降至最低,随后在夜间再次升高[48]。呼气中氢气的排出量不仅取决于进食和禁食模式,还与宿主器官功能相关[49]。在检测前24小时摄入低碳水化合物饮食,可减少呼气中氢气的排出量[50];而摄入抗性淀粉和膳食纤维则会增加呼气中氢气的排出量[51,52]。研究发现,外分泌性胰腺功能不全和小肠细菌过度生长(SIBO)患者在禁食状态下,呼气中的氢气浓度更高[53,54];且SIBO患者的体重、体重指数(BMI)和内脏脂肪含量与氢气生成量呈负相关[55]。
一项在体研究表明,大鼠每日两次吸入4%的氢气、每次1小时、持续6个月后,体重下降,且参与“烟酰胺腺嘌呤二核苷酸磷酸(NADP⁺)还原为还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)”反应的代谢物水平升高,例如葡萄糖-6-磷酸脱氢酶(G6PD,参与磷酸戊糖途径)、6-磷酸葡萄糖酸脱氢酶(参与磷酸戊糖途径)以及苹果酸(参与三羧酸循环和胞质代谢)[56]。在脉冲伏安法(PFV)检测中,当施加电势相对于Ag/AgCl电极从+0.2 V升至+0.8 V时,G6PD的氧化电流迅速增加[57]。谷胱甘肽还原酶(GR)以NADPH为还原辅因子,催化氧化型谷胱甘肽(GSSG)还原为还原型谷胱甘肽(GSH),且其初始反应速率会随NADPH浓度的升高达到饱和[58]。
尽管呼气中的氢气浓度会在一天中发生波动,但短期暴露于高浓度氢气可能会影响氧化还原酶的反应速率,进而促进NADP⁺和GSSG的还原。因此,气态环境氢气可能成为一种新的调控手段——通过调控氧化还原酶的电极电势,来评估酶的动力学特征和机体的代谢功能。未来研究需深入探讨相关酶动力学机制,以充分阐明可逆氢电极电势如何影响细胞氧化还原状态和氧化应激水平。
7. 结论
氢气由结肠微生物群发酵产生,并从肺部呼出体外。氢气呼气试验可通过无创方式测量潮气末氢气浓度,该浓度与组织内氢气浓度处于平衡状态:当组织中氢气分压高于潮气末氢气分压时,氢气会扩散至肺泡并被呼出;当组织中氢气分压低于潮气末氢气分压时,氢气会从肺泡扩散至组织。氢气浓度通常以其在大气中的体积百分比表示,因此呼气中的氢气浓度可视为与其分压相等。
可逆氢电极电势取决于与溶液平衡的气态氢气分压的对数值,以及溶液中氢离子的活度。本研究引入“环境氢气浓度的负对数(pH₂)”作为一项指标,通过与大气环境对比,评估人体的氧化还原电势,进而分析代谢功能和ROS生成情况。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1503727.html?mobile=1
收藏

