氢气减轻青鳉急性缺氧诱导的脑部氧化损伤与炎症损伤
缺氧诱导的脑部氧化应激与炎症是导致神经系统疾病的关键因素。氢气作为一种具有强效抗氧化和抗炎特性的治疗剂,近年来受到广泛关注。本研究旨在评估氢气对急性缺氧诱导青鳉脑部损伤的保护作用。实验中将青鳉暴露于缺氧环境后,分别置于通入空气、氢气或臭氧的水体中恢复。
通过LOX-1缺氧探针成像与缺氧诱导因子-1α(HIF-1α)免疫染色发现,空气组和臭氧组青鳉的脑组织存在持续性缺氧,而氢气处理显著缓解了这一现象。组织学分析显示,缺氧后青鳉中脑区域出现广泛血管淤血,氢气处理可明显减轻该损伤。末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)实验表明,氢气能抑制缺氧诱导的神经元凋亡。
免疫组织化学与酶联免疫吸附测定(ELISA)结果显示,空气组和臭氧组青鳉脑部的8-羟基-2'-脱氧鸟苷(8-OHdG,氧化损伤标志物)及促炎标志物(环氧合酶-2(COX-2)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α))水平显著升高,而氢气处理可有效抑制这些指标的上升。氧自由基吸收能力(ORAC)实验证实,氢气能恢复脑部的抗氧化能力。行为学分析进一步表明,氢气处理可改善青鳉的运动活性并稳定其呼吸功能。
上述结果表明,氢气可保护青鳉免受缺氧诱导的氧化损伤与炎症损伤,或许能为缺氧相关神经系统疾病提供一种具有潜力的治疗策略。
Sato E, Shimamura N, Saiki C, Sunada K, Miwa N, Xiao L. Hydrogen Gas Mitigates Acute Hypoxia-Induced Oxidative and Inflammatory Brain Injuries in Medaka (Oryzias latipes). Antioxidants (Basel). 2025 Sep 18;14(9):1130.
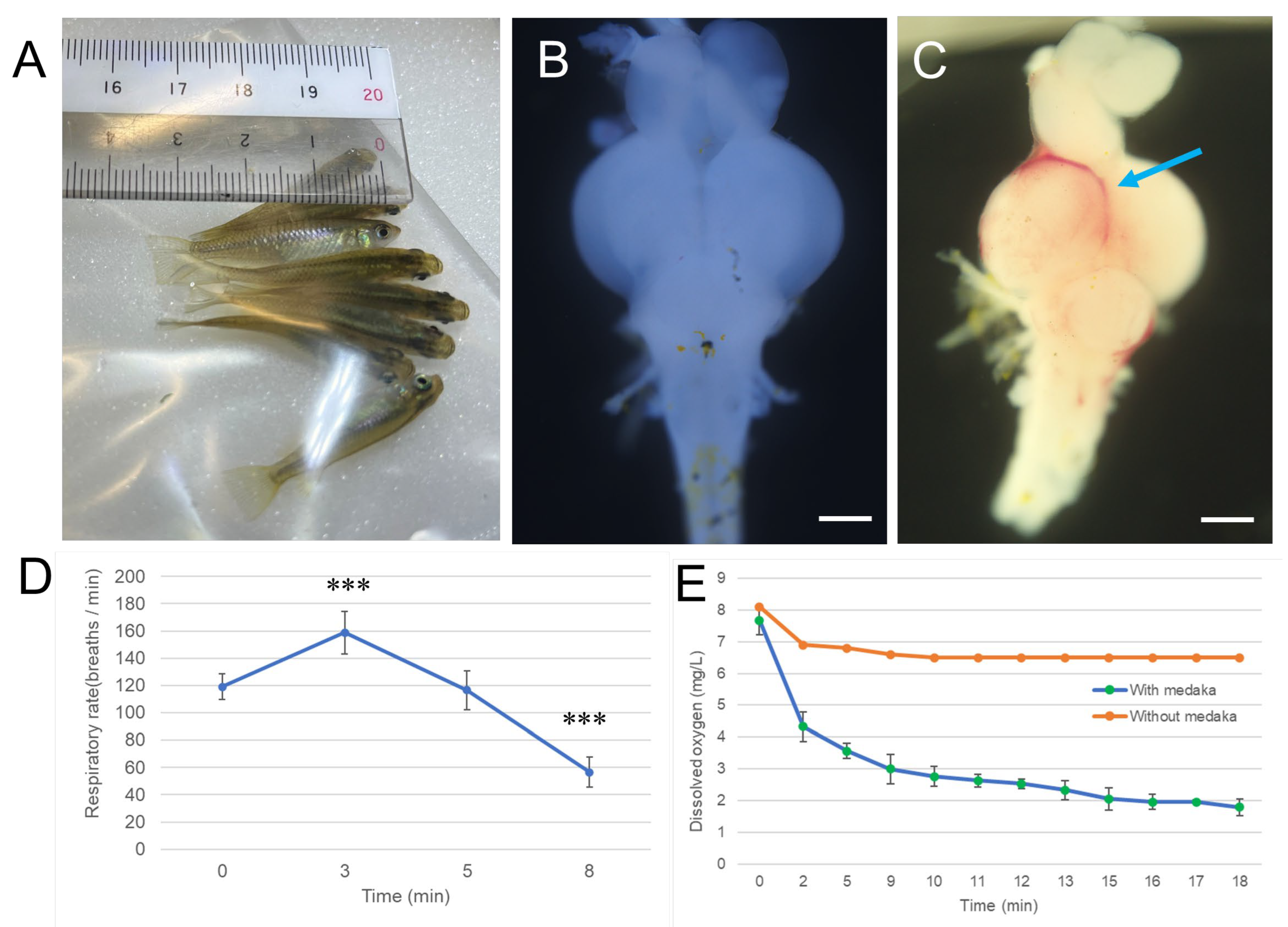
图 1. 缺氧诱导青鳉呼吸频率改变与脑部出血
将 Matsushiro 品系青鳉置于仅含少量水和空气的密封袋(Ziplock bag)中 9 分钟,以构建急性缺氧环境。暴露期间,使用 TOMLOV 数码显微镜记录青鳉的鳃盖运动(即呼吸频率)。在不同时间点,每次记录 30 秒内青鳉的呼吸次数,每个时间点重复记录 3 次。将溶解氧探针插入上述密封袋中以测定溶解氧浓度,为防止漏气,该密封袋需进一步装入两个更大的密封袋内密封。对溶解氧水平进行 18 分钟的持续监测。缺氧处理后,将青鳉转移至通入空气的水体中,恢复约 1 小时。随后解剖青鳉并取出完整脑部,进行宏观观察。
1. 引言
氧气对于维持神经元代谢和突触功能至关重要。即使是短暂的缺氧,也可能导致大脑(人体对氧气依赖性最强的组织之一)出现广泛功能障碍[1]。脑缺氧会干扰线粒体呼吸、增加活性氧(ROS)生成、消耗内源性抗氧化防御物质,并破坏细胞能量稳态。这些作用共同引发氧化应激和神经炎症,进而导致神经元功能异常甚至死亡[2,3,4]。
缺氧诱导的脑氧化损伤是急性神经系统疾病(如中风、围产期窒息[5,6])以及与衰老相关的慢性神经退行性疾病的关键致病因素。持续性或间歇性缺氧会加剧DNA氧化损伤、脂质过氧化和蛋白质氧化,进而诱发神经元凋亡、损害神经发生,并导致认知功能下降[7,8,9]。在慢性间歇性缺氧状态下的脑区中,已检测到氧化DNA损伤标志物——8-羟基-2'-脱氧鸟苷(8-OHdG)水平升高,这与神经退行性疾病早期阶段相关,凸显了氧化应激在缺氧相关神经病理过程中的作用[10]。
缺氧诱导因子-1α(HIF-1α)是细胞应对缺氧反应的核心分子,作为关键转录调控因子,它能帮助细胞适应低氧环境。在新生儿缺氧缺血性脑损伤中,HIF-1α的短暂激活可通过诱导促红细胞生成素(EPO)和血管内皮生长因子(VEGF)发挥神经保护作用,支持神经元存活并促进新生血管形成。然而,HIF-1α的持续表达则与神经元凋亡增加、血脑屏障(BBB)破坏相关,从而加剧神经炎症和组织损伤[11,12]。
此外,缺氧还会刺激促炎酶和细胞因子的表达,包括环氧合酶-2(COX-2)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α),这些物质会放大神经炎症级联反应,加速神经元损伤[13,14,15]。血管功能障碍也是缺氧性脑损伤的典型特征:缺氧会破坏血脑屏障完整性、诱发微血管出血,并促进脑水肿[16]。这些血管病变会阻碍神经毒性代谢产物的清除,进一步加剧神经退行性改变。
鉴于缺氧诱导的脑损伤具有多因素特性(包括ROS过量生成、炎症信号激活和血管功能障碍),目前迫切需要能同时靶向这些相互关联病理通路的治疗策略。分子氢(H₂)因其具有选择性抗氧化和抗炎特性,作为潜在神经保护剂受到越来越多的关注。在中风、新生儿缺氧缺血性脑病和创伤性脑损伤的动物模型中,临床前研究表明,给予H₂可缩小梗死面积、抑制神经元凋亡、减轻细胞因子释放,并改善功能预后[17]。例如,小鼠吸入2% H₂ 1小时,可通过调节神经炎症、减轻氧化应激和阻止神经元死亡,显著缓解脑损伤并改善认知障碍;在创伤性脑损伤后的肺部保护中,也观察到了类似的保护效应[18,19]。此外,近期一项前瞻性、多中心、随机、双盲、安慰剂对照临床试验显示,在心脏骤停后护理期间,吸入2% H₂可改善脑缺血患者的神经预后[20]。
青鳉(Medaka)是一种遗传学可控且生理特性与脊椎动物高度相关的模型生物,其缺氧信号通路与哺乳动物具有保守性,非常适合用于研究缺氧损伤效应。以往研究表明,青鳉在缺氧应激下会产生广泛的生物学反应,包括基因表达改变、卵泡发育异常、激素失衡,甚至会出现遗传雌性向表型雄性的性别分化转变[21,22]。在分子水平上,缺氧可激活p53、PI3K-Akt等关键神经血管和代谢通路,这进一步证明了青鳉在缺氧相关研究中的适用性[23]。在神经学研究中,青鳉还具有独特优势:胚胎透明、神经系统保守、行为可量化,且在伦理和实验操作方面更具便利性。本研究进一步强调,优化组织保存技术对于充分发挥青鳉在神经生物学研究中的应用价值至关重要[24]。
基于上述研究背景,本研究以成年日本青鳉(Oryzias latipes)为模型,探究急性缺氧诱导的脑损伤。我们检测了多种病理指标,包括氧化应激、炎症反应、血管淤血、神经元凋亡、呼吸模式改变和行为缺陷。利用青鳉体型小、适合整体分析的特点,我们建立了一套简单且可重复的实验方案,用于诱导急性缺氧并评估恢复情况。研究采用了一系列综合评估方法——包括组织学染色、末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)实验、免疫组织化学(IHC)、氧化DNA损伤检测、酶活性测定、呼吸频率监测和行为追踪——以表征组织损伤及恢复干预措施的效果。此外,我们还通过比较青鳉在通入氢气、空气或臭氧的水体中缺氧后的恢复情况,探究了具有已知抗氧化和抗炎特性的小分子——氢气(H₂)的治疗潜力。本研究为青鳉模型在缺氧诱导器官损伤研究中的应用提供了新方向,并证实氢气有望成为缓解急性缺氧应激相关脑损伤的干预手段。
2. 材料与方法
2.1 试剂与仪器
缺氧探针溶液(LOX-1)购自日本东京MEDICAL & BIOLOGICAL LABORATORIES株式会社。戴维森固定液(Davidson’s solution)购自日本武藤纯化学品株式会社(Muto Pure Chemicals Co. Ltd.)。其他常规试剂购自日本大阪富士胶片和光纯药株式会社(FUJIFILM Wako Pure Chemical Corporation)。溶解氧测定仪(型号DO-5519E)购自日本大阪惠尼斯公司(Kenis co., Inc.)。氢气发生器(型号Lita Air)购自日本大阪利塔心脏国际株式会社(Lita Heart International Co., Ltd.);臭氧发生器(型号R200-Black-JP,品牌WUOAUM)和气泵(型号FEDOUR 300LPH)购自日本亚马逊(Amazon.co.jp,东京亚马逊公司)。
2.2 实验动物
所有实验操作均经日本齿科大学东京生命齿学部动物伦理委员会批准(批准号:24-14-1,2024年10月10日),并严格遵循ARRIVE指南(动物研究报告规范指南)。野生型成年日本青鳉(Oryzias latipes)包括Matsushiro品系、Himedaka品系(红色)和黑色品系,均来源于日本国家生物资源项目青鳉资源库(https://shigen.nig.ac.jp/medaka/,访问日期:2025年1月14日)及当地水族供应商。青鳉饲养于水族箱中,环境为12小时光照/12小时黑暗循环,水体为经除氯处理的自来水(添加硫代硫酸钠,浓度为2 mL/10 L),饲养温度为室温,每日投喂商业干饲料。实验用青鳉(雌雄混合,总长度30-40 mm)随机分配至各处理组。由于未观察到显著的性别特异性差异,故将雌雄青鳉的数据合并进行分析。
2.3 缺氧暴露与恢复
将5-20条青鳉置于密封拉链袋(A7-A5尺寸)中,袋内仅含少量水和有限空气,暴露9-30分钟以诱导缺氧(图1A)。使用TOMLOV数码体视显微镜(中国深圳TOMLOV公司)记录青鳉的鳃盖运动。采用溶解氧测定仪测量水体溶解氧浓度(补充视频S1)。缺氧处理后,将青鳉分别转移至通入空气(Air组)、含4%氢气的空气(H₂组)或臭氧(O₃组,浓度0.02-0.03 ppm)的水体中,恢复1小时。参照既往方法[25],通过低温麻醉法处死青鳉,取其脑部用于后续分析;或将脑部置于戴维森固定液中固定,经脱水后进行石蜡包埋。
图1 缺氧诱导青鳉呼吸频率改变与脑部出血
将Matsushiro品系青鳉置于仅含少量水和空气的密封拉链袋中9分钟,构建急性缺氧环境。暴露期间,使用TOMLOV数码显微镜记录青鳉的鳃盖运动(即呼吸频率)(补充视频S1)。在不同时间点,每次记录30秒内青鳉的呼吸次数,每个时间点重复3次。将溶解氧探针插入上述密封袋中以测定溶解氧浓度,为防止漏气,该密封袋需进一步装入两个更大的密封拉链袋内。对溶解氧水平进行18分钟的持续监测,补充视频S1中展示了8-9分钟时段内具有代表性的10秒监测片段。缺氧处理后,将青鳉转移至通入空气的水体中,恢复约1小时。随后解剖青鳉并取出完整脑部,进行宏观观察。(A)青鳉在密封拉链袋中接受缺氧暴露的照片;(B)未接受缺氧暴露的青鳉完整脑部代表性图像;(C)缺氧恢复后青鳉完整脑部代表性图像,蓝色箭头指示出血区域,比例尺=500 μm;(D)缺氧暴露期间青鳉呼吸频率的变化,***p<0.001,与0分钟时相比;(E)缺氧暴露期间水体中的溶解氧水平。所有实验均独立重复5次。
2.4 LOX-1信号成像
在低温麻醉条件下,使用微量注射泵(型号MSPE-1,日本东京As One公司)通过腹腔注射给予青鳉LOX-1(浓度2 mM,体积10 μL)[25]。在正常水体中恢复1小时后,按照上述方法对青鳉进行缺氧处理及后续恢复。使用振动切片机(型号NeoLinearSlicer MT,日本京都Dosaka EM公司)将脑部切成200 μm厚的切片,并用激光共聚焦扫描显微镜(型号LSM700,日本东京卡尔蔡司公司)进行成像。采用ImageJ软件(1.54p版本,美国国立卫生研究院,马里兰州贝塞斯达市)对荧光强度进行定量分析[26]。
2.5 组织学与免疫组织化学检测
将石蜡包埋的脑部切片(厚度10 μm)进行苏木精-伊红(H&E)染色和免疫组织化学染色。所用一抗包括抗缺氧诱导因子-1α(HIF-1α)抗体(H1alpha67,购自美国赛默飞世尔科技公司东京分公司)、抗8-羟基-2'-脱氧鸟苷(8-OHdG)抗体(购自日本静冈县日研精机株式会社)和抗环氧合酶-2(COX-2)抗体(ab62331,购自英国Abcam公司东京分公司)。辣根过氧化物酶(HRP)标记的二抗购自Abcam公司(货号ab6802、ab16284)。采用HISTOFINE SAB-PO(M)试剂盒(购自日本东京Nichirei Bioscience公司)进行二氨基联苯胺(DAB)显色反应。使用NanoZoomer S20数码切片扫描仪(购自日本静冈县滨松光子学株式会社)进行成像,并用ImageJ软件对结果进行定量分析。
2.6 末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)实验
采用原位凋亡检测试剂盒(购自日本滋贺县Takara生物公司)检测凋亡细胞。切片经脱蜡处理后,用蛋白酶K(购自美国西格玛奥德里奇公司东京分公司)消化并透化。样本在37°C下用末端脱氧核苷酸转移酶(TdT)孵育1小时进行标记,随后用碘化丙啶(PI)进行复染,最后使用激光共聚焦扫描显微镜(LSM700,购自德国卡尔蔡司公司东京分公司)成像。通过ImageJ软件对TUNEL阳性细胞进行定量统计。
2.7 酶联免疫吸附测定(ELISA)
使用EzRIPA缓冲液(购自日本东京ATTO公司)提取青鳉脑组织中的蛋白质。制备蛋白质样本后,按照试剂盒说明书,采用小鼠白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)ELISA试剂盒(货号M6000B、MTA00B,购自美国Bio-Techne公司东京分公司)对青鳉脑组织蛋白质样本进行检测。
2.8 乙酰胆碱酯酶(AChE)活性测定
在冰上解剖获取青鳉脑组织,用PBS(-)缓冲液冲洗后,加入300 μL预冷的0.05 M磷酸盐缓冲液进行匀浆处理。匀浆液在4°C下以10,000×g离心10分钟,收集上清液。采用BCA法( bicinchoninic acid assay,二辛可宁酸法)测定蛋白质浓度。将蛋白质浓度标准化后的上清液用于过氧化氢酶活性测定、乙酰胆碱酯酶活性测定以及氧自由基吸收能力(ORAC)测定。
乙酰胆碱酯酶活性采用荧光法测定[27]:将上清液与5.6 mM碘化乙酰硫代胆碱(溶于缓冲液I,缓冲液I组成为0.12 M氯化钠、0.2%曲拉通X-100、1 mM乙二胺四乙酸(EDTA)、50 mM羟乙基哌嗪乙磺酸(HEPES),pH 7.5)在室温下孵育30分钟。取20 μL反应混合物转移至96孔板中,加入缓冲液II(组成为1 mM EDTA、0.2%曲拉通X-100、50 mM乙酸盐缓冲液,pH 5.0)和20 μL 7-二乙氨基-3-(4-马来酰亚胺苯基)-4-甲基香豆素(溶于乙腈,浓度0.4 mM)。室温孵育1小时后,使用酶标仪(HITACHI SH-9000Lab)在激发波长365 nm、发射波长450 nm处测定荧光强度。
2.9 氧自由基吸收能力(ORAC)测定
为评估脑组织的抗氧化能力,参照既往报道的方法进行ORAC测定[28]。简要步骤如下:在黑色96孔板的每个孔中,加入25 μL脑组织上清液或水溶性维生素E类似物(Trolox)标准品、25 μL 12 mM 2,2'-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH)和150 μL 70 nM荧光素。在37°C条件下,使用酶标仪(HITACHI SH-9000Lab)每隔5分钟测定一次荧光强度,持续90分钟,激发波长为480 nm,发射波长为520 nm。
2.10 青鳉运动轨迹追踪
为评估缺氧诱导的青鳉行为变化,采用Tracker软件(6.3.2版本,网址:https://opensourcephysics.github.io/tracker-website/,访问日期:2025年7月10日)对各组青鳉恢复阶段的视频进行分析。经过空间和时间校准后,对单个青鳉进行追踪,测定其游泳距离和鳃盖(呼吸)运动频率,以此评估恢复阶段青鳉的运动活性和呼吸反应。
2.11 统计学分析
参照既往研究报道的方法进行统计学分析[24,29]。所有数据均采用GNU PSPP统计分析软件(0.8.2-gad9374版本,网址:https://www.gnu.org/software/pspp/,访问日期:2025年3月11日)和基于Excel的EZAnalyze工具(网址:http://www.ezanalyze.com/,访问日期:2025年3月11日)进行分析。首先进行单因素方差分析(one-way ANOVA),随后采用事后检验(包括Tukey检验和Bonferroni校正)。统计学显著性设定为p<0.05。所有实验均独立重复3-5次。
3 结果
3.1 青鳉缺氧暴露时长与脑损伤程度的关系
本研究首先探究青鳉缺氧暴露时长与脑损伤程度的关联。由于呼吸频率变化是反映青鳉缺氧严重程度的简单可观测指标,因此研究同时分析了缺氧诱导的呼吸变化与溶解氧水平的关系。如**图1**和补充视频S1所示,将青鳉置于仅含少量水和空气的密封拉链袋中以构建缺氧环境,并在缺氧暴露期间记录其鳃盖运动和溶解氧水平。青鳉呼吸频率基线值为119次/分钟;缺氧暴露3分钟后,呼吸频率升至159次/分钟;5分钟时,呼吸频率回落至接近基线水平;而8分钟后,呼吸频率显著下降至57次/分钟(**图1D**)。
在不含青鳉的密封拉链袋中,溶解氧仅轻微下降:基线时为8.1 mg/L,5分钟时降至6.8 mg/L,10分钟后稳定在6.5 mg/L。与之相反,在含有青鳉的密封袋中,溶解氧急剧下降:基线时为7.8±0.45 mg/L,5分钟时降至3.6±0.23 mg/L,9分钟时进一步降至2.9±0.35 mg/L(**图1E**)。这些结果表明,缺氧初期会诱导青鳉过度通气,而当氧气耗尽达到临界状态时,其呼吸活动会急剧减弱。
此外,与未暴露于缺氧环境的青鳉脑部(**图1B**)相比,部分青鳉在缺氧暴露9分钟后出现脑内出血(**图1C**),且伴随偶发死亡。这一结果提示,在密封拉链袋构建的缺氧环境中暴露9分钟是青鳉的最低致死阈值。既往针对斑马鱼的研究表明,缺氧诱导的脑损伤具有时间依赖性。例如,缺氧10分钟后,斑马鱼视顶盖出现可见梗死灶,缺氧35分钟后梗死灶扩散至整个脑部[30],此类梗死灶可通过2,3,5-三苯基氯化四氮唑(TTC)染色观察到。
为采用类似方法评估青鳉脑梗死情况,研究初期尝试对青鳉脑组织进行TTC染色。然而,如补充图S1所示,TTC染色结果高度依赖脑组织的结构完整性:未处理青鳉的完整脑组织染色均匀呈红色,而机械损伤的脑组织则出现苍白或未染色区域。这表明,由于解剖操作易导致青鳉小型脆弱脑组织出现人工损伤,TTC染色不适用于青鳉脑损伤评估。
因此,研究采用H&E染色和TUNEL实验评估青鳉脑组织的组织学变化和细胞凋亡情况。如补充图S2A所示,延长缺氧暴露时间(超过30分钟)会导致青鳉中脑出现明显的血管扩张和淤血;TUNEL染色结果显示,视顶盖区域出现大量凋亡细胞(补充图S2B)。这些结果证实,延长缺氧暴露会导致青鳉严重脑损伤,且H&E染色和TUNEL实验在评估青鳉脑血管损伤和细胞损伤方面,比TTC染色更可靠。
既往研究报道,当水体溶解氧浓度低于2.8 mg/L时,鱼类会出现死亡[31]。在本研究中,将青鳉置于密封拉链袋中诱导缺氧9分钟时,水体溶解氧浓度为2.9±0.35 mg/L。综合考虑8分钟后青鳉鳃盖运动频率急剧下降、9分钟后出现脑内出血及偶发死亡等结果,研究选择9分钟作为后续实验的标准化缺氧暴露时长。
3.2 氢气抑制缺氧诱导的青鳉脑部LOX-1信号和HIF-1α表达并减轻血管损伤
为评估氢气是否对缺氧诱导的青鳉脑损伤具有保护作用,研究检测了氢气对缺氧标志物和血管完整性的影响。
研究首先采用LOX-1缺氧探针评估氢气是否能缓解缺氧状态。如**图2A**和补充图S3所示,阴性对照组(NC)青鳉中脑仅出现微弱的LOX-1信号,表明其处于正常氧合状态;而在通入空气的水体中恢复的青鳉(空气组)中脑出现强烈的LOX-1信号,提示存在严重缺氧应激。值得注意的是,在通入氢气的水体中恢复的青鳉(氢气组),其LOX-1信号较空气组显著减弱(**图2B**),表明氢气可缓解青鳉脑组织缺氧。
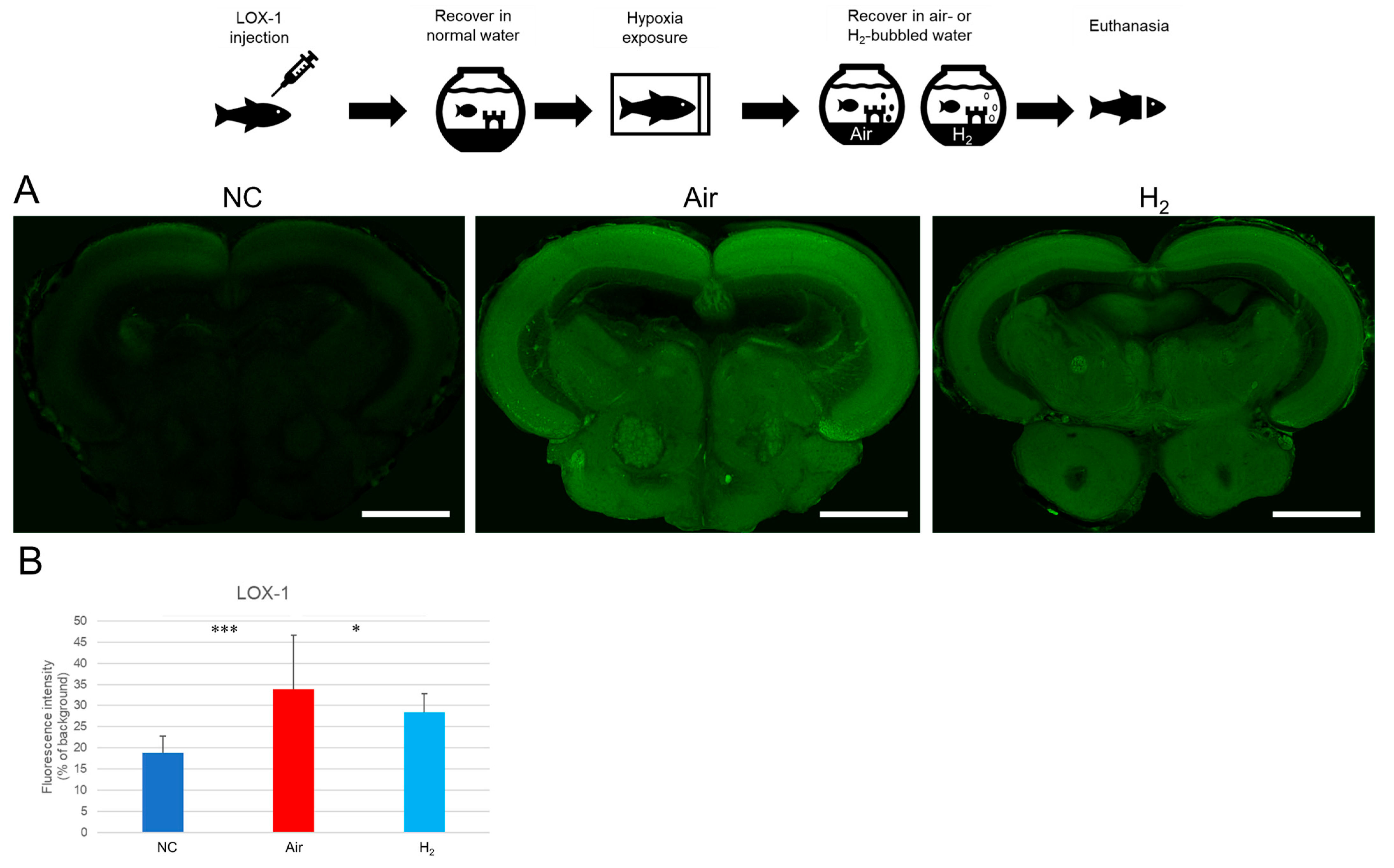
图2 氢气对缺氧诱导的青鳉脑切片LOX-1探针信号的影响
在低温麻醉条件下,向Matsushiro品系青鳉(每组n=20)腹腔注射LOX-1缺氧探针(2 mM,10 μL),随后在正常饲养水体中恢复1小时。按照“材料与方法”部分所述,将青鳉暴露于缺氧环境9分钟;缺氧处理后,立即将其转移至以下两种恢复环境之一,恢复1小时:通入空气的水体(空气组)或通入氢气的水体(氢气组)。阴性对照组(NC)青鳉始终饲养于正常水体,不进行缺氧暴露。处理结束后,处死青鳉,使用振动切片机将脑组织切成200 μm厚的切片,并用激光共聚焦扫描显微镜观察。上方示意图展示实验流程。(A)青鳉脑切片LOX-1荧光的代表性图像,每组额外2个示例见补充图S3,比例尺=500 μm;(B)采用ImageJ软件对5个脑切片的LOX-1荧光强度进行定量分析,*p<0.05,***p<0.001,实验独立重复3次。
接下来,研究检测了氢气对青鳉脑部HIF-1α表达和血管淤血的影响。由于臭氧(O₃)富含氧气,研究增设通入臭氧的水体组(臭氧组)作为对照。如**图3A**和**图3C**所示,H&E染色结果显示,与阴性对照组相比,空气组青鳉中脑出现广泛血管淤血;而氢气组青鳉的淤血血管数量显著减少。意外的是,臭氧组青鳉的血管淤血程度比空气组更显著。
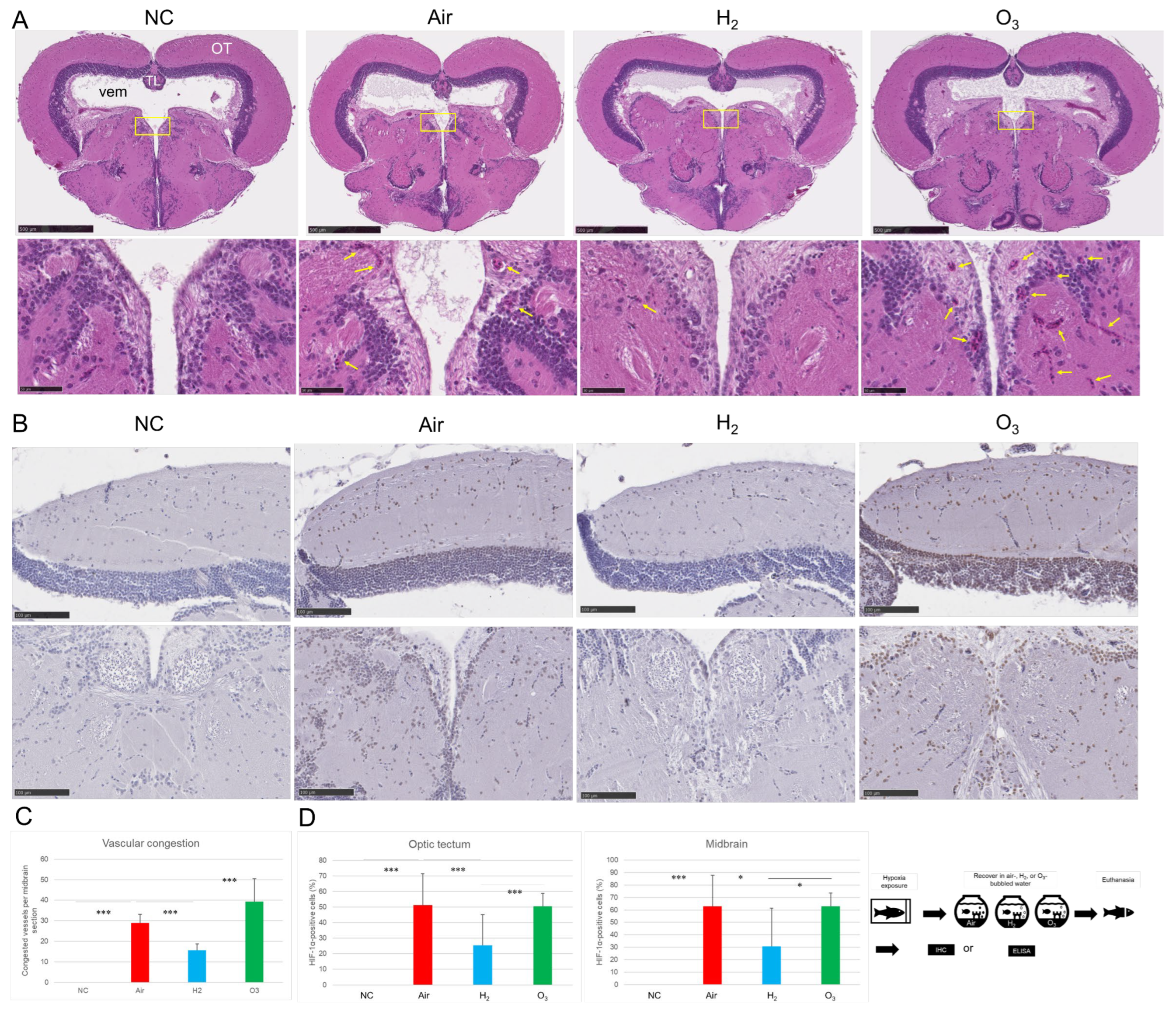
图3 氢气对缺氧诱导的青鳉脑组织血管淤血和HIF-1α表达的影响
按照“材料与方法”部分所述,对红色品系青鳉(每组n=20)进行缺氧处理;缺氧后,将其转移至以下三种环境之一恢复1小时:通入空气的水体(空气组)、通入氢气的水体(氢气组)或通入臭氧的水体(臭氧组),实验流程见右下角示意图(补充视频S2)。恢复结束后,处死青鳉,将脑组织置于戴维森固定液中固定、脱水、石蜡包埋并切片,进行组织学分析。切片分别进行H&E染色或采用抗HIF-1α抗体进行免疫组织化学检测,使用NanoZoomer S20数码切片扫描仪对切片进行扫描。(A)上方为H&E染色脑切片的代表性图像,每组额外2个示例见补充图S4;OT=视顶盖,TL=纵纹 torus longitudinalis,Vem=中脑室,NC=阴性对照组,比例尺=500 μm;下方为方框区域的放大图,黄色箭头指示淤血血管,比例尺=50 μm;(B)HIF-1α表达的代表性免疫组织化学图像,每组额外2个示例见补充图S4;棕色区域为HIF-1α阳性细胞,蓝色为细胞核复染;上方为视顶盖区域,下方为中脑中央区域,比例尺=100 μm;(C)采用ImageJ软件对每组10个切片的中脑淤血血管数量进行定量分析,***p<0.001;(D)采用ImageJ软件对每组10个切片的视顶盖和中脑中央区域HIF-1α阳性细胞数量进行定量分析,*p<0.05,***p<0.001;所有实验独立重复5次。
免疫组织化学分析结果显示,阴性对照组青鳉未检测到HIF-1α表达;而空气组青鳉的视顶盖和中脑中央区域均出现强烈的HIF-1α免疫反应,提示存在严重缺氧应激;臭氧组青鳉也呈现类似的HIF-1α表达上调模式,表明臭氧处理无法缓解缺氧。值得注意的是,氢气组青鳉的HIF-1α表达水平较空气组和臭氧组均显著降低,表明氢气可有效减弱细胞的缺氧反应(**图3B**、**图3C**)。
上述结果表明,氢气不仅能通过降低LOX-1信号和HIF-1α表达来缓解青鳉脑组织缺氧,还能改善青鳉脑部血管完整性。
3.3 氢气抑制缺氧诱导的青鳉脑组织凋亡与氧化DNA损伤
接下来,我们探究了氢气是否能抑制缺氧诱导的青鳉脑组织凋亡及氧化DNA损伤。末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)实验(图4A、B)显示,阴性对照组(NC)青鳉的视顶盖区域几乎未观察到凋亡细胞;而空气组青鳉视顶盖的凋亡细胞数量显著增加。与之相反,与空气组相比,氢气处理组的凋亡细胞数量显著减少。

图4 氢气对缺氧诱导的青鳉脑组织凋亡的影响
如上方示意图所示,将Matsushiro品系青鳉(每组n=20)暴露于缺氧环境9分钟,随后分别在通入空气或氢气的水体中恢复1小时。采用TUNEL检测试剂盒对脑组织切片进行染色,并用激光共聚焦扫描显微镜观察。(A)青鳉脑切片视顶盖区域TUNEL染色的代表性图像,每组额外2个示例见补充图S5,比例尺=100 μm;绿色为凋亡细胞,红色为碘化丙啶(PI)染色的细胞核。(B)采用ImageJ软件对每组10个切片视顶盖区域的凋亡细胞进行定量分析,*p<0.05,***p<0.001,实验独立重复3次。
为评估氧化DNA损伤,我们通过免疫组织化学(IHC)检测了脑组织中8-羟基-2'-脱氧鸟苷(8-OHdG)的表达。免疫组织化学染色结果显示,阴性对照组青鳉中脑的8-OHdG表达量极低(图5A、B);而空气组和臭氧组(O₃组)青鳉的视顶盖及中脑核心区域均出现大量8-OHdG阳性细胞,且臭氧组的染色强度最高。与之相反,氢气组青鳉的8-OHdG阳性细胞数量显著少于空气组和臭氧组。
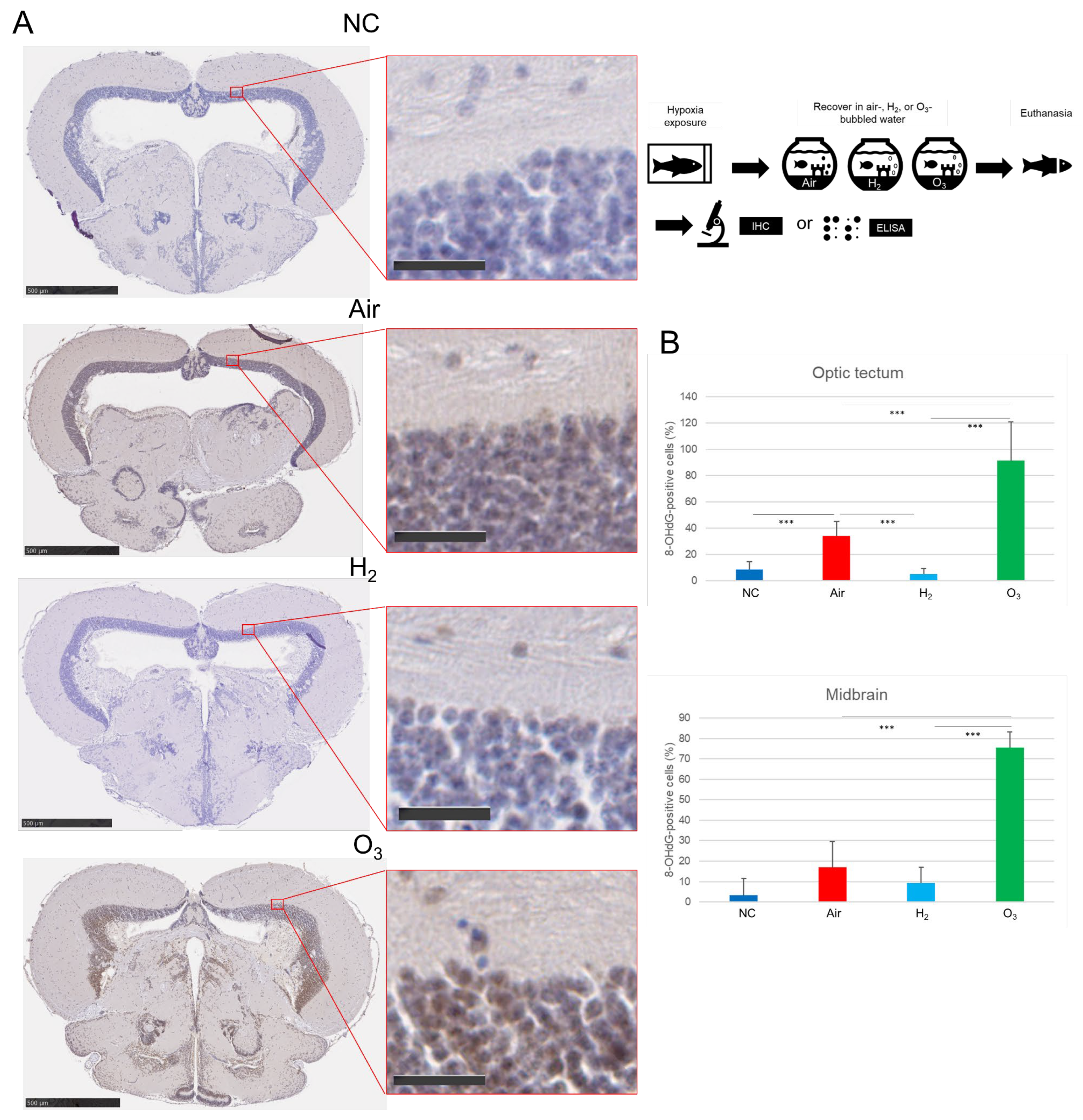
图5 氢气对缺氧诱导的青鳉脑组织氧化DNA损伤的影响
如右上角示意图所示,将红色品系青鳉(n=20)暴露于缺氧环境后,按照图3所述条件进行恢复。采用抗8-OHdG抗体对脑组织切片进行免疫组织化学染色,并用NanoZoomer S20数码切片扫描仪扫描。(A)青鳉脑切片8-OHdG染色的代表性图像,每组额外2个示例见补充图S6;棕色为8-OHdG阳性染色,蓝色为细胞核复染;左侧为全脑切片(比例尺=500 μm),右侧为视顶盖放大图(比例尺=25 μm)。(B)采用ImageJ软件对每组10个切片视顶盖区域的8-OHdG阳性细胞进行定量分析,***p<0.001,实验独立重复5次。
上述结果表明,在缺氧条件下,氢气可保护青鳉脑组织免受缺氧诱导的凋亡及氧化DNA损伤。
3.4 氢气抑制缺氧诱导的青鳉脑组织炎症反应
我们通过免疫组织化学和酶联免疫吸附测定(ELISA),进一步探究了氢气对缺氧诱导的青鳉脑组织炎症反应的影响。环氧合酶-2(COX-2)是一种可诱导的促炎酶,对其进行免疫染色发现,空气组和臭氧组青鳉视顶盖区域的COX-2表达量均显著升高(图6A、B)。在中脑核心区域,与阴性对照组相比,臭氧组的COX-2表达量显著升高,而空气组的COX-2表达量虽有中度上升,但无统计学意义。与之相反,氢气组的COX-2表达量显著低于空气组和臭氧组,尤其在视顶盖区域表现更为明显。
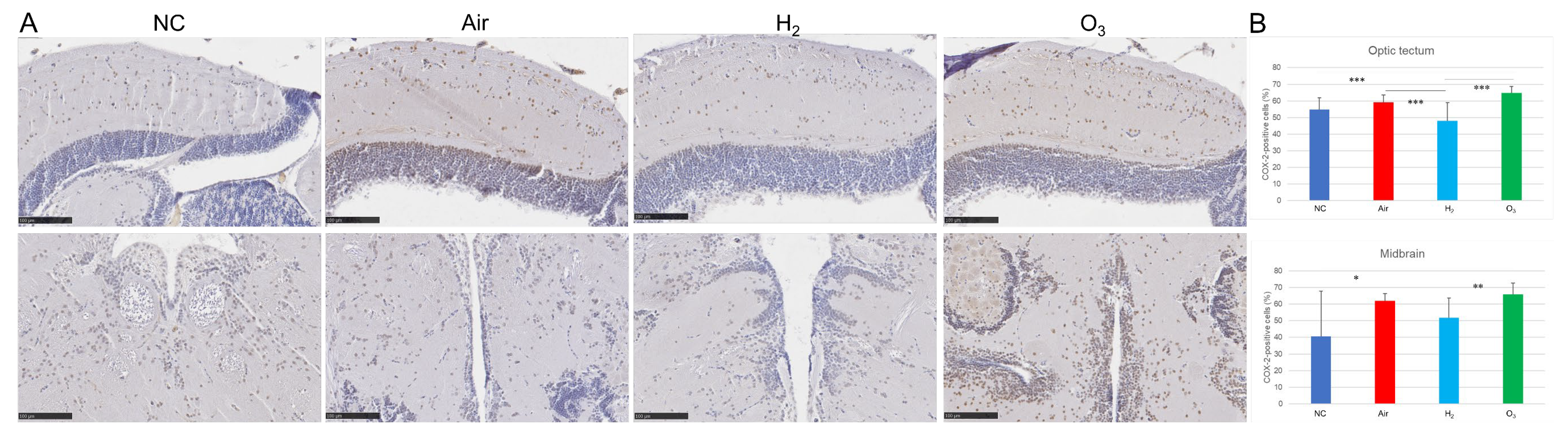
图6 氢气对缺氧诱导的青鳉脑组织COX-2表达的影响
将红色品系青鳉(每组n=20)暴露于缺氧环境后,按照图3所述条件进行恢复。采用抗COX-2抗体对脑组织切片进行免疫组织化学染色,并用NanoZoomer S20数码切片扫描仪扫描。(A)青鳉脑切片COX-2染色的代表性图像,每组额外2个示例见补充图S7;棕色为COX-2阳性染色,蓝色为细胞核复染,比例尺=100 μm。(B)采用ImageJ软件对每组10个切片视顶盖区域(上图)和中脑区域(下图)的COX-2阳性细胞进行定量分析,*p<0.05,**p<0.01,***p<0.001,实验独立重复5次。
ELISA结果显示,仅空气组青鳉脑组织中的白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)水平显著升高。尽管氢气处理有降低脑组织中IL-6和TNF-α水平的趋势,但氢气组、空气组与臭氧组之间的差异无统计学意义(图7A、B)。
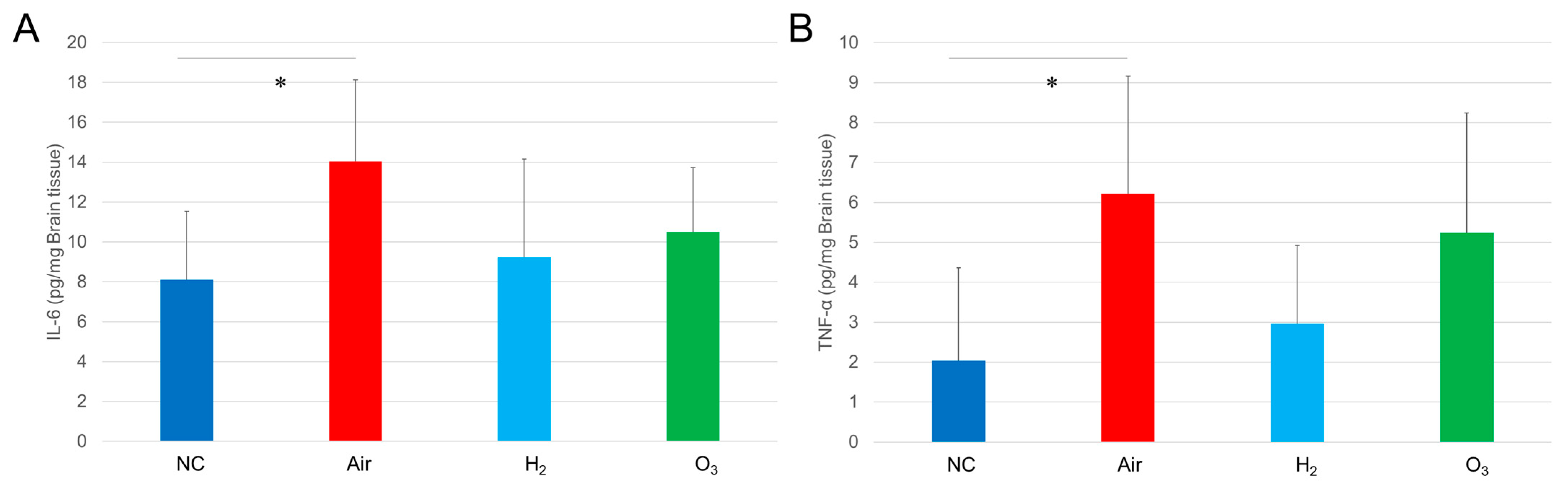
图7 氢气对缺氧诱导的青鳉脑组织炎症细胞因子分泌的影响
将红色品系青鳉(每组n=20)暴露于缺氧环境后,按照图3所述条件进行恢复。收集青鳉脑组织,用超声匀浆机匀浆,采用RIPA蛋白提取试剂盒处理后,通过IL-6和TNF-α ELISA试剂盒进行检测。(A)脑组织IL-6 ELISA检测结果;(B)脑组织TNF-α ELISA检测结果;*p<0.05,实验独立重复5次。
上述结果表明,在青鳉急性缺氧条件下,氢气可在一定程度上抑制缺氧诱导的脑组织炎症反应。
3.5 氢气恢复缺氧后青鳉的抗氧化能力并使呼吸及运动活性恢复正常
已知脑损伤会破坏酶活性、削弱抗氧化防御系统,并导致呼吸和行为变化[32,33]。为探究急性缺氧是否会对青鳉产生类似影响,我们在青鳉暴露于缺氧环境并在不同气体条件下恢复后,检测了其乙酰胆碱酯酶(AChE)活性、总抗氧化能力、呼吸频率及运动行为。
如图8A所示,四个组的AChE活性无显著差异,这表明单次急性缺氧暴露在1小时恢复时间内,未对胆碱能酶功能产生可检测到的变化。可能需要更长时间或反复缺氧暴露,才会对AChE活性产生影响。
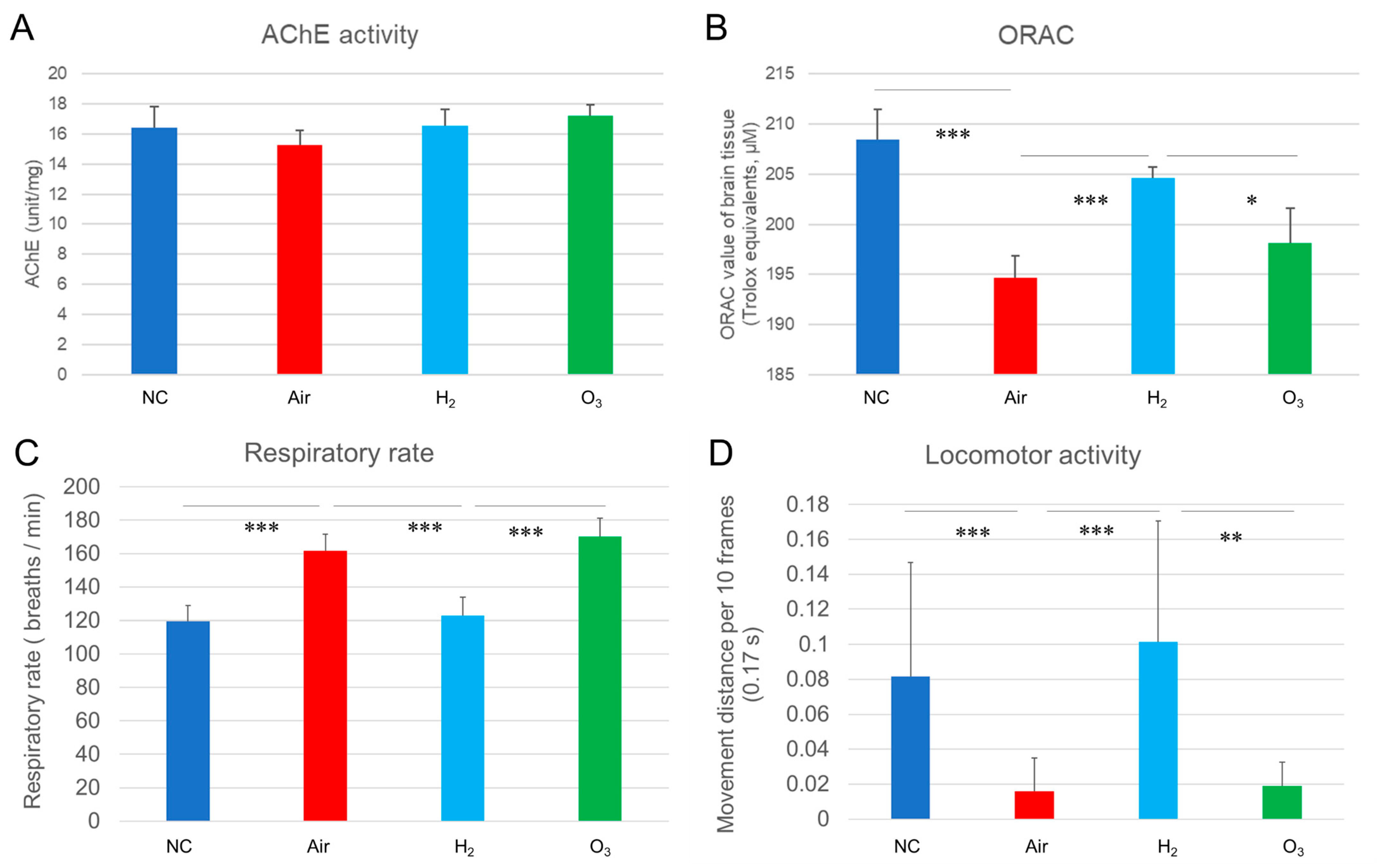
图8 氢气对缺氧暴露后青鳉脑组织呼吸频率、运动活性、AChE活性及抗氧化能力的影响
将黑色品系青鳉(每组n=20)暴露于急性缺氧环境后,按照图3所述条件进行恢复。恢复后处死青鳉,收集脑组织并在预冷的0.05 M磷酸盐缓冲液中匀浆,取上清液用于检测AChE活性及通过氧自由基吸收能力(ORAC)实验检测抗氧化能力。记录青鳉恢复阶段的行为,代表性片段见补充视频S2。分析时,采用Tracker软件处理更长时间的视频记录,以评估鳃盖(呼吸)运动频率和运动活性。(A)脑组织AChE活性;(B)代表抗氧化能力的ORAC值;(C)缺氧暴露后的呼吸频率;(D)运动活性(以每0.17秒(10帧)的移动距离表示);*p<0.05,**p<0.01,***p<0.001,所有实验独立重复3次。
与之相反,ORAC实验显示,与阴性对照组相比,空气组和臭氧组的抗氧化能力显著降低(图8B),这表明缺氧诱导的氧化应激超出了青鳉脑部固有的抗氧化防御能力。而氢气处理显著恢复了其抗氧化能力,使其达到与阴性对照组相当的水平,这凸显了氢气对氧化损伤的保护作用。
为评估青鳉的功能恢复情况,我们采用Tracker软件检测了其恢复阶段的鳃盖运动频率和运动活性(代表性行为见补充视频S2)。如图8C所示,空气组和臭氧组的呼吸频率分别升至162次/分钟和170次/分钟,而阴性对照组为120次/分钟;与之相反,氢气组青鳉的呼吸频率为123次/分钟,与阴性对照组接近,且显著低于空气组和臭氧组。
运动能力分析(图8D)显示,空气组(0.016 cm/10帧)和臭氧组(0.019 cm/10帧)的移动距离大幅缩短,而阴性对照组为0.082 cm/10帧;值得注意的是,氢气组青鳉的移动距离为0.101 cm/10帧,显著高于空气组和臭氧组,且与阴性对照组相当。
上述结果表明,氢气不仅能恢复青鳉的抗氧化能力,还能改善急性缺氧损伤后的呼吸功能和行为表现,这意味着氢气可提高青鳉整体的生理适应能力。
4. 讨论
本研究表明,急性缺氧暴露会导致青鳉出现显著脑损伤,具体表现为脑内出血、血管淤血、神经元凋亡、氧化DNA损伤、抗氧化能力下降、炎症反应增强,以及呼吸频率和运动活性改变。重要的是,在通入氢气的水体中恢复可显著减轻这些缺氧诱导的损伤效应,凸显了氢气作为神经保护剂的潜力。
研究还发现,鳃盖运动(鱼类呼吸频率的替代指标)是反映缺氧应激的敏感指标。其呈现的“先过度通气、后急剧减弱”的双相反应,与缺氧从轻度向重度发展的过程一致。这些生理变化还伴随脑内出血、血管淤血和凋亡细胞增多(尤其在中脑区域),这与哺乳动物缺氧缺血性脑病模型中报道的血管损伤和神经元损伤特征相似[34]。
氢气处理显著减轻了血管病变和神经元凋亡。苏木精-伊红(H&E)染色和TUNEL实验显示,氢气处理组青鳉中脑的血管淤血程度减轻、凋亡细胞数量减少。这些组织学层面的改善还伴随运动活性增强和呼吸频率稳定,表明氢气处理有助于青鳉整体生理功能的恢复。
在分子层面,即使在通入空气的水体中恢复1小时后,青鳉脑部仍检测到强烈的LOX-1信号和HIF-1α表达,证实脑组织存在持续性缺氧损伤。血管淤血的组织学证据提示,血流障碍导致的继发性缺氧可能是脑组织损伤持续存在的原因之一。与之相反,氢气处理显著减轻血管淤血,并抑制LOX-1信号和HIF-1α表达,表明氢气可改善组织氧合状态或减轻缺氧诱导的细胞应激。这些结果与既往研究结论一致——氢气可调控HIF-1α信号通路,缓解缺氧相关组织损伤[35]。
氧化应激是缺氧诱导损伤的典型特征,本研究中表现为青鳉脑部8-羟基-2'-脱氧鸟苷(8-OHdG)水平升高、氧自由基吸收能力(ORAC)值降低。氢气处理有效逆转了这些变化,体现其清除羟自由基和过氧亚硝基阴离子的能力[36]。此外,氢气还降低了环氧合酶-2(COX-2)的表达,并抑制炎症细胞因子(白细胞介素-6、肿瘤坏死因子-α)水平,进一步证实了其抗炎潜力,这与临床和临床前研究报道的结论相符[37,38]。
值得注意的是,臭氧在多个指标上均加剧了缺氧诱导的损伤,包括血管淤血、氧化DNA损伤、炎症反应、呼吸频率升高和运动活性降低。由于臭氧具有强氧化性,其可能通过与细胞大分子反应而加重组织损伤。与之相反,氢气因其分子体积极小且呈非极性,可轻松穿透生物膜(包括血脑屏障、细胞质膜、线粒体膜和核膜),实现深层组织渗透并有效清除活性氧。
氢气对急性缺氧诱导脑损伤的神经保护作用,可能源于其多效性机制:首先,氢气可选择性清除细胞毒性最强的活性氧(羟自由基•OH和过氧亚硝基阴离子ONOO⁻),且不干扰细胞信号传导所需的生理性活性氧,从而恢复氧化还原平衡[39];其次,有研究报道氢气可调控线粒体功能,维持三磷酸腺苷(ATP)生成并抑制线粒体通透性转换,这在缺氧应激中至关重要[40];第三,本研究观察到氢气可抑制HIF-1α表达并减轻缺氧诱导的血管淤血,提示其可能稳定血管功能、防止缺氧诱导的内皮功能障碍;第四,氢气可通过下调核因子-κB(NF-κB)和促炎细胞因子表达发挥抗炎作用[41],进而减少继发性组织损伤。这些多方面机制共同作用,或许可以解释氢气在青鳉模型中展现出的广泛保护效应。
尽管本研究结果具有参考价值,但仍存在一些局限性:首先,研究以小型硬骨鱼青鳉为实验对象,虽其在缺氧和神经血管反应建模方面具有优势,但无法完全复刻哺乳动物大脑的复杂性;其次,未对氢气在青鳉组织中的摄取和分布动力学进行定量分析,未来研究应检测脑组织中的氢气浓度以验证其生物利用度;第三,尽管证实氢气可减轻氧化应激和炎症反应,但未直接探究其调控的具体分子信号通路(如线粒体信号通路、丝裂原活化蛋白激酶MAPK、核因子E2相关因子2 Nrf2激活等);第四,研究仅考察了急性缺氧暴露的情况,反复缺氧及氢气处理的长期效应仍有待探索;最后,将水生动物模型的研究结果转化至临床实践需谨慎,因生理特征和暴露方式的差异可能影响最终效果。
综上,本研究结果表明氢气是一种具有潜力的急性缺氧诱导脑损伤治疗剂。其多方面益处(包括保护血管完整性、抑制凋亡、减轻氧化应激和炎症反应、促进功能恢复)支持在实验研究和临床研究中进一步探索其应用。通过机制研究和哺乳动物模型验证以解决上述局限性,对于推进氢气疗法在缺氧性脑损伤中的应用至关重要。
5. 结论
本研究表明,氢气对急性缺氧诱导的青鳉脑损伤具有显著保护作用。氢气处理可减轻血管淤血、神经元凋亡、氧化DNA损伤和炎症反应,同时恢复抗氧化能力并促进功能恢复。与之相反,臭氧暴露会加剧缺氧损伤,这凸显了在缺氧条件下谨慎选择治疗性气体的重要性。这些研究结果证实,氢气有望成为一种安全有效的干预手段,用于预防或减轻缺氧相关组织损伤,值得在高等脊椎动物模型和临床研究中进一步探索。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1503840.html?mobile=1
收藏

