药物与饮食联合或可改善儿童癌症治疗效果
小鼠研究表明,剥夺神经母细胞瘤对特定氨基酸的摄取,可改变其蛋白质合成模式,从而抑制肿瘤生长并促进细胞分化。
神经母细胞瘤是一种恶性程度极高的癌症,约占儿童癌症相关死亡病例的15%[1]。该病源于交感神经系统发育过程中组织前体细胞的失控增殖——交感神经系统是负责调控“战斗或逃跑”反应的神经分支。目前的治疗手段包括手术、联合干细胞移植的强化化疗、放疗及免疫治疗。尽管采用了多种干预措施,高危神经母细胞瘤患者的生存率仍较低,且存活患儿还可能承受治疗带来的长期副作用。因此,全球研究者正持续探索毒性更低、靶向性更强、疗效更优的治疗方案[2,3]。2023年,美国食品药品监督管理局(FDA)批准了一种名为二氟甲基鸟氨酸(DFMO)的药物,用于治疗高危神经母细胞瘤。切尔卡维(Cherkaoui)等人在《自然》(*Nature*)杂志发表的研究[4]则报告了一种在小鼠体内测试的饮食干预方案,该方案或可辅助DFMO治疗。
神经母细胞瘤的基因突变数量虽较少,但常存在导致基因拷贝数增加(即基因扩增)的遗传改变。其中最典型的是*MYCN*基因(编码转录因子MYCN),在所有高危神经母细胞瘤病例中,该基因的扩增比例达30%~50%[5,6]。与*MYCN*位于同一条染色体片段上的基因往往会随其一同扩增[7],*ODC1*基因便是其中之一,且该基因的表达也受MYCN的直接转录调控[8]。
*ODC1*基因编码鸟氨酸脱羧酶1(ODC1),这种酶是代谢分子“多胺”合成过程中的关键限速酶。多胺对细胞生长至关重要,它可与多种对蛋白质合成有重要意义的生物分子结合并影响其功能,例如转运RNA(tRNA)、核糖体以及启动翻译过程的蛋白质[9-11]。
多胺也被认为与癌症(包括神经母细胞瘤[12])的进展相关。DFMO用于神经母细胞瘤治疗的研究已持续数十年,其作用机制是通过抑制ODC1来阻断多胺的生成。过去数年的研究表明,要减缓肿瘤进展,需使用高剂量DFMO,以彻底剥夺神经母细胞瘤赖以生存的多胺[13,14]。
切尔卡维团队旨在深入探索神经母细胞瘤的代谢机制,并寻找可辅助DFMO治疗的策略。他们首先对三种神经母细胞瘤组织中的代谢物进行了详细分析:人类原发性肿瘤组织、移植了患者来源神经母细胞瘤细胞系的小鼠肿瘤样本,以及过表达*MYCN*基因的基因工程小鼠肿瘤组织。该分析揭示了肿瘤内多胺从头合成的复杂动态调控机制——研究发现,肿瘤细胞所需的多胺前体分子“鸟氨酸”,主要来自血液摄取,而非自身合成。通过同位素示踪和质谱分析,作者进一步证实,这些鸟氨酸由健康组织生成,且其来源是饮食中的脯氨酸和精氨酸这两种氨基酸。
剥夺脑瘤的特定氨基酸或可增强化疗效果
研究者推断,将DFMO与“不含脯氨酸和精氨酸的饮食”联用,或可通过“双管齐下”的方式有效抑制多胺合成:一方面抑制限速酶ODC1的活性,另一方面耗尽其底物鸟氨酸。在实验中,接受该联合方案治疗的“肿瘤移植小鼠”和“过表达*MYCN*的基因工程小鼠”,其存活时间显著长于以下对照组:正常饮食的对照组、仅接受“无脯氨酸-精氨酸饮食”的组,以及仅接受DFMO治疗的组。部分接受联合治疗的小鼠甚至实现了完全缓解,且在整个研究剩余周期内未出现复发。
这种治疗效果的背后机制是什么?该团队及其他研究者此前的研究已表明,多胺耗竭会阻止翻译起始蛋白eIF5A被多胺(如亚精胺)修饰,从而阻碍蛋白质翻译。而在本次研究中,作者进一步探究了“更严重的多胺耗竭”对翻译过程的影响。他们通过核糖体图谱技术,捕捉了所有正在被核糖体翻译的信使RNA(mRNA)的“快照”,并发现了一种独立于eIF5A调控之外的多胺耗竭效应。
在翻译过程中,核糖体会在mRNA的特定密码子(编码氨基酸的核苷酸三联体)处停滞或减速,且这种停滞主要发生在以腺嘌呤(A)结尾的密码子上。值得注意的是,与细胞周期和增殖相关的基因中,“A结尾密码子”的占比极高;而与细胞分化相关的基因中,这类密码子的数量则较少。作者认为,这一现象会引发“翻译重编程”——即细胞会优先抑制促增殖通路,转而激活驱动神经分化的通路,从而阻止肿瘤细胞的失控分裂(见图1)。
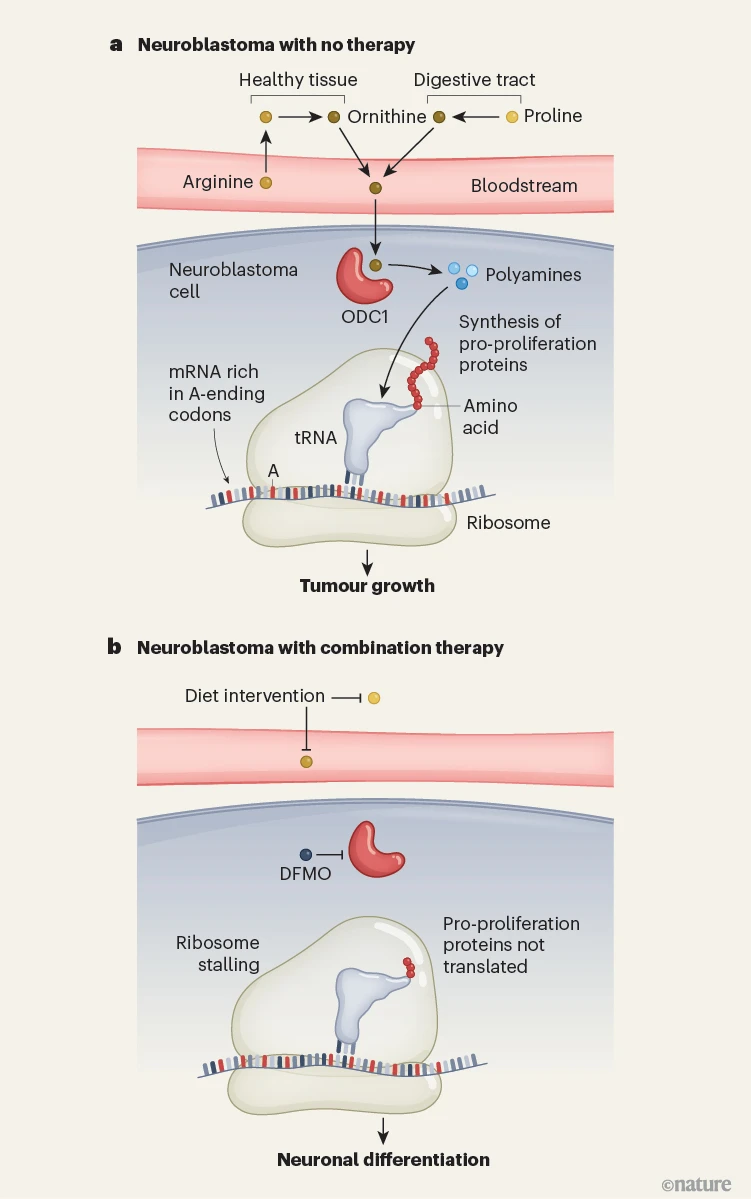
图1 神经母细胞瘤的联合治疗机制
切尔卡维等人[4]提出的神经母细胞瘤联合治疗方案示意图。神经母细胞瘤是一种儿童癌症,由发育中神经系统的细胞失控增殖引起。
a)正常机制:饮食中的脯氨酸和精氨酸用于合成鸟氨酸;神经母细胞瘤细胞从血液中摄取鸟氨酸,并在ODC1酶(神经母细胞瘤中该酶过表达)的作用下将其转化为多胺;多胺是转运RNA和核糖体翻译“富含A结尾密码子(编码氨基酸的核苷酸三联体)的mRNA”所必需的;而富含A结尾密码子的mRNA,多来自与增殖相关的基因,这些促增殖蛋白的合成会驱动肿瘤生长。
b)联合治疗机制:作者通过“无脯氨酸-精氨酸饮食”联合ODC1特异性抑制剂DFMO,实现对神经母细胞瘤的多胺剥夺;多胺耗竭导致核糖体会在A结尾密码子处停滞,进而引发“翻译重编程”——促增殖蛋白的翻译过程受阻,细胞转而优先翻译驱动神经分化的基因,最终抑制肿瘤生长。
切尔卡维团队提出,“多胺可通过调控蛋白质翻译来影响细胞命运”这一机制,可能是进化过程中形成的“细胞适应不同代谢状态”的方式。这一机制在胚胎发育中可能尤为重要——因为胚胎发育过程中,细胞命运的精准决定至关重要。未来的研究可进一步探索“翻译重编程”在进化和发育中的作用,以及它在正常细胞、应激状态细胞和疾病状态细胞中是否存在、如何发生。
目前,DFMO已成为高危神经母细胞瘤患儿的标准治疗药物之一。而“DFMO+无脯氨酸-精氨酸饮食”的联合方案,也展现出良好的治疗潜力。但该方案能否在人体中起效,仍需通过Ⅰ期临床试验验证。尤其需要注意的是,让儿童长期坚持限制性饮食可能存在挑战,且氨基酸剥夺还可能引发急性毒性副作用[15]。对于已在接受复杂治疗的低龄患者而言,这种额外负担不容小觑。
此外,“降低精氨酸水平的替代方案”(如精氨酸降解酶)也可能具有治疗价值。例如,一种可降解天冬酰胺的酶(天冬酰胺酶),已被证实对儿童白血病治疗至关重要[16]。
最后,在许多癌症类型中,都存在MYC家族基因扩增和*ODC1*表达升高的现象。因此,探究本文提出的联合治疗方案是否对其他癌症类型同样有效,将是未来极具意义的研究方向。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1503435.html?mobile=1
收藏

