 精选
精选
研究人员已成功构建出能被可卡因选择性激活的离子通道,这类通道可刺激或抑制大脑神经元细胞的电活动。将这些可卡因激活离子通道用于改造大鼠的神经回路后,大鼠对可卡因的寻求行为减少,但对食物的寻求行为未受影响。
问题背景
药物成瘾是一项难以解决的公共卫生问题。成瘾性药物会劫持大脑回路,触发“药物寻求-摄入”的自我放大正反馈循环[1]。成瘾研究的核心目标之一,是找到一类特定脑细胞——它们既能逆转上述成瘾循环,又不会影响大脑对食物、性、社交互动等自然奖赏的处理过程。然而,负责强化“药物寻求”与“药物摄入”行为的脑细胞,恰好也参与自然奖赏的处理,这使得针对性干预面临挑战。
与自然奖赏相比,成瘾性药物的一个显著特征是:**药物暴露速度**是决定成瘾风险的关键因素[2]。这是因为急性药物暴露会导致神经调节剂多巴胺突然升高,而多巴胺会进一步强化药物寻求行为[3]。若能以与“药物摄入-体内作用-大脑响应”时间进程完全匹配的方式,干预介导奖赏强化的神经过程,或许能实现对药物成瘾的选择性抑制。
但实际情况更为复杂:反复用药的时间进程通常不固定,且每种药物独特的物理化学特性会进一步干扰其在大脑中的暴露时间规律。这些因素导致科研人员难以精准干预仅与“药物摄入”相关的神经元功能。
解决方案
受人体生理调控系统(如体温、食欲调节系统)的启发,我们提出假设:通过基因工程构建一种“药物敏感性负反馈机制”,使其对抗药物奖赏强化循环,或可打破成瘾周期(图1a)。我们研发出一种人工受体蛋白,其特性如下:仅对“用药时大脑中可卡因浓度”产生响应,而不会与体内天然存在的分子发生作用。
由于自然界中可卡因不会直接激活离子通道,我们通过蛋白质工程合成了“可卡因响应型离子通道”——这类通道在可卡因作用下会开放。我们可将这些可卡因激活受体靶向递送至特定细胞类型,并构建了多种通道变体:当被可卡因激活时,部分变体能增强(兴奋)细胞电活动,另一部分则能减弱(抑制)细胞电活动。
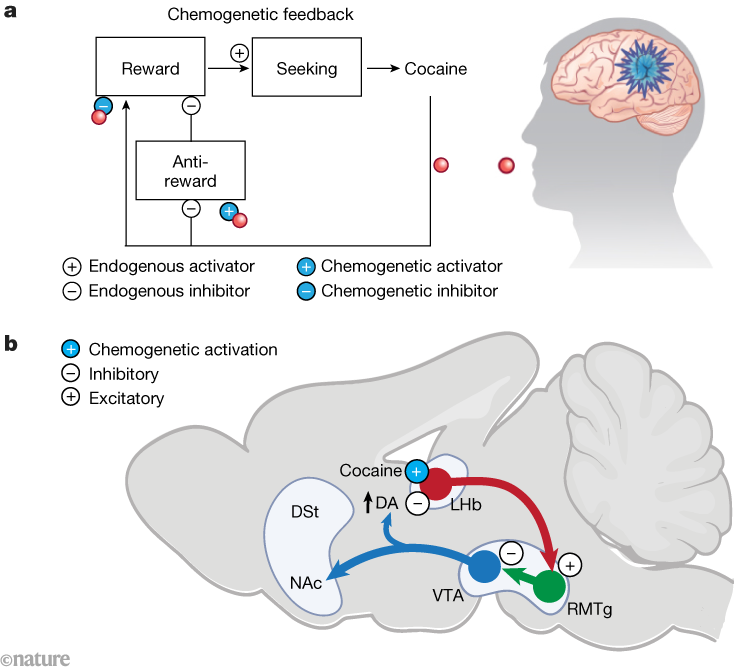
图1 用于成瘾回路的可卡因敏感性离子通道
a. 可卡因(红色球体)奖赏强化反馈回路(白色圆圈内为作用符号),以及经基因工程改造的化学遗传学离子通道对该回路的拮抗作用(蓝色圆圈内为作用符号)——这类离子通道被设计为可被可卡因激活,进而刺激或抑制神经元活动。
b. 大鼠大脑中的奖赏处理回路,显示化学遗传学离子通道在外侧缰核(LHb)中的应用:该通道介导的反馈可拮抗药物奖赏强化反馈。正常情况下,可卡因诱导的神经调节剂多巴胺(DA)升高会抑制外侧缰核神经元,同时也会影响其他回路;而在外侧缰核神经元中表达“兴奋性可卡因激活化学遗传学离子通道”后,可在“与可卡因暴露时间同步”的前提下,对抗可卡因对外侧缰核神经元的正常抑制作用。最终结果是:大鼠对可卡因的寻求行为减少,但对自然奖赏的愉悦感未受影响。
(图中缩写:DSt-背侧纹状体;NAc-伏隔核;RMTg-吻侧中脑导水管周围灰质;VTA-腹侧被盖区)
a图改编自文献[5](美国科学促进会AAAS),b图使用BioRender制作。
图片来源:Gomez, J. L. 等/Nature(CC BY 4.0)
我们将这类工程离子通道中的“兴奋性变体”,靶向递送至经训练可自主静脉注射可卡因的大鼠的**外侧缰核(LHb)** 区域(图1b)。已知外侧缰核具有抑制“成瘾性药物及自然奖赏的强化效应”的功能,且当可卡因进入大脑时,该区域的神经元会受到短暂抑制[4]。我们通过可卡因响应型离子通道测试了一个关键假设:仅在可卡因存在时兴奋外侧缰核神经元,逆转该神经回路节点的信号方向,是否能减少大鼠的可卡因寻求行为。
结果显示:与对照组相比,在外侧缰核神经元中表达“兴奋性可卡因激活离子通道”的大鼠,其可卡因诱导的多巴胺升高幅度减弱,且可卡因自主注射行为显著减少。由于该离子通道仅在可卡因存在时才兴奋外侧缰核神经元,大鼠对食物奖赏的寻求与摄入行为未受任何影响。
意义与展望
这些实验验证了一种核心策略的可行性:为特定成瘾性药物设计“定制化受体”,可在抑制药物寻求行为的同时,不影响自然奖赏的处理。此外,通过选择性减弱“可卡因摄入的奖赏强化效应”,研究人员可利用“兴奋性”和“抑制性”两种离子通道变体,筛选出“足以抑制可卡因寻求行为”的关键神经元。
本研究存在一个局限性:我们尚未明确外侧缰核中“在可卡因作用下通常会被抑制的特定细胞亚群”。这意味着,我们的“可卡因激活兴奋性通道”可能同时刺激了部分“正常情况下不会被可卡因抑制的外侧缰核神经元”。
尽管如此,这种“减少可卡因寻求行为”的策略仍可拓展——例如,研发针对其他成瘾性药物的选择性离子通道。这一方向最终可能催生出“不影响自然奖赏愉悦感”的成瘾基因疗法。类似思路还可用于开发“生物信号分子(如代谢物、激素)的人工反馈通路”。
(作者单位:Scott M. Sternson 任职于美国霍华德·休斯医学研究所及加利福尼亚大学圣迭戈分校;Michael Michaelides 任职于美国马里兰州巴尔的摩市国家药物滥用研究所内部研究项目)
专家观点
这项研究设计精妙,不仅阐述了“新型工具的构建与应用方法”,还将为药物依赖领域的研究人员提供重要助力。作者通过一系列严谨实验,完成了对“嵌合型可卡因选择性受体”的特性分析,并在体内模型中验证了其效用。总体而言,这是一项极具突破性的研究。
(点评专家:Brandon Henderson,任职于美国西弗吉尼亚州亨廷顿市马歇尔大学)
研究背后的故事
“构建离子通道以在神经回路中创建人工反馈”这一想法,源于我们此前在“神经回路”及“化学调控离子通道工程”领域的研究基础[5]。当前神经回路研究中,越来越多的研究通过“闭环扰动神经元电活动”来验证神经动态变化对行为的因果作用——具体而言,就是以与行为输出精确同步的方式,对抗或增强神经元活动。
传统闭环方法通常基于光遗传学或电刺激技术实现神经元活动的快速调控,而我们则探索了“药理学闭环策略”的开发。这种策略的核心应用场景是:某些行为(如药物摄入)会引发“从身体到大脑的化学信号传导”,该信号反过来会强化“引发该行为的神经回路”。我们两个实验室此前的合作基础,以及互补的专业背景,为本次研究的顺利开展提供了保障。
(作者:S.M.S. 与 M.M.)
编辑视角
这项研究看似违背直觉——因为可卡因通常会通过升高多巴胺水平来强化药物寻求行为。目前尚不确定这种“大脑回路改造”策略能否转化至临床应用,但“仅针对性减弱药物成瘾性,而不影响其他生理功能”的研究思路,为药物依赖机制研究提供了重要工具。
(点评编辑:Bryden Le Bailly,《自然》杂志高级编辑)
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1500690.html?mobile=1
收藏

