 精选
精选
脑胶质瘤饥饿疗法:控制关键氨基酸
关键氨基酸匮乏时,小鼠脑肿瘤生长速度减缓
部分胶质母细胞瘤会从周围环境中“窃取”丝氨酸——这一弱点为治疗打开了突破口。

胶质母细胞瘤(在这张彩色扫描图左下侧呈红色斑点状)是一类生长迅速的脑肿瘤,患者确诊后通常存活时间仅1-2年。图片来源:Zephyr/科学图片库(Science Photo Library)
科学家发现[1],一种极具致命性的脑肿瘤常通过窃取关键营养物质来助力其恶性生长——而这一特性可被利用以减缓癌症扩散。
实验表明,许多被称为“胶质母细胞瘤”的脑肿瘤,并不会自行合成丝氨酸(一种关键氨基酸),而是从周围环境中获取,这成为其代谢过程中的“阿喀琉斯之踵”(致命弱点)。研究人员为患有特定类型胶质母细胞瘤的小鼠喂食不含丝氨酸的饲料,结果发现,由于无法通过常规方式获取丝氨酸,小鼠体内肿瘤的生长速度显著放缓,且小鼠的存活时间也有所延长。
加拿大汉密尔顿市麦克马斯特大学(McMaster University)的神经外科科学家希拉·辛格(Sheila Singh)未参与此项研究,她评价道:“这篇论文是该领域的重大突破。研究人员确实找到了胶质母细胞瘤的一个代谢弱点,且这一弱点可通过治疗策略加以利用。”
该研究成果于9月3日发表在《自然》(*Nature*)期刊上。
凶险的疾病
胶质母细胞瘤会以极快的速度侵袭脑组织,且治疗后几乎必然复发。目前针对该肿瘤的标准治疗手段通常包括手术,以及术后联合化疗与放疗。大多数确诊这类癌症的患者,存活时间仅为1-2年。
该研究的合著者、美国安阿伯市密歇根大学(University of Michigan)的癌症神经科学家安德鲁·斯科特(Andrew Scott)表示,肿瘤会从宿主身上窃取糖分及其他营养物质,随后利用这些“赃物”维持自身的代谢通路——即一系列将食物转化为有用分子的化学过程,“不择手段地持续生长”。
为弄清胶质母细胞瘤的这一“生存策略”具体如何运作,这篇《自然》论文的作者研究了8名接受脑肿瘤切除手术的患者。手术过程中,医生为患者输注了带有特定碳同位素标记的糖分子,之后研究人员对患者的肿瘤样本及周围脑组织样本进行了分析。
通过追踪同位素的去向,研究团队发现,部分胶质母细胞瘤会利用从周围环境中获取的糖分合成各类物质,例如构成DNA的基础成分,而这正是肿瘤得以疯狂生长的原因之一。
肿瘤的“小把戏”
为验证研究发现并进一步深入探索,团队还对移植了人类胶质母细胞瘤组织的小鼠展开研究。研究人员开发了建模技术,以确定肿瘤消耗和利用营养物质的方式。合著者、密歇根大学的生物化学家科斯塔斯·利西奥蒂斯(Costas Lyssiotis)指出:“健康脑组织会自行合成丝氨酸,与之相反,许多胶质母细胞瘤则‘省掉了这步麻烦’——因为它们可以直接‘吞噬’丝氨酸。”研究人员认为,肿瘤通过“窃取”丝氨酸,可节省原本用于合成丝氨酸所需的糖分;而这些节省下来的糖分,又能被癌细胞用于合成DNA、RNA及其他助力细胞增殖的分子的基本结构单元。
研究团队意识到,肿瘤对“窃取”丝氨酸的依赖,实则是其一大“软肋”。为验证这一弱点,研究人员为携带肿瘤的小鼠喂食不含丝氨酸及甘氨酸(可转化为丝氨酸的一种氨基酸)的饲料。结果显示,患有特定类型胶质母细胞瘤的小鼠,食用这种特殊饲料后的存活时间比食用标准饲料更长;尽管另一种类型肿瘤的小鼠未表现出这一差异,但所有携带肿瘤的小鼠在食用无丝氨酸饲料的同时接受放化疗联合治疗后,存活时间均有所延长。
后续计划
斯科特表示,研究团队希望明年启动一项无丝氨酸饮食的临床试验。这种饮食方式虽无法治愈胶质母细胞瘤,但可为部分患者争取更多生存时间。
该研究的合著者、密歇根大学的医师科学家丹尼尔·瓦尔(Daniel Wahl)称,团队提出的多数抗肿瘤方案都未能进入大规模人体试验阶段,但这一方案“(在小鼠实验中)展现出了足够的潜力和良好的耐受性,因此我们决定开展临床试验……我对此非常期待。”
Rewiring of cortical glucose metabolism fuels human brain cancer growth | Nature
皮质葡萄糖代谢重组为人类脑癌生长供能
摘要
大脑会大量消耗葡萄糖,为神经生理活动供能[1]。而脑癌(如胶质母细胞瘤)会脱离正常生理调控,获得增殖并侵袭健康组织的能力[2]。目前,脑癌如何通过重组葡萄糖利用方式驱动其恶性生长,尚不明确。本研究向患有脑癌的患者及小鼠体内输注13C标记葡萄糖,并结合定量代谢流分析,绘制出葡萄糖来源的碳在肿瘤与大脑皮质中的代谢去向。通过对皮质及胶质瘤组织中碳、氮标记的直接且全面检测,我们发现了显著的代谢转变:在人类大脑皮质中,葡萄糖碳会为三羧酸循环氧化、神经递质合成等关键生理过程供能;与之相反,胶质瘤会下调这些生理过程,转而从周围环境中摄取氨基酸等替代碳源,并将葡萄糖来源的碳重新分配,用于合成增殖与侵袭所需的分子。在小鼠实验中,通过饮食氨基酸调控靶向这种代谢重组,可选择性改变胶质母细胞瘤的代谢模式,减缓肿瘤生长,并增强标准治疗方案的疗效。这些发现揭示了恶性脑肿瘤如何利用葡萄糖抑制正常生理活动、助力恶性扩张,同时为提升治疗效果提供了潜在的治疗策略。
胶质瘤是最常见的恶性脑肿瘤,由神经胶质细胞发生转化,形成具有侵袭性的脑侵袭性细胞而来[3]。胶质母细胞瘤(GBM)是成人中最常见且恶性程度最高的原发性恶性脑肿瘤,具有侵袭性强、耐药性高、预后极差的特点[3,4]。尽管目前的标准治疗方案包括手术切除、放疗(RT)及替莫唑胺(TMZ)化疗,但胶质母细胞瘤几乎都会复发,大多数患者在确诊后1-2年内死亡[4]。治疗效果不佳的主要原因是肿瘤耐药性,而广泛的肿瘤异质性进一步限制了治疗效果[3,5]。不过,通过明确并靶向胶质母细胞瘤中促进耐药性的共性代谢弱点,或许能突破这一治疗困境[6,7,8,9]。
深入了解肿瘤的代谢活动,对于合理指导代谢导向治疗至关重要。正电子发射断层扫描(PET,使用葡萄糖类似物)[10]、磁共振波谱分析及代谢组学等技术,可用于检测葡萄糖摄取量及代谢物丰度,而稳定同位素示踪技术则能直接监测代谢活性。为明确营养物质的差异化代谢方式,研究人员会追踪含重同位素(非放射性)的底物进入下游代谢物的过程,从而揭示不同条件下活跃的代谢通路。将该技术应用于人类癌症研究发现,肾癌中葡萄糖氧化过程受抑制[11],而肺癌中乳酸利用、糖酵解及葡萄糖氧化过程均增强[12]。该技术在人类脑癌中的应用尚有限,现有研究仅表明胶质瘤的三羧酸(TCA)循环具有活性,且可同时利用葡萄糖和乙酸供能[13,14]。目前,胶质瘤中其他代谢通路的活跃程度、其与邻近脑组织的代谢差异,以及这些差异是否具备治疗可靶向性等问题,仍未得到解答。
为解决这些问题,我们向患有高级别胶质瘤的患者,以及移植了原位胶质母细胞瘤的小鼠体内输注同位素标记的营养物质,追踪这些物质在癌组织与大脑皮质组织下游代谢通路中的去向。同时,我们将这些检测结果与代谢流模型相结合,量化体内代谢反应的绝对速率。研究发现,恶性脑肿瘤会改变葡萄糖碳的利用方向,不再用于三羧酸循环氧化、氨基酸类神经递质合成等生理过程,部分原因是其会从环境中回收丝氨酸等营养物质。相反,肿瘤会优先利用葡萄糖碳合成生长所需的核苷酸。我们还发现,这种代谢调控具有可塑性:胶质母细胞瘤会在治疗刺激下,通过适应性上调相关通路产生耐药性。通过饮食调控限制替代碳源,可使胶质母细胞瘤的代谢模式偏离生物量合成,并提高放化疗的疗效。综上,本研究通过对脑肿瘤与邻近皮质组织的代谢活性进行全面对比检测,揭示了肿瘤特异性的代谢重组机制,而这种机制可通过精准饮食干预进行选择性靶向。
颅内组织中的葡萄糖示踪
为明确异质性胶质母细胞瘤群体中的共性代谢表型,我们向拟接受手术切除的疑似胶质母细胞瘤患者,以及多个颅内患者来源胶质母细胞瘤模型小鼠体内,输注均匀标记的13C葡萄糖([U-13C]葡萄糖)。随后,利用质谱(MS)技术,确定葡萄糖来源的13C在皮质及不同肿瘤区域中的下游代谢去向(图1a)。
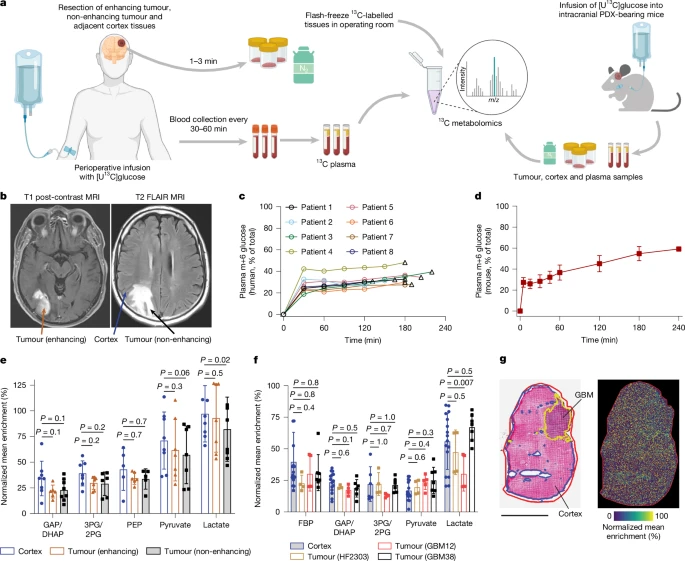
图1:脑肿瘤与皮质中的葡萄糖标记情况
a. 向胶质瘤患者及患者来源颅内胶质母细胞瘤小鼠模型中输注[U-13C]葡萄糖并进行分析的示意图(该图使用BioRender制作)。b. 基于磁共振成像确定组织采集区域的示例。c. 输注[U-13C]葡萄糖后,不同时间点患者动脉血中m+6葡萄糖的富集度(患者8在0时刻的血浆样本无法进行分析;三角形标注的是组织切除及快速冷冻的时间点)。d. 输注[U-13C]葡萄糖后,不同时间点小鼠动脉血中m+6葡萄糖的富集度(数据为各时间点的平均值±标准差)。e、f. 向8例胶质瘤患者(e)及小鼠模型(f)输注[U-13C]葡萄糖后,颅内组织中糖酵解中间产物的富集度(按每位患者或每只小鼠的标记血浆葡萄糖进行标准化;数据为平均值±标准差)。组间比较采用线性混合效应模型,以个体为随机截距;对每种代谢物,采用Holm法校正不同组织类型间的多重两两比较;统计检验均为双侧检验。g. 原位生长的GBM38患者来源异种移植瘤(PDX)的HE染色结果(左图),以及显示乳酸13C富集度的基质辅助激光解吸电离(MALDI)成像结果(右图,组织中最大富集度设为100%)。使用独立的仪器进行重复成像,结果一致;比例尺:3毫米。
(注:FBP=1,6-二磷酸果糖;GAP=3-磷酸甘油醛;DHAP=磷酸二羟丙酮;3PG/2PG=3-磷酸甘油酸/2-磷酸甘油酸;PEP=磷酸烯醇式丙酮酸)
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1500322.html?mobile=1
收藏

