从大气到线粒体:氧级联反应
摘要
本章将简要概述氧气从大气输送至其最终利用场所(线粒体)的基本原理,以及调控和优化该输送过程以提升效率、保障机体整体“存活”的机制。这一过程通过四个连续步骤实现,具体包括:
1. 空气通过对流性质量转运进出肺泡腔;
2. 氧气与二氧化碳在肺泡和肺毛细血管血液之间通过扩散进行交换;
3. 血液通过对流性质量转运从肺循环输送至体循环;
4. 二氧化碳与氧气在体循环毛细血管中通过扩散在血液与组织细胞之间完成交换。
在呼吸循环与体循环的对流性转运和扩散性转运之间,存在一个关键连接环节——血红蛋白(hemoglobin)。血红蛋白具有重要的功能特性,可增强呼吸气体的转运效率,并确保氧气高效输送至所有组织细胞。本章还将概述相关生理过程,正是这些过程使机体能以高效方式应对各类氧代谢需求。此外,文中还将列举若干病理状态实例,这些病理状态可能会降低氧输送过程的效率,或导致调控异常,进而引发细胞、组织和/或器官缺氧及后续功能障碍。
参考文献
Biro, George P. "From the atmosphere to the mitochondrion: the oxygen cascade." Hemoglobin-based oxygen carriers as red cell substitutes and oxygen therapeutics. Berlin, Heidelberg: Springer Berlin Heidelberg, 2013. 27-53.
一、引言
氧气是能量代谢不可或缺的物质。在能量代谢过程中,食物中化学键所储存的能量通过一系列逐步的化学反应释放,并以高能磷酸化合物(ATP和磷酸肌酸)的形式为所有细胞功能供能。尽管存在不依赖氧气的产能过程,但这类过程对整体能量稳态的贡献极小,且适用范围有限。
碳水化合物和脂肪形式的食物,通过糖酵解、脂肪酸氧化和三羧酸循环(克雷布斯循环),首先在线粒体中生成高能磷酸化合物NADH(还原型烟酰胺腺嘌呤二核苷酸)和FADH(还原型黄素腺嘌呤二核苷酸)。这两种物质富含能量,因其含有一对具有高转移势能的电子。当这些电子转移至氧气时,能量会被释放出来;通过氧化磷酸化过程,这些能量能以ATP(三磷酸腺苷)的形式高效储存。
ATP广泛参与各类生物学过程,既包括基础水平的维持功能(如维持细胞离子通道和离子梯度),也涉及消耗能量的外部做功过程(如肌肉运动)。由于机体外部做功过程的强度存在差异,其能量需求也需在较大范围内进行调节。因此,氧转运系统需根据不同的代谢需求,以相应速率将氧气输送至各个器官和细胞。
从大气到所有器官、组织、细胞及线粒体的氧转运系统,需满足以下要求(Pennock & Attinger, 1968):
1.过程需具备能量效率:心肌和呼吸肌所做的功不应被浪费,且占机体总能量输出的比例需相对较小。
2.过程需对器官和细胞代谢活动的波动需求敏感。
3.过程需能响应不同器官的代谢需求变化,并能根据各器官和细胞的功能及代谢需求,实现区域性血流分布的匹配。
4.过程需确保氧气能通过扩散作用从血液高效渗透至代谢细胞及其线粒体中。
不同器官的细胞对氧气的利用速率差异显著;从静息状态到最大运动强度,机体总耗氧量的变化可达10倍(Wagner, 2011)。氧转运系统需据此做出相应调整。当该系统无法满足当前氧气需求时,即会出现“缺氧”状态。缺氧存在多种形式,下文将进一步探讨。
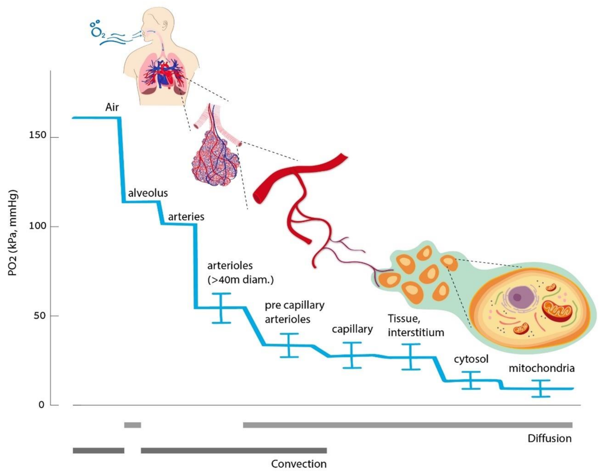
整个氧转运系统的示意图如图2.1所示。
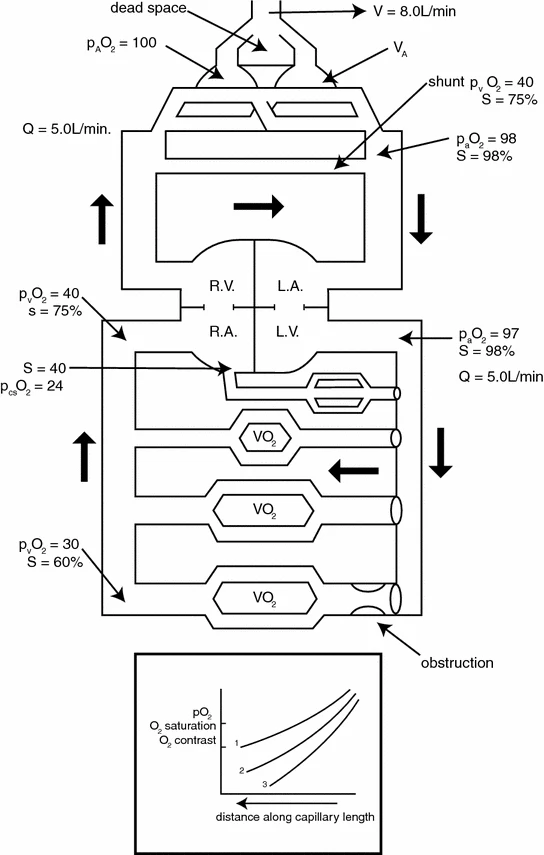
图2.1 氧转运系统的概念示意图(含呼吸和循环组件)
该图包含若干公认的关键参数值,如氧分压、血红蛋白氧饱和度及空气和血液的总流量。在呼吸系统中,展示了肺泡通气量、无效腔和分流组件;在循环系统中,展示了四个代表性的体循环血管床(包括冠状动脉循环,其氧提取率较高),以及另外三个从血液中消耗和提取氧气的代表性血管床。最下方的血管床展示了存在严重阻塞(如动脉粥样硬化斑块)时血流受限的情况。
图底部的插入图从概念上展示了在三种条件下,理想毛细血管中氧分压(pO₂)、氧饱和度和氧含量的变化:1. 正常灌注;2. 灌注量相对于组织耗氧量不足;3. 灌注严重不足,导致氧气在到达毛细血管下游末端前即完全耗尽,进而引发部分细胞缺氧。
图中缩写含义如下:S=氧饱和度;Q=心输出量;V=通气量;VO₂=耗氧量;下标:a=动脉;A=肺泡;v=静脉;cs=冠状窦;RA=右心房;RV=右心室;LA=左心房;LV=左心室。
二、氧转运系统的组成部分
氧转运系统由以下连续过程组成:
1. 大气空气的对流性质量转运:呼吸肌的收缩与舒张为空气从环境进入肺肺泡腔提供动力。呼吸肌的活动主要由延髓和脑桥呼吸中枢及外周化学感受器调控。
2. 跨肺泡-毛细血管膜的被动扩散:在氧分压梯度(肺泡氧分压pAO₂ - 毛细血管氧分压pcO₂)的“驱动”下,氧气穿过肺泡-毛细血管膜、血浆和红细胞膜,最终与血红蛋白(HGb)结合。
3. 血液的对流性质量转运:心肌的收缩与舒张为血液从肺泡毛细血管和左心,经血管分布系统输送至所有体循环毛细血管,并最终回流至右心提供动力。这一过程受自主神经系统、多种激素、血管活性肽、前列腺素类物质、一氧化氮(NO)及其他影响血流分布的局部血管调节功能调控。
4. 向线粒体的被动扩散:在氧分压梯度(平均毛细血管氧分压 - 平均线粒体氧分压)的驱动下,氧气从毛细血管血液穿过质膜进入组织间隙,再穿过细胞膜进入细胞质(若存在肌红蛋白MGb,可辅助这一过程),最终进入线粒体。
在呼吸过程的“对流阶段与扩散阶段”之间,以及循环过程的“对流阶段与扩散阶段”之间,存在一个关键连接环节——氧-血红蛋白平衡关系,该关系可通过血红蛋白氧解离曲线(ODC)体现,如图2.2所示。
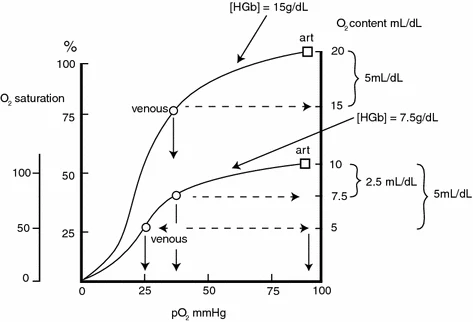
图2.2 正常血液(血红蛋白浓度[HGb]=15 g/dL)与贫血血液([HGb]=7.5 g/dL)的氧解离曲线概念图
需注意:在“正常”条件下,若血流速率固定,每100mL血液可提取5mL氧气,此时静脉氧分压约为40 mmHg(公认“正常”值),氧饱和度下降25%。而对于贫血血液,每100mL血液仅需提取2.5mL氧气,即可达到与“正常”血液相似的静脉血参数。若要从每100mL灌注血液中提取5mL氧气,则需更低的静脉端组织氧分压和氧饱和度(即更大程度的去饱和),且这一情况仅能通过增加血流来代偿——这正是贫血可能导致组织缺氧的根本原因。
氧解离曲线的生理意义
根据亨利定律,氧气在水中的溶解遵循“氧浓度与水所接触的氧分压呈简单线性关系”。在37°C时,氧气在水中的溶解度系数为0.03 mL/dL·mmHg。因此,在海平面正常大气氧分压(约150 mmHg)下,体温环境中水中的氧浓度约为4.4 mL/L(或更常用单位0.44 mL/dL,即0.44体积%),这一浓度无法满足人类机体的存活需求。
血红蛋白的进化(其Fe2⁺基团可与氧气可逆结合)是恒温生物生存的重要进化适应,使其能够通过调节氧输送速率来满足不同的需求。关于血红蛋白的生物化学特性,本书后续章节将由Mozzarelli进行更全面的探讨。
血红蛋白由蛋白质(两条α链和两条β珠蛋白链)和四个卟啉环组成,每个卟啉环的疏水“口袋”中均含有一个铁原子,这种结构极大地改变了铁的特性。当血红蛋白暴露于极高氧分压环境时,所有氧结合位点都会被氧饱和(即结合氧分子),此时血红蛋白达到“完全饱和”状态——每克血红蛋白可结合1.34 mL氧气,这一数值被称为血红蛋白的“氧容量”。
在正常血液血红蛋白浓度(150 g/L,或更常用单位15 g/dL)下,完全饱和的血液氧浓度(或氧含量)约为20 mL/dL。当血液血红蛋白浓度发生变化时,其氧含量会成比例变化,但每克血红蛋白的氧容量保持不变。当血红蛋白暴露于低氧分压环境时,部分结合的氧气会“解离”,这一过程由“氧解离曲线(ODC)”调控。
氧气与铁的结合呈连续性:结合第一个铁原子会促进氧气与第二个铁原子的结合,以此类推;而结合第四个铁原子则需要更大的氧分压增量。氧气的解离过程则完全相反。这些现象是“氧-血红蛋白解离曲线(ODC)呈S形”的根本原因。如图2.1所示,当以氧饱和度为纵轴、氧分压为横轴绘图时,曲线在初始阶段陡峭上升,当氧分压升至约70 mmHg及以上时,曲线逐渐趋于平缓。
这种S形曲线带来两个重要优势:
1. 肺毛细血管中的氧结合:血液流经肺毛细血管时,会暴露于肺泡内通常较高的氧分压环境(海平面条件下约为100 mmHg),这一压力足以使血红蛋白接近完全饱和。由于在肺泡氧分压范围内,氧解离曲线相当平缓,因此即使肺泡氧分压低于正常水平,血红蛋白的去饱和程度也仅轻微增加。更重要的是,氧-血红蛋白平衡关系极大地促进了氧气跨肺泡-毛细血管壁的扩散——当氧气扩散进入血浆后,会立即扩散进入红细胞并与血红蛋白紧密结合,导致血浆氧分压始终维持在较低水平,肺泡空气与血浆之间仍保持较大的氧分压梯度;同时,尽管大量氧气已与血红蛋白结合,红细胞内的氧分压仍较低。这些因素均有利于氧气持续从肺泡空气扩散至毛细血管血浆,再进入红细胞与血红蛋白结合。因此,血红蛋白所能结合和转运的氧气量,远高于氧气在血液水溶液中的溶解量。
2. 体循环毛细血管中的氧释放:血液流经被活跃代谢细胞包围的体循环毛细血管时,会处于低氧分压环境。在这一氧分压范围内,氧解离曲线相当陡峭——氧分压的微小下降即会导致氧饱和度大幅降低,氧气先释放至血浆,再扩散至组织细胞。此时,上述扩散增强效应会反向发挥作用:当氧气离开血浆时,血浆氧分压下降,红细胞内氧分压也随之降低;氧解离曲线的陡峭部分确保了大量氧气能从血红蛋白上解离,同时仍维持相对较高的红细胞内氧分压。血浆中的氧气消耗会被红细胞内血红蛋白的去饱和所补充,从而使血浆氧分压保持在足以支持氧气持续向外扩散的水平。
“标准氧-血红蛋白平衡关系”(定义为温度T=37°C、pH=7.4、二氧化碳分压pCO₂=40 mmHg条件下)以“血红蛋白50%氧饱和度对应的氧分压”来定义,该值被称为p50(即氧饱和度中点对应的氧分压,或使血红蛋白达到半饱和所需的氧分压),正常p50值约为27 mmHg。氧解离曲线的数学近似表达式为希尔方程(见下文公式2.6)。
氧解离曲线的形状保持不变,但多种因素可通过使曲线沿氧分压轴左右水平移动,改变其位置——这源于血红蛋白与氧气的亲和力发生定量变化。影响氧解离曲线的重要生理因素包括温度、pH值、二氧化碳浓度(pCO₂)及红细胞内有机磷酸盐(尤其是2,3-二磷酸甘油酸,2,3-DPG)的浓度:
- 温度升高、pCO₂升高、pH值降低,均会导致曲线右移,即血红蛋白达到半饱和所需的氧分压(p50)升高,也称为“亲和力降低”。
- 一个便于记忆的规律是:运动肌肉中发生的变化(高温、酸性增强、高碳酸血症)会导致曲线右移。在任意给定组织氧分压下,曲线右移均可增加氧气的解离量,从而提高氧释放效率;同时,这对肺部氧结合的不利影响较小,且通常可通过通气改善和肺泡氧分压升高来抵消。
关于红细胞内变构调节因子(2,3-二磷酸甘油酸,2,3-DPG)的生理意义,本文篇幅有限,无法展开全面探讨。人类红细胞的结构独特,专为单一功能(气体转运,如氧气、二氧化碳、一氧化氮等)设计——它不含细胞核和线粒体,且血红蛋白浓度高达36 g/dL。因此,红细胞的能量代谢依赖糖酵解来生成有机磷酸盐。
2,3-DPG是糖酵解的中间产物,其在红细胞内的稳态浓度由DPG变位酶和DPG磷酸酶的活性决定。血红蛋白β链与2,3-DPG之间存在高亲和力结合:当2,3-DPG浓度较高时,血红蛋白分子会发生构象变化,导致p50升高。红细胞内2,3-DPG浓度变化可使p50在15–34 mmHg的较大范围内波动(Nunn, 1987)。从功能上看,当p50从27 mmHg升至34 mmHg时,在40 mmHg氧分压下,血红蛋白的去饱和程度会增加近10%,可为组织多释放约1.6 mL/dL的氧气(Murray, 1976)。
红细胞内pH值降低对氧解离曲线的影响,部分是通过改变2,3-DPG浓度实现的:pH降低会抑制DPG变位酶并调控DPG磷酸酶,最终导致p50升高,曲线右移。
首先必须明确区分氧分压(pO₂)、氧饱和度,与氧含量(oxygen content)这些概念。如前所述,每克血红蛋白(HGb)在完全饱和(高氧分压环境下)时可结合1.36 mL氧气。这意味着在正常血红蛋白浓度(约15 g/dL)下,每分升血液可携带近20 mL氧气。假设血液流经某一血管床时,每100 mL血液会释放5 mL氧气,那么静脉血的氧含量将降至15 mL/dL,静脉血氧饱和度为75%(计算公式:[(20-5)/20]×100%),静脉血氧分压约为40 mmHg。
但如果血红蛋白浓度降至7.5 g/dL(例如失血后输注晶体液稀释血液的情况),其完全饱和时的氧容量将降至约10 mL/dL。在上述相同假设场景中,若每100 mL血液仍需释放5 mL氧气,静脉血氧饱和度会降至50%,静脉血氧分压约为27 mmHg,组织氧供将因此受损。由此可见,血红蛋白浓度决定了血液的氧容量和氧含量,但不决定氧饱和度——氧饱和度完全由氧解离曲线(ODC)和血液所处环境的氧分压共同决定(如图2.2示意图所示)。事实上,在上述贫血案例中,机体缓解潜在缺氧的生理适应机制是“氧解离曲线右移”,从而在任意给定毛细血管血氧分压下,释放更多“额外”氧气。
病理状态下的生理影响
1. 储存血液的氧解离曲线变化:在4°C下储存的库血会迅速丢失2,3-二磷酸甘油酸(2,3-DPG),导致氧解离曲线左移,p50(血红蛋白半饱和氧分压)可低至15 mmHg。在此情况下,血液在组织中释放氧气的难度显著增加,输注后的红细胞需至少24小时才能“恢复活性”,并恢复正常的氧亲和力。
2. 贫血状态的代偿机制:无论是慢性还是急性贫血,红细胞内2,3-DPG浓度都会升高,导致氧解离曲线右移,从而改善组织中的氧释放效率。
3. 低动脉氧分压相关疾病:在动脉氧分压显著降低的场景(如高海拔环境或严重肺部疾病)中,氧解离曲线右移的影响具有两面性——既会阻碍肺部氧气结合,又能促进组织氧气释放。
4. 呼吸衰竭伴二氧化碳潴留:呼吸衰竭导致的酸中毒和高碳酸血症会使氧解离曲线右移,但当血气指标校正至标准状态(温度37°C、pH 7.4、二氧化碳分压40 mmHg)时,p50和2,3-DPG浓度会恢复正常。
5. 遗传性血红蛋白病:部分(非全部)遗传性血红蛋白病会因珠蛋白链构象改变,导致p50升高或降低。镰状细胞贫血是特殊案例:除氧亲和力改变外,还伴随红细胞膜变形性和脆性显著异常、血红蛋白结晶,以及特异性血管病变。
与血红蛋白结合的特殊气体配体
三种气体可作为血红蛋白的特殊配体,其结合会显著影响氧运输功能:
1. 一氧化碳(CO):机体在卟啉代谢过程中会自然产生少量一氧化碳,但暴露于非生理高浓度一氧化碳时,因其与血红素铁的亲和力约为氧气的300倍,会竞争性取代血红素上的氧气。一氧化碳与血红素铁结合不仅会降低血液氧容量,还会导致剩余氧气结合位点的氧解离曲线左移,进一步阻碍氧释放。
2. 氰化物(CN⁻):氰化物与血红素铁的亲和力同样极高,作用机制与一氧化碳类似;但更重要的是,它对线粒体呼吸链中的细胞色素亲和力更强,会抑制氧气消耗和能量(ATP)生成。
3.一氧化氮(NO):作为正常生理配体,一氧化氮在血管调节中具有特殊作用,部分机制是通过“血红蛋白铁与珠蛋白的S-亚硝基基团之间的循环反应”实现(Lima, Forrester et al., 2010;Haldar & Stamler, 2013),这是心血管信号通路中调节氧输送的关键过程。
缺氧的分类
目前公认的缺氧类型包括:
- 低氧血症(Hypoxemia):血液氧饱和度低于正常水平。
- 组织缺氧(Tissue hypoxia):器官、组织或细胞水平的氧供不足。
- 循环性缺氧(Stagnant hypoxia):因血流减少(如缺血)导致的组织缺氧。
- 组织毒性/细胞毒性缺氧(Histotoxic/Cytotoxic hypoxia):因物质干扰线粒体呼吸链(如氰化物竞争性结合耗氧位点),导致ATP生成受损或停止。
- 贫血性缺氧(Anemic hypoxia):因血液中功能性血红蛋白浓度不足,或大量氧结合位点被高亲和力配体(如一氧化碳)占据导致氧容量降低,最终引发氧供不足。
缺氧的生理影响
缺氧的生理影响极为广泛,此处无法逐一列举。简而言之,其影响取决于三个因素:缺氧的严重程度、机体耐受性,以及缺氧是突发短暂性还是长期持续性(长期缺氧会促使机体产生适应和耐受机制,以缓解部分负面影响)。细胞对缺氧的耐受可能涉及多种机制,包括“代谢休眠”(降低代谢活性)、提高氧提取效率,以及调整酶系统和基因表达,从而在低氧环境下维持代谢活动(Leach & Treacher, 1992)。
氧转运系统的核心公式及意义
以下公式代表氧转运系统的组成部分及其相互作用(Leach & Treacher, 1992): (2.1)肺泡气方程 (2.2)动脉血氧含量方程 (2.3)氧输送速率方程 (2.4)氧提取率方程
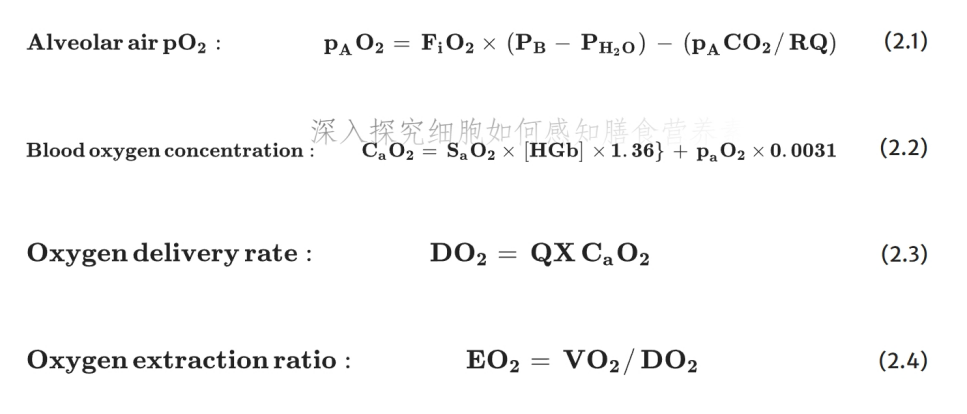
各公式的具体意义如下:
1.肺泡气方程(公式2.1):在给定大气压下,扣除气管空气在体温下饱和水蒸气压后的肺泡气氧分压。该方程描述了稳态下“氧气消耗”和“二氧化碳生成”对肺泡气氧分压的影响,也是肺毛细血管血液在快速流经毛细血管时所达到的平衡氧分压——根据氧解离曲线(ODC),此氧分压决定了血红蛋白的氧饱和度。
2. 动脉血氧含量方程(公式2.2):计算从肺循环流出的动脉血氧浓度(未计入静脉血掺杂导致的氧损失)。公式中,血氧饱和度相关项为“每克血红蛋白完全饱和时的氧容量(1.36 mL/g)×血红蛋白浓度”,物理溶解项为“体温下氧气在血液水中的溶解度(0.0031 mL O₂/(mL 水·mmHg))×动脉血氧分压”。该公式清晰体现了血红蛋白结合氧的优势:1克完全饱和的血红蛋白所转运的氧气量,是其在血液水溶液中溶解量的40倍以上;100 mL血液中15克血红蛋白的氧转运能力,更是溶解量的600倍以上。结合肺泡气方程可知,当呼吸空气或在高海拔环境下血红蛋白无法完全饱和时,吸入富氧气体可显著提升血氧含量。
3. 氧输送速率方程(公式2.3):表明心输出量和血氧含量在满足机体氧需求时具有同等重要性,二者呈互补关系。但该公式未涉及“满足不同器官可变氧需求的精细调节机制”——即通过调整心输出量的分布来匹配局部需求。若将公式应用于单个器官,可将“心输出量”替换为“器官血流量”,后者可在较大范围内波动以适应器官需求。
4. 氧提取率方程(公式2.4):隐含核心信息是“血液中可提取的氧气比例有限”,回流至静脉系统的血液中必须保留一定浓度的氧气。氧提取率决定了静脉血的残余氧饱和度,结合氧解离曲线可进一步确定血液流经体循环毛细血管后的氧分压。毛细血管末端需维持一定氧分压,以确保存在足够的氧分压梯度,使氧气能扩散至距离毛细血管较远的细胞。
在静息状态下,体循环回流静脉血的氧饱和度通常为70%–75%,混合静脉血氧分压约为40 mmHg。不同器官的氧提取率差异显著:心脏等器官提取率较高,部分器官提取率较低;骨骼肌等器官的氧提取率波动范围大(静息与运动状态差异显著),而大脑等器官则维持相对稳定的总氧耗和氧提取率。
下文将详细描述“氧转运系统”的四个阶段,即氧气从大气到线粒体的“氧级联反应”。需特别强调的是:在氧转运的呼吸和循环阶段中,对流性质量转运与扩散过程之间的关键连接环节,是“氧分压(pO₂)与血红蛋白饱和度(及血液氧含量)之间的氧解离曲线(ODC)关系”。Mozzarelli撰写的章节将详细阐述该关系的机制及本质,此处需重点关注其核心功能——在肺循环中,高肺泡氧分压环境下,氧解离曲线促进氧气与血红蛋白结合;在体循环中,毛细血管周围细胞持续消耗氧气导致血管外氧分压降低,氧解离曲线则促进氧气从血红蛋白释放。
三、氧级联反应的第一步:从环境到肺泡腔的质量转运
3.1 大气到肺泡腔的气体转运
在海平面,大气总压力为760 mmHg,含氧量21%,因此大气氧分压约为159 mmHg。空气进入气管-支气管树后,被加热至体温并饱和水蒸气(水蒸气分压为47 mmHg,会降低有效气压),故进入肺泡时的氧分压为(760-47)×21%≈150 mmHg。由于肺泡气中二氧化碳分压约为40 mmHg(来自组织代谢排出),氧气浓度被稀释,最终平均肺泡气氧分压(pAO₂)降至约100 mmHg(符合上述肺泡气方程(公式2.1))。
3.1.1 肺通气
呼吸肌的吸气-呼气周期性活动维持双向气流,经多个呼吸周期平均后,肺泡气中氧分压和二氧化碳分压分别稳定在100 mmHg和40 mmHg左右。当机体氧耗和二氧化碳生成量发生显著变化时,复杂的神经调节机制(调控总通气量和肺泡通气量)可使肺泡气氧分压和二氧化碳分压维持在上述稳定水平。
从静息睡眠时的基础需求到最大运动强度,机体氧耗和二氧化碳生成量的变化范围可达10倍(Murray, 1976)。脑桥内存在“中枢振荡器”,可产生吸气-呼气周期的交替兴奋/抑制信号(Morschel & Dutschman, 2009),该节律在延髓(呼吸和心血管系统主要调节中枢所在地)进一步调制。延髓腹侧区域对pH变化极为敏感(主要由脑脊液中未缓冲的二氧化碳分压变化引起),是维持动脉血二氧化碳分压稳定的核心部位(Guyenet, 2008;da Silve, Li et al., 2010;Nattie, 2011)——该区域二氧化碳浓度的微小变化,即可引发肺泡通气量显著调整,从而维持肺泡和动脉血二氧化碳分压接近恒定。
延髓呼吸中枢的神经信号通过脊髓运动核的传出纤维传递至膈肌、肋间肌和腹肌。除延髓中枢外,迷走神经(X)和舌咽神经(IX)的传入纤维还会将主动脉体和颈动脉体化学感受器的信号传递至孤束核,再转至脑桥和延髓的整合神经元。主动脉体和颈动脉体化学感受器主要感知动脉血氧分压的显著变化,也对二氧化碳分压变化敏感,是高海拔或急性肺损伤时“动脉血氧分压降低引发通气增强”的主要驱动因素。此外,肺实质机械感受器通过迷走神经传递肺扩张信息,呼吸肌肌梭通过传入纤维向脊髓传递肌肉张力信息,共同参与通气调节。
肺通气的力学机制
呼吸肌收缩需克服三种阻力以产生肺内气流:
1. 肺和胸壁复合体的弹性回缩力;
2. 气道内气流的摩擦阻力,以及肺与胸廓间的摩擦阻力;
3. 惯性气流阻力(主要由气道总横截面积决定,符合泊肃叶定律)(Murray, 1976)。
在静息呼吸状态下,正常气道阻力极小,呼吸功占机体总氧耗的比例很低。但当代谢活动增强、需增加通气量和氧输送时,呼吸功也会相应增加:潮气量和呼吸频率升高会导致肺内双向气流的总量和流速呈指数级增加,气流形态转为湍流;在最大运动强度下,呼吸功会成为限制因素——因其消耗了全部额外摄入的氧气。同样,在接近最大通气量时,需呼气肌主动收缩以维持高流速气流,而呼气肌收缩可能导致气道动态压缩(尤其是无软骨充分支撑的小气道),进一步增加气道阻力,形成“阻力增加→气流受限→气体陷闭”的有害正反馈循环。
气道阻力可通过气道平滑肌的收缩/舒张调节,后者受交感神经及其激动剂、多种炎症介质,以及一氧化氮介导的舒张因子调控(Spina, 2008)。但在气道平滑肌过度收缩的病理状态(如哮喘)中,即使通气量较低,气道阻力也可能增加数倍,呼吸功占总氧耗的比例大幅升高(Ozier, Allard et al., 2011),从而严重限制氧转运系统对需求增加的应答能力,降低运动耐量。此外,气道自身具备氧感知能力,可通过反射机制做出适应性应答(Peers & Kemp, 2001;Waypa & Schumacker, 2010)。
缺氧性肺血管收缩
当肺泡气缺氧时,会出现“缺氧性肺血管收缩”现象:在高海拔环境下表现为全身性反应,在局部肺单位因通气减少导致缺氧时表现为局部反应。该机制可将血流导向通气更充分的肺区域,以维持通气-血流匹配。其具体机制尚未完全明确,但已知涉及血管细胞(可能是内皮细胞)的氧感知,以及后续触发功能应答的信号通路(Waypa & Schumacker, 2010)。
3.1.2 肺血流
除支气管动脉血流外,全部心输出量在右心室收缩驱动下流经肺循环。静息状态下,肺动脉压正常范围为20/10 mmHg,左心房压约为5–8 mmHg,肺循环平均压力差约为12 mmHg;肺毛细血管平均压力估计为10–12 mmHg,显著低于体循环毛细血管压力。这种低压状态具有重要生理意义:
1. 通过Starling力(血管内压与组织间液压力差、胶体渗透压差)维持肺泡腔干燥,避免肺水肿;
2. 保护肺泡-毛细血管膜的结构完整性;
3. 肺循环阻力仅为高压体循环的1/14,使右心室做功维持在较低水平。
根据肺弥散功能测量估算,在任意时刻,全部活跃的肺毛细血管床中约含70 mL血液(Ceridon, Beck et al., 2010),这些血液分布在巨大的气-血接触表面积上,为气体交换提供充足条件。
3.1.3 通气-血流匹配
氧转运系统中,有两个通常影响较小的组分不参与呼吸气体交换:无效腔(dead space)和分流(shunt)(如图2.1所示)。无效腔包括大气道的解剖无效腔和未通气的肺泡;分流包括解剖学右向左分流和未灌注的肺泡,二者统称为静脉血掺杂(venous admixture)。在这些组分中,血液无法与肺泡气接触,因此只要其体积可忽略不计,气体交换就能高效进行。
血液正常且充分氧合的前提是“全肺及几乎所有肺单位的通气与血流均匀匹配”(West, 1965)。若单个肺单位的通气与血流不匹配,会对气体交换产生不利影响:
- 通气相对于血流不足的肺单位,其肺泡气和毛细血管末端氧分压会低于正常水平;
- 血流相对于通气不足的肺单位,其肺泡气和毛细血管末端氧分压会高于正常水平。
因此,通气不足的肺单位整体表现为“分流样效应”,血流不足的肺单位整体表现为“无效腔样效应”。当大量肺单位出现显著通气-血流不匹配时,会导致低氧血症(West, 1965)。
一个反直觉的现象是:通气过度、氧分压高于正常的肺单位,无法代偿通气不足、氧分压低于正常的肺单位——其原因仍与氧解离曲线(ODC)相关。由于正常氧分压下血红蛋白已处于氧解离曲线的平台期,即使氧分压进一步升高,血氧饱和度和氧含量也不会显著增加;而通气不足导致的氧分压降低,会直接引起血氧饱和度和氧含量下降。当来自所有肺单位(包括通气-血流不匹配单位)的血液在肺静脉中混合时,最终动脉血的氧饱和度、氧含量和氧分压会主要反映“通气不足单位”的影响,表现为整体降低。
尽管机体存在局部调节机制(如局部缺氧性肺血管收缩),可改善肺单位的通气-血流匹配(West, 1965),但肺部病变导致的显著通气-血流(VA/Q)不匹配,仍会引发低氧血症,并对氧转运系统产生不利影响(West, 1965)(如公式2.3所示)。
四、氧级联反应的第二步
4.1 氧气从肺泡气向肺毛细血管血液的扩散
在静息状态下,肺内肺泡气与毛细血管血液之间高效的呼吸气体交换依赖四个关键因素:1. 较大的氧分压梯度(约100-40 mmHg);2. 可供气体交换的表面积大且扩散屏障薄;3. 氧气具备有利的扩散系数。血液流经毛细血管床的速度较快(约0.7秒),上述三个因素可促使氧气分压在此期间接近完全平衡。第四个关键因素是氧解离曲线(ODC):氧气从肺泡气扩散至血浆中溶解,再进入红细胞与血红蛋白(HGb)快速结合,氧解离曲线可促进这一过程高效转运大量氧气。当氧分压梯度最大时,氧解离曲线陡峭段对应的血红蛋白与氧的高亲和力,会推动氧气初始阶段的快速扩散。血液进入肺毛细血管时,混合静脉血氧分压约为40 mmHg,血氧饱和度约为70%-75%,此时血红蛋白结合第四个氧原子的速度最快。随着血液沿毛细血管流动,氧分压梯度逐渐减小,氧气分压平衡速度会减慢,但即便肺泡氧分压发生变化,氧解离曲线的平台段仍能促进平衡过程(Murray,1976;Nunn,1987)。尽管二氧化碳的分压梯度较小(46-40 mmHg),但由于其扩散系数更高,肺泡气与毛细血管血液之间的二氧化碳分压平衡速度比氧气更快。
当机体代谢需求增加时(如运动、发热等情况),心输出量和通气量会相应调节,导致气道内空气和肺循环中血液的总体流量及流速均升高。由此对呼吸气体交换造成的限制(如毛细血管血流通过时间缩短),可通过多种因素得到缓解,包括:
1. 肺泡表面和毛细血管的募集(即更多肺泡和毛细血管参与气体交换),以及通气与血流匹配度的改善;
2. 体循环中氧气提取量增加,返回肺部的静脉血氧分压降低,从而扩大肺泡与毛细血管之间的分压梯度;
3. 进入肺循环的静脉血pH值和二氧化碳分压降低,导致氧解离曲线右移。
这一气体扩散的第二步为被动过程,其能量消耗源于呼吸肌和右心室的做功(用于推动空气流动和血液循环),符合前文所述的“效率需求”原则。
氧转运前两步的核心作用是优化前文公式2.3中的“血氧含量”这一变量。以下因素可能严重损害这一过程:
1. 呼吸功能受损(神经肌肉功能障碍、胸壁畸形、胸膜肿块、肺顺应性降低);
2. 大气压降低;
3. 肺实质或肺血管疾病;
4. 心脏疾病;
5. 中枢神经系统和脊髓损伤或疾病(如运动神经元病);
6. 功能性血红蛋白缺乏(贫血、高铁血红蛋白血症、一氧化碳中毒、血红蛋白病)。
综上:肺通气的调节机制是通过改变神经信号输出,调整呼吸频率和潮气量,进而改变肺泡通气量。肺泡通气量的变化会影响“氧气提取”和“二氧化碳释放”所涉及的气体体积,最终改变肺毛细血管血液所平衡的气体稳态浓度。若病理状态影响机体维持正常血气成分的能力,可能会严重削弱机体为器官和组织提供充足氧供以满足其代谢需求的能力,进而引发缺氧。
五、氧级联反应的第三步
5.1 氧气从肺循环向体循环毛细血管的质量转运
5.1.1 心输出量
心输出量(CO)指一侧心室每分钟泵出的血液量,单位为升/分钟(L/min),由心率(HR)和每搏输出量(SV)两个因素决定。正常成年人静息状态下,心率约为60次/分钟,每搏输出量约为75毫升,因此心输出量约为60次/分钟×75毫升=4500毫升/分钟(即4.5 L/min)。从静息状态到最大运动强度,心输出量可增加至约22.5 L/min,增幅达5倍——其中心率可增加至静息状态的3倍,每搏输出量可增加至静息状态的2倍。由此可见,氧转运能力可通过调整心输出量以适应广泛的代谢需求(见公式2.3),同时还能根据不同器官的活动状态调节血流分布。例如,静息状态下流向骨骼肌的血流极少;而在剧烈运动时,流向运动肌肉和心脏的血流会不成比例地增加,流向腹部器官等部位的血流则可能维持不变,甚至暂时减少。此外,消化期间胃肠道血流会增加,以满足其分泌和吸收需求。这种调节机制可“经济高效”地节省心肌做功,同时通过增加心输出量满足机体的氧需求,符合前文所述的效率原则。
5.1.2 心率的调节
正常情况下,心率由右心房窦房结的自主去极化速率决定,受交感-肾上腺系统(加速心率)和迷走神经(减慢心率)的双重调控。静息状态下,迷走神经的抑制作用占主导;当机体需要增加心率时,会通过抑制迷走神经活性和增强交感神经活性实现。临床上可观察到一种典型现象——压力感受性反射(又称减压反射):颈动脉窦和主动脉弓处的压力感受器可感知血压的急性变化,并通过反射调节使心率产生反向应答(如血压升高时心率减慢,血压降低时心率加快)。当心率过快(心动过速)时,心室充盈和射血的时间会缩短,间接影响心室功能;此时心室会通过改变收缩力(见下文)来适应这种变化。需要注意的是,其他调节心室功能(进而影响每搏输出量)的介质,并不会直接影响心率。
5.1.3 每搏输出量的调节
每搏输出量的决定因素可借用骨骼肌力学概念描述,即前负荷、收缩力和后负荷:
- 前负荷:指心室舒张末期容积,是决定每搏输出量的重要初始因素;
- 后负荷:指心室收缩时需克服的阻力,对左心室而言为主动脉压,对右心室而言为肺动脉压。当室内压低于主动脉压或肺动脉压时,心室处于等容收缩期,心肌细胞缩短仅会拉伸弹性结缔组织;当室内压超过动脉压后,心室才开始射血,进入射血期(此时心肌同时完成内功和外功)。
心室的总做功量由前负荷、后负荷以及心肌本身的特性(收缩力)共同决定(Hunter,Janicki等,1980)。
心肌可通过两种重要机制改变张力产生量和每搏输出量:
1. 基于初始长度的斯塔林定律(Starling’s Law):这是心脏固有的特性,主要由前负荷决定。该定律指出,在一定范围内,心室产生的收缩力(进而决定每搏输出量)与前负荷(即心室舒张末期容积,也就是心室舒张充盈后的容积)呈正相关。其底层机制与骨骼肌收缩的“滑行丝理论”一致——收缩开始前肌动蛋白与肌球蛋白丝的重叠程度,决定了可形成的横桥数量,进而决定收缩力大小和做功量。
2. 通过外部因素改变收缩力:即在特定前负荷和后负荷下,改变心肌做功能力(Sagawa,Suga等,1977;Baan,van der Velde等,1992)。交感-肾上腺刺激、正性肌力药物等均可增强心肌收缩力:在任意给定前负荷和后负荷下,心肌产生的张力会增加,收缩速度会加快,且能从相同的舒张末期容积收缩至更小的收缩末期容积,从而使每搏输出量增加。收缩力增强的亚细胞机制可能与收缩期细胞内钙离子浓度升高有关——钙离子浓度升高可促使更多横桥参与反应并加快其循环速度。
在上述两种机制中,斯塔林定律主要在无法通过其他方式增强收缩力的情况下(如心力衰竭)发挥作用(Norman,ouriri等,2011;Little和Applegate,1993);除此之外,机体优先通过改变心肌收缩力来增加每搏输出量。
正常心率下,舒张期持续时间足以保证心室充分充盈;但心率升高时,舒张充盈时间缩短,此时心房收缩对心室充盈至关重要,且心室需具备足够高的舒张顺应性(即心室腔易于扩张的能力)。在交感-肾上腺刺激期间,心率和每搏输出量会同时增加:收缩力增强使心室能以更快的收缩速度,在缩短的心动周期内收缩至更小的收缩末期容积,从而实现每搏输出量的增加。因此,尽管心动过速会增加每搏输出量的泵出次数,但也会缩短每个心动周期的持续时间;而收缩力的同步增强可显著提高每搏输出量,最终使心输出量达到静息状态的5倍。
左心室收缩会将血液以高压“推送”至左心,随后血液通过动脉分布系统流向所有器官及其毛细血管。流向单个器官的血流及其内部的区域血流分布,受复杂调控系统的支配——该系统的核心功能是优化氧供,以满足器官的代谢需求及特定的非代谢功能(如分泌、吸收等)。心输出量在不同区域的分布,由各器官的总阻力(主要取决于小动脉平滑肌的收缩/舒张程度)决定。调节小动脉平滑肌收缩/舒张的关键因素包括:自主神经系统、多种血管活性肽激素(如内皮素、血管紧张素)、局部作用的“自体活性物质”前列腺素(如前列环素、血栓素),以及局部氧和二氧化碳浓度。小动脉平滑肌舒张的主要机制与一氧化氮(NO)的生成有关:NO可调节细胞内可溶性鸟苷酸环化酶(sGC)的活性,其产物环磷酸鸟苷(cGMP)会进一步抑制血管平滑肌细胞的横桥循环,从而导致血管舒张。
各器官血流调节的复杂性体现在多个层面:不同器官血管平滑肌细胞的表型差异及其特异性受体、对血管活性肽和自主神经递质敏感的受体类型与密度、所有调节功能的层级关系,以及各器官的氧代谢需求和非代谢功能相关的血流需求(如分泌、吸收、水盐平衡调节、体温调节等)。
综上:心输出量通过调节心率和每搏输出量实现变化。心率受交感神经和副交感神经调控——交感神经具有正性变时作用(加快心率),而副交感神经(通过迷走神经)具有负性变时作用(减慢心率)。心肌改变收缩力的能力是其关键特性:当存在限制每搏输出量的因素时(如舒张期缩短导致前负荷降低、后负荷增加导致射血减少),心肌可通过以更快速度产生更大张力,并收缩至更小的收缩末期容积,从而扩大每搏输出量的调节范围。
如公式2.3所示,心输出量(可实现5倍增幅)是体循环氧转运中的核心可变因素。正常情况下,血氧含量相对稳定,无法像心输出量那样实时变化。因此,心输出量是补偿血氧含量不足、维持或增加体循环氧转运的主要调节变量。
六、外周循环
外周循环的主要组成部分(大动脉、小动脉、毛细血管和静脉)在调节机制与功能上存在差异,下文将对其逐一阐述。
大动脉中的血流情况
大动脉作为主要的血液分配血管,其管壁相对较厚,管壁内的螺旋状排列平滑肌受交感神经调控。平滑肌的主要功能是改变血管的顺应性,进而影响压力波形态及脉压大小(即收缩压与舒张压之间的差值)。大动脉内的血流多呈层流状态,血管对血流的阻力相对较小。因此,从主动脉到最细小的分配动脉,血压的损耗量极少。不过,在血管分叉处以及管腔内存在局部凸起阻塞的部位,层流可能转变为湍流(伴随血流阻力增加)。大动脉的分支为各个器官供血,这些器官在血液循环中呈并联排列,而流向每个器官的血流量则取决于该器官小动脉所呈现的总阻力相对值。
小动脉中的血流与血压
小动脉由上级血管经多次分支形成,直径约为100微米。这类血管壁上包裹着相对较厚的环形平滑肌,该平滑肌对多种血管活性介质高度敏感,可通过多种特异性受体产生反应。根据泊肃叶定律(血流量与驱动压力成正比,与血管半径的四次方、血管长度及血液黏度成反比),平滑肌的收缩程度会决定小动脉的直径,进而决定其对血流的阻力大小。在当前语境下,在特定驱动压力下,影响血流量的最关键因素是小动脉半径变化所产生的阻力。因此,小动脉是灌注压下降幅度最大的部位。同时,小动脉内的高速血流速度会在此处大幅降低。
小动脉的阻力主要发挥以下三种作用:
1. 所有小动脉共同构成的阻力系统可限制大动脉内血液的流出量,从而维持较高的平均动脉压和舒张压。
2. 某一器官的所有小动脉共同调节流向该器官的血流量,实现血液在不同器官间的合理分配。
3. 任一器官内的每一条小动脉都会将较高的动脉血压降至与血液胶体渗透压相近的水平,这样既能避免结构薄弱的毛细血管壁承受过高压力,又能基于Starling力(Starling forces)促进毛细血管内外的液体交换。
小动脉平滑肌的调控机制复杂且具有双向性。多种全身性自主神经介质、体液介质(内分泌介质:血管紧张素、内皮素;局部旁分泌介质:前列腺素类)可通过多种不同类型的受体(不同器官中受体分布差异显著)作用于平滑肌,使其通过“主动收缩”(跨桥循环增强)产生反应。与之相反的舒张效应则主要通过单一机制实现,即“抑制”跨桥循环。舒张效应的共同通路涉及一氧化氮(NO)的合成与释放,NO可在局部及下游区域激活可溶性鸟苷酸环化酶(sGC),进而生成环磷酸腺苷(cAMP);cAMP作为介质,可抑制平滑肌的跨桥循环,最终导致平滑肌舒张。对于脑、心脏、肾脏、肝脏等代谢活性较高的重要器官,其小动脉平滑肌的活性还受到额外调控——该调控机制对器官内的氧供情况敏感,而线粒体可能是氧传感器(Waypa & Schumacker, 2010)。
毛细血管中的血流情况
由于小动脉的阻力较大,血液流入毛细血管后流速进一步降低,这一特点为气体交换创造了有利条件。毛细血管壁由单层内皮细胞构成,内皮细胞下方有基底膜支撑。毛细血管的内径与红细胞(RBC)直径相近,甚至更小,因此红细胞在通过毛细血管时需要发生变形。这种变形不仅能使红细胞内的物质充分混合,从而促进氧气和二氧化碳在细胞内的均匀分布,同时也是毛细血管全长范围内静水压显著下降的原因之一。
根据Starling假说,在毛细血管前半段,由于毛细血管内静水压高于血管壁两侧的胶体渗透压差值,会发生液体的净滤过;而到了毛细血管后半段,随着静水压降至低于血管壁两侧的净胶体渗透压,液体则会发生净重吸收。最终,毛细血管内外的液体交换达到净平衡状态,实现细胞外液的持续循环。
七、氧级联的第四步
7.1 氧气从毛细血管血液扩散至代谢细胞,并在细胞内扩散至耗氧部位(线粒体)
气体在液体介质中的扩散遵循菲克(Fick)扩散方程,该方程明确了扩散通量的影响因素,公式如下:

(公式2.5)
其中,A为扩散面积;D为气体的扩散系数;ΔP为气体分压差;d为扩散距离,因此ΔP/d代表分压差梯度。
氧气输送的最简单模型是克罗格(Krogh)双同心圆模型:一束细胞构成一个圆柱状结构,一根毛细血管从圆柱中心穿过,且毛细血管到圆柱周边所有细胞的距离大致相等。这一简化模型有助于理解气体扩散交换的维持机制,其原理与前文所述的肺毛细血管气体交换原理一致。在该模型中,氧气从血红蛋白上解离释放,二氧化碳则通过三种不同的运输形式被血液摄取;同时,氧气持续向毛细血管供血区域内的所有细胞扩散。功能性(即开放状态的)毛细血管密度决定了氧气从毛细血管血液扩散到耗氧细胞及其线粒体的距离,且该距离会根据细胞的活性水平在较大范围内变化(Wagner, Venkataraman et al., 2011)。如前文所述,红细胞中的血红蛋白(HGb)能够从血浆中摄取并结合氧气,这一过程可减小单位体积氧气所对应的氧分压增量,从而维持较大的分压差梯度,最终促进氧气的扩散。
进入毛细血管的血液初始氧分压(pO₂)较高,但由于周围环境的氧分压较低,血液会开始释放氧气:首先是血浆中溶解的氧气,随后是与血红蛋白结合的氧气。由于圆柱状结构内所有细胞都在持续消耗氧气,从毛细血管的“流入端”到“流出端”,氧气分压会沿血管纵向和径向逐渐降低(见图2.1底部插图)。氧气扩散的主要驱动力是血液与细胞之间的氧分压梯度。血红蛋白的氧解离特性(ODC)能够促进氧气在毛细血管内快速、高效地释放。在圆柱状结构的边缘区域,距离毛细血管最远的细胞处于最为不利的地位,因为这些细胞周围环境的氧分压最低。
线粒体作为“氧库”,是氧气扩散路径的终点,也是局部氧分压最低的部位。体内线粒体的氧分压难以直接测定(Lanza & Sreekumaran Nair, 2009, 2010),但有一项研究采用新型检测方法估算出,在体内肝脏组织中,线粒体氧分压的范围为30-40毫米汞柱(Mik, Johannes et al., 2008),这一数值远高于此前估算的临界氧分压(Lanza & Sreekumaran Nair, 2009)。若情况确实如此,那么当毛细血管末端的氧分压处于这一范围(30-40毫米汞柱)时,将不足以推动氧气从毛细血管远端扩散出去——尽管该区域的实际氧分压可能高达30-40毫米汞柱(Pitman, 2011)。
当然,克罗格圆柱模型将单根毛细血管视为一组相邻细胞的唯一氧气来源,这与真实的微循环系统存在较大简化。实际微循环网络极为复杂:单个毛细血管会持续处于开放与关闭状态,且在任何时刻,都有多余的毛细血管为不止一组细胞供血。这种结构特点使得氧气从毛细血管到细胞的扩散距离能够灵活调整,从而优化氧气向细胞及线粒体的扩散效率(Pitman, 2011)。微循环系统中的氧分压梯度也远比克罗格圆柱模型所展示的更为复杂(Tsai, Johnson et al., 2003; Pitman, 2011)。尽管如此,器官静脉血的氧合状态变化,仍可作为判断该器官氧合情况的有效方向性指标。因塔列塔(Intaglietta)及其同事通过活体显微镜技术,对易于透光观察的组织进行了活体显微观察与定量分析,清晰地揭示了微循环结构的复杂性。
前文已给出氧运输系统的核心方程(公式2.3):
(公式2.3)
在氧气输送的两个关键决定因素中,血氧含量主要取决于血红蛋白浓度[HGb];而当前的氧分压(pO₂)则根据氧解离曲线(ODC)及希尔(Hill)方程决定氧合血红蛋白饱和度(SO₂),希尔方程如下:
(公式2.6)
其中,n=2.6,为希尔系数。

此时,需要结合菲克原理对公式2.3和公式2.4进行扩展。菲克原理指出,氧气进入毛细血管的速率等于氧气流出速率与消耗速率之和,公式表达为:
(公式2.7)

公式2.7中的血氧含量可表示为:(公式2.8),公式2.4可扩展为:(公式2.9)

由此可知,氧提取率(E)是指从动脉血氧含量中提取的氧气比例。通过氧提取率,可计算出从微循环流出的“静脉血”中的氧合血红蛋白饱和度;而毛细血管末端对应的氧分压,则是推动氧气向细胞扩散的驱动力。毛细血管流入端与流出端的血液氧分压,以及途中的氧气提取速率,会通过复杂的机制共同决定组织平均氧分压(mean tissue pO₂),且这种变化会体现在毛细血管末端的氧分压上。
分析氧转运系统的另一种方法,是通过氧供与氧耗之间的关系来进行(Leach & Treacher, 1992)。<sup>脚注2</sup> 该分析方法的核心是绘制氧耗量随氧供量变化的关系曲线。在正常情况下,当氧供量在一定范围内降低时,氧耗量相对不受氧供量的影响。在此范围内,机体可通过提高氧摄取率(即扩大动-静脉血氧含量差)来满足自身对氧的需求,且不会出现明显的缺氧状态。然而,当氧供量进一步降低到某一拐点后,随着氧供量的持续下降,氧耗量会近乎呈线性下降。这一拐点所代表的状态是:大量细胞出现严重缺氧,以至于无法再利用氧气,进而转向无氧代谢。在该分析中,无法识别出那些无法消耗氧气的缺氧细胞,只能确定其数量足以产生可观测到的影响。此时,可观察到一些“缺氧”或无氧代谢的指标(如乳酸生成等)(Leach & Treacher, 1998;Schober & Schwarte, 2012)。
当氧转运系统因病理原因无法为当前的代谢需求提供充足氧气时,会导致组织氧分压(pO₂)降低,即出现缺氧(Leach & Treacher, 1998)。这种情况可能在以下情形中发生:
1. 氧供速率组成成分的影响
氧供速率由两个成分构成,其中血流量具有可变性,而血液中血红蛋白浓度通常稳定在约140-160g/L。因此,针对血氧含量不足的代偿反应是增加血流量,具体表现如下:
- a. 血红蛋白浓度([HGb])显著降低会导致血氧含量和氧供量下降。由于氧摄取率升高、毛细血管末端及组织平均氧分压降低,可能引发缺氧,除非血流量能按比例相应增加。
- b. 当肺泡氧分压(pO₂)降低、存在具有生理意义的分流、通气血流比例失衡时,动脉血氧含量会下降。即便氧摄取率正常,毛细血管末端及组织平均氧分压也会降低,除非通过增加血流量来代偿。
- c. 肺泡氧分压(pO₂)降低时,动脉血氧含量同样会下降,除非通过增加血流量来代偿。
- d. 相反,血红蛋白浓度([HGb])显著升高会使血氧含量和氧供量增加,但这会导致血液黏度大幅上升,进而需要心脏承担更大的工作负荷。
- e. 某些需氧器官(如心脏)在正常状态下的氧摄取率已接近极限,进一步提高氧摄取率的空间有限,因此:
- i. 若器官工作负荷和代谢性氧需求显著增加,必须通过按比例增加血流量来满足需求;
- ii. 当工作负荷和代谢率升高时,若血流量受限且血红蛋白浓度([HGb])显著降低,必然会导致组织缺氧;
- iii. 血液中氧合血红蛋白解离特性发生具有生理意义的改变(如亲和力增加、p50降低),同时伴随血红蛋白浓度([HGb])降低,可能引发组织缺氧,并限制机体对氧需求增加的应对能力;
- iv. 相反,当工作负荷和代谢需求升高时,若血红蛋白浓度([HGb])显著升高,也可能导致组织缺氧,因为随之而来的血液黏度升高可能会限制血流量的增加。
2. 心输出量调节能力的限制
通过增加心输出量来应对全身氧需求增加的能力,可能会因心脏组织缺氧而受限,进而形成恶性循环:心脏本应能在正常5倍动态范围内通过增加心输出量来应对需求,但在功能受损、收缩储备不足的情况下,这种调节能力会受到限制。具体限制因素可能包括:
- a. 心肌收缩功能障碍或收缩期功能异常,其成因多样,包括:
- i. 能量代谢障碍(Rosca & Hoppel, 2010),如冠状动脉疾病、线粒体功能障碍、有效功能心肌细胞数量减少(如心肌梗死)、心肌病、心脏瓣膜病、缺血再灌注损伤及心肌顿抑;
- ii. 后负荷过重,如确诊高血压患者;
- iii. 心肌肥厚(Machackova, Barta et al., 2006),会增加心肌内氧的扩散距离;
- iv. 心力衰竭(Little & Applegate, 1993)。
- b. 心肌充盈功能障碍或舒张期功能异常(Bateman, Sharpe et al., 2003;Periasamy & Janssen, 2008),常见于:
- i. 心肌肥厚(Machackova, Barta et al., 2006);
- ii. 心肌纤维化;
- iii. 心力衰竭。
- c. 特发性或疾病相关的复杂性心肌病,包括:
- i. 糖尿病性心肌病(Boudina & Abel, 2010);
- ii. 脓毒症相关性心肌病(Romero-Bernejo, Ruiz-Bailen et al., 2011;Fernandes & Cesar de Assuncao, 2012);
- iii. 心力衰竭;
- iv. 应激性心肌病(Richard, 2011);
- v. 内皮功能障碍(Endeman & Schriffrin, 2004;Ding & Triggle, 2005;Feletou & Vanhoutte, 2006)。
7.1.1 心脏能量代谢与冠脉循环
心脏是典型的需氧器官,且在通过调节心输出量(可达到正常水平的5倍)来应对氧需求变化的过程中发挥核心作用,这一过程需要心脏代谢负荷发生显著改变。因此,对冠脉循环的简要探讨具有特殊意义。
心肌在等容收缩期通过产生张力和压力做功,在射血期通过心肌缩短做功。这两个因素以及心肌做功时的收缩力水平,共同决定了心肌氧耗量(Crossman, 2004)。
7.1.2 冠脉循环的特殊特征
心脏作为需氧器官,需要持续的氧气供应以维持其代谢活动,进而保障其正常做功。在静息状态下,心脏接收约5%的心输出量以维持各项功能,同时消耗约10%的机体能量输出。由于心脏内三磷酸腺苷(ATP)和磷酸肌酸(CP)储备量极少,其耐受缺氧的时间很短,缺氧会迅速导致心肌收缩活动停止。
左心室会产生较高的室内压,因此为心内膜下层供血的壁内动脉会受到高室内压的压迫,在收缩期峰值时,这些动脉内的血流可能会完全中断。因此,心内膜下心肌的灌注主要发生在心室舒张期——此时灌注压力为主动脉舒张压,而心室内压极低。这就导致:若舒张期血流不足,心内膜下层心肌极易发生缺氧损伤。
冠脉循环的独特之处在于其氧摄取率最高,且冠状静脉血氧分压(pO₂)和血氧饱和度极低:在静息状态下,冠状静脉血的血氧饱和度约为40%,血氧分压(pO₂)为25-30mmHg。这对应着机体最宽的动-静脉血氧含量差,约为11-12mL/dL(Sheppard & VanHoutte, 1979)。这一现象也反映出,心肌氧耗量占机体总氧耗量的比例高于冠脉血流量占心输出量的比例。较高的氧摄取率使得心脏难以通过进一步大幅提高氧摄取率来增加自身的氧供量。然而,心肌仍能将其工作输出提升至正常水平的5倍,即便在动脉血压(即冠脉血流灌注压)波动的情况下也能实现。此外,当机体需通过增加心输出量来应对氧需求增加时,心率会加快,这会缩短每个心动周期中心肌的灌注时间。
心脏之所以具备这种调节能力,其适应机制包括:大幅增加冠脉血流量(氧供的另一个组成成分);特殊的微循环结构(丰富的毛细血管网);线粒体的广泛分布以及肌红蛋白的存在。
冠脉循环具有自身调节功能:在生理相关的动脉血压范围内,冠脉血流量在很大程度上不受血压影响。但当冠脉小动脉达到最大舒张状态时,血流量与血压呈线性关系。冠脉循环的自身调节还体现在:通过改变小动脉阻力,使冠脉血流量在较大范围内适应心肌细胞当前的氧需求,因此小动脉水平的阻力具有高度可变性。在静息状态下,冠脉基础张力较高,但可通过主动舒张使张力降低数倍。在特定灌注压力下,冠脉基础血流量与最大主动舒张状态下的血流量之间的差值,即为冠脉舒张储备。正常的冠脉舒张储备量是心脏能够通过增加自身血液供应来应对各种代谢需求变化的主要原因。
冠脉舒张储备的生理意义体现在冠状动脉疾病的病理生理过程中。正常的主要冠状动脉分支几乎不存在血流阻力,阻力主要来源于下游的小动脉,小动脉的最大舒张程度决定了冠脉储备。然而,若较大动脉存在动脉粥样硬化或其他病理性阻塞,要维持满足基础需求的冠脉基础血流量,就必须相应降低小动脉阻力。这会缩小小动脉在氧需求增加时的舒张空间,导致最大可达血流量受限,使得氧供量无法满足高负荷运动等场景下的氧需求。此外,动脉粥样硬化斑块会导致局部内皮功能障碍,进一步损害血管的舒张反应。
正常心脏能够应对高氧需求的另一个重要因素是其微循环结构:心肌细胞与毛细血管的数量比例约为1:1,这确保了氧的扩散距离较短(扩散距离主要由心肌细胞直径决定)。当氧需求增加时,机体可募集额外的毛细血管,但更重要的促进因素是:线粒体在心肌细胞内广泛分布(Jones, 1986),且肌红蛋白的存在有助于氧气在心肌细胞内部的扩散。当心肌因心肌细胞增大而出现肥厚时,氧的扩散距离会延长,这可能会对心肌细胞的氧供应产生不利影响。
7.1.3 线粒体的功能
线粒体中的耗氧过程发生在嵌入其内膜的5个连续酶复合物中,这些复合物共同构成了线粒体呼吸链(Duchen, 1999)。在这5个复合物中,有4个复合物能提供还原型烟酰胺腺嘌呤二核苷酸(NADH),并将自由电子传递至第5个复合物——ATP合酶,ADP(二磷酸腺苷)在此处发生氧化磷酸化生成ATP。在这一过程中,氧气被用于生成水和二氧化碳。
部分氧气不会被完全氧化,而是在两个膜结合酶复合物处成为活性氧(ROS)生成的底物(Gao, Laude et al., 2008)。超氧阴离子(O₂⁻·)就是其中一种活性氧。正常情况下,线粒体内部存在多种强效抗氧化防御机制,可有效清除生成的活性氧。但当抗氧化物质不足时,活性氧会对线粒体DNA造成损伤(Gao, Laude et al., 2008;Rosca & Hoppel, 2010)。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1499689.html?mobile=1
收藏

