氢化镁减轻顺铂诱导听力损失
摘要
顺铂是一种广泛使用的化疗药物,但其剂量限制性耳毒性常导致不可逆性听力损失。其发病机制涉及氧化应激、细胞凋亡、DNA损伤及炎症反应,目前有效的预防策略仍十分有限。本研究证实,释氢化合物氢化镁(MgH₂)对顺铂诱导的听力损失具有强效保护作用。结果显示,在体内实验中,MgH₂可保护听觉功能并维持耳蜗毛细胞的完整性;在体外实验中,它能显著减轻顺铂诱导的HEI-OC1细胞(House Ear Institute-Organ of Corti 1细胞,即耳蜗 Corti 器细胞)及耳蜗组织外植体的氧化应激与细胞凋亡。值得注意的是,MgH₂可抑制NOD样受体家族含 pyrin 结构域蛋白3(NLRP3)介导的炎症级联反应,从而减少下游炎症损伤。这些发现表明,MgH₂通过整合抗氧化、抗炎和抗凋亡通路缓解顺铂诱导的听力损失,其中NLRP3是关键调控分子。综上,本研究为MgH₂作为预防顺铂诱导听力损失的潜在治疗候选药物提供了有力证据。
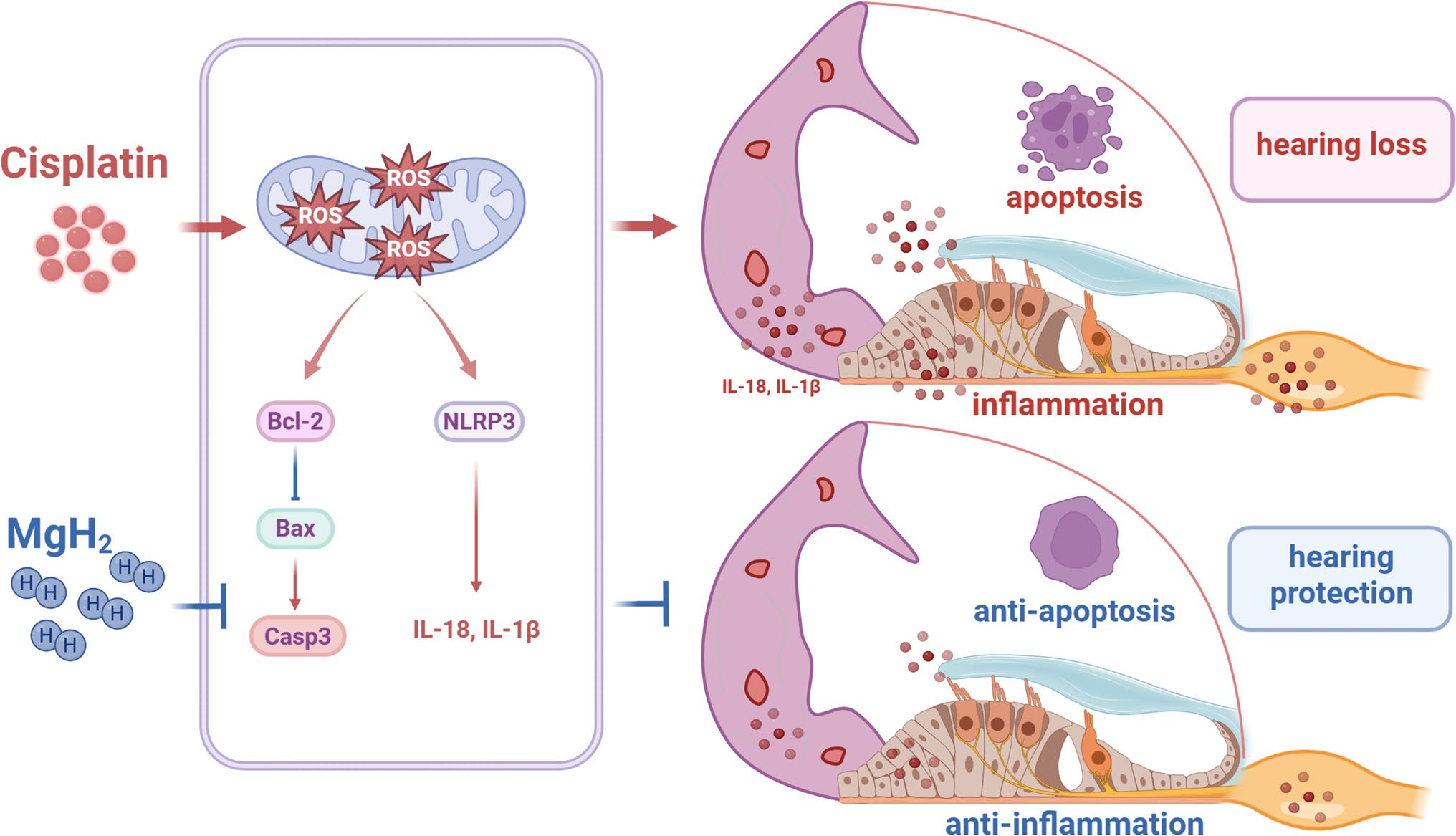
图7 氢化镁效应机制示意图
本文原文信息:
Hu Y, Zhang Y, Li S, Yu Y, Wang J, Lou Z, Zhang B, Xing Y, Chen Z. Therapeutic Potential of MgH2 in Mitigating Cisplatin-Induced Hearing Loss. Neurosci Bull. 2025 Aug 11.
引言
顺铂是一种铂类化疗药物,广泛用于治疗多种实体瘤,包括头颈部肿瘤、膀胱癌、卵巢癌和睾丸癌[1-4]。尽管其临床疗效已得到证实,但顺铂会引发严重不良反应,如肾毒性、神经毒性和耳毒性[5-7]。其中,耳毒性尤为值得关注——它会导致不可逆的感音神经性听力损失、耳鸣和耳痛,严重影响患者生活质量[8]。顺铂诱导耳毒性的发生率为20%~80%,儿童对此尤为敏感[9-11]。在儿童群体中,听力损失会严重损害认知、心理和社会发育,对长期健康构成重大挑战。因此,阐明顺铂诱导耳毒性的病理生理机制并开发有效的治疗策略,已成为亟待解决的关键需求。
顺铂诱导耳毒性的发病机制涉及复杂的细胞和分子过程,其中细胞凋亡、氧化应激、DNA损伤和炎症反应发挥核心作用[12-15]。顺铂优先在耳蜗结构(如Corti器、螺旋神经节神经元和血管纹)中蓄积,通过改变内淋巴的离子平衡破坏耳蜗稳态[16,17]。活性氧(ROS)的产生及后续炎症反应是介导顺铂耳毒性的关键因素[18,19]。ROS蓄积是细胞损伤的主要诱因,会引发一系列级联反应,如线粒体功能障碍和p53信号通路激活,进而导致Bcl2相关X蛋白(Bax)与B细胞淋巴瘤-2蛋白(Bcl-2)失衡。这种失衡会通过细胞色素C释放、胱天蛋白酶-9(Caspase-9)激活及后续胱天蛋白酶-3(Caspase-3)介导的蛋白切割,激活内源性凋亡通路,最终导致内耳细胞凋亡[13]。从氧化应激到细胞死亡的过程中,炎症反应起着关键作用[14]。NOD样受体家族含pyrin结构域蛋白3(NLRP3)是介导耳蜗内炎症损伤的核心调控因子[20-22]。NLRP3炎症小体(由NLRP3、含CARD结构域的凋亡相关斑点样蛋白及前胱天蛋白酶-1组成)激活后,会触发Caspase-1切割,进而释放白细胞介素-1β(IL-1β)、白细胞介素-18(IL-18)等促炎细胞因子[23-25]。这些细胞因子会加剧炎症反应,导致耳蜗细胞进一步死亡[26]。大量研究表明,NLRP3信号通路在顺铂诱导耳毒性的发病机制中具有关键作用[15,27]。
尽管在阐明顺铂诱导听力损失的分子机制方面取得了进展,但有效的耳保护疗法向临床转化的过程仍缓慢且充满挑战。目前,硫代硫酸钠(STS)是唯一经美国食品药品监督管理局(FDA)批准的治疗药物;而顺铂灭活剂、抗氧化剂、抗氧化酶保护剂、谷胱甘肽合成促进剂及抗炎化合物等其他策略[28-32],虽在临床和临床前研究中显示出一定耳保护效果[33,34],但其临床应用受到诸多限制——如干扰顺铂的抗肿瘤疗效、分布不佳、清除迅速,这些因素共同导致药物无法维持有效治疗浓度。因此,亟需更有效、更精准的疗法来克服这些挑战,实现更优的耳保护效果。
氢气(H₂)疗法在耳蜗保护领域具有探索价值,有望减轻顺铂对耳蜗的损伤。氢气可缓解组织和细胞的氧化应激,且不会干扰正常的代谢氧化过程或细胞信号传导[35]。氢气吸入疗法已成功应用于多种疾病的治疗,包括脑损伤[35-37]、血管疾病[38]和癌症[39]。通过减少ROS生成,氢气有望调节由噪音和耳毒性药物引起的耳蜗损伤相关炎症微环境[40-43]。然而,氢气的临床应用仍面临挑战:扩散性强、在水溶液中溶解度低、直接吸入存在安全顾虑,这些因素均限制了单一吸入给药方式的疗效。
为克服上述局限性,研究人员开发了新型镁基氢化材料,可实现氢气的可控、持续释放,以优化治疗效果。其中,氢化镁(MgH₂)不仅能大量储存氢气并实现可控释放,还可在室温下安全稳定储存[44-47]。凭借这些特性,微米级MgH₂颗粒可实现可靠、持久且充足的局部氢气释放,为听力损失治疗提供了新方向。此前基于小鼠模型的体内研究表明,MgH₂安全性良好,无显著不良反应[48]。
本研究通过体外和体内模型,全面探究了MgH₂对顺铂诱导听力损失的作用:通过听觉功能评估分析听力阈值变化,通过形态学分析深入了解耳蜗结构的保存情况,同时检测NLRP3及炎症标志物以明确耳蜗微环境中的分子变化。研究结果不仅证实了MgH₂的治疗潜力,也为未来开发顺铂诱导听力损失的预防策略开辟了新途径。
材料与方法
研究设计
实验设计如图1所示。在体内实验中,共选取124只听觉脑干反应(ABR)阈值正常的小鼠,采用随机均等分组方式分为4组:对照组、单纯顺铂组、顺铂+MgH₂组、单纯MgH₂组。每组中,分别在给药前和给药后7天,对5只小鼠进行ABR阈值和畸变产物耳声发射(DPOAE)检测。完成ABR和DPOAE检测后,处死小鼠进行形态学分析,每组选取3只小鼠用于耳蜗毛细胞(HCs)计数。为探究MgH₂保护耳蜗免受顺铂耳毒性损伤的机制,在治疗后3天和7天,每组选取2只小鼠的耳蜗样本进行RNA测序;随后通过实时定量聚合酶链反应(qRT-PCR)验证相关基因在耳蜗中的表达(每组2只小鼠样本)。此外,采用酶联免疫吸附试验(ELISA)检测每组3只小鼠样本中IL-1β、IL-10和IL-18的水平,以评估耳蜗的炎症反应。初步实验证实,单纯MgH₂对耳蜗功能和形态无显著影响,因此在后续机制研究中,重点关注对照组、单纯顺铂组、顺铂+MgH₂组3组;单纯MgH₂组被认为无必要纳入,因其无法为核心作用机制研究提供额外信息。该设计简化了实验方案,减少了小鼠使用量,同时使研究更聚焦于MgH₂如何调控顺铂诱导的分子变化。
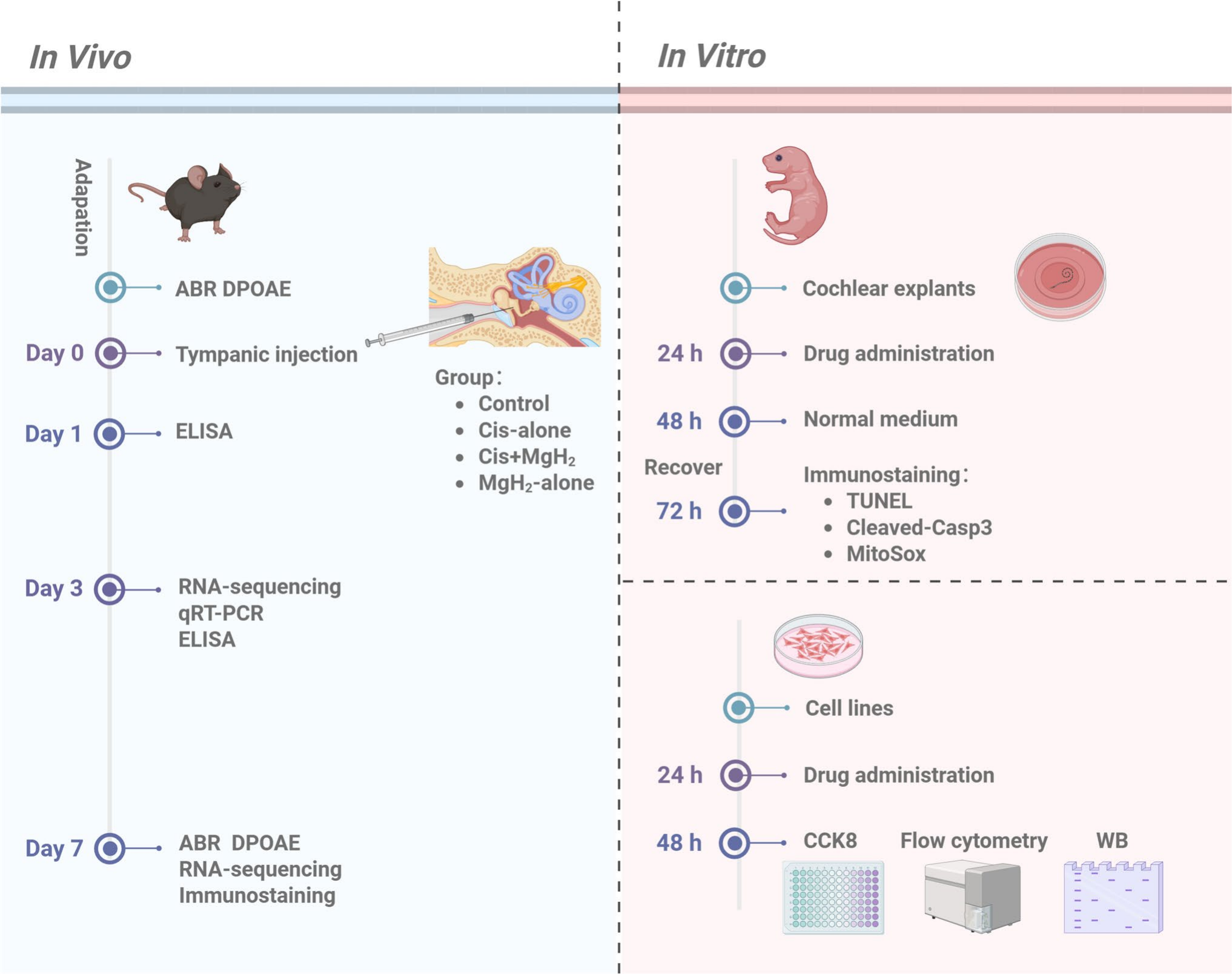
图1.实验时间线示意图。
在体外实验中,与体内研究同步进行:选取24只出生后3天的小鼠,分为4组(每组6只),获取耳蜗组织外植体。通过TUNEL染色和活化Caspase-3染色评估毛细胞凋亡水平,通过MitoSOX染色评估毛细胞的线粒体氧化应激水平。每种检测均使用4个耳蜗样本,以确保结果的一致性和可靠性。
在HEI-OC1细胞系体外实验中:细胞计数试剂盒-8(CCK-8)实验每组设5个重复孔,用于评估细胞活力;每组选取3个培养皿提取细胞蛋白,用于后续蛋白质印迹(WB)分析;采用 Annexin V/PI 染色流式细胞术评估细胞凋亡,每组收集3个独立培养皿的细胞样本。
实验批准
所有实验流程均经上海市第六人民医院动物伦理委员会批准,符合机构伦理准则。所有实验方法均遵循相关机构和国家的指南与规定。
实验动物
6~8周龄C57BL/6小鼠购自苏州SPF生物技术有限公司。所有小鼠饲养环境温度控制在20~24℃,光照周期为12小时光照/12小时黑暗,自由摄食饮水。
药物给药
通过腹腔注射1%戊巴比妥钠(按体重0.01 mL/g)麻醉小鼠。在手术立体显微镜下,使用Microfil柔性针头[49]进行双侧鼓膜注射(每耳0.02 mL)。为降低鼓膜注射风险,研究采用了精准注射技术、严格无菌操作、注射后监测及预防性使用抗生素等措施[50]。根据分组不同,注射溶液包括生理盐水(0.9% NaCl)、顺铂(P4394,Sigma公司,美国密苏里州圣路易斯市)和/或MgH₂:对照组每耳注射0.02 mL生理盐水;单纯顺铂组注射浓度为1 mg/mL的顺铂溶液;单纯MgH₂组注射浓度为1 mg/mL的MgH₂溶液;顺铂+MgH₂联合治疗组同时注射浓度均为1 mg/mL的顺铂与MgH₂混合溶液。造模阶段仅注射1次,分别在注射前和注射后7天进行听觉功能评估。末次听力检测后,处死小鼠进行形态学分析。
听觉脑干反应(ABR)检测
在隔音室内,使用RZ6 BioAMP处理器(TDT System III,美国佛罗里达州阿拉楚阿市Tucker-Davis Technologies公司)检测ABR。通过Bio-Sig RP软件(美国佛罗里达州阿拉楚阿市Tucker-Davis Technologies公司)在开放环境中评估听力阈值。小鼠经1%戊巴比妥钠麻醉后,维持体温在约37℃;将皮下记录电极置于颅顶,参考电极和接地电极分别置于双侧乳突区;在小鼠头部前方10 cm处放置宽带扬声器以传递听觉刺激。检测频率为4、8、16、22.6、32和45.2 kHz:在各频率下,声压级(SPL)从90 dB开始,高SPL时以10 dB为步长递减,接近阈值时以5 dB为步长递减。听力阈值定义为能诱发出可重复I波的最低声压级;若在90 dB SPL下未记录到ABR波形,则将阈值记为95 dB。比较各组间I波振幅和潜伏期的差异。
畸变产物耳声发射(DPOAE)检测
DPOAE与ABR同步检测。小鼠麻醉后,将ER10B+麦克风系统(美国伊利诺伊州埃尔克格罗夫村Etymotic公司)的耳塞插入耳道。采用一级纯音f1(频率为8、16、32 kHz)和二级纯音f2(f2/f1比值为1.2)诱发DPOAE;刺激强度从90 dB SPL降至10 dB SPL,以10 dB为步长递减;对2f1-f2频率处的反应信号进行512次平均。
免疫荧光染色
将小鼠深度麻醉后,通过颈椎脱臼法处死,取出耳蜗并浸泡于冰浴的磷酸盐缓冲液(PBS)中。在耳蜗顶端和圆窗处钻孔,移除镫骨以暴露卵圆窗。随后将耳蜗置于4%多聚甲醛(PFA)中,在室温下固定2小时。于4℃条件下,用乙二胺四乙酸(EDTA)脱钙48小时后,骨迷路会变得柔软且半透明。在解剖显微镜下分离基底膜,并将其分为顶回、中回和底回。用1%曲拉通X-100(Triton X-100)透化膜30分钟,再用10%牛血清白蛋白封闭1小时。加入靶向特定蛋白的一抗(表1),在4℃下孵育过夜。用PBS洗涤3次后,加入荧光标记二抗(表1)孵育1-2小时,随后再次洗涤3次。将基底膜用含4',6-二脒基-2-苯基吲哚(DAPI,用于细胞核染色)的抗荧光淬灭封片剂封片。使用共聚焦激光扫描显微镜(蔡司LSM 980,德国奥伯科亨市蔡司集团)拍摄图像,并用ImageJ软件对荧光强度和细胞标志物进行定量分析。
表1 本研究中使用的抗体
细胞培养与处理
HEI-OC1细胞(House Ear Institute-Organ of Corti 1细胞,即耳蜗Corti器细胞)采用高糖达尔伯克改良伊格尔培养基(DMEM)培养,培养基中添加10%胎牛血清(Gibco公司,美国马萨诸塞州沃尔瑟姆市),并置于33℃、10%二氧化碳(CO₂)的环境中培养。参照已建立的实验方案[49],加入20μmol/L顺铂处理24小时以诱导细胞损伤。联合处理组中,顺铂与氢化镁(MgH₂)共同给药并孵育24小时,以评估MgH₂的保护作用并确定最佳保护浓度。两种人神经母细胞瘤(NB)细胞系(IMR-32和SH-SY5Y)的培养参照此前文献描述的方案进行[51,52]。
细胞活力检测
采用细胞计数试剂盒-8(CCK-8,HY-K0301,美国新泽西州蒙茅斯章克申市MedChemExpress公司)评估细胞活力。将细胞以每孔5000个的密度接种于96孔板,孵育过夜后,分别用20μmol/L顺铂和不同浓度的MgH₂处理24小时。更换为含10% CCK-8试剂的新鲜培养基后,将细胞置于37℃下孵育1-4小时。使用酶标仪测定450nm处的吸光度值。每个实验条件设5个复孔,以空白孔作为对照。细胞活力以未处理对照组的百分比表示。
Annexin V/PI流式细胞术分析
采用Annexin V-FITC/PI凋亡检测试剂盒(BD Biosciences Pharmingen公司,美国加利福尼亚州圣迭戈市),通过流式细胞术评估HEI-OC1细胞的凋亡率。收集HEI-OC1细胞,用PBS洗涤2次,然后重悬于1×结合缓冲液中,调整细胞浓度至1×10⁶个/mL。随后加入5μL Annexin V-FITC和5μL碘化丙啶(PI),在室温避光条件下孵育10-20分钟。孵育结束后,加入500μL结合缓冲液,立即用流式细胞仪分析凋亡细胞,并用FlowJo软件处理数据。每个实验条件至少重复3次,以确保结果的可重复性。
耳蜗组织外植体培养
耳蜗组织外植体取自出生后3天(P3)的C57BL/6J小鼠(由上海杰思捷实验动物有限公司提供),将其接种于Cell-Tek包被的圆形盖玻片上,采用DMEM/F12培养基(11320082,Gibco公司,美国马萨诸塞州沃尔瑟姆市)培养,培养基中添加1% N-2添加剂(17502001,Gibco公司)、2% B-27添加剂(17504044,Gibco公司)和100μg/mL氨苄青霉素(A5354-10ML,上海生工生物工程股份有限公司),培养环境为37℃、5% CO₂,培养24小时。之后,用20μmol/L顺铂(单独或联合MgH₂)处理外植体24小时。在正常培养基中恢复培养24小时后,将外植体置于4% PFA中,在室温下固定1小时。通过肌球蛋白VIIa(myosin VIIa)免疫荧光染色评估毛细胞(HC)活力,并参照此前方法,用ImageJ软件手动计数毛细胞数量。
TUNEL检测与活性氧(ROS)检测
将耳蜗组织外植体用4% PFA固定30分钟,1% Triton X-100透化10分钟,然后加入TUNEL反应液(C1089,上海碧云天生物技术有限公司)或MitoSOX Red荧光探针(S0061S,上海碧云天生物技术有限公司),在37℃下孵育1小时以标记凋亡细胞。采用DAPI染色显示细胞核,肌球蛋白VIIa抗体标记毛细胞。染色完成后,在共聚焦显微镜下观察并分析耳蜗组织中的凋亡细胞。
RNA提取与实时定量聚合酶链反应(qRT-PCR)
采用EZ-press RNA纯化试剂盒(EZBioscience公司,美国明尼苏达州罗斯维尔市),从每个样本的2只小鼠耳蜗中提取总RNA。使用4×逆转录大师混合液(4× Reverse Transcription Master Mix)将RNA逆转录为cDNA:42℃孵育15分钟(逆转录反应),随后95℃孵育30秒(酶灭活)。采用2× SYBR Green qPCR大师混合液(2× SYBR Green qPCR Master Mix),在LightCycler 96系统(罗氏公司,德国曼海姆市)上进行qRT-PCR检测。以β-肌动蛋白(β-actin)作为内参基因,对目的基因表达水平进行标准化处理。每个反应设3个复孔,所有实验至少重复3次以确保可重复性。引物序列见表2。
表2 实时定量聚合酶链反应(qRT-PCR)所用引物**
信使核糖核酸(mRNA)测序
在药物处理后3天和7天,收集各组小鼠的耳蜗组织(排除前庭区域),每个样本合并4个耳蜗,采用TRIzol试剂(Invitrogen公司,美国加利福尼亚州卡尔斯巴德市)提取RNA。检测RNA纯度和浓度后,使用VAHTS Universal V6 RNA-seq文库制备试剂盒构建测序文库。转录组测序和生物信息学分析由上海欧易生物医学科技有限公司(OE Biotech Co., Ltd)完成。
参照此前研究使用的方案[53],在Illumina NovaSeq 6000平台上对RNA测序文库进行测序,每个样本产生约5000万条原始读数(raw reads)。质控后,使用HISAT软件将清洁读数(clean reads)与参考基因组比对,并以每千碱基转录本序列每百万测序读数中的片段数(FPKM)量化基因表达水平。采用DESeq2软件进行差异表达分析,以Q值<0.05且倍数变化(fold-change)>2或<0.5为阈值,筛选显著差异表达基因(DEGs)。通过超几何检验对差异表达基因进行功能富集分析,以识别在基因本体(GO)、京都基因与基因组百科全书(KEGG)通路、Reactome通路和WikiPathways中显著富集的条目。使用基因集富集分析(GSEA)软件进行GSEA分析,评估预定义基因集的富集情况。
蛋白质印迹(Western Blot)检测
将HEI-OC1细胞在含蛋白酶抑制剂(GRF101,Epizyme公司,美国马萨诸塞州剑桥市)的RIPA裂解缓冲液(PC101,Epizyme公司)中匀浆。将匀浆液在4℃、15000×g条件下离心20分钟,去除细胞碎片。采用二辛可宁酸(BCA)蛋白质定量试剂盒(P0012,上海碧云天生物技术有限公司)测定蛋白质浓度。取等量蛋白质(20-40μg)上样至4%-20%梯度十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶(PG113,Epizyme公司)中进行电泳分离,随后将蛋白质转移至聚偏氟乙烯(PVDF)膜上。用含5%脱脂牛奶的Tris缓冲盐溶液(含吐温20,TBST)封闭膜1小时后,加入一抗在4℃下孵育过夜。洗涤后,加入辣根过氧化物酶(HRP)标记的二抗孵育1小时。使用Omni-ECL™ Femto超灵敏化学发光试剂盒显影蛋白质条带,并用ChemiDocXRS成像系统拍摄图像。用ImageJ软件对目的蛋白质条带进行定量分析,以β-actin作为内参蛋白校正数据。每个实验重复3次。
酶联免疫吸附试验(ELISA)
采用商品化小鼠ELISA试剂盒(Abclonal公司,中国武汉市)检测耳蜗组织中白细胞介素-1β(IL-1β)、白细胞介素-18(IL-18)和白细胞介素-10(IL-10)的表达水平。每个样本包含2个耳蜗,将耳蜗在裂解缓冲液中匀浆,离心后收集上清液。使用酶标仪测定450nm或570nm处的吸光度值,通过将吸光度值代入标准曲线计算细胞因子浓度。
统计学分析
采用GraphPad Prism(10.2.0版本)进行统计学分析。数据以“平均值±标准差”或“平均值±标准误”表示,均来自至少3次独立生物学重复实验。两组间比较采用非配对双尾Student t检验;三组及以上比较采用单因素或双因素方差分析(ANOVA),随后通过Tukey多重比较检验确定组间具体差异。统计学显著性定义为双侧P<0.05,更高显著性水平分别标注为**P<0.01、***P<0.001和****P<0.0001。免疫荧光强度、灰度值测量等专项数据分析采用ImageJ软件完成。所有实验均至少独立重复3次,以确保结果的可靠性和可重复性。
结果
氢化镁(MgH₂)在体内减轻顺铂诱导的听力损失
处理后7天,听觉脑干反应(ABR)检测显示,单纯顺铂组在所有测试频率(4、8、16、22.6、32和45.2kHz)下均出现显著的阈值偏移,与对照组相比,阈值分别升高51±1.0dB、75±0.0dB、75±1.6dB、70±2.7dB、52±2.6dB和45±3.5dB。相比之下,顺铂+MgH₂组的阈值偏移显著减小,在32kHz和45.2kHz频率下,阈值分别降低32dB和22dB。这些结果表明,单纯顺铂组在所有频率下均出现明显听力损失,而顺铂+MgH₂组的听力损伤程度显著减轻(图2A、B)。此外,阈上功能分析显示,与单纯顺铂组相比,顺铂+MgH₂组的I波振幅更高、潜伏期更短;而单纯顺铂组的ABR阈值超过90dB SPL,无法测量其I波振幅和潜伏期(图2C、D)。上述结果表明,MgH₂能有效缓解顺铂诱导的听力损失,并在多个频率下维持听觉敏感性。
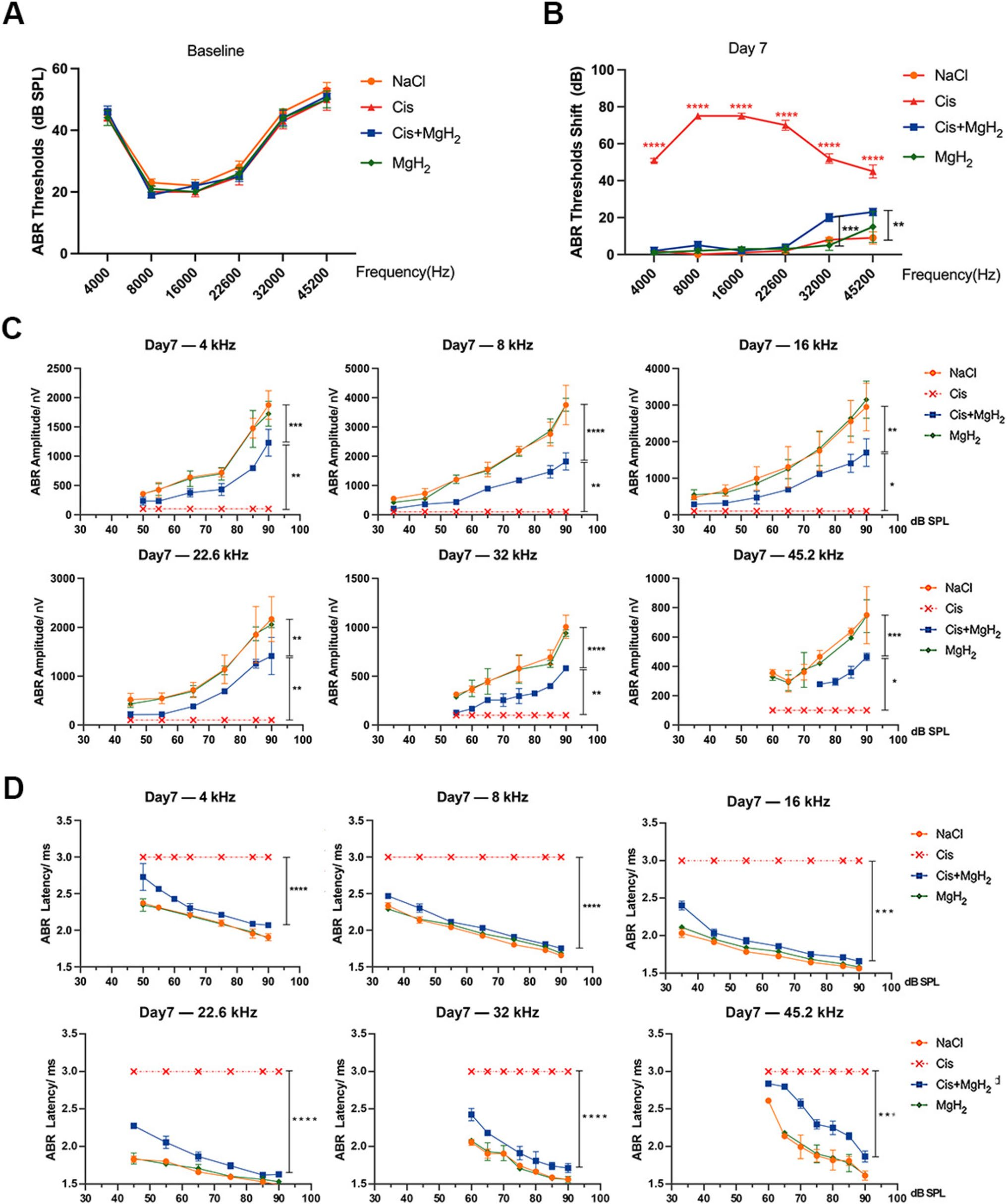 图2.氢化镁(MgH₂)减轻C57BL/6J小鼠中顺铂诱导的听力损失。A. 处理前C57BL/6J小鼠的基线听觉脑干反应(ABR)阈值。B. 处理后7天各组小鼠的ABR阈值偏移,用于评估听力损失情况(n=5)。C、D. 以I波振幅和潜伏期衡量的阈上听觉功能,用于检测听觉神经反应的完整性。*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
图2.氢化镁(MgH₂)减轻C57BL/6J小鼠中顺铂诱导的听力损失。A. 处理前C57BL/6J小鼠的基线听觉脑干反应(ABR)阈值。B. 处理后7天各组小鼠的ABR阈值偏移,用于评估听力损失情况(n=5)。C、D. 以I波振幅和潜伏期衡量的阈上听觉功能,用于检测听觉神经反应的完整性。*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
氢化镁(MgH₂)缓解顺铂诱导的外毛细胞功能障碍与退化
药物处理后7天,对比单纯顺铂组与对照组发现,顺铂处理导致8、16和32kHz频率下的畸变产物耳声发射(DPOAE)振幅显著降低。但处理后7天,与单纯顺铂组相比,顺铂+MgH₂组在8kHz和16kHz频率下的DPOAE振幅下降幅度更小;在32kHz频率下,两组的DPOAE振幅均显著降低,且组间无显著差异(图3A)。这些结果表明,MgH₂能有效保护外毛细胞(OHC)功能,尤其在8kHz和16kHz频率下效果显著。
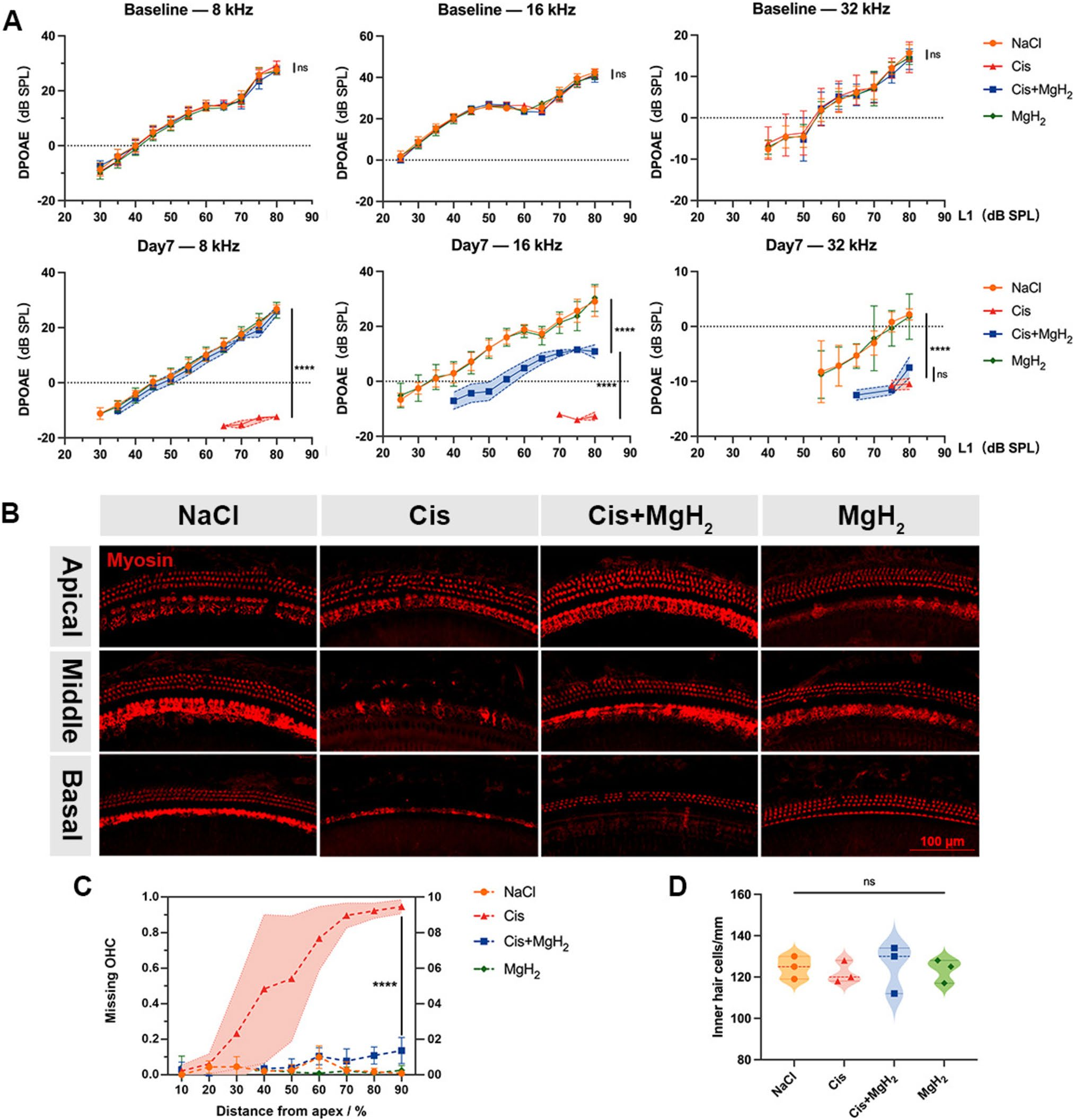
图3.氢化镁(MgH₂)缓解顺铂诱导的外毛细胞(OHC)功能障碍与丢失。A. 在8、16和32kHz频率下进行DPOAE检测,评估外毛细胞功能(n=5)。B. 通过免疫荧光染色和形态学分析,评估耳蜗顶回、中回和底回的内毛细胞(IHC)与外毛细胞存活情况。C. 耳蜗图显示整个基底膜上外毛细胞的丢失情况(n=3)。D. 各组每毫米基底膜上存活的内毛细胞数量。****P<0.0001。
药物处理后7天,单纯顺铂组出现显著的外毛细胞丢失,且细胞死亡率从耳蜗顶回(约20%)到底回(约80%)逐渐升高(图3C)。具体而言,单纯顺铂组在外毛细胞丢失率方面:顶回(距耳蜗顶端20%处)为6.1%±5.8%,中回(50%处)为54.1%±35.3%,底回(80%处)为92.3%±4.3%(图3B、C)。相比之下,联合MgH₂处理的小鼠外毛细胞丢失极少:顶回(20%处)丢失率为0.9%±1.9%,中回(50%处)为4%±4.9%,底回(80%处)为10.8%±4.8%,这些数值与对照组无显著差异。值得注意的是,所有组的内毛细胞(IHC)存活情况基本未受影响(图3D)。尽管未观察到内毛细胞显著丢失,但我们认为这并不能排除其存在功能损伤的可能性,这一点仍需进一步研究。
氢化镁(MgH₂)缓解顺铂诱导的HEI-OC1细胞凋亡
用不同浓度的顺铂(0、5、10、20、40和80μmol/L)处理HEI-OC1细胞24小时,通过细胞计数试剂盒-8(CCK-8)检测细胞活力。结果显示,顺铂以剂量依赖性方式降低细胞活力,半数抑制浓度(IC₅₀)为20μmol/L,此时细胞存活率为47.45%(图4A)。基于此结果,后续实验选择20μmol/L作为顺铂处理浓度。单独使用MgH₂时,浓度低于0.5mg/mL时无毒性,浓度更高则会产生毒性(图4B)。用20μmol/L顺铂分别与0.06mg/mL、0.125mg/mL MgH₂联合处理细胞,可显著减少细胞死亡,存活率分别达到95.50%和96.80%;其中0.06mg/mL被确定为发挥保护作用的最佳浓度(图4C)。
为评估MgH₂是否会干扰顺铂的抗肿瘤活性,研究使用了两种已广泛研究的神经母细胞瘤(NB)细胞系——IMR-32和SH-SY5Y[54]。体外联合处理实验表明,MgH₂在这两种细胞系中均未降低顺铂的细胞毒性(图S1)。
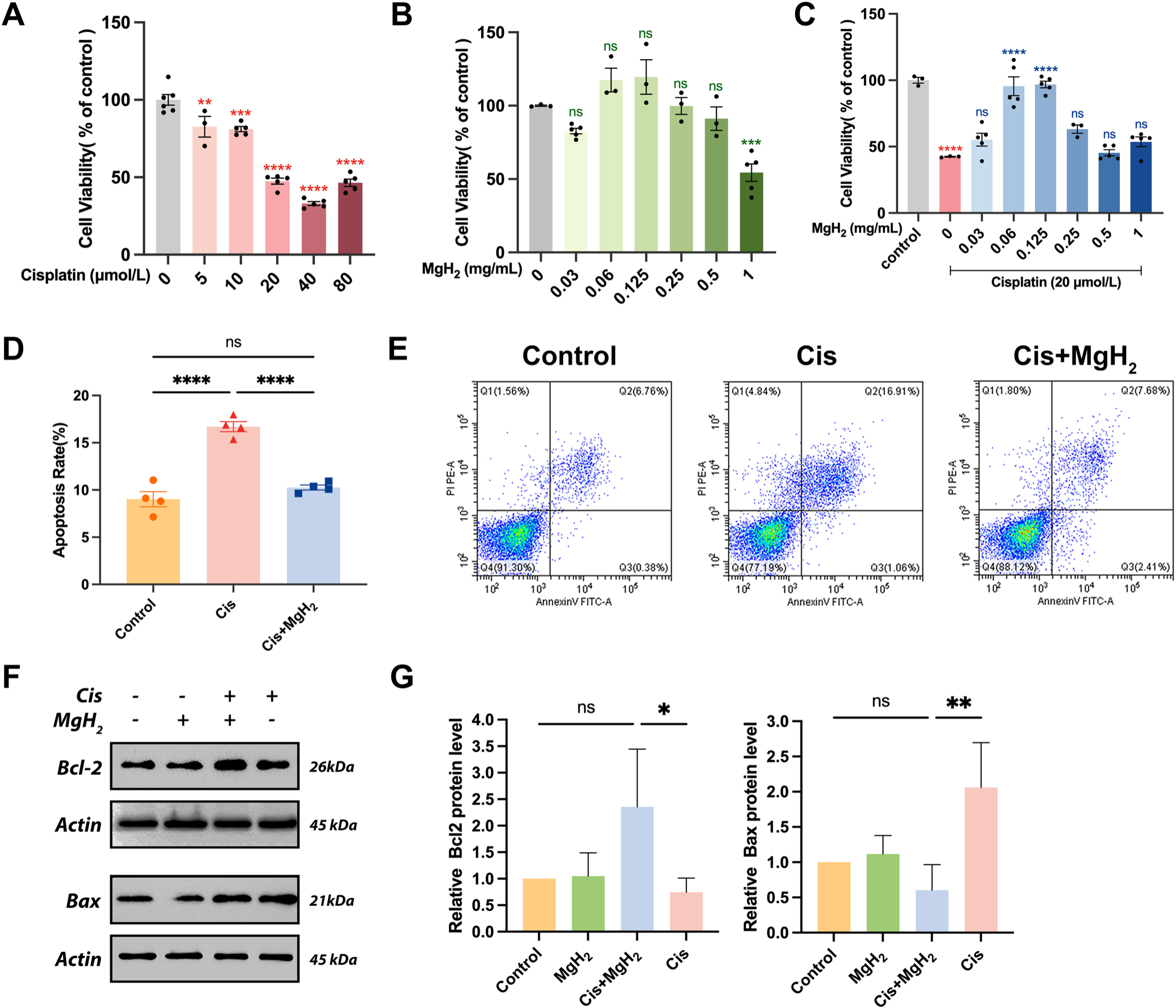
图4.氢化镁(MgH₂)缓解顺铂诱导的HEI-OC1细胞凋亡。A- C. 通过CCK-8检测,评估不同浓度顺铂和MgH₂处理24小时后HEI-OC1细胞的活力。D、E. 通过流式细胞术,检测顺铂单独处理与顺铂+MgH₂联合处理后HEI-OC1细胞的凋亡率。F、G. 通过蛋白质印迹(WB)检测并分析顺铂单独处理与顺铂+MgH₂联合处理后,HEI-OC1细胞中凋亡相关蛋白Bcl-2和Bax的表达水平(n=3)。*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
流式细胞术进一步验证显示,单纯顺铂组的细胞死亡率为16.71%,而联合MgH₂处理组的细胞死亡率降至10.26%,这一结果支持“MgH₂可有效减轻顺铂诱导的细胞死亡”这一结论(图4D、E)。此外,蛋白质印迹分析显示,与单纯顺铂处理组相比,联合处理组HEI-OC1细胞中抗凋亡蛋白Bcl-2的表达显著上调约3.2倍,而促凋亡蛋白Bax的表达降低3.4倍(图4F、G)。
氢化镁(MgH₂)通过减少耳蜗外植体的氧化应激,缓解顺铂诱导的凋亡
将出生后3天(P3)野生型C57BL/6J小鼠的耳蜗外植体进行体外培养,用20μmol/L顺铂联合0.125mg/mL MgH₂处理24小时,随后在培养基中恢复培养24小时。通过肌球蛋白VIIa(myosin VIIa)和αII血影蛋白(spectrin αII)抗体进行免疫荧光染色,量化耳蜗顶回、中回和底回中存活的外毛细胞数量。结果显示,单纯顺铂处理的外植体中,外毛细胞显著丢失,每个耳蜗回的外毛细胞数量仅为150个/毫米;相比之下,顺铂+MgH₂联合处理的耳蜗外植体中,外毛细胞存活率显著更高,每个回的外毛细胞数量为400个/毫米,与对照组相当(图5A)。
免疫染色结果显示,单纯顺铂组中,末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)阳性毛细胞和活化胱天蛋白酶-3(cleaved caspase-3)阳性毛细胞数量显著增加;而顺铂+MgH₂组的凋亡细胞数量显著减少(图5B-E)。考虑到氧化应激在顺铂诱导的耳蜗损伤中起核心作用,研究进一步检测了MgH₂是否能减少活性氧(ROS)的产生。通过MitoSOX Red染色评估线粒体氧化应激水平,结果显示,与对照组相比,单纯顺铂组中MitoSOX阳性毛细胞数量显著增加,线粒体ROS水平升高(图5F、G)。综上,这些结果表明,MgH₂至少可通过减轻氧化应激,缓解顺铂诱导的凋亡。
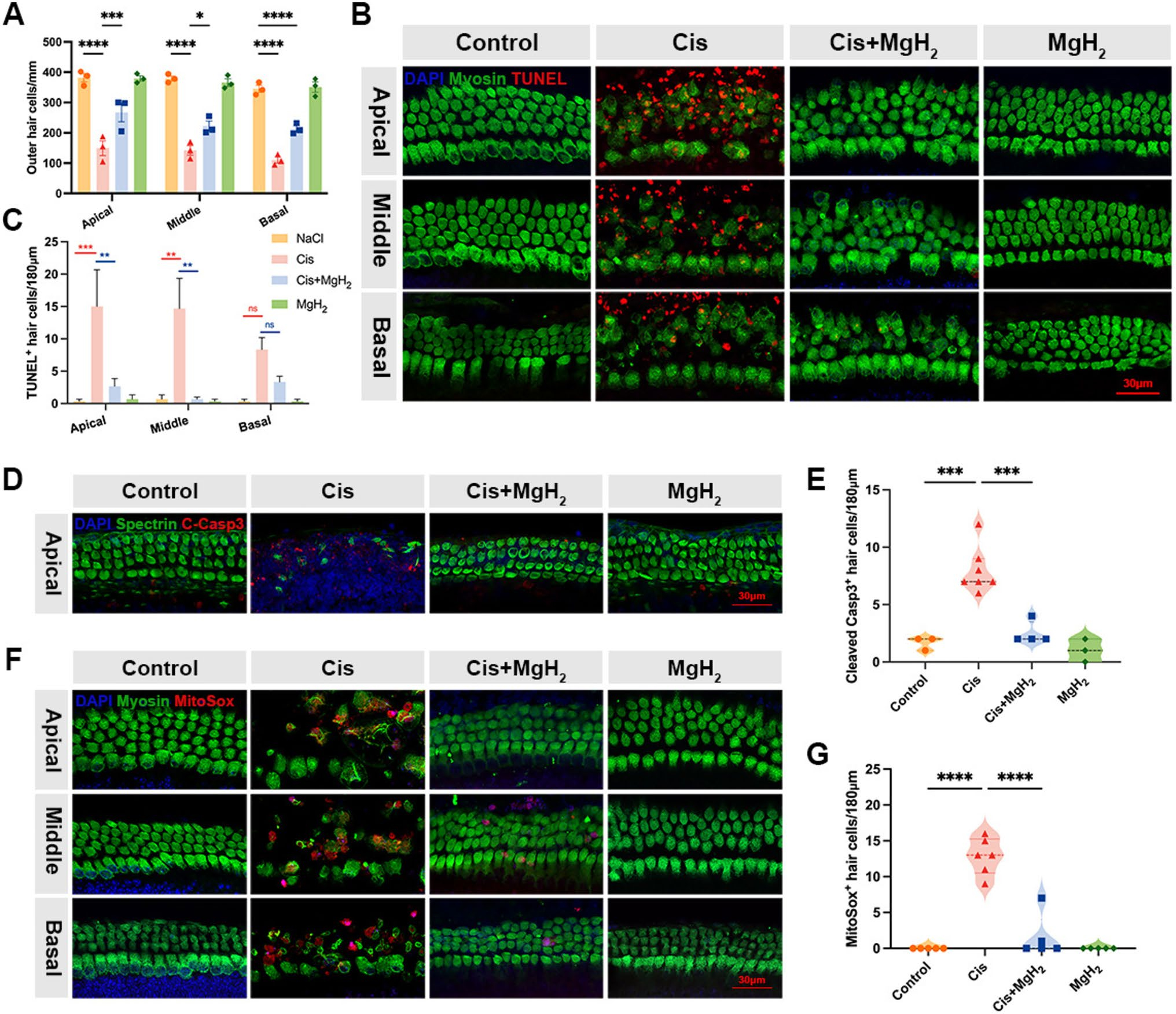
图5.氢化镁(MgH₂)缓解耳蜗外植体中顺铂诱导的凋亡与氧化应激。A. 通过肌球蛋白VIIa和αII血影蛋白抗体免疫荧光染色,量化顺铂单独处理与顺铂+MgH₂联合处理后,耳蜗外植体中毛细胞的存活情况。B-E. 通过TUNEL染色(n=3)和活化胱天蛋白酶-3染色,检测耳蜗外植体中的凋亡细胞,评估MgH₂对顺铂诱导毛细胞凋亡的保护作用。F、G. MitoSOX Red染色显示,MgH₂处理可降低顺铂处理后小鼠耳蜗外植体中的线粒体活性氧(ROS)水平。(比例尺:30微米)。*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
氢化镁(MgH₂)通过调控NLRP3介导的炎症反应,保护耳蜗免受顺铂诱导的损伤
RNA测序结果显示,对比顺铂+MgH₂组与单纯顺铂组,共筛选出显著差异表达基因(DEG)648个,其中389个基因下调,259个基因上调(图6A)。研究展示了“单纯顺铂组vs顺铂+MgH₂组”中,通过基因本体(GO)分析筛选出的前30个上调生物学过程,以及通过京都基因与基因组百科全书(KEGG)通路分析筛选出的20个最显著富集的信号通路(图6B、C)。这些通路主要与急性炎症反应、核因子-κB(NF-κB)信号通路、肿瘤坏死因子(TNF)信号通路、趋化因子信号通路和NOD样受体信号通路相关,提示炎症在此过程中起核心作用。
值得注意的是,基因集富集分析(GSEA)显示,与单纯顺铂组相比,顺铂+MgH₂处理组中白细胞介素-1β(IL-1β)产生的调控水平降低(图6D)。对与IL-1β产生相关的差异表达基因进行热图分析,进一步显示MgH₂处理可抑制炎症相关关键基因的表达,包括髓系分化因子88(Myd88)、 Toll样受体4(Tlr4)、NOD样受体家族含pyrin结构域蛋白3(Nlrp3)、Gasdermin D(Gsdmd)、胱天蛋白酶-1(Casp1)和凋亡相关斑点样蛋白(Pycard)(图6D)。与体外研究结果一致,耳蜗组织的转录组分析进一步显示,单纯顺铂组中凋亡和氧化应激通路显著上调,而MgH₂联合处理可显著抑制这两条通路的激活(图S2)。
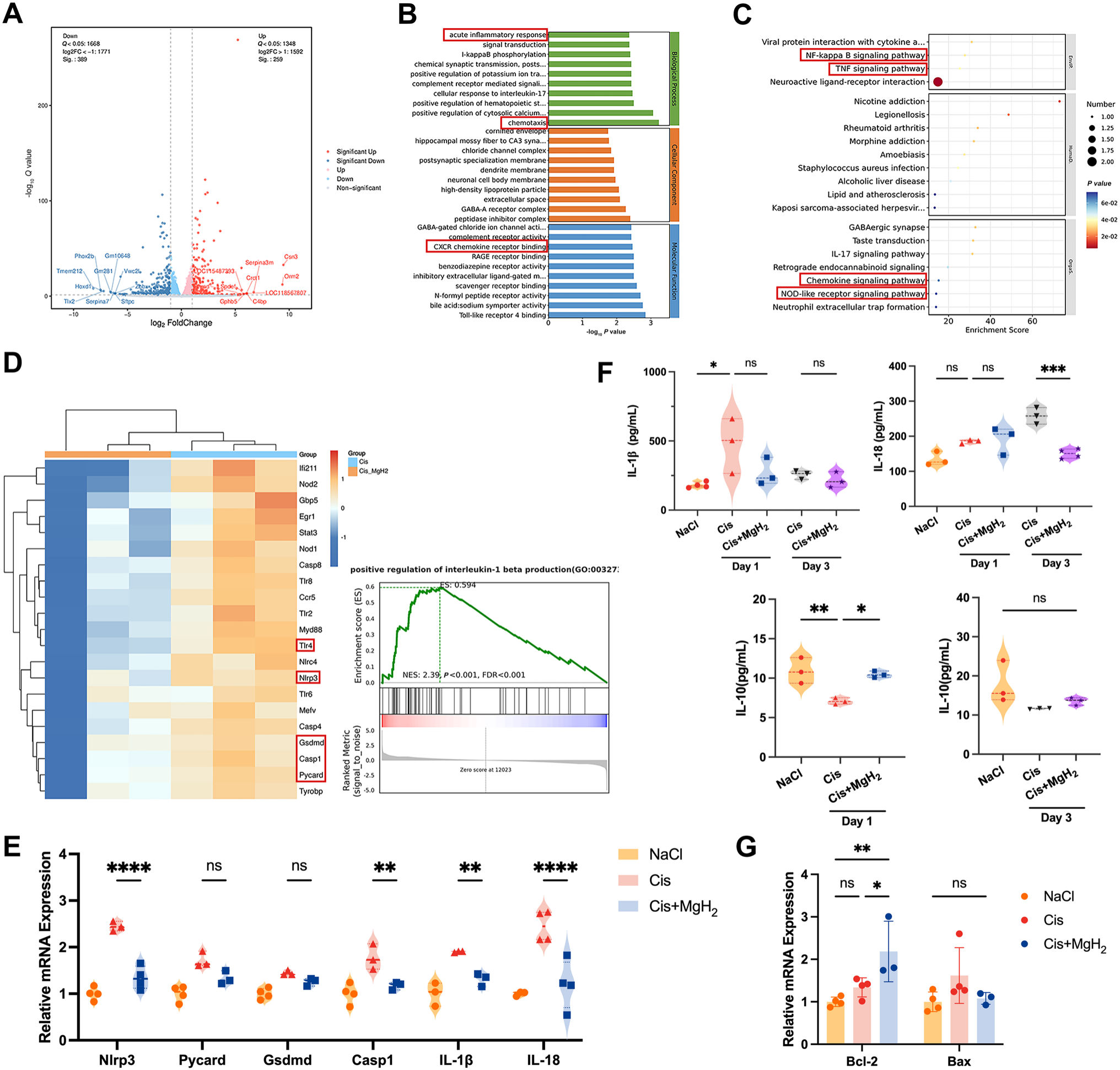
图6.通过调控NLRP3炎症小体激活与炎症反应,探究氢化镁(MgH₂)对顺铂诱导耳蜗损伤的保护作用。A. 采用RNA测序技术,评估单纯顺铂处理与顺铂+MgH₂联合处理小鼠耳蜗的转录组变化,筛选出显著上调和下调的基因。B、C. 通过基因本体(GO)分析和京都基因与基因组百科全书(KEGG)通路分析,确定与处理条件相关的关键生物学过程及显著富集的信号通路。D. 白细胞介素-1β(IL-1β)产生相关基因的热图,展示基因表达聚类模式:红色表示表达水平相对较高,蓝色表示表达水平相对较低;采用基因集富集分析(GSEA)评估单纯顺铂组与顺铂+MgH₂组间IL-1β产生的变化(标准化富集分数NES=2.39,P<0.001)。E. 通过实时定量聚合酶链反应(qRT-PCR),检测处理后小鼠耳蜗组织中炎症相关基因(包括Nlrp3、Pycard、Gsdmd、Casp1、Il-1β和Il-18)的表达水平。F. 采用酶联免疫吸附试验(ELISA),定量检测处理后1天和3天耳蜗样本中促炎细胞因子IL-1β、IL-18及抗炎细胞因子IL-10的水平。G. 通过qRT-PCR,检测处理后小鼠耳蜗组织中凋亡相关基因(包括Bcl-2和Bax)的表达水平。*P<0.05,**P<0.01,***P<0.001,**P<0.0001。
为进一步验证上述发现,我们通过qRT-PCR检测了炎症损伤相关基因(包括Nlrp3、Pycard、Gsdmd、Casp1、Il-1β和Il-18)的表达水平(图6E)。结果显示,单纯顺铂组中这些基因的表达显著上调;而与单纯顺铂组相比,顺铂+MgH₂联合处理组中这些基因的表达显著降低。这表明MgH₂可抑制NLRP3的激活,而NLRP3在耳蜗炎症反应中发挥关键作用。
为进一步量化炎症反应,我们采用ELISA检测了处理后1天和3天耳蜗组织中的炎症细胞因子水平(图6F)。结果显示,与单纯顺铂组相比,MgH₂处理显著降低了IL-18的水平,同时提高了抗炎细胞因子IL-10的表达。综上,这些结果证实,MgH₂可通过抑制NLRP3激活,有效减轻顺铂诱导的耳蜗炎症反应。
此外,我们还探究了MgH₂在体内对顺铂诱导细胞凋亡的保护作用。qRT-PCR分析显示,顺铂处理显著下调了抗凋亡基因Bcl-2的表达;而与单纯顺铂组相比,顺铂+MgH₂联合处理可有效恢复Bcl-2的表达水平(图6G)。这些发现与我们此前在细胞层面和耳蜗外植体层面的实验结果一致,为“MgH₂可保护耳蜗免受顺铂诱导的凋亡通路损伤”提供了有力证据。
讨论
本研究提供了充分证据,证实MgH₂能有效缓解顺铂诱导的听力损失,并显著维持耳蜗功能。具体而言,MgH₂对听觉系统的关键组成部分——毛细胞(HC)具有保护作用,其作用机制具有多效性,主要包括:减轻顺铂引发的线粒体氧化应激、抑制驱动促炎细胞因子释放的NLRP3激活,以及阻断耳蜗微环境中的凋亡信号通路。这些发现凸显了MgH₂作为预防听力损失潜在干预手段的治疗价值,其中NLRP3被确定为其保护作用的潜在调控分子。
在缓解顺铂诱导的听力损失方面,MgH₂相比目前美国食品药品监督管理局(FDA)批准的治疗药物硫代硫酸钠(STS)具有多项优势。STS通过清除活性氧(ROS)并与顺铂形成无生物活性的复合物发挥耳保护作用,但这种复合物的形成会削弱顺铂的抗癌疗效,从而降低其临床治疗潜力[33]。相比之下,MgH₂不会干扰顺铂的抗癌特性,是一种更具潜力的替代方案。
此外,STS的临床应用还受限于其狭窄的治疗窗口(需在顺铂处理后6小时内给药),且关于其在成人人群中的疗效数据尚不充分。与之不同,MgH₂颗粒尺寸极小,能够有效穿透血-迷路屏障(BLB),在耳蜗外淋巴中蓄积,并到达细胞核和线粒体等发挥治疗作用的靶点部位[55-57]。这些特性表明,MgH₂在保护耳蜗免受顺铂损伤的同时,还能维持顺铂的抗癌活性,有望成为一种更高效、更安全的替代方案。
MgH₂的创新材料设计实现了氢气(H₂)的可控局部释放,相比传统H₂补充方式有显著进步。传统H₂递送方式(如吸入H₂气体、静脉输注富氢盐水)存在诸多局限性:尽管有研究表明,与单纯顺铂组相比,吸入2% H₂气体可使豚鼠在30kHz频率下的电生理阈值偏移降低24dB[42],但这种方式存在全身清除快、个体间差异大的问题,均会影响治疗的一致性和整体效果;静脉输注富氢盐水虽能实现更可控的释放,但由于药物在体内广泛分布,仍难以在耳蜗中维持稳定的H₂浓度。
相比之下,MgH₂通过单次鼓膜注射即可实现H₂的靶向局部递送,有效克服了上述挑战。其在圆窗膜处形成的“储库效应”可确保H₂的长期滞留,从而实现更稳定、持续的治疗效果。这种局部递送系统能保证耳蜗部位H₂浓度的一致性,减少个体间差异,提升治疗的可靠性。
MgH₂通过调控关键凋亡调控因子,有效减轻顺铂诱导的细胞凋亡:它可降低促凋亡蛋白Bax的表达,同时提高抗凋亡蛋白Bcl-2的水平,从而恢复Bax/Bcl-2平衡。从机制上看,我们的研究表明,这种保护作用至少部分是通过减轻氧化应激介导的。
此外,本研究还揭示了顺铂诱导的氧化应激与NLRP3激活之间存在复杂的相互作用,尽管二者相互作用的精确分子机制尚未完全明确。以往研究提出,ROS可能通过氧化硫氧还蛋白相互作用蛋白(TXNIP)激活NLRP3,进而促进炎症小体组装[58,59];ROS也可能通过线粒体DNA释放或钾离子(K⁺)外流间接触发NLRP3激活,而这两种途径都是已证实的炎症小体形成的启动因素[60,61]。值得注意的是,MgH₂似乎能减少ROS蓄积,这可能会阻断ROS介导的TXNIP氧化,或减轻线粒体功能障碍——这两个过程都是NLRP3激活的关键步骤。未来可通过使用ROS清除剂或线粒体靶向抗氧化剂开展研究,进一步明确在该模型中氧化应激是否是NLRP3激活和细胞凋亡的主要驱动因素。
此外,ROS可同时触发凋亡通路和NLRP3炎症小体通路,其中胱天蛋白酶-1(Caspase-1)在介导这两条通路的交叉对话中发挥关键作用,可能将焦亡与凋亡联系起来[62,63]。需注意的是,当前的平行通路模型是一种简化表述,这些通路之间可能存在动态相互作用,这一点仍需进一步研究。
此外,我们的RNA测序分析还发现了多种炎症介质(包括Tlr2/6/8、Nod1/2、Myd88、Gbp5和Ccr5),它们超出了经典的NLRP3通路范畴。这些炎症反应主要由TLR/NOD-MyD88-NF-κB信号轴驱动:受应激的毛细胞释放损伤相关分子模式(DAMPs),模式识别受体识别这些分子后,激活该信号轴。值得注意的是,研究显示MgH₂可广泛抑制这些炎症通路,表明其具有广谱抗炎作用。未来可通过单细胞RNA测序进一步剖析细胞类型特异性转录反应,明确MgH₂的细胞靶点。
同时,镁(Mg)本身在这些保护作用中的角色也不容忽视。已知镁具有抗炎特性[64-66],Mg很可能与H₂协同作用,共同介导MgH₂的治疗效果。尽管Mg与H₂相互作用的具体机制仍在研究中,但有研究表明,H₂的直接作用靶点可能是血红素(尤其是血红素铁原卟啉形式)[67]:在缺氧条件下,H₂可与血红素的催化功能相互作用,产生一氧化碳(CO)。已有研究证实,CO对顺铂诱导的耳毒性具有保护作用[68],这可能也是MgH₂治疗潜力的一部分。
在临床实践中,鼓膜穿刺注射(经鼓膜注射)被广泛认为是内耳局部药物递送的首选方式。直径不超过1微米的分子可通过细胞间或跨细胞途径穿过圆窗膜,直接进入内耳[69]。鼓膜穿刺注射糖皮质激素已被用于治疗多种听觉疾病,包括突发性感音神经性听力损失、耳鸣、自身免疫性内耳病和梅尼埃病。实验研究也证实,局部给药的糖皮质激素具有耳保护作用,尤其在减轻顺铂诱导的耳毒性方面效果显著。与全身给药相比,这种靶向递送方式可使内耳中的药物浓度显著升高,同时最大限度地减少全身副作用,并维持顺铂的抗癌疗效,是一种极具潜力的耳保护策略。
尽管本研究证实MgH₂能有效保护耳蜗毛细胞,但它在促进毛细胞再生、确保听力功能长期维持方面的潜力仍不明确。此外,耳蜗高频区域存在功能损伤的现象表明,MgH₂可能无法对所有频率下顺铂诱导的损伤提供完全保护。未来需要进一步研究:探索全身给药或无创给药等替代递送方式,以提高其临床适用性;将MgH₂与针对其他机制的治疗药物联合使用,构建更全面的顺铂耳毒性预防策略;阐明MgH₂调控NLRP3激活和炎症微环境的精确分子机制;深入探索MgH₂的药代动力学特征,包括长期效应、潜在副作用和临床安全性;开展临床试验,在大样本队列中评估MgH₂的疗效,确定其用于人体的最佳剂量和长期安全性。
综上,本研究表明MgH₂是缓解顺铂诱导耳毒性的潜在治疗候选药物。通过保护耳蜗毛细胞,MgH₂解决了外周听觉系统的关键脆弱点;其保护作用源于减轻线粒体氧化应激、调控耳蜗微环境中NLRP3介导的炎症细胞因子,以及抑制细胞凋亡(图7)。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1498132.html?mobile=1
收藏

