氢气递送用于精准免疫调节:机制、检测方法及应用
摘要
分子氢(H₂)的递送在精准免疫调节方面的潜力日益受到认可,其主要通过抗氧化作用、调节炎症因子、抑制细胞凋亡等多种途径发挥作用。这些作用有助于维持免疫系统的平衡与功能,凸显了H₂在多种炎症性疾病中的治疗前景。然而,目前仍存在两个关键问题尚未解决:H₂免疫调节作用的潜在机制尚不明确,且缺乏精准的检测方法来阐明体内剂量 - 疗效关系。由于以往的综述侧重于开发用于H₂递送的纳米材料,往往忽视了对免疫调节机制的分析,也未能更新检测方法。为填补这些空白,本综述探讨了H₂的免疫调节机制、最新检测方法以及先进H₂递送系统的分类与应用,旨在加深对利用其特性进行精准免疫调节策略的理解。
Li G, Cui H, Fan R, Liu G, Hou Z, Zhang Y, Che X, Wang T, Wei H, Li P. Delivery of Molecular Hydrogen for Precision Immunomodulation: Mechanisms, Detection Methods, and Applications. Adv Sci (Weinh). 2025 Jul 6:e00283. doi: 10.1002/advs.202500283. Epub ahead of print. PMID: 40619605.
1 引言
氢是自然界中最简单且分布最广泛的元素,也是人体中含量最丰富的元素之一[1]。近年来的研究日益表明,分子氢(H₂)作为一种新型气态信号分子,具有显著的免疫调节作用,包括抗凋亡、抗炎和选择性抗氧化反应[2,3]。与一氧化氮(NO)、一氧化碳(CO)和硫化氢(H₂S)等其他“明星”气态信号分子相比[4-7],H₂即使在高浓度下也无细胞毒性,且具有优异的生物安全性,使其成为极具吸引力的治疗应用候选者,尤其在免疫反应调节方面[8,9]。H₂的治疗潜力最早在1975年被注意到,当时Dole等人报道高压H₂通过其抗氧化特性抑制小鼠皮肤肿瘤的生长[10]。然而,由于高压H₂存在潜在安全隐患,加之技术不够发达,这一初步发现并未受到广泛关注。1996年,David Jones提出H₂可以中和炎症细胞攻击病原体时产生的羟基自由基(·OH),且不会对人体造成毒性[11]。尽管这一假设最初只是推测,但在2007年得到了证实,研究表明H₂能选择性清除有害自由基,从而减轻炎症和缺血再灌注损伤[12]。在这些早期研究结果的基础上,更多近期研究强调了H₂在治疗多种免疫相关疾病方面的潜力,包括关节炎、慢性伤口、心血管疾病、结肠炎症和肝炎等[13]。
尽管关于H₂的免疫调节潜力已有令人鼓舞的发现,但由于给药方面的挑战,其有效的临床应用仍然有限。目前的方法包括直接吸入H₂、饮用富氢水以及注射H₂饱和盐水[14,15]。此外,氢水浴、凝胶和贴片已被探索用于皮肤炎症等局部病症[16]。然而,这些方法存在诸如H₂负载量低、难以实现向深部组织病变的可控递送以及无法长期维持治疗浓度等局限性[17]。纳米技术通过利用纳米材料开发精准且靶向的H₂递送系统,彻底改变了H₂递送领域[18]。自2017年以来,封装H₂生成催化剂的光子驱动纳米反应器已被用于局部提高H₂浓度,降低炎症诱导的爪水肿小鼠体内的活性氧(ROS)水平和促炎因子[19]。H₂递送纳米材料的不断发展,使得精确控制H₂的浓度、作用时间和作用部位成为可能。这确保了靶部位的持续治疗水平,最大限度地减少了脱靶效应,并提高了H₂递送在免疫调节中的整体疗效。
尽管已取得重大进展,但H₂调节免疫反应的潜在机制仍未完全明确。此外,由于H₂分子体积小、极性低且组织穿透能力强,它可以快速穿过大多数药物无法透过的血脑屏障等屏障[20,21]。因此,体内H₂的检测对于了解其生物学效应、体内转运、靶向行为以及剂量与疗效的关系至关重要[22]。然而,现有综述主要侧重于H₂递送材料的开发,往往忽视了对免疫调节机制的分析,也未能更新检测方法。为填补这些空白,本综述旨在探讨H₂的免疫调节机制、检测方法的最新进展以及先进H₂递送系统的分类与应用,以加深对基于H₂递送的精准免疫调节策略的理解(图1)。
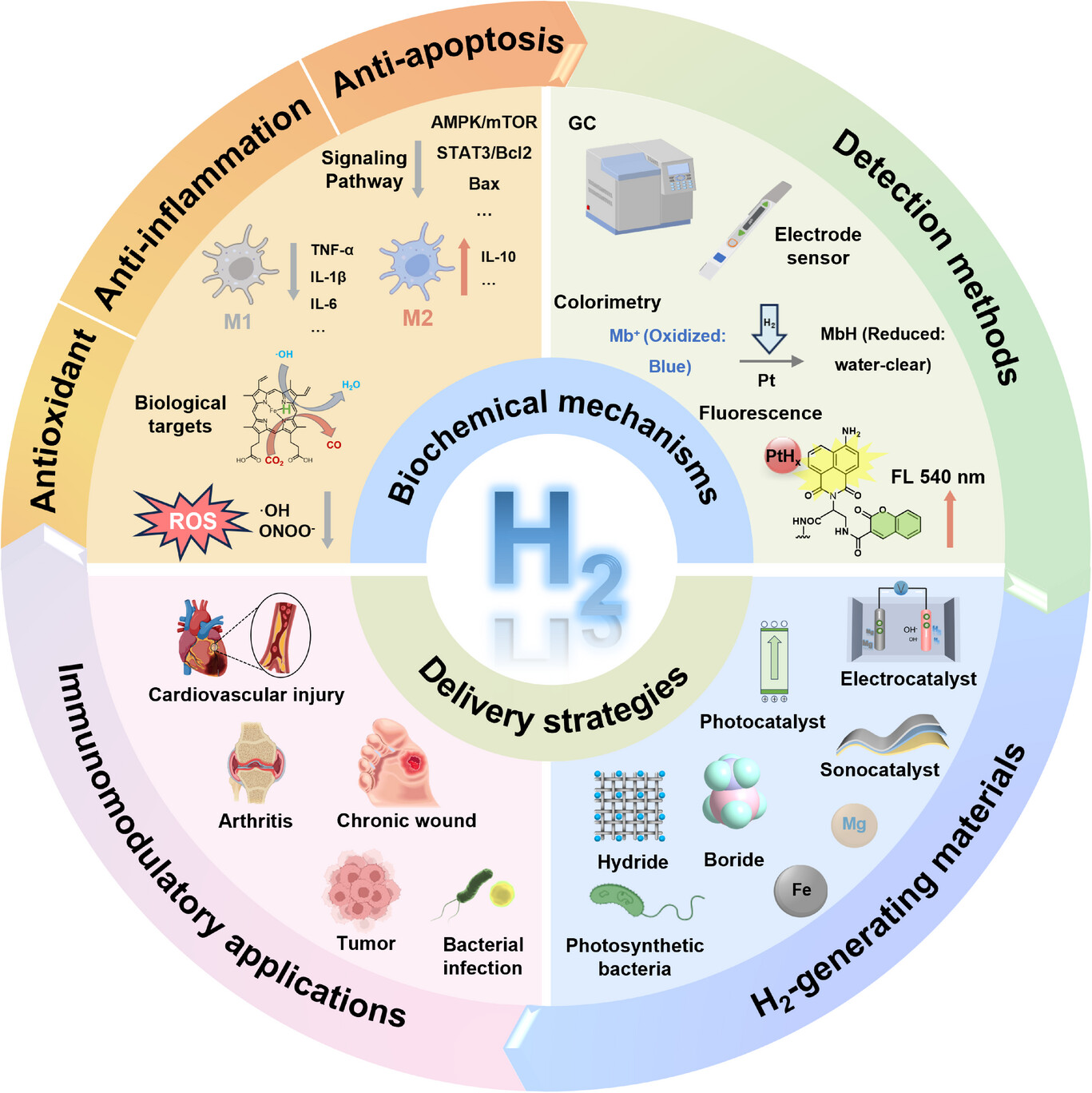
图1 用于免疫调节的H₂递送示意图
2 H₂的免疫调节机制
炎症与氧化应激密切相关,氧化应激对免疫反应有显著影响[23]。一方面,炎症可引发细胞衰老并释放活性氧(ROS),过量的ROS会导致体内氧化应激[24,25]。另一方面,ROS通过上调核因子κB(NF - κB)信号通路促进肿瘤坏死因子 - α(TNF - α)等促炎因子的合成[26]。这些促炎因子激活三磷酸吡啶核苷酸(NADPH)氧化酶的表达,从而促进NADPH合成ROS,进一步加剧体内的炎症反应[27,28]。研究表明,H₂在减轻氧化应激和调节免疫反应中发挥关键作用[29]。2007年,Ohsawa等人发现H₂可以选择性清除细胞中的·OH和过氧亚硝酸盐(ONOO⁻)等强氧化剂,减轻对蛋白质、DNA等的氧化损伤,且不影响其他生物活性ROS[12]。此后,许多研究都聚焦于H₂的免疫调节机制[30]。然而,由于H₂的水溶性低(1.6 ppm)且活化能高,H₂与·OH和ONOO⁻的直接反应效率较低[22]。因此,研究人员推测体内存在催化H₂相关反应的酶。2022年,何 Qianjun 设计了游离和蛋白质限制的铁卟啉,通过催化氢化选择性中和剧毒的·OH,从而介导H₂的抗氧化、抗炎和抗衰老作用。在缺氧微环境(如肿瘤缺氧区域)中,铁卟啉通过催化氢化将CO₂还原为CO,进而原位介导CO信号通路,最终实现抗癌和免疫调节等治疗效果[31]。这项研究首次提出并证实了铁卟啉作为H₂的生物靶点,同时阐明了其对线粒体的调节作用以及对免疫调节的系统影响。
H₂通过相关信号转导通路调节炎症基因的表达。大量研究表明,H₂可通过减少TNF - α、白细胞介素 - 1β(IL - 1β)、白细胞介素 - 6(IL - 6)、干扰素 - γ(INF - γ)、细胞间黏附分子 - 1(ICAM - 1)和高迁移率族蛋白1(HMGB - 1)等促炎因子的释放,同时上调抗炎细胞因子白细胞介素 - 10(IL - 10)来减轻炎症[13,19,32,33]。此外,有研究表明H₂可通过激活Nrf2/HO - 1信号通路减轻脓毒症中的过度炎症反应并减少内皮损伤[34]。Cardinal等人进一步报道,H₂通过抑制丝裂原活化蛋白激酶(MAPK)信号通路抑制促炎因子的产生,从而减轻肾移植的炎症反应[35]。除了经典的炎症模型外,近期研究表明H₂在神经退行性疾病背景下可调节免疫微环境。例如,He等人的研究显示,在斑马鱼阿尔茨海默病模型中,富氢水显著减轻氧化应激,减少神经炎症细胞因子(如TNF - α、IL - 6、IL - 1β),并恢复肠道菌群组成,从而凸显了H₂在肠 - 脑轴中的免疫调节作用[36,37]。
同时,H₂对自噬的调节具有情境依赖性,H₂促进或抑制自噬取决于组织类型、疾病状态和信号通路激活等因素。在心肌细胞肥大模型中,H₂抑制过度自噬以防止病理性重塑[38]。同样,在脂多糖诱导的急性肺损伤中,H₂饱和盐水通过ROS/AMPK/mTOR信号通路抑制过度激活的自噬,减轻组织损伤[39]。相反,在肺癌细胞中,H₂通过抑制STAT3/Bcl2信号增强凋亡和自噬,有趣的是,抑制自噬进一步放大了H₂的促凋亡作用[40]。此外,越来越多的证据表明,H₂通过显著降低Bax、caspase 3和caspase 9等凋亡相关蛋白的表达,在正常组织中发挥抗凋亡作用[41]。然而,H₂调节这些蛋白表达的确切信号通路仍不清楚。此外,H₂是否通过影响线粒体结构和功能来干扰凋亡过程也仍不确定。
尽管取得了这些显著进展,但关于H₂介导的免疫调节的分子机制仍存在几个关键问题。例如,除了已知的对氧化应激和凋亡相关蛋白的影响外,H₂是否还有其他分子靶点,以及NO或H₂S等其他气态信号分子是否能通过催化或信号通路发挥类似的下游效应,目前仍不清楚。此外,需要实验证据来阐明H₂是否能干扰涉及铁/锰/锌卟啉的类芬顿反应,从而阻止免疫相关疾病的进展[31]。另外,尽管已知四种气态信号分子(H₂、NO、CO和H₂S)均能调节免疫反应,但专门研究H₂与其他NO和H₂S之间相互作用的研究仍然非常有限。鉴于它们存在重叠的信号通路,如NF - κB和MAPK,协同和拮抗相互作用在生物学上都是合理的。例如,已表明NO和H₂S可协调血管反应和血压调节,而初步研究表明H₂和CO之间可能存在相互作用[42]。相比之下,H₂与NO或H₂S之间的直接相互作用在很大程度上仍未被探索。这些空白指出了未来研究的重要方向,以便更好地理解气态信号分子如何调节免疫系统。未来的研究需要阐明这些机制的相对贡献,并更好地理解H₂介导其免疫调节作用的分子途径。
3 H₂的检测方法
H₂浓度检测对于研究H₂在体内的分布、动态变化和剂量 - 效应关系至关重要。在H₂研究的早期阶段,气相色谱(GC)因其高精度和准确性,成为检测溶液或血液中H₂浓度的主流方法,并随后在生物医学研究中得到广泛应用。例如,2007年发表的第一篇关于H₂生物学的开创性论文就采用了这种方法,随后的研究也使用GC监测吸入H₂后血液中H₂水平的变化(图2A)[12,43]。此外,质谱(MS)能够检测极低浓度的H₂,但其在H₂生物医学研究中的应用仍然有限。值得注意的是,具有选择离子监测(SIM)的气相色谱 - 质谱(GC - MS)方法(GC - MS/SIM)为生物样品中H₂的定量测定提供了一种可行的方法,无需复杂的预处理。在这种方法中,氦气用作载气以分离分析物和内标。基于H₂与²²Ne的峰面积比,建立气相中H₂定量的校准曲线。这种GC - SIM - MS方法具有高灵敏度,H₂分析的检测限为1.7 ppm[44]。然而,GC和MS受限于设备复杂、体积庞大、对环境条件要求严格以及成本高昂,这限制了这些方法的实际应用。因此,具有更强便携性和实时检测能力的电极传感方法日益受到青睐[45,46]。其中,电阻式半导体传感器通过气体吸附材料的电化学分析原理实现对H₂浓度的有效检测[47,48]。Sang Hun Kim等人通过结合分级多孔SnO₂纳米结构和PdO开发了一种结构独特的H₂传感器,该传感器表现出优异的选择性、响应速度、传感动力学和较短的恢复时间。值得注意的是,该传感器对呼出气体中H₂的检测限达到0.096 ppm[49]。基于CuO传感器的研究通过复合材料的设计进一步优化了H₂的检测性能。对于溶液中H₂的检测,电化学H₂传感器因其快速准确的响应特性而在许多领域得到广泛应用。这种类型的传感器通过传感电极吸收和分解H₂,然后通过电流检测来量化H₂浓度(图2B)。该方法不仅用于监测生物降解过程,还用于评估体内镁合金降解过程中H₂浓度对成骨相关细胞类型的影响。此外,结合电化学原理的H₂检测装置,如用[NiFe]氢化酶修饰的碳基微电极,拓宽了H₂检测的适用性。
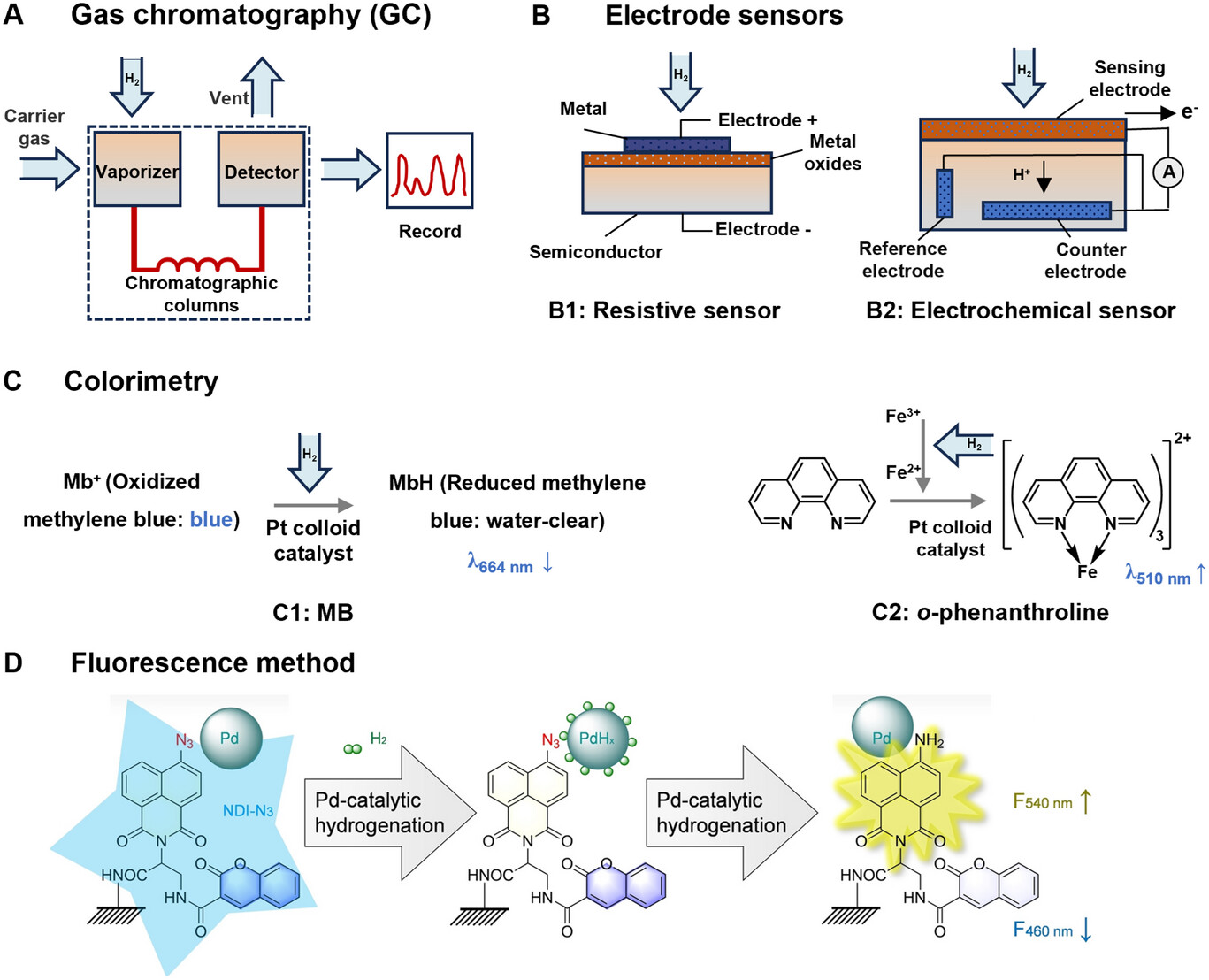
图2 H₂检测方法的机制。A)气相色谱法。B)电极传感器(电阻式传感器和电化学传感器)。C)比色法(MB和邻菲啰啉)。D)荧光法。经许可转载[22]。2022,Wiley - VCH。
基于氧化还原反应的比色法为检测水溶液中的H₂含量提供了一种经济实用的方法。该方法涉及亚甲基蓝(MB)与H₂在胶体铂催化下的氧化还原反应。操作过程包括逐滴加入MB溶液,直到溶液变为蓝色,表明存在H₂。值得注意的是,无色溶液暴露于空气中的氧气会变为蓝色,这使得水中H₂的直接分光光度检测变得复杂,因为溶液的颜色会因与大气氧的相互作用而变化。这种方法能够检测的H₂浓度约在0.2至1.6 mg·L⁻¹之间[50]。此外,一种在酸性条件下测定水溶液中H₂浓度的简单快速的紫外 - 可见分光光度法,是基于在胶体铂存在下铁离子与H₂之间的氧化还原反应。释放的亚铁离子随后通过与邻菲啰啉的比色反应进行定量,并在510 nm处测量吸光度(图2C)。该方法对水中H₂的检测限达到0.696 µM[51]。然而,需要注意的是,这种方法可能会受到溶液中其他氧化或还原物质的干扰,限制了其在血液和细胞培养液等复杂样品中的应用。
分子影像探针能够实时追踪体内的氢气(H₂),提供更高的时间和空间灵活性,同时最大限度地减少组织损伤[52]。此外,结合分子影像探针的荧光光谱法为体内H₂检测提供了新视角。通过将钯(Pd)纳米颗粒以及叠氮化物/香豆素修饰的荧光团与聚乙二醇(PEG)修饰的介孔二氧化硅纳米颗粒(NDI-N3/Pd@MSN-PEG)结合,设计并合成了一种比率型荧光H₂探针。该探针利用包裹在介孔二氧化硅中的小型Pd纳米颗粒的氢化催化作用,快速捕获H₂并催化其转化为高反应性氢原子。这一过程将NDI-N3转化为NDI-NH₂,从而在540 nm处产生荧光发射(图2D)。所开发的H₂探针具有高选择性、快速响应性、高灵敏度和低检测限(26.7 nM)[22]。该探针已成功用于观察H₂在细胞、动物和植物中的超快跨膜运输,显示出作为研究H₂在免疫调节中作用的通用工具的巨大潜力。
4 按不同产氢机制分类的氢气递送材料
基于氢气产生机制对氢气递送材料进行分类,已成为探索氢气在免疫调节中的有效利用以及开发先进氢气递送系统的重要策略。在本节中,我们将过去五年报道的用于免疫调节的氢气递送材料分为三大类:产氢催化材料、储氢材料和产氢活体生物材料(表1)。这种分类全面概述了每一类材料,强调了它们在解决传统方法效率低下问题方面的潜力。
表1. 过去五年中按不同产氢方法分类的氢气递送材料。
4.1 产氢催化材料
催化的概念起源于化学领域,并已广泛应用于工业和能源部门。近年来,它逐渐向生物医学领域过渡[94,95]。与化学工业追求高催化效率不同,生物医学研究需要具有灵敏响应性和可控释放性的催化材料[96]。催化材料在生物医学中一个特别有前景的应用是产氢。根据驱动过程的能量来源,催化产氢大致可分为三类:光催化产氢、电催化产氢和声催化产氢。这些方法利用不同形式的能量诱导产氢所需的催化反应,有望在慢性炎症疾病的长期免疫调节应用中发挥作用。
4.1.1 光催化产氢
光触发的光催化产氢为按需从水中释放氢气提供了一种高度可操控的方法。这个过程依赖于光催化剂吸收光线并利用其能量驱动化学反应。在生物医学领域,这项技术通过提供持续且可控的氢气释放,显示出巨大的潜力,这对治疗应用至关重要。自1972年Fujishima等人发现TiO₂电极上的光催化水分解现象以来,半导体光催化已成为一个关键的研究领域,特别是在生物医学领域[97]。这个过程始于半导体材料吸收光线,将电子从价带激发到导带,在价带中留下空位或空穴。这些分离的电子和空穴随后驱动与水分子的氧化还原反应:电子将水还原生成氢气,而空穴将水氧化生成氧气[98]。这种受控过程提供了精确的时空氢气释放,使其在靶向治疗应用中极具前景。在各种半导体材料中,二氧化钛(TiO₂)纳米颗粒因其生物相容性、化学稳定性和无毒性而备受关注。近期的进展包括开发近红外(NIR)光催化剂,例如掺杂氢原子的TiO₂纳米棒在可见光和近红外光下显示出更高的效率,拓宽了它们在生物医学环境中的适用性[53,54]。为了进一步提高光催化性能,异质结工程已成为一种很有前景的策略。例如,构建了铋(Bi)纳米晶体修饰的Bi₂WO₆/H-TiO₂异质结,实现了双重光催化功能:葡萄糖降解和氢气生成。在光照射下,葡萄糖作为牺牲剂,促进有效的电荷分离和持续的氢气产生。这种合理的设计不仅提高了氢气生成的效率,还展示了基于异质结的光催化剂在生理环境中的多功能性[55]。此外,最近开发了装饰有钯纳米点的氢掺杂TiO₂纳米棒(HTON-Pd)作为一种多功能光催化剂,能够在可见光照射下同时产生氢气和温和的热能。这种双功能设计为开发具有精确时空控制的光响应材料提供了一个有前景的平台,并在集成到先进的生物医学产氢材料中具有巨大潜力[56]。
然而,尽管近红外响应光催化剂取得了进展,组织特异性光穿透仍然是体内应用的关键限制因素。近红外光在皮肤或皮下肿瘤等浅表组织中具有良好的穿透性,非常适合治疗浅层病变。相比之下,它在大脑等深部组织中的穿透性有限,通常需要使用高强度光源或侵入性光纤。这些实际考虑强调了使光响应催化剂设计与靶部位的解剖特征相匹配的重要性,以最大限度地提高治疗效果,同时最小化潜在的组织损伤。为了解决窄带隙材料中的电荷复合等局限性,已开发出诸如SnS1.68-WO2.41之类的Z型纳米催化剂,它结合了高还原电位和氧化电位,以增强电荷分离和近红外吸收,实现高效产氢[58]。在这一进展的基础上,进一步的改进导致了多光子响应近红外光催化剂的开发。一个值得注意的例子是ZrTc-Co,它基于Zr-MOF结构,整合了噻唑并噻唑基有机配体(Tc)作为模型多光子活性单元。这种材料的表面修饰引入了钴离子作为光催化活性位点。ZrTc-Co能够吸收多个光子,使其达到更高的能量状态,并显著增强光催化产氢。这种材料改善了电子-空穴分离并优化了吸附条件,使其成为深部组织氢气递送的有前景候选者[59]。
同时,天然和合成的光敏剂进一步推动了光催化系统的发展。修饰的卟啉,如在[FeFe]TPP/GEM/FCS纳米颗粒氢气发生器中使用的那些,在医疗应用中也显示出显著前景,能够在特定光照条件下产氢[60]。此外,金属有机框架(MOFs)和聚合物半导体,如g-C3N4,已被探索通过精确调整和掺杂来增强光催化性能[62]。这些混合系统,包括半导体聚合物点(Pdots),提供了可调节的光学带隙和改进的光催化活性。例如,研究人员展示了使用脂质体作为纳米反应器的Pdots在原位产氢方面的治疗潜力[63]。总的来说,光敏剂和混合系统的这些进展补充了基于半导体的光催化,为生物医学产氢应用中的可控氢气释放提供了新的创新解决方案。
4.1.2 电催化产氢
电催化产氢利用电能从水中产生氢气,提供了对氢气释放的精确控制[99]。传统的中医针灸针(电极)为体内电化学产氢提供了一种新方法。Qi等人证明,通过施加约3 V的低电压,这些电极在酸性环境中促进有效的电化学反应,从而产生局部氢气[64,65]。然而,对外部电源的需求可能使其在未来的临床应用中不太实用。可植入电极允许精确调节氢气产生,在神经应用中特别有前景;然而,必须仔细考虑电极材料的长期生物相容性和机械稳定性,以确保在体内的安全和持续使用。此外,锌-铁微/纳米结构经过工程设计以提高锌的水解速率。通过调整锌与铁的比例,这些结构能够实现可控的氢气释放,提供了一种持续高效的产氢方法[66]。然而,铁针的低电催化活性和不稳定性限制了其实际应用。
镁(Mg)及其合金广泛用于临床植入物,也已被探索作为局部氢气释放的潜在材料。虽然镁与水反应生成氢气,但反应速率缓慢限制了其效率。为了解决这个问题,通过在镁棒上原位还原Pt开发了一种微 galvanic 电池(MgG)。这种基于镁的 galvanic 电池可以在不需要外部电源的情况下自发产生氢气,为局部氢气递送提供了一种实用的方法。在小鼠体内研究中表明,植入4T1肿瘤中的MgG棒在15天内有效降解,在血液或主要器官中没有显著的Mg²⁺积累。Pt纳米颗粒逐渐被清除,主要通过肾脏排泄。未观察到组织学损伤或异常的肝/肾功能,表明Mg²⁺和Pt成分都具有良好的生物相容性和生物安全性[67]。这些发现支持了MgG作为一种安全且可生物降解的体内产氢材料的潜力。同时,最近的研究引入了锰掺杂的Ni₂S₃纳米电极(MnNi₂S₃ NEs)作为一种创新的电催化剂,用于增强电催化产氢。这些纳米电极通过降低初始能垒和促进氢气的有效解吸,显著改善了析氢反应,从而实现了更可控和有效的氢气产生[68]。
4.1.3 声催化产氢
声催化产氢利用超声能量驱动水分解反应,为在各种治疗环境中产生氢气提供了一种有前景的方法。超声波具有优异的组织穿透性,特别适用于关节和大脑等深部组织;然而,过多的能量输入可能导致热损伤或机械损伤,因此精确控制超声参数对于安全应用至关重要。该领域的最新发展引入了声催化剂,以提高氢气产生的效率和控制。例如,介晶ZnS纳米颗粒经过工程设计,实现了有效的声催化全水分解,提供了氢气和氧气的持续释放[69]。此外,二维SnS纳米片已成为一种有效的声催化剂,利用其强压电效应进行超声驱动的产氢。这些SnS纳米片能够在低功率密度的超声波下高效产氢,使其非常适合局部和深部组织应用[70]。在这一进展的基础上,全氟化合物(PFCs)已成为增强生物医学应用中产氢的补充技术。PFCs是惰性有机化合物,对氧气具有高亲和力,使其在改善组织氧合方面特别有用。由于其优异的生物相容性,PFCs广泛用于临床应用,如人工血液替代、器官保存、超声成像和¹⁹F磁共振成像。其中,载氢全氟辛基溴(PFOB)纳米液滴因其高储氢能力而脱颖而出。这些基于PFOB的纳米乳液通过范德华相互作用表现出对氧气的大溶解能力,并且在受到低强度聚焦超声(LIFU)作用时可以触发爆炸性氢气释放。LIFU的低频、低强度特性具有优异的生物安全性,能够精确且可控地将氢气递送到靶部位[71]。这些进展强调了声催化材料在各种生物医学应用中精确高效产氢的潜力。此外,硫化铋(Bi₂S₃)与原位Pt纳米颗粒的结合通过优化电荷分离和氢气产生,即使在缺氧条件下也表现出改进的催化性能[72]。
4.2 储氢材料
储氢材料无需外部电源或催化剂即可产生氢气。根据其成分,这些材料可分为三大类:还原性金属、氢化物和硼化物。
4.2.1 还原性金属
铁(Fe)和镁(Mg)等还原性金属对酸高度敏感,可产生氢气,有利于靶向氢气递送。然而,它们在生理条件下也不稳定。为了解决这个问题,已开发出涂有羧甲基纤维素(CMC)的铁纳米颗粒。CMC涂层保护铁免受氧化,并且小尺寸的Fe@CMC纳米颗粒表现出优异的被动靶向特性以及在弱酸存在下的高产氢响应性[73]。基于镁和铁的潜力,这些金属不仅用作医疗设备中的可生物降解材料,还显示出作为产氢剂的前景。例如,Sung提出了一种含有镁粉的聚乳酸-羟基乙酸共聚物(PLGA)微粒系统(Mg@PLGA MPs)[100]。疏水性PLGA阻碍水渗透到Mg@PLGA MPs中,从而限制氢气的释放速率。此外,Li等人开发了一种涂有透明质酸(HA)的生物相容性镁微电机。镁产生的氢气气泡作为推进剂,使微电机能够被运输到靶部位进行治疗,展示了一种新的氢气递送方法[74]。此外,碳酸钙纳米颗粒包覆的镁系统(Mg-CaCO3)[75]、可生物降解的载妥布霉素镁微电机(Mg-Tob motor)[76]和二维Mg₂Si纳米片(MSN)[77,78]都利用基于镁的系统高效产氢,突出了镁作为一种可生物降解的反应性金属在各种应用中实现氢气递送的独特性能。
4.2.2 氢化物
基于钯(Pd)的氢化物(PdH)因其与氢原子的独特相互作用而具有显著的储氢能力。它能够实现靶向氢气递送和受控释放,特别是在暴露于近红外(NIR)光时。特别是,PdH纳米颗粒独特的尖状形态进一步增强了氢气释放并促进了与周围组织的相互作用,使其在生物医学应用中很有前景[79-82]。在PdH的基础上,氢化钙(CaH₂)和氢化镁(MgH₂)等金属氢化物是有效的自发产氢材料。例如,CaH₂可以通过与水反应持续产生氢气:
CaH2+2H2O = Ca(OH)2+2H2 (1)
当纳米CaH₂分散在低分子量聚乙二醇(PEG)中时,这种特性会进一步增强,与水接触时会产生大量氢气[83]。
与碱金属产氢的副产品金属氢氧化物可能使处理过程复杂化不同,H-Si与环境水快速且持续地反应生成氢气,无需外部能量输入。这提供了一种更高效和可持续的产氢方法,突显了基于氢化物的氢气递送技术的不断进步[84,85]。然而,开发现场产氢系统的一个挑战是需要与水和酸反应来触发氢气释放。这些材料的一个重要但经常被忽视的方面是它们的生物相容性,这对临床应用至关重要。为了解决这个问题,人们越来越关注寻找能够直接存储高还原电位氢原子的替代载体。一种有前景的候选材料是钨青铜(HxWO3,0 < x < 1),这是一种固态氢载体,其中氢原子可以可逆地插入和提取。氧化钨材料的生物相容性已得到广泛验证,这降低了生理排斥和治疗后毒性的风险,使其成为安全有效的氢气递送的有吸引力的选择[86]。
4.2.3 硼化物
基于硼化物的材料,包括氨硼烷(AB,NH3·BH3)[87]、六硼化钙(CaB6)[89]和硼化镁(MgB2)[90],正成为自发产氢的有前景候选者,在特定条件下提供高效、无催化剂的氢气释放方法。NH3·BH3具有高氢含量和令人印象深刻的152.9 g·L⁻¹的体积氢密度[101],在酸性条件下发生水解反应释放氢气,反应如下:
NH3⋅BH3 + H+ +3H2O=NH4+ + B(OH)3 +3H2 (2)
NH3·BH3在中性和碱性环境中保持稳定,但在酸性条件下快速释放氢气,且该过程会因加热而加速。当AB嵌入聚合物基质或多孔微球中时,可提供受控的、持续的氢气释放,使其适合靶向生物医学应用[88]。同样,六硼化钙和硼化镁与水反应生成氢气和金属氢氧化物,特别是在酸性条件下。这些基于硼化物的材料为自发产氢提供了有效的手段,可用于受控的氢气递送。
4.3 产氢活体生物材料
上述传统的产氢方法通常受到反应条件、对催化剂的需求和材料消耗的限制。一旦材料耗尽,就无法持续产氢,并且反应过程中可能会产生残留的副产品,在医疗应用中带来潜在的安全风险。生物产氢利用微生物的自然代谢途径产生氢气,为产氢提供了一种可持续且环保的方法。Wu等人开发了一种共生藻类-细菌凝胶贴片,其中整合了小球藻和地衣芽孢杆菌,地衣芽孢杆菌的呼吸作用建立了一个缺氧环境,这对于激活小球藻中的氢化酶至关重要,从而在光合作用过程中产生氢气[91]。已知绿藻和光合细菌(PSB)在光照和厌氧条件下都会产生氢气。绿藻主要使用水作为底物,而PSB利用有机化合物,展示了这些微生物中可用的多种生物产氢途径[92]。此外,Zhang团队将产氢产气肠杆菌封装在微针中,在维持细菌活力的同时通过其代谢过程持续产生氢气。这种方法能够精确控制药物释放的深度和速率。总的来说,这些方法突出了生物系统在各种应用中高效且靶向产氢的潜力[93]。
5 氢气递送材料在精准免疫调节中的应用
5.1 关节炎中的活性氧清除
骨关节炎(OA)和类风湿关节炎(RA)是复杂的自身免疫性和炎症性疾病,会导致关节组织严重受损,发病率和死亡率均较高。[102] 活性氧(ROS)以及白细胞介素 - 1β(IL - 1β)、白细胞介素 - 6(IL - 6)、肿瘤坏死因子 - α(TNF - α)等促炎细胞因子的过量产生,在骨关节炎和类风湿关节炎的发病及进展中起着关键作用。活性氧可直接损伤软骨细胞、滑膜细胞和骨细胞,导致细胞凋亡和死亡。[103] 此外,活性氧还能激活炎症信号通路,促进炎症介质的释放,加重关节炎病情。利用氢气清除活性氧以减轻炎症,已成为一种新颖且颇具前景的关节炎治疗方法,但氢气扩散迅速、停留时间短,难以实现稳定的治疗效果。[84, 85, 104]
为了在发炎的关节中利用氢气实现有效的免疫调节,研究人员开发了多种智能氢气递送系统,尤其是以镁为核心材料的系统,因为镁具有生物可降解性,且能在原位产生氢气。Wan等人设计了Mg@PLGA微球(Mg@PLGA MPs),用于在骨关节炎治疗中实现氢气的局部可控释放(图3A)。在病变关节附近进行肌内注射后,这些微球通过镁的可控降解逐渐产生氢气,能有效清除活性氧并减轻炎症,且不会引起局部碱化。[100] 这种方法成功减轻了组织炎症,防止了软骨破坏,凸显出其临床应用潜力。同样,Xu等人开发了一种生物相容性良好的、涂有透明质酸的镁基微电机,用于类风湿关节炎的精准治疗。在超声引导下将这些微电机进行关节内给药,它们会持续产生氢气,这不仅能推动微电机增强组织穿透性,还能有效清除活性氧并下调促炎细胞因子。在胶原诱导的关节炎大鼠模型中,该策略显著减轻了关节损伤,降低了关节炎的严重程度,通过靶向和持续递送氢气,展示出更强的治疗效果。[74]
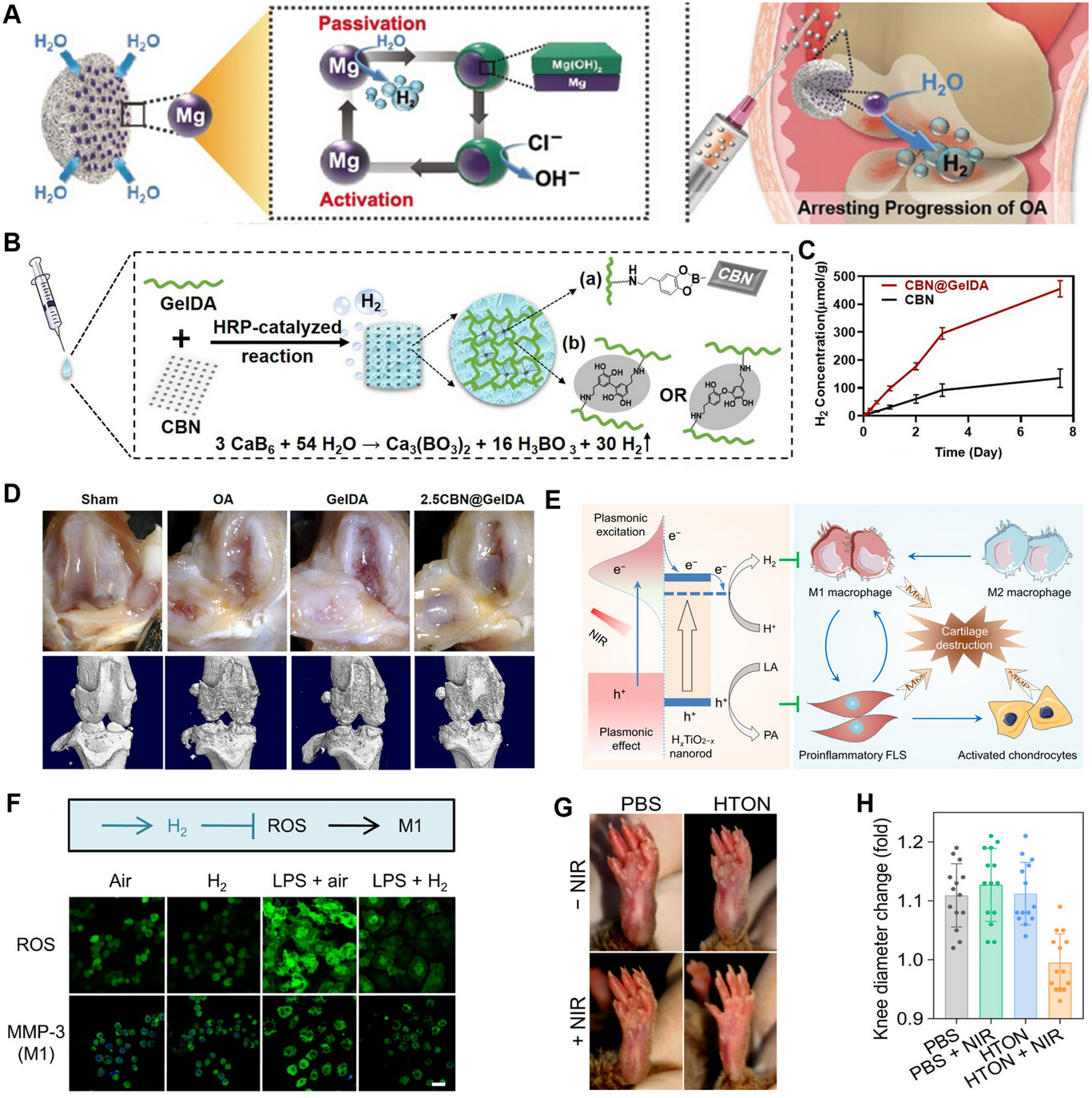
图3
A)Mg@PLGA纳米颗粒产生氢气抑制骨关节炎进展的示意图。[100] B)CBN@GelDA水凝胶的制备过程示意图。C)CBN@GelDA水凝胶在37°C的PBS溶液中的氢气累积释放行为。D)不同组处理后28天大鼠膝关节的代表性照片和显微CT扫描图。[89] 2023,Elsevier。E)近红外响应型HTON用于关节炎滑膜微环境(SME)调节的近红外光催化策略和机制示意图。F)氢气对细胞内活性氧水平和巨噬细胞极化的影响。比例尺:20µm。G)类风湿关节炎小鼠经39天治疗后左后爪的代表性数字图片。H)类风湿关节炎小鼠经32天治疗后的膝关节直径变化。[54] 2022,美国科学促进会。
直接液体注射用于递送氢气的纳米载体,容易从注射部位流失,可能会造成关节软骨磨损。[105] 为解决这一问题,水凝胶作为常用的药物和纳米颗粒递送系统,成为了一种有前景的解决方案。水凝胶可通过减少物理摩擦,确保治疗剂的可控局部释放,从而减轻关节损伤。[106, 107] Zhang等人制备了一种可注射水凝胶,该水凝胶由嵌入多巴胺接枝明胶中的六硼化钙纳米片(CBN@GelDA水凝胶)组成,作为一种高负载、可持续释放氢气的系统用于骨关节炎治疗(图3B)。[89] 这种水凝胶提供了一个稳定且生物相容性良好的基质,有助于氢气在较长时间内持续释放,有效减轻氧化应激和炎症反应,同时促进巨噬细胞向抗炎的M2表型极化(图3C)。在骨关节炎大鼠模型中,单次注射CBN@GelDA水凝胶显著减少了关节破坏,改善了软骨完整性,为炎症性关节疾病的长期管理提供了一种有前景的策略(图3D)。此外,基于干细胞的策略最近也融入了氢气释放机制,以进一步提高骨关节炎的治疗效果。例如,Zhou等人设计了携带氢气发生器的间充质干细胞,这些干细胞在全身给药后会归巢到骨关节炎关节,并在酸性微环境的刺激下产生氢气。释放的氢气可减轻线粒体功能障碍,减少细胞凋亡,维持旁分泌活性,逆转氧化还原和免疫失调。值得注意的是,这种方法还能促进M2型巨噬细胞极化,增强软骨再生,凸显了细胞治疗与局部氢气递送相结合的协同效益。[88]
尽管取得了这些进展,但按需且持续地释放氢气对于增强关节炎的精准免疫调节仍然至关重要。为满足这一需求,研究人员开发了其他可控氢气递送策略。例如,静电纺丝技术已被用于将H - Si纳米片包封到甲基丙烯酰化明胶短纤维中,以便在大鼠骨关节中实现氢气的缓慢、长期释放。这种方法旨在降低H - Si的反应速率,实现持续的治疗效果。[85] 在这些策略的基础上,He等人开发了高度稳定的、单分散的掺氢二氧化钛(HxTiO2 - x)纳米棒(HTON),用于类风湿关节炎滑膜微环境(SME)的近红外光催化调节(图3E)。[54] 在近红外光照射下,HTON不仅能在局部产生氢气,清除促炎性M1巨噬细胞中的活性氧,抑制其促炎表型并防止软骨损伤,还能消耗滑膜微环境中产生的过量乳酸(LA),阻止其侵入软骨,从而改善滑膜微环境(图3F、G)。此外,在类风湿关节炎小鼠中观察到膝关节直径显著减小(图3H)。这种双重功能策略为关节炎的精准免疫调节提供了有效途径。
5.2 慢性伤口愈合
慢性伤口,如糖尿病足溃疡(DFUs)和严重烧伤,其特征是持续的炎症、氧化应激和微生物感染。[108, 109] 在糖尿病足溃疡中,高血糖水平会导致晚期糖基化终产物积累,引发活性氧过量产生、慢性炎症和组织再生受损。用于治疗慢性伤口的常规药物往往会出现继发性失效,导致治疗效果不佳。[110] 氢气能够激活各种内源性干细胞,促进自体胶原蛋白的生成,从而诱导新的伤口愈合模式,加速愈合过程。[111]
氢气递送材料的最新进展推动了氢气在慢性伤口感染治疗中的应用。Chen等人开发了一种由活芽孢杆菌和普通小球藻制成的氢气递送水凝胶敷料,该敷料在光激活下产生氢气,以加速糖尿病伤口愈合。[91] 糖尿病伤口中的高糖环境往往会限制免疫调节的效果。He等人通过将具有适当带隙结构的二氧化钛纳米棒(HTON)作为可见光(VIS)敏感的光催化剂,开发了一种消耗葡萄糖并产生氢气的系统。该系统利用葡萄糖作为牺牲剂,通过可见光氙灯光催化产生氢气(图4A)。[53] 通过调节可见光的照射时间和功率密度,可以轻松控制氢气的产生和葡萄糖的消耗,这有利于HTON覆盖的糖尿病伤口中的葡萄糖消耗和免疫调节(图4B)。为了进一步增强对氢气产生的时空控制,最近研究人员通过用异氰酸酯基团修饰ZIF - 8并负载AB,开发出了ISO - ZIF - 8@AB纳米平台。该系统结合了光催化和水解机制,即使在黑暗条件下,也能通过带隙变窄和Zn2 +辅助的AB水解,实现可见光触发的氢气产生(图4C)。它实现了双相氢气释放曲线,其特点是初始爆发释放,随后持续释放超过14天,从而更好地匹配慢性伤口炎症管理的动态需求。[112]
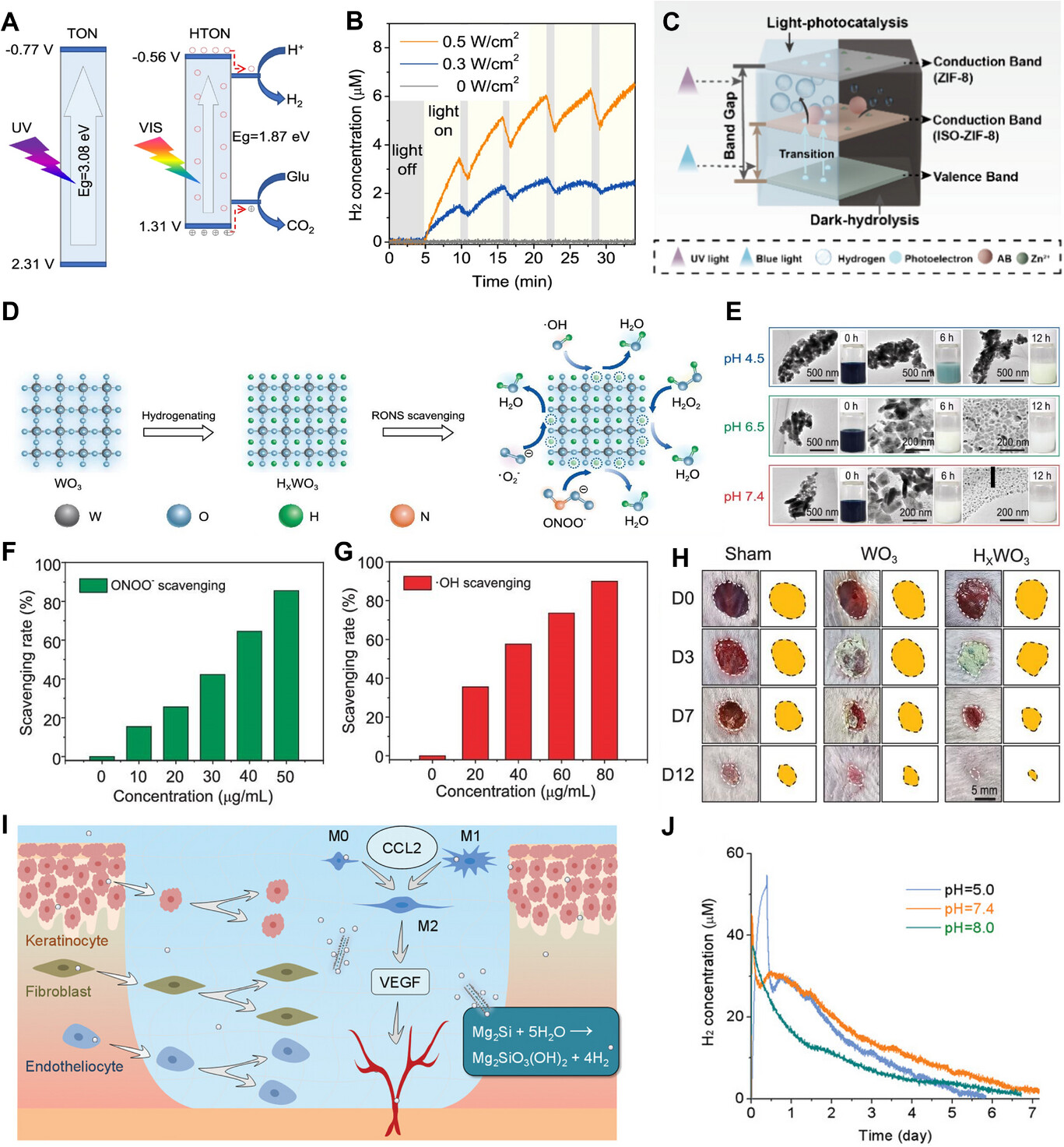
图4
A)TON和HTON的能带结构以及可见光催化产生氢气和消耗葡萄糖的机制示意图。B)在不同功率密度的氙灯照射下,HTON纳米催化剂在葡萄糖水溶液(20 mM)中的可见光催化产氢行为。[53] 2022,Springer Nature。C)ISO - ZIF - 8@AB纳米平台释放氢气的示意图。[112] 2025,美国化学会。D)HxWO3的制备及活性氧和氮物种(RONS)清除示意图。E)高分辨率透射电镜图像显示HxWO3纳米颗粒在0至12小时的pH响应降解过程中的崩解。F)不同HxWO3浓度下对过氧亚硝酸根阴离子(ONOO−)的清除率。G)不同HxWO3浓度下对羟基自由基(·OH)的清除率。H)经PBS、WO3和HxWO3处理后,第0、3、7和12天的动态伤口愈合过程代表性图像。[86] 2024,中国科学出版传媒股份有限公司。I)MSN@CS/HA敷料持续释放氢气的伤口愈合策略和机制。J)MSN@CS/HA水凝胶敷料在不同pH值的PBS溶液中的氢气释放曲线。[77] 2023,Wiley - VCH。
虽然像HTON和ISO - ZIF - 8@AB这样的材料具有光响应特性,但其他系统无需外部能量输入。Zhu等人提出了一种更通用的解决方案,设计了氢钨青铜(HxWO3),它利用糖尿病伤口环境独特的温度和pH条件来产生原子氢(图4D)。[86] 该材料表现出温度依赖性的原子氢释放行为,其独特的pH响应生物降解性确保了治疗后在病理部位的清除(图4E)。HxWO3产生的原子氢能有效地将活性氧和氮物种(RONS)转化为水,调节有益的抗炎细胞因子的表达(图4F、G)。这一过程刺激细胞增殖和血管生成,最终加速慢性糖尿病伤口的愈合(图4H)。
同样,严重烧伤伤口存在广泛的组织损伤、缺血再灌注损伤和氧化应激,这对伤口愈合构成了重大挑战。[113, 114] 为解决这一问题,开发长效氢气递送系统可以改善伤口愈合效果。He等人利用二维Mg2Si纳米片(MSN)开发了一种产氢平台,并将其嵌入壳聚糖/透明质酸水凝胶(MSN@CS/HA)中,用于深度烧伤伤口治疗(图4I)。[77] 与以往的氢气递送材料相比,MSN@CS/HA水凝胶可维持氢气释放长达一周,显著提高细胞活力,减少氧化应激,促进血管生成和组织再生(图4J)。此外,设计的MSN@CS/HA水凝胶具有优异的生物相容性,其降解产物包括氢气、Mg2 +、SiO32−、壳聚糖(CS)和透明质酸(HA),毒性低且易于在体内代谢。MSN@CS/HA水凝胶的生物相容性和延长的氢气释放能力使其成为烧伤伤口护理的有前景的选择,为免疫调节中的氢气递送提供了一种耐用且安全的替代方案。
5.3 心血管损伤缓解
研究表明,氢气可预防心血管疾病(CVDs),如缺血再灌注(I/R)损伤、动脉粥样硬化(AS)、心肌梗死、心脏重构和辐射诱导的心脏损伤。[115, 116] 氢气能够抑制细胞和组织内的·OH和ONOO−,显著降低氧化应激,进而减少心血管疾病发病机制中常见的炎症。心肌细胞和血管细胞(包括内皮细胞和平滑肌细胞)的损伤是心血管疾病中心血管功能障碍的关键风险因素。[117] 此外,纤维化和细胞凋亡的加剧与心力衰竭密切相关。研究表明,氢气治疗(每天吸入2%的氢气,持续3小时,共28天)显著改善了心肌梗死小鼠的心脏功能,减少了纤维化区域,减轻了缺氧诱导的心肌细胞损伤,并抑制了血管紧张素II诱导的心脏成纤维细胞迁移和激活。[118]
最近,一些研究小组专注于氢气递送,以实现心血管疾病的精准免疫调节。Xu等人通过种子介导法开发了PdH纳米袋立方体(PdH0.12 NPCs),采用“刚柔耦合”策略来增强对泡沫细胞形成的抑制,阻断动脉粥样硬化的进展。在“刚性”方面,Pd纳米袋立方体(Pd NPCs)充当抗氧化酶(过氧化氢酶和超氧化物歧化酶),清除活性氧,防止氧化型低密度脂蛋白(oxLDL)的产生,减弱脂质摄取(图5A)。[80] 在“柔性”方面,在近红外二区激光照射下,局部温度升高会破坏Pd - H键,触发氢气释放(图5B)。这通过上调PPAR - γ的表达,激活LXR - α/ABCA1/ABCG1介导的胆固醇转运通路,促进脂质外流(图5C)。通过这种“刚柔耦合”策略,同时减少脂质摄取和增强脂质外流,有效增强了对泡沫细胞的抑制,减轻了动脉粥样硬化病变的进展(图5D)。同样,Hu等人设计了PdHs纳米酶用于靶向动脉粥样硬化治疗。在他们的方法中,在合成过程中添加铁物种,在PdH基金属纳米酶中制造出独特的四足针状结构,赋予它们更强的自噬能力。TN - PdHs纳米酶被巨噬细胞内化后,在动脉粥样硬化病变处积累,其强大的活性氧清除能力、基于氢气的抗炎作用和自噬诱导协同作用,发挥出强大的抗动脉粥样硬化效果。这种双重机制增强了TN - PdHs的抗炎和抗氧化特性,使其成为动脉粥样硬化治疗的一种有前景的方法。[81]
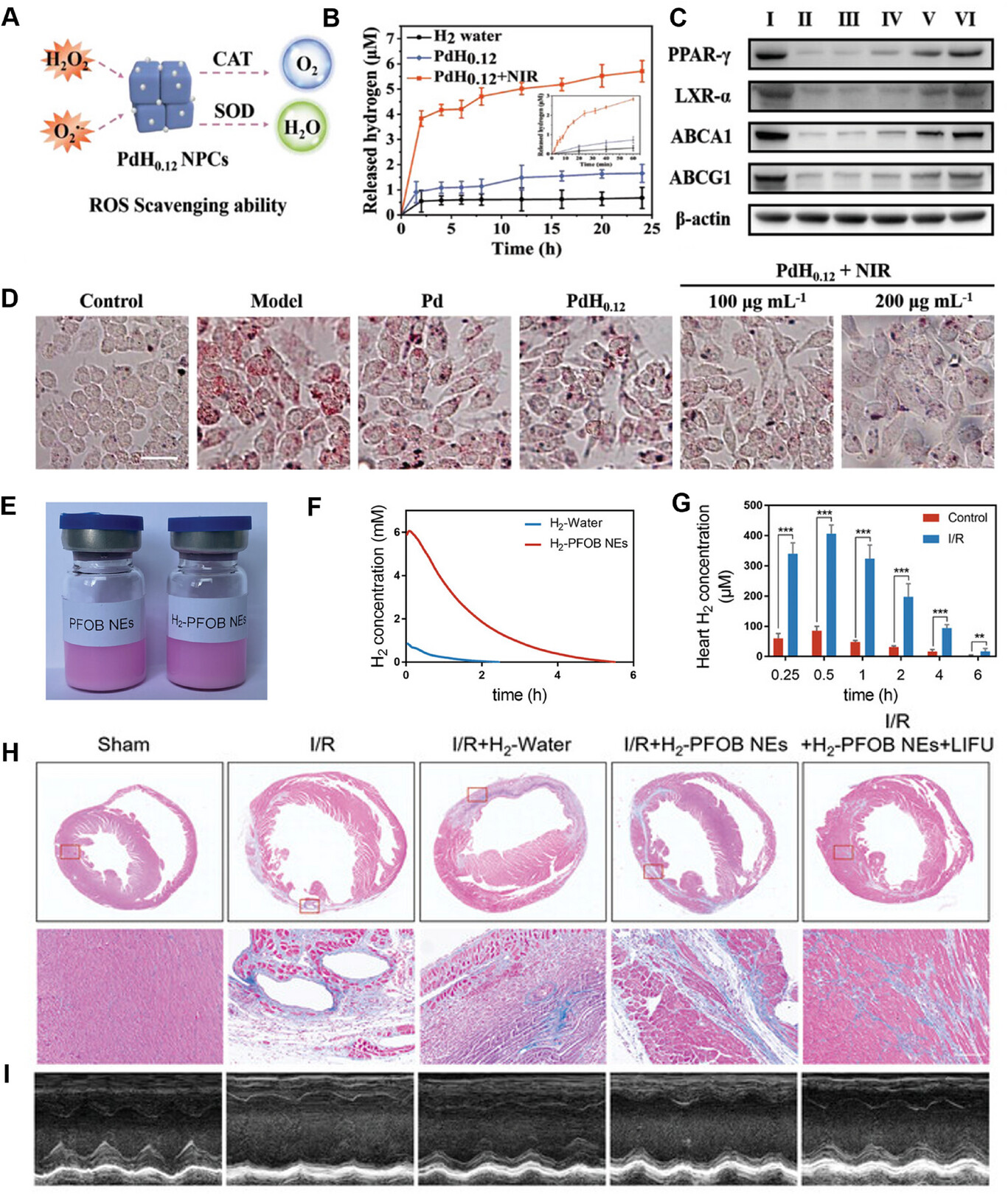
图5
A)PdH0.12 NPCs的活性氧清除能力示意图。B)使用MB探针测量的氢气水、Pd NPCs和PdH0.12 NPCs的氢气释放行为。C)不同处理后RAW264.7细胞中PPAR - γ、LXR - α、ABCA1和ABCG1蛋白水平的蛋白质印迹分析。D)不同处理后oxLDL诱导的RAW264.7细胞泡沫细胞形成的光学显微镜图像。比例尺:25µm。[80] 2021,Wiley - VCH。E)H2 - PFOB纳米乳剂(H2 - PFOB NEs)的代表性图像。F)随着时间的推移,氢气水和H2 - PFOB纳米乳剂中剩余氢气浓度的变化。G)注射H2 - FPOB纳米乳剂后不同时间,通过氢气微电极测量正常小鼠和缺血再灌注(I/R)小鼠体内的氢气浓度。H)小鼠心脏的代表性Masson染色图像。I)小鼠心脏的代表性超声心动图图像。[71] 2023,Wiley - VCH。
然而,这些PdH纳米材料存在无机生物安全性问题,其在临床转化中的应用仍面临挑战。为解决这些挑战,Nie等人报道了一种使用氢气 - 全氟辛基溴化物纳米乳剂(H2 - PFOB NEs)治疗心肌缺血再灌注损伤的新方法。[71] 基于先前的研究表明全氟辛基溴化物纳米乳剂(PFOB NEs)通过范德华相互作用具有优异的氧增溶能力,他们首先证明这些乳剂也能有效负载氢气(图5E)。此外,利用超声独特的低强度和低频特性,可通过低强度聚焦超声(LIFU)在靶部位精确触发H2 - PFOB纳米乳剂中氢气的释放,确保优异的生物安全性。如图5F所示,与氢气水相比,H2 - PFOB纳米乳剂的氢气释放速率更慢,适合氢气的持续释放。此外,对缺血再灌注小鼠心脏中氢气浓度的微电极测量显示,H2 - PFOB纳米乳剂递送的氢气峰值浓度更高,且释放持续时间更长,证实了其向缺血再灌注损伤心肌的靶向递送能力(图5G)。此外,超声心动图结果显示,与氢气水组相比,H2 - PFOB组和H2 - PFOB + LIFU组的心肌纤维化面积均显著减少,心脏功能得到改善(图5H、I)。这表明H2 - PFOB纳米乳剂与低强度聚焦超声联合使用,可最大限度地发挥对心肌缺血再灌注损伤的保护作用。
5.4 肿瘤微环境调节
慢性炎症在癌症进展中起着关键作用,它通过释放细胞因子、生长因子和趋化因子,促进细胞增殖并抑制细胞凋亡,从而创造一个有利于肿瘤发展的微环境。[119, 120] 氢气被认为是一种很有前景的抗癌剂,因为它能抑制癌细胞的能量代谢,抑制血管内皮生长因子的表达,并激活全身免疫反应。[121, 122] 此外,氢气具有选择性抗氧化特性,这在预防肿瘤发生中起着重要作用。[12] 值得注意的是,研究表明富氢电解水可以通过降低表皮生长因子受体2的表达,破坏细胞外信号调节激酶和蛋白激酶B等关键信号蛋白的磷酸化,诱导乳腺癌细胞凋亡。[123] 通过选择性清除活性氧,氢气减轻染色体损伤,抑制肿瘤相关信号通路的异常激活。这一作用有助于染色体损伤的及时修复,从而防止肿瘤的发生和发展。[124] 鉴于肿瘤组织中高水平的活性氧会促进肿瘤增殖、迁移和侵袭,利用氢气递送对肿瘤微环境进行免疫调节,为抑制肿瘤生长和转移提供了一种有前景的策略。[125]
为了在肿瘤区域产生大量氢气(H₂),刘等人将氢化钙(CaH₂)纳米颗粒分散在低分子量聚乙二醇(PEG)中,并将其注射到肿瘤内。这些纳米颗粒与水反应生成氢气,从而调节肿瘤微环境(TME)[83]。程等人通过在镁棒表面修饰铂,开发了一种基于镁的电化学电池(MgG)。当植入肿瘤后,MgG棒在肿瘤内产生氢气,诱导线粒体功能障碍并破坏细胞内氧化还原平衡。残留的氢氧化镁(Mg(OH)₂)可以中和酸性的肿瘤微环境,抑制肿瘤生长[67]。然而,这些方法无法精确控制氢气的释放时间和剂量。金等人开发了一种可用于临床的针灸针作为电极,通过温和的电化学反应,在肿瘤微环境中可控地原位生成足够的氢气。值得注意的是,由于氢气还参与肿瘤细胞的各种生理活动,其释放会破坏肿瘤微环境的微妙平衡,导致肿瘤功能异常。治疗后,癌症相关炎症的减轻有助于免疫系统恢复,从而提高治疗效果[64,65]。
实现肿瘤的靶向免疫治疗对于高效、低毒的癌症治疗至关重要。鉴于过表达的乳酸(LA)在肿瘤免疫微环境中发挥重要作用,郭等人在原位肝癌模型中采用了二维硫化锡(SnS)纳米片(SSN)[70]。压电催化诱导的氢气生成与同时发生的乳酸消耗协同作用,使效应性CD8⁺T(TCD8⁺)细胞从肿瘤细胞的免疫抑制中释放出来,并抑制调节性T(Treg)细胞,从而激活肿瘤免疫,实现高效的肝癌免疫治疗(图6A)。如图6B所示,在超声(US)刺激下,SSN可以在细胞内同时催化氢气生成和乳酸消耗。SSN通过压电催化产生的氢气可抑制干扰素-γ(IFN-γ)刺激的Hepa 1–6细胞中程序性死亡配体1(PD-L1)的过表达,有望通过靶向PD-L1/PD-1通路激活肿瘤免疫。一方面,压电催化产生的氢气抑制肿瘤细胞上PD-L1的表达,从而释放受免疫抑制的TCD8⁺细胞。另一方面,通过压电催化消耗乳酸可抑制Treg细胞并激活TCD8⁺细胞(图6C)。在28天的治疗期间,接受治疗的小鼠存活率保持在100%(图6D)。治疗结束时,对提取的肝组织进行生物发光成像显示,超声驱动的SSN+超声压电催化治疗几乎完全根除了原位肝肿瘤(图6E)。
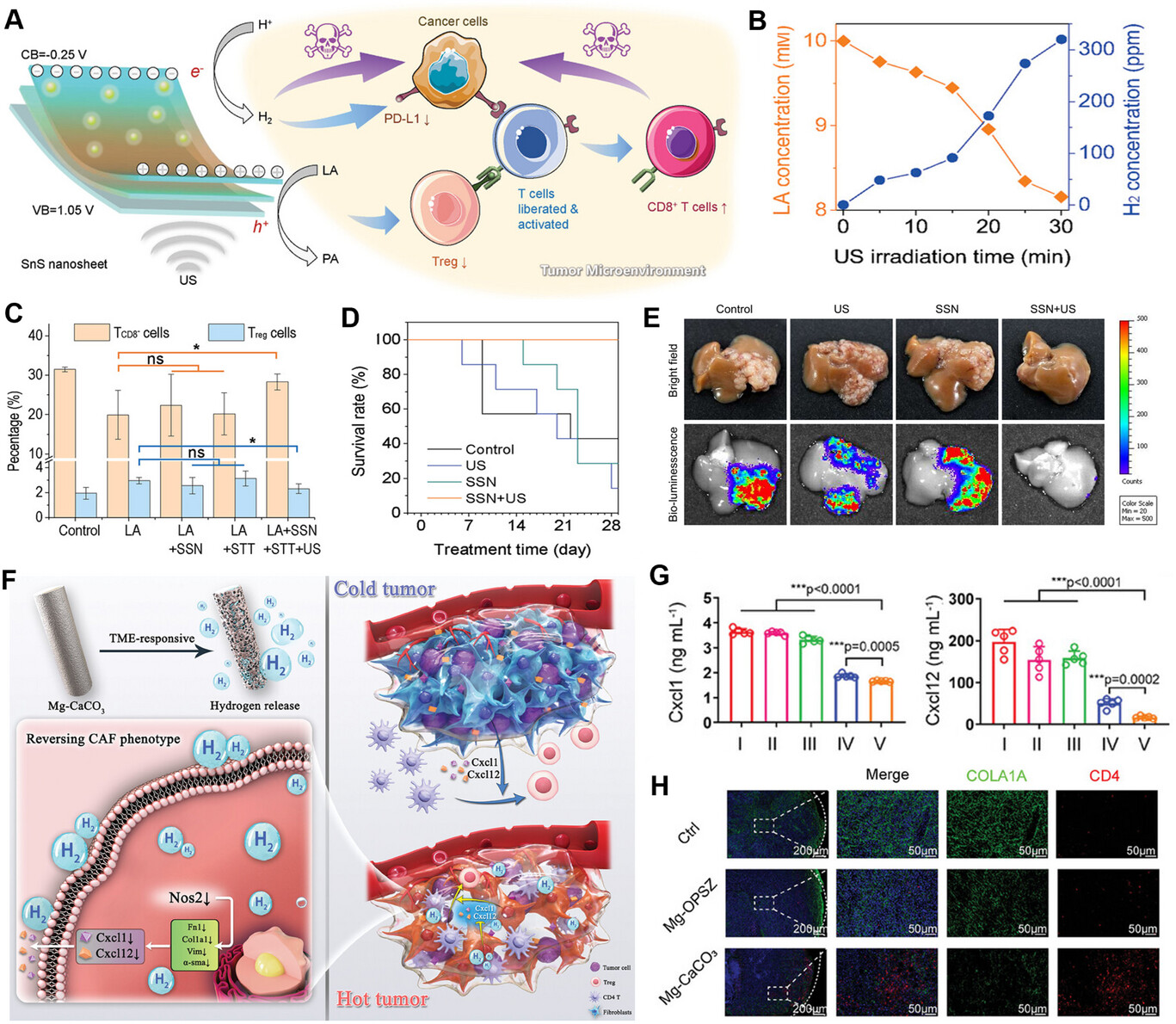
图6
A)硫化锡纳米片介导的压电催化产氢和乳酸剥夺用于肿瘤免疫激活的机制示意图。B)细胞内SSN介导的压电催化产氢和乳酸消耗。C)不同处理组中TCD8⁺和Treg细胞比例的比较。D)肝肿瘤荷瘤小鼠治疗后的存活率。E)治疗28天后 dissected肿瘤的代表性数字照片。经许可转载[70]。2023,Wiley-VCH。F)Mg-CaCO₃重塑肿瘤微环境和抑制肿瘤的机制示意图。G)不同处理后癌相关成纤维细胞(CAFs)上清液中Cxcl1和Cxcl12水平的定量分析。H)不同处理后Balb/c小鼠肿瘤的免疫荧光图像。经许可转载[75]。2024,Wiley-VCH。
针对癌细胞的氢气递送策略已有大量研究,但氢气递送对肿瘤微环境的免疫调节作用仍不明确。癌相关成纤维细胞(CAFs)通过形成药物递送和免疫细胞浸润的物理屏障,同时分泌转化生长因子-β(TGF-β)、白细胞介素-6(IL-6)和趋化因子配体2(CCL2)等因子抑制T细胞活性并招募免疫抑制细胞,在促进肿瘤进展中起着关键作用[126-128]。靶向癌相关成纤维细胞有望增强抗肿瘤免疫并改善治疗效果。孙等人使用涂有碳酸钙的镁棒(Mg-CaCO₃),在弱酸性肿瘤微环境中实现氢气的快速稳定释放(图6F)[75]。释放的氢气减少了癌相关成纤维细胞产生的促肿瘤和免疫抑制因子(Cxcl1和Cxcl12),并增强了CD4⁺T(TCD4⁺)细胞介导的抗肿瘤免疫(图6G、H)。通过逆转癌相关成纤维细胞的促癌表型,该系统可以将“冷”肿瘤转化为“热”肿瘤,最终显示出增强的免疫激活效果。
5.5 抗菌作用
多重耐药(MDR)细菌感染是一个重大的公共卫生挑战,由于抗生素的过度使用导致了严重的耐药性,使得传统的抗菌疗法越来越无效[129,130]。氢气介导的治疗最近在抗感染应用中显示出前景,特别是在细菌感染管理和免疫调节方面[131]。氢气可以增强细菌膜的通透性,促进药物或离子的渗透,同时清除活性氧以减轻炎症反应,为感染控制提供了一种安全且多功能的方法[132]。例如,王等人开发了一种基于金属有机框架的氢气释放平台(Pd(H)@ZIF-8),该平台对幽门螺杆菌(H. pylori)感染具有疗效[133]。在胃部环境中,Pd(H)@ZIF-8分解释放氢气和锌离子(Zn²⁺)(图7A)。氢气破坏细菌膜的完整性,从而增强锌离子的细胞摄取,导致细胞内物质泄漏、代谢紊乱和有效的细菌根除(图7B-D)。余等人进一步利用PdH纳米氢化物进行氢气-光热协同抗菌治疗,显示出强大的抗菌、抗生物膜和伤口愈合特性[131]。从机制上讲,在氧化应激通路中,氢气-光热协同作用上调细菌代谢基因(dmpI、narJ、nark),增加氧化酶的表达,从而提高活性氧水平并导致DNA损伤。在膜损伤通路中,这种协同作用严重破坏细菌膜,促进氢气扩散到细菌内并诱导细胞内DNA泄漏。
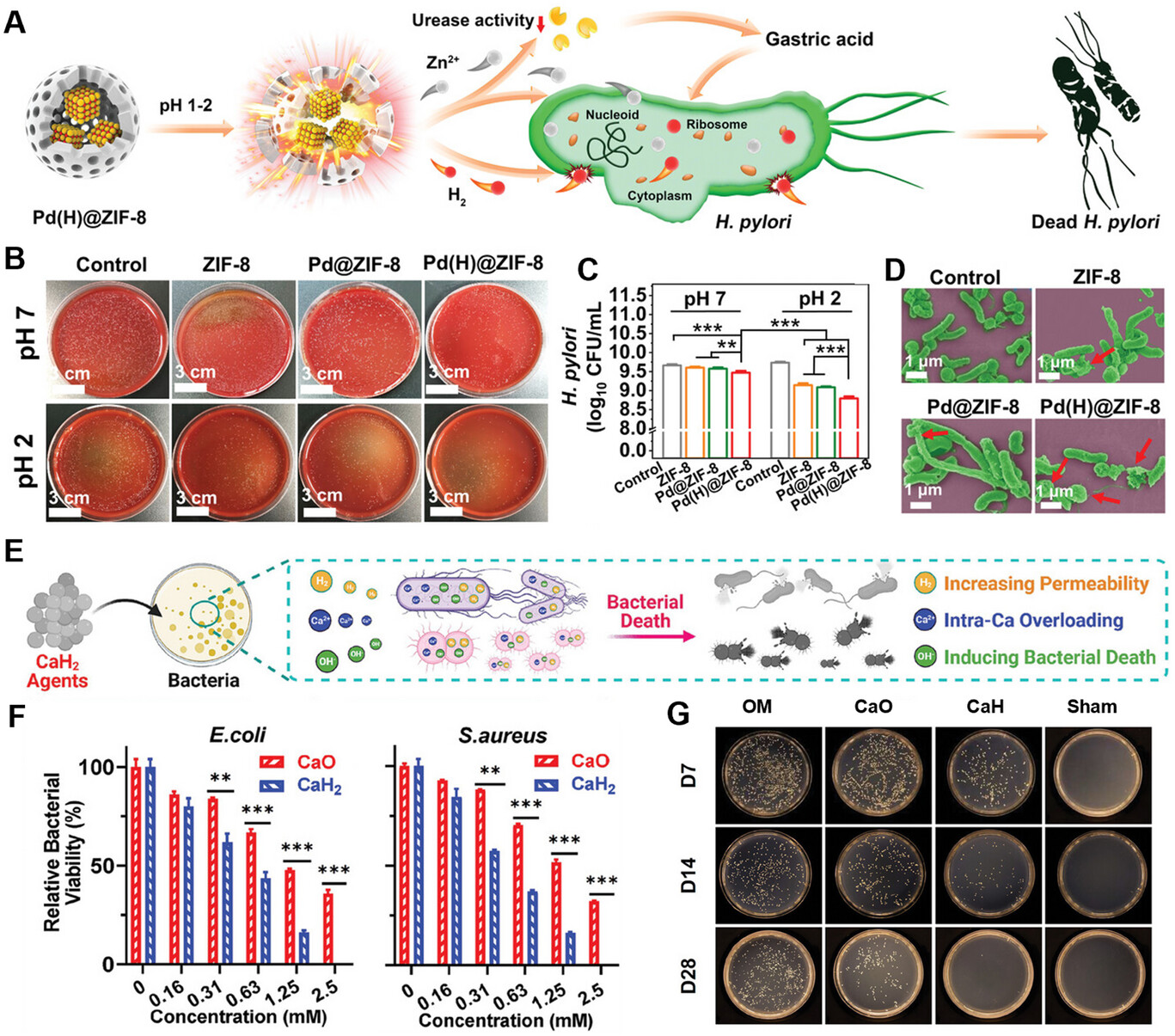
图7
A)Pd(H)@ZIF-8在胃酸条件下的抗菌机制图。B)幽门螺杆菌菌落平板图像和C)不同pH条件下不同样品处理后通过每毫升菌落形成单位(CFUs)计数的幽门螺杆菌生长情况。D)不同处理后幽门螺杆菌的生理形态变化扫描电镜(SEM)图像。E)氢化钙材料的抗菌性能示意图。F)处理后大肠杆菌(E. coli)和金黄色葡萄球菌(S. aureus)的残留百分比。G)处理后骨髓中细菌含量的平板涂布测定。
氢气因其抗炎特性,在治疗败血症等深部细菌感染方面受到广泛关注,这些特性有助于提高生存率,并具有其他生物学效应,包括抗凋亡、抗休克和自噬调节活性[134]。氢气的可控递送和主动推进在管理这些感染方面具有巨大潜力。屠等人开发了基于镁的微电机(Mg-Tob电机),用于盲肠结扎穿孔小鼠模型的败血症体内联合治疗[76]。Mg-Tob电机是通过用可生物降解的聚乳酸-羟基乙酸共聚物(PLGA)层不对称包覆镁微粒,然后再包覆载有妥布霉素的海藻酸钠-壳聚糖水凝胶制备而成,它利用败血症小鼠的腹膜液为镁-水反应提供燃料。在微电机界面持续产生的氢气推动微电机运动,并作为抗炎剂发挥作用。同时,氢气的持续释放实现了抗生素妥布霉素的可控递送,达到双重免疫调节和抗感染治疗效果。同样,一种自推进的Janus镓/镁双金属微电机被设计用于释放氢气,这有助于它突破唾液和龈沟液等生物屏障,到达牙周袋底部,发挥抗菌和抗炎作用[135]。此外,氢化钙可以产生氢气,增强细菌膜的通透性(约1.5倍),促进羟基离子(OH⁻)和钙离子(Ca²⁺)进入细菌(图7E)[136]。由此产生的碱性环境抑制细菌增殖并诱导细菌死亡,而氢气则清除感染区域过量的活性氧。在金黄色葡萄球菌(S. aureus)感染的小鼠胫骨骨髓炎模型中,与氧化钙(CaO)相比,氢化钙显著减少了细菌数量和局部炎症,为骨髓炎等深部组织感染提供了一种更安全、更有效的治疗方法(图7F、G)。这些研究强调了氢气在抗菌治疗中的多维度应用。通过创新的氢气递送平台,在细菌感染中实现了精确的免疫调节,为对抗多重耐药细菌感染提供了治疗选择。
5.6 其他炎症性疾病的调节
慢性肝病(CLDs),包括非酒精性脂肪肝(NAFLD),由于其进行性炎症、纤维化和代谢并发症可导致肝硬化或肝癌,因此治疗难度极大[137,138]。用于慢性肝病的当前治疗方法,如抗炎药物,往往会带来毒性副作用,并进一步加重肝脏负担[139,140]。氢气递送材料的最新发展通过利用氢气的广谱免疫调节特性,提供了一种新的治疗方法。例如,钯(Pd)纳米晶体在肝靶向氢气递送方面显示出前景。这些纳米颗粒经静脉给药后,在肝脏中积累,并在吸入气体时捕获氢气,以PdH的形式将其以固态储存(图8A)[79]。这使得有毒自由基(如·OH)的局部催化氢化成为可能,提高了氢气递送的有效性。氢气在肝脏中的受控释放确保了促炎细胞因子(包括白细胞介素-1β、白细胞介素-6和肿瘤坏死因子-α)水平的显著降低,从而减轻炎症(图8B)。氢气治疗的疗效与其剂量密切相关。由于氢气固有的扩散特性,它无法在肝脏内高浓度积累[141]。因此,向肝细胞靶向且持续释放氢气对于提高治疗效果至关重要,尽管这仍然是一个挑战。在此基础上,何团队创新性地开发了N-(3-三乙氧基甲硅烷基丙基)-葡萄糖酰胺(Glu)修饰的Mg₂Si纳米片(MSN-Glu),通过识别细胞表面的脱唾液酸糖蛋白受体,主动靶向肝细胞,实现向肝细胞的精确氢气递送(图8C)。开发的MSN-Glu纳米颗粒表现出显著的氢气递送能力,达105 mg/g,是饱和富氢水的6.6×10⁴倍,并且在生理条件下可持续释放氢气长达8天(图8D)。体外实验表明,递送的氢气有效阻断了基于血红素的类芬顿反应(图8E)。在非酒精性脂肪肝小鼠模型中,MSN-Glu处理后,作为氧化损伤和脂质过氧化的敏感标志物——丙二醛(MDA)被完全清除,同时谷胱甘肽(GSH)水平恢复正常,表明肝功能得到恢复(图8F、G)。这种靶向递送方法不仅减少了全身副作用,而且在改善慢性肝病的治疗效果方面具有巨大潜力。
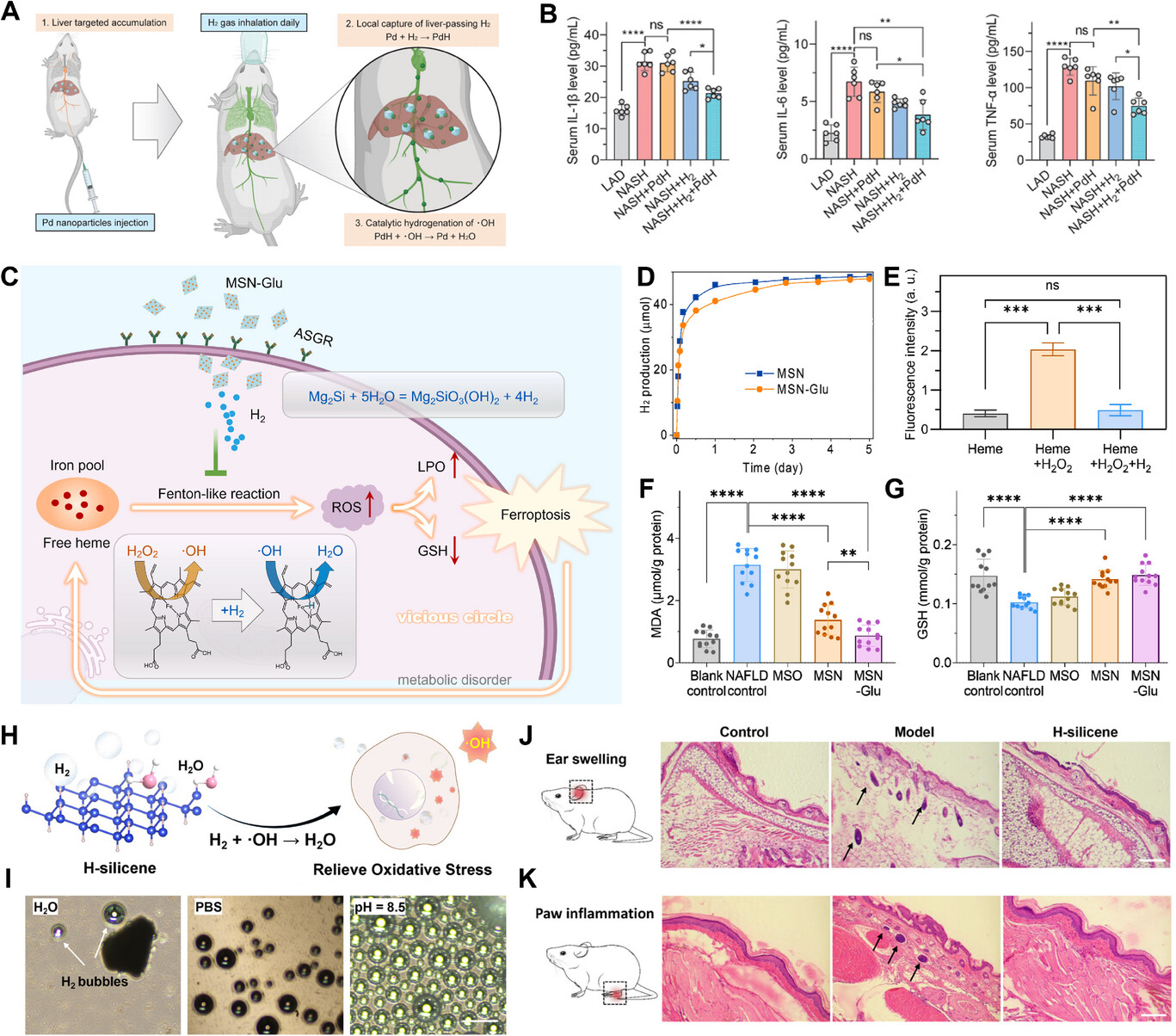
图8
A)钯纳米颗粒在肝脏中局部捕获氢气并催化·OH氢化的治疗策略和机制示意图。B)治疗结束时肝脏切片中血清细胞因子(包括白细胞介素-1β、白细胞介素-6和肿瘤坏死因子-α)的水平。2023,Ivyspring International Publisher。C)MSN-Glu靶向递送氢气以阻断血红素催化的非酒精性脂肪肝恶性循环的示意图。D)MSN和MSN-Glu的氢气释放曲线。E)通过测量细胞内荧光强度定量相对·OH水平。ns,无显著差异。F、G)肝脏丙二醛(F)和谷胱甘肽(G)含量。H)氢硅烯释放的氢气清除氧化应激下细胞中活性氧的示意图。I)氢硅烯与水、PBS和氢氧化钠溶液(pH=8.5)反应过程中产生氢气气泡的光学显微镜图像;比例尺:200µm。J)耳肿胀模型示意图和不同处理后小鼠耳朵的苏木精-伊红(H&E)染色;比例尺:200µm。K)爪炎症模型示意图和不同处理后小鼠足垫的H&E染色;比例尺:200µm。
急性炎症通常会因氧化应激而加剧,其中过量的活性氧起着核心作用[142]。最近的创新包括使用超薄二维硅纳米片,特别是氢硅烯(H-silicene),它在按需产生氢气方面显示出显著潜力[143]。硅虽然储量丰富且成本低廉,但传统上与水的反应速率较低。然而,纳米级硅由于其高表面积和活性位点,表现出显著增强的氢气生成。氢硅烯是一种具有氢化悬空键的硅纳米片,它的开发解决了这一限制(图8H)[84]。这种材料与水剧烈反应,产生大量氢气(图8I)。生成的氢气作为一种强效抗氧化剂,有效清除活性氧,减轻与急性炎症相关的氧化应激。在小鼠耳肿胀和爪炎症模型中,氢硅烯已显示出优异的抗炎效果(图8J、K)。高表面积和活性氢键促进氢气的快速释放,进而保护细胞免受氧化损伤和凋亡。这种能力使氢硅烯成为急性炎症管理的可行候选者,因为在急性炎症中,快速有效地减少活性氧至关重要。此外,氢硅烯的独特特性不仅限于氢气生成。其高生物相容性和无毒的副产品(主要是二氧化硅)确保了它适合治疗用途。这使其成为治疗一系列炎症性疾病的有吸引力的选择,在这些疾病中,快速且局部的氢气递送可以提供显著缓解。总之,先进氢气递送系统的发展,特别是通过使用氢硅烯等二维硅纳米片,代表了在急性炎症管理方面的重大进步。这些系统为高效、安全地递送氢气提供了一种有前景的方法,满足了炎症相关疾病中有效免疫调节的需求。
6 结论与展望
总之,氢气递送为精准免疫调节提供了一种有前景的方法,能有效减轻各种疾病中的氧化应激并调节炎症反应。最近的进展,特别是铁卟啉作为氢气生物靶点的发现,揭示了氢气在治疗各种疾病方面具有治疗潜力的根本原因。这一发现不仅加深了我们对氢气生物医学效应的理解,也为氢气递送系统的个性化设计提供了理论基础。通过提高靶向准确性、生物安全性和成像能力,该领域有望提高氢气递送的有效性,为当前难以治疗的疾病带来创新解决方案。
在纳米技术的推动下,智能氢气递送系统能够实现可控、靶向和刺激响应性的氢气释放,在调节免疫相关疾病方面具有显著的治疗潜力。尽管取得了这些令人鼓舞的进展,氢气递送用于免疫调节的临床转化仍面临挑战。未来的研究重点包括提高氢气递送材料的生物安全性、优化递送机制以增强靶向性,以及理解氢气在不同疾病状态下的剂量依赖性治疗效果。此外,整合实时监测技术以精确控制氢气释放及其治疗效果是一个有待探索的领域。未来的努力还应集中在开发用于氢气检测的亚细胞成像技术,以及探索阻断涉及铁/锰/锌卟啉的类芬顿反应的可行性,这可能会影响慢性炎症疾病的进展。此外,开发结合诊断、治疗和实时监测的智能多功能氢气递送系统,将为未来更有效的基于氢气的治疗铺平道路。通过提高靶向准确性、生物安全性和成像能力,该领域有望提高氢气递送的有效性,为当前难以治疗的疾病带来创新解决方案。
Acknowledgements
This work was supported by the National Natural Science Foundation of China (52473148 and 52473265), the Key Research and Development Program of Shaanxi (2024SF-YBXM-438), the Natural Science Foundation of Chongqing (CSTB2023NSCQ-MSX0225) and Shaanxi Provincial Science Fund for Distinguished Young Scholars (2023-JC-JQ-32).
李鹏教授

转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1494537.html?mobile=1
收藏

