 精选
精选
一种抗原呈递细胞亚型可抑制早期对食物抗原的免疫反应
在人的一生中,每个人都会接触到通过皮肤、肺部和肠道进入体内的外来抗原。特别是在生命早期,人们会摄入许多新型食物,并接触到定植于黏膜组织的微生物。免疫系统如何学会“耐受”外来抗原,同时又能对病原病毒和细菌等其他威胁保持快速反应,这仍是免疫学中一个尚未解决的问题。
在本期《科学》杂志第268页,Cabric等人(1)描述了这一谜题的关键部分。作者在小鼠的肠系膜淋巴结中发现了一种抗原呈递细胞(APC)亚型,这种细胞有助于训练调节性T细胞(Treg细胞),从而在断奶前后抑制对食物抗原的炎症反应。这一APC亚型的发现可能为开发食物相关过敏和炎症疾病的疗法打开大门。
对摄入的无害外来抗原的口服耐受,是避免过度免疫反应(导致肠道炎症、食物过敏或乳糜泻——一种针对饮食中麸质的肠道自身免疫反应)的关键(2)。Treg细胞是口服耐受的重要介质。它们由在肠道引流淋巴结中对食物和共生菌抗原具有特异性的初始T细胞(表达CD4+的细胞)分化而来。这些抗原特异性Treg细胞随后迁移回肠道,阻止其他免疫细胞对这些抗原发起破坏性反应。长期以来,初始CD4+T细胞如何被诱导成为食物特异性Treg细胞一直不明确,不过近期的研究(3-7)已开始指向候选的APCs。
最近发现,肠道中存在能诱导Treg细胞分化并对肠道微生物成分产生耐受的APCs(2)。它们的标志是表达视黄酸受体相关孤儿受体γ转录因子(RORγt)的一种亚型,该因子对多种免疫细胞的分化和功能至关重要(8)。在口服耐受的背景下,这些APCs通过多种标准被识别,并被赋予了不同的名称,包括RORγt+APCs(6)、RORγt+树突状细胞(4、9)、胸腺外AIRE表达细胞(7)以及表达PR结构域蛋白16的耐受型树突状细胞(5)。尽管这些研究大多集中在实验室小鼠身上,但在人类肠道引流淋巴结中也能发现看似等效的APCs(5、10、11)。然而,在小鼠和人类中发现的各种APC类型的重叠程度,以及它们的命名共识,仍有待确定。
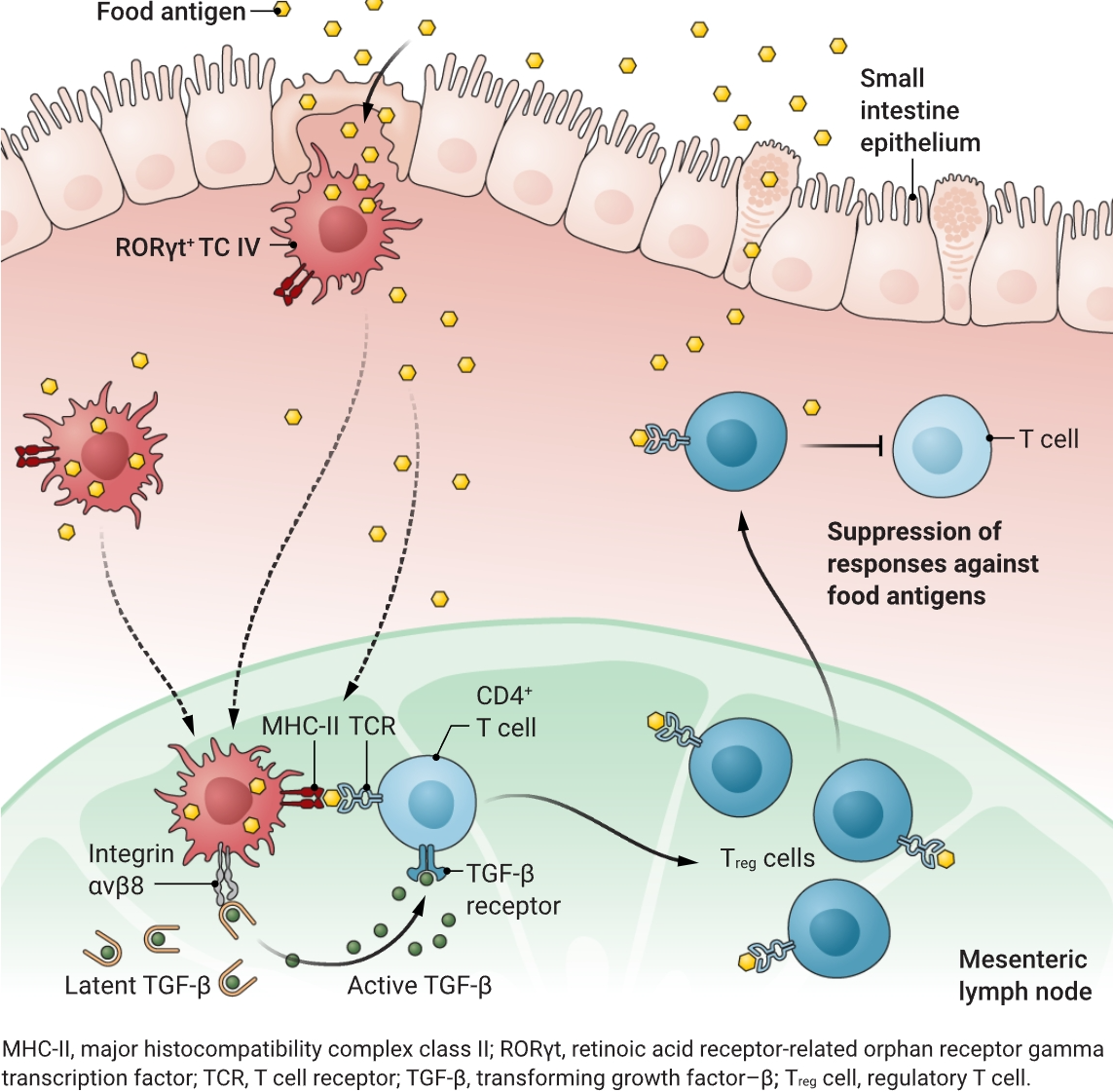
Cabric等人将其称为忒提斯细胞(TCs),他们对小鼠体内的RORγt+APCs进行了全面分析,发现其中一些细胞不仅参与共生菌特异性Treg细胞的分化,还参与识别食物抗原的Treg细胞的分化。忒提斯细胞有多种类型,作者发现,仅存在于肠道和肠道引流淋巴结中的RORγt+TC IV亚型,对食物特异性Treg细胞的发育至关重要。他们发现,TC IV亚型表达整合素αVβ8异二聚体蛋白、主要组织相容性复合体II类(MHCII)、视黄醛脱氢酶2和干扰素调节因子8(11)。作者还观察到,TC IV能轻易摄取通过灌胃方式给予小鼠的卵清蛋白抗原。通过追踪注入卵清蛋白灌胃动物体内的OVA特异性CD4+T细胞,Cabric等人注意到,当RORγt+细胞缺乏MHC-II时,肠系膜淋巴结中OVA特异性CD4+T细胞向Treg细胞的转化就会消失。这导致小鼠在再次接触卵清蛋白时出现肠道炎症。这种反应归因于辅助性T细胞对抗原的失控反应,包括释放细胞因子以激活其他免疫细胞来对抗威胁。此外,通过口服灌胃对卵清蛋白产生耐受的小鼠,在随后经鼻给予该抗原时,也能避免发生肺部炎症。
呈递食物抗原
小肠中的细胞对食物抗原进行取样后,这些抗原会被RORγt+忒提斯细胞IV亚型(TC IV)摄取。这些细胞在MHC-II上向肠系膜淋巴结中的初始CD4+T细胞呈递抗原。随后,活化的TGF-β驱动初始CD4+T细胞分化为Treg细胞。这些Treg细胞迁移回肠道,抑制对食物抗原的免疫反应,从而减少炎症和食物过敏的发生。
图表来源:K. HOLOSKI/SCIENCE
值得注意的是,Cabric等人发现,小鼠体内TC IV的数量在断奶期达到最多,而这一时期免疫系统的免疫激活阈值更高(12)。这为诱导口服耐受、减少食物过敏提供了一个机会窗口(13)。一种解释可能是,TC IV还能减弱对肠道病原体的反应。因此,它们在生命早期后数量减少,可能是一种策略,既能在生命后期加强对感染的保护,又能满足出生后关键时期对食物和共生菌产生耐受的需求。
这些TC IV是如何诱导初始CD4+T细胞优先分化为Treg细胞的呢?Cabric等人发现,TC IV表达整合素αVβ8,这是将潜在转化生长因子-β(TGF-β)转化为活性形式的关键。通过使用骨髓嵌合小鼠(骨髓被来自另一小鼠的骨髓替代),作者发现,RORγt+细胞要在肠系膜淋巴结中刺激Treg细胞的发育,既需要抗原呈递,也需要潜在TGF-β的转化(见图)。目前尚不清楚TC IV的其他特征是否也有助于触发Treg细胞的产生。
Cabric等人的发现挑战了一种传统观点,即树突状细胞(参与大多数CD4+T细胞反应调控的主要APC)是促进口服耐受的关键。作者报告称,树突状细胞在刺激口服抗原特异性Treg细胞的发育方面并非必需,但在TC IV的调控下,树突状细胞似乎在维持那些正朝着Treg细胞命运分化的早期抗原经验性CD4+T细胞方面发挥作用。
未来的研究需要评估食物特异性Treg细胞和耐受性反应能维持多久,以及已建立的耐受性是否可以被打破。此外,确定TC IV如何以及在何处获取抗原,以及它们在频繁摄入少量食物抗原与少数几次高剂量抗原暴露(如实验中的卵清蛋白)时的反应有何不同,也将是一件有趣的事。探索当已经存在针对相同抗原的致敏性炎症辅助性T细胞时,或者在接触新食物抗原的同时发生感染或接受抗生素治疗的情况下,如何产生食物特异性Treg细胞,也将极具意义。在这种情况下,可能是诱导Treg细胞产生的APCs与启动促炎性辅助性T细胞的APCs之间的平衡,决定了耐受性是维持还是被打破(3)。探索肠道中促进Treg细胞产生的APCs在人类中的功能是否与在小鼠中相同,以及是否可以在临床上利用口服耐受来改善自身免疫、移植排斥和神经炎症,这些都将是重要的研究方向。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1494170.html?mobile=1
收藏

