 精选
精选
日本在氢气生物医学研究,特别是氢气应用于血液透析技术方面有非常领先的技术,10多年前就已经开展了大量临床试验,明确了氢气溶解于血液透析液中对于改善血透患者透析导致的各种副作用,例如血压不稳定,皮肤瘙痒等都有不同程度的改善。但是这些试验存在一个共同的不足,那就是氢气浓度非常低,远低于普通氢水中氢气浓度。这显然会限制和制约该技术的效果。日本最新用��做的这一新技术探索,把氢气溶解度显著提高到几乎饱和浓度,我强烈相信,将来用于临床血液透析患者,将会产生非常显著的效果。这一新技术将会给血液透析患者们带来福音。当然这一所谓新技术,从技术难度来说,也并不复杂,临床上血液透析和体外循环和膜肺等都广泛使用,当然这些技术主要用于氧气的溶解,这里只不过是用于氢气的溶解。
采用创新直接溶解技术在透析期间递送高浓度氢气:犬模型中的在体动力学研究
摘要
氢气(H₂)具有广泛的治疗潜力。血液透析过程中会使用大量与血液接触的透析液,这为氢气递送提供了一种颇具前景的方法。我们研发了一种创新系统来生成富氢透析液,该系统与传统电解法不同,它通过将氢气直接溶解到自来水中产生饱和水,随后对其进行反渗透(RO)处理以制备透析液。在单只犬的血液透析模型中使用该系统时,我们对氢气浓度进行了测量,结果显示氢气水平维持在较高且稳定的状态(反渗透水中约为1600 ppb;最终透析液中稳定在约230 ppb)。氢气能高效扩散到体外血液循环回路中,出口处的浓度达到透析液浓度的54.0%-67.7%。然而,全身动脉(肺动脉、颈动脉)中的氢气浓度较低,这表明肺部对氢气有显著的清除作用,意味着氢气主要在回路和透析器内发挥局部作用。与传统电解水方法相比,这种直接溶解系统能递送更高且更稳定的氢气浓度。其设计更简单,安装成本可能更低,这表明它有望在临床上广泛应用。未来的研究应探索血液透析滤过(HDF),以潜在增强全身性氢气递送,并评估其长期临床效益。

2007年,Ohsawa等人[1]关注到氢气(H₂)温和的还原能力,发现它能够选择性清除有害的活性氧(ROS),同时对生物信号传导所必需的活性氧影响极小。他们进一步报道,氢气可通过减轻脑缺血再灌注损伤过程中产生的大量羟基自由基(OH•),缩小梗死面积[1]。随后,众多临床试验表明,氢气在治疗从急性到慢性的多种疾病方面均有疗效[2]。人们已探索出多种氢气递送方法,包括吸入氢气、饮用富氢水、注射富氢盐水以及泡富氢水浴[3]。
日本维持性血液透析(HD)患者的数量已接近峰值,但由于人口老龄化以及基础疾病模式的转变,重症患者的患病率正不断上升[4]。尽管血液透析能够防止患者因肾衰竭死亡,但这种人工器官治疗的非生理性不可避免地会引发慢性炎症和氧化应激[5]。这些因素会导致患者出现与血液透析相关的主观症状,如不适和疲劳,还可能引发血液透析相关并发症[6]。因此,血液透析患者的平均预期寿命约为同龄健康人的一半,这是一个亟待解决的严峻挑战[6]。鉴于全球范围内器官捐献者持续短缺,许多患者仍不得不依赖血液透析[7]。人们已多次尝试改善血液透析回路和透析器与生物机体的相互作用,但这些尝试并未充分改善患者的预后[8]。在微生物管理方面,研究重点集中在去除内毒素(一种已知的慢性炎症触发因素)上,这促使水和透析液的净化标准不断提高[9]。
鉴于每次血液透析都会使用大量透析液,且透析液通过半透膜与血液持续接触,使透析液富含氢气或许是一种很有前景的治疗策略。现有的一种方法是使用由电解水制备的透析液[10,11]。2005年,东北大学医学院与日本Trim公司(日本大阪市北区)联合开展研究项目,启动了电解水透析技术[12,13]。这种方法将阴极电解水(在阴极电解得到的水)经反渗透处理后作为透析稀释用水。最近有研究表明,电解水透析的治疗效果可归因于其中溶解的氢气[14]。先前的研究证实,电解水透析能有效降低慢性血液透析患者的氧化应激和炎症标志物(如白细胞介素-6、髓过氧化物酶),并改善临床指标(如高铁血红蛋白水平、淋巴细胞凋亡情况、高血压)[15,16]。此外,一项非随机、非盲法的前瞻性观察性研究表明,电解水透析可能有助于降低慢性血液透析患者的全因死亡率以及非致命性心脑血管事件的发生率[17-20]。我们研发了一种生成富氢透析液的新型系统,该系统不采用传统方法中的水电解工艺,而是通过直接溶解氢气来制备饱和氢自来水。随后,这种饱和氢自来水被处理成富氢反渗透水,用于制备透析液。我们使用该系统对一只犬进行了富氢透析液透析,并测量了透析液中、血液循环回路进出口处以及身体不同部位血液样本中的氢气浓度。
材料与方法
富氢透析液的制备
我们研发了一个新型装置来生成饱和氢自来水,该装置由氢气发生器(H2JI1;Doctor’s Man公司,日本横滨市青叶区)和气体分离中空纤维膜组件(PF-004D;DIC公司,日本东京都板桥区)组合而成(图1)。该装置在约100 kPa的压力下使自来水饱和氢气。使用溶解氢测定仪(SGHA-P3-A;NISSHA FIS公司,日本大阪市淀川区)和溶解氧测定仪(DO-31P;DKK-TOA公司,日本东京都新宿区)分别测量氢气和氧气的浓度。经过净化和加压的自来水被输送至使用点。在加压之前,自来水与大气接触,因此溶解气体的浓度与大气压相对应。根据亨利定律,加压可使更多气体溶解,理论上溶解量可达表压(输送压力)水平(表1)[21]。我们采用吸入法,使氢气压力低于水压,以避免输送过程中产生气泡(图2)。这种方法利用高速流动的水在中空纤维管腔内产生的压降,促进氢气从纤维周围的气相溶解到水中。将这种饱和氢自来水送入个人透析用水制备设备(MH500CX;日本水系统公司,日本东京都中央区),以生成富氢反渗透水。然后,将这种富氢反渗透水输送至个人多功能透析机(DBB-100NX;日机装公司,日本东京都涩谷区)用于制备透析液。
Table 1. - Relationship Between Hollow Fiber Internal Pressure and Dissolved Hydrogen Gas Amount at a Water Temperature of 20°C
Tap Water Pressure | Atmospheric Gas Dissolution Section | Hydrogen Gas Dissolvable Section | ||||
Gauge Pressure (kPa) | Absolute Pressure (kPa) | Absolute Partial Pressure (kPa) | Oxygen (ppm) | Nitrogen (ppm) | Absolute Partial Pressure (kPa) | Dissolvable Hydrogen (ppm) |
40 | 141.3 | 101.3 | 8.86 | 15.70 | 40 | 0.65 |
50 | 151.3 | 101.3 | 8.86 | 15.70 | 50 | 0.81 |
60 | 161.3 | 101.3 | 8.86 | 15.70 | 60 | 0.97 |
80 | 181.3 | 101.3 | 8.86 | 15.70 | 80 | 1.30 |
100 | 201.3 | 101.3 | 8.86 | 15.70 | 100 | 1.62 |
120 | 221.3 | 101.3 | 8.86 | 15.70 | 120 | 1.94 |
140 | 241.3 | 101.3 | 8.86 | 15.70 | 140 | 2.27 |
160 | 261.3 | 101.3 | 8.86 | 15.70 | 160 | 2.59 |
180 | 281.3 | 101.3 | 8.86 | 15.70 | 180 | 2.92 |
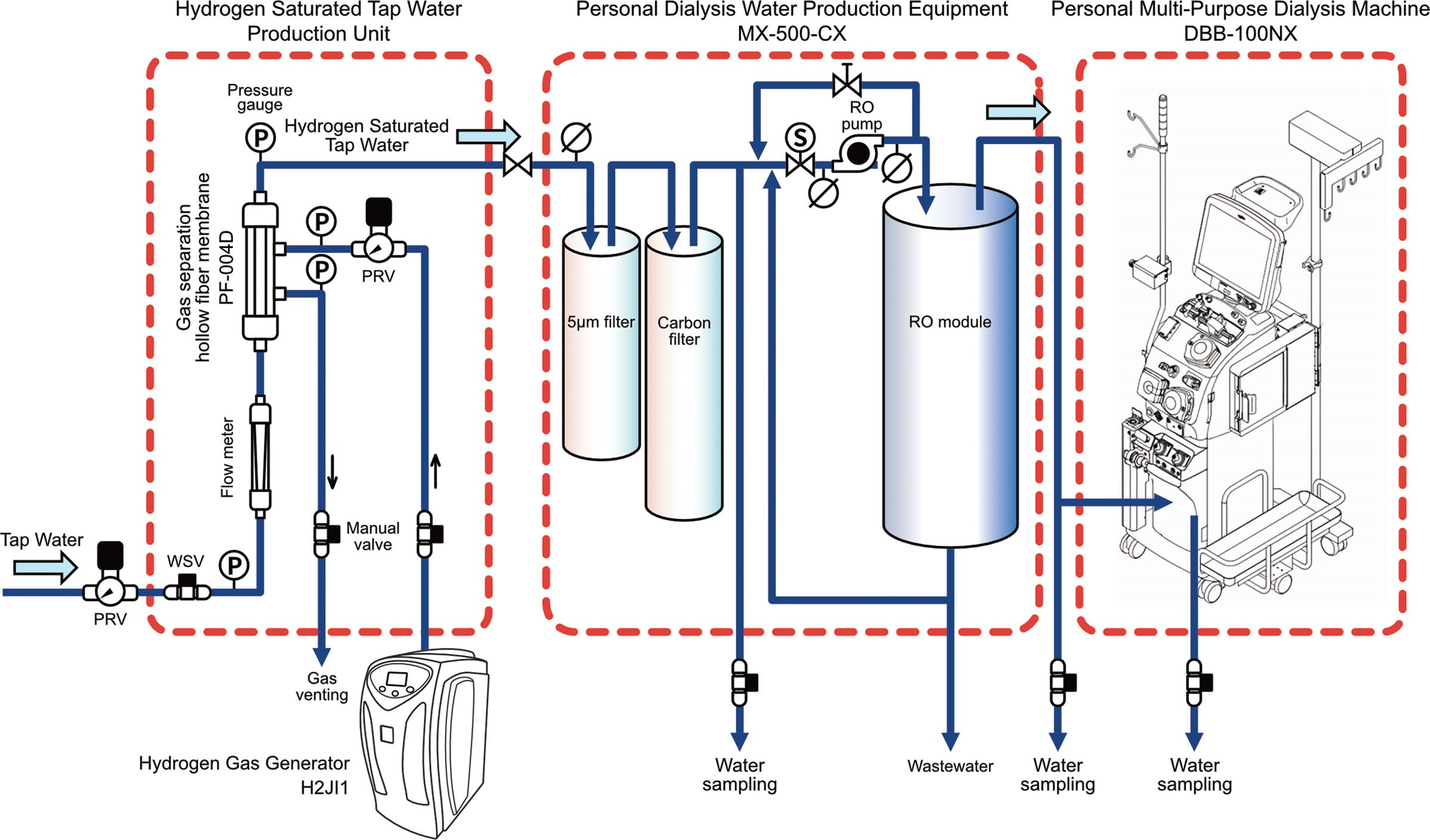
图1. 富氢透析液生成系统示意图。(组件:氢气溶解单元、个人透析用水制备设备、个人多功能透析机)。PRV,减压阀;RO,反渗透;WSV,止水阀。

图2. 吸入法和输送法;吸入法中,氢气压力保持低于水压。输送法中,氢气压力保持高于水压。
动物模型
所有实验流程均在一只12月龄、体重13公斤的雌性TOYO比格犬身上进行,实验过程中犬处于全身麻醉状态。本实验方案已获得山口大学机构动物护理和使用委员会的批准(批准号:619),并按照该大学的动物处理指南进行操作。经皮在桡侧皮静脉放置静脉导管。通过推注丙泊酚(7毫克/公斤;辉瑞日本公司,东京都涩谷区)诱导麻醉,气管插管后用异氟烷(1-2 MAC;大日本住友制药株式会社,大阪市中央区)维持麻醉。呼吸管理采用手动或机械通气(Apollo;德尔格日本医疗公司,东京都品川区)。为建立血液透析通路,在颈部进行无菌准备后,做纵向颈部切口,暴露右侧颈总动脉(RCCA)和颈总静脉。将血液通路导管(6512-20W;柯惠日本公司,东京都港区)插入右侧颈总静脉,推进至前腔静脉,用于透析通路。将16G导管(UA-1627-S;日机装公司,大阪市摄津市)插入右侧颈总动脉,然后关闭切口。此外,经皮将5Fr鞘管(RR-AC5D03S;泰尔茂公司,东京都涩谷区)插入左侧颈总静脉,并将Swan-Ganz导管(132F5;爱德华兹生命科学公司,美国加利福尼亚州欧文市)推进至肺动脉(PA)。持续监测麻醉、呼吸、循环和体温。透析前进行全身计算机断层扫描(CT)(Supria 64层;日立医疗公司,千叶县柏市)和头部磁共振成像(MRI)(APERTO Inspire,0.4T;日立医疗公司)。CT使用的造影剂为碘帕醇(555mgI/1.5毫升;光制药株式会社,东京都台东区),MRI使用的造影剂为钆特醇(0.1毫升/公斤;博莱科日本公司,东京都丰岛区),均通过静脉注射给药。进行头部MRI是为了排除与氢气给药可能相关的脑栓塞风险。透析后,让动物从麻醉中恢复,由兽医评估其神经状态。次日重复进行神经评估、全身CT和头部MRI检查。
氢气浓度测量
采用气相色谱仪(mBA-3000;太阳公司,大阪市城东区)测量透析液和血液样本中的氢气浓度。测量透析液时,用250微升汉密尔顿注射器(1725LTN;汉密尔顿公司,美国内华达州里诺市)从透析液入口管路采集100微升样本。同时,从四个部位采集1毫升血液样本:肺动脉、右侧颈总动脉、血液循环回路入口(动脉管路,血液入口)和血液循环回路出口(静脉管路,血液出口)。每个部位的样本均由专门人员同步采集。
富氢透析液透析操作
使用DBB-100NX透析机、透析回路(NV-Y1002P;日机装公司)、透析器(FX-100:聚砜膜,面积1.0平方米,超滤率(UFR)为113毫升/千帕/小时;费森尤斯医疗日本公司,福冈县浮羽市)和透析浓缩液(Kindaly AF5;扶桑药品工业株式会社,大阪市中央区)进行透析。使用肝素钠(日机装公司)作为抗凝剂(初始推注:500单位,持续输注:500单位/小时)。血液透析进行4小时,血流量(Qb)为50毫升/分钟,透析液流量(Qd)为100毫升/分钟,不进行超滤。为使透析液流量达到300毫升/分钟(最低设定速率),使用输液泵分流200毫升/分钟的透析液。用生理盐水(大塚制药工厂,德岛县鸣门市)预充血液循环回路。血液循环回路的预充量为85毫升,透析器的预充量为47毫升。在透析前、透析期间的5、10、15、30、60、120和240分钟以及透析后5分钟测量透析液中的氢气浓度。在相同时间点从肺动脉、右侧颈总动脉、血液入口和血液出口采集用于测量氢气浓度的血液样本(图3)。
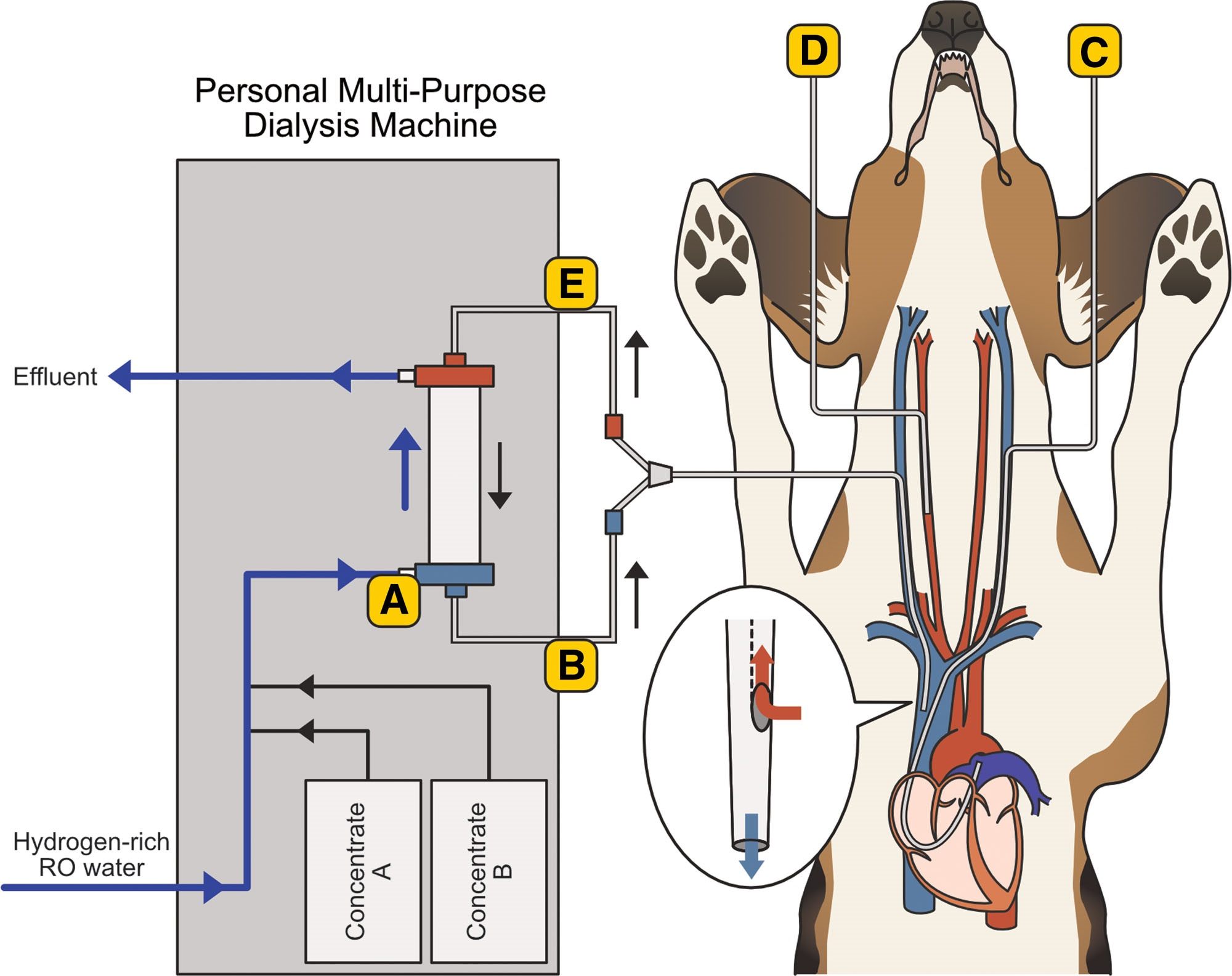
图3. 样本采集部位(A:透析液,B:血液出口侧,C:肺动脉,D:右侧颈总动脉,E:血液入口侧)。RO,反渗透。
结果
透析液制备特点
表2总结了在不同氢气供应压力下,透析液制备过程不同阶段测量的氢气和氧气浓度。为使反渗透水中的溶解氢浓度维持在约1600 ppb(100千帕下的饱和浓度),中空纤维膜的出水压力保持在200千帕(估计膜的压力损失为30千帕)。氢气供应压力调节在125至150千帕之间。尽管氢气供应压力增加,饱和氢自来水中的溶解氧浓度仍保持相对稳定(约4400-4800 ppb)。即使饱和氢自来水中的溶解氢浓度维持在约1600 ppb,最终透析液中的浓度仍稳定在约230 ppb。这一浓度降低归因于透析机内置的真空脱气功能(-73千帕或-550毫米汞柱)。
透析期间的血流动力学和呼吸参数 整个手术过程中对生命体征(血压、心率、经皮血氧饱和度[SpO₂])进行了监测(表3)。麻醉诱导后,持续输注多巴胺(2.4-4.8μg/kg/min;泰尔茂公司)和去甲肾上腺素(0.03-0.22μg/kg/min;阿尔弗雷萨制药公司,大阪市中央区)以维持血压;透析开始后未改变输注速率。透析开始时血压为118/67mmHg,但开始后不久降至92/50mmHg,因此需要输注羟乙基淀粉130000(67.5ml;费森尤斯卡比日本公司,东京都品川区),1小时后预防性地进行了第二次输注。在儿茶酚胺和羟乙基淀粉的支持下,透析期间血压保持稳定(表3)。动脉血气分析显示,术中pH值稳定(例如,透析1小时时pH为7.32,透析4小时时pH为7.31)。 透析后恢复后的神经功能评估未发现异常。这只犬表现出正常行为、完整的颅神经功能、适当的姿势反应和生理性脊髓反射。次日重复进行的CT和头部MRI扫描未发现栓塞和脑梗死迹象。
Table 2. - Relationship Between Hydrogen Gas Supply Pressure and Hydrogen and Oxygen Concentrations in the Hydrogen-Enriched Tap Water Production Unit, Personal Dialysis Water Production Equipment, and Personal Multi-Purpose Dialysis Machine
Time Points of Measurement (min) | Hydrogen Dissolution Unit | Hydrogen Gas Supply Pressure (kPa) | RO Equipment | Dialysate | |||||||
Water Temperature (°C) | Inlet Pressure (kPa) | Inlet Pressure (kPa) | Pump Pressure (kPa) | Outlet Pressure (kPa) | RO Flow Rate (L/min) | RO Purity (mS/m) | RO Hydrogen Concentration (ppm) | RO Oxygen Concentration (ppm) | Hydrogen Concentration (ppm) | ||
0 | 18 | 240 | 125 | 170 | 640 | 180 | 0.7 | 0.16 | 1.66 | 4.8 | 0.22 |
30 | 18 | 240 | 130 | 180 | 630 | 190 | 0.7 | 0.16 | 1.68 | 4.8 | 0.23 |
60 | 18 | 240 | 130 | 180 | 630 | 170 | 0.7 | 0.15 | 1.60 | 4.7 | 0.23 |
120 | 17 | 240 | 140 | 180 | 640 | 160 | 0.7 | 0.15 | 1.77 | 4.4 | 0.33 |
180 | 18 | 240 | 140 | 180 | 640 | 190 | 0.6 | 0.15 | 1.58 | - | - |
240 | 18 | 240 | 150 | 180 | 640 | 190 | 0.7 | 0.15 | 1.92 | 4.7 | 0.24 |
Post (5 min) | - | - | - | - | - | - | - | - | - | - | 0.20 |
Table 3. - Changes in BP, RA, PA, HR, and SpO2 During Dialysis
Time Points for Monitoring (min) | BP (mm Hg) | RA (mm Hg) | PA (mm Hg) | HR (bpm) | SpO2 (%) | ||||||
s | d | m | s | d | m | s | d | m | |||
Pre | 118 | 67 | 80 | 8 | 2 | 4 | 18 | 9 | 14 | 96 | 97 |
5 | 92 | 50 | 61 | 7 | 2 | 4 | 18 | 8 | 12 | 101 | 98 |
10 | 100 | 57 | 68 | 7 | 2 | 5 | 18 | 9 | 13 | 100 | 97 |
15 | 100 | 53 | 66 | 8 | 2 | 4 | 19 | 9 | 14 | 100 | 97 |
30 | 103 | 54 | 67 | 8 | 2 | 4 | 20 | 10 | 14 | 105 | 97 |
60 | 102 | 57 | 69 | 8 | 2 | 4 | 21 | 10 | 15 | 117 | 97 |
90 | 98 | 56 | 68 | - | - | - | - | - | - | 111 | 97 |
120 | 93 | 55 | 65 | 7 | 3 | 4 | 19 | 8 | 13 | 107 | 97 |
150 | 123 | 69 | 83 | - | - | - | - | - | - | 89 | 96 |
180 | 97 | 59 | 69 | - | - | - | - | - | - | 107 | 96 |
210 | 94 | 59 | 68 | - | - | - | - | - | - | 117 | 96 |
240 | 105 | 60 | 72 | 7 | 3 | 4 | 18 | 6 | 11 | 106 | 99 |
Post (5 min) | 94 | 54 | 64 | 7 | 3 | 4 | 16 | 7 | 11 | 108 | 98 |
BP, blood pressure; d, diastolic; HR, heart rate; m, mean; PA, pulmonary artery pressure; RA, right atrial pressure; s, systolic; SpO2, transcutaneous oxygen saturation.
Table 4. - Changes in Hydrogen Concentrations in Dialysate and Blood (ppb)
Pre | Time (min) | 5 min After | |||||||
5 | 10 | 15 | 30 | 60 | 120 | 240 | |||
Dialysate | 65.1 | 236.7 | 240.5 | 263.9 | 256.2 | 254.9 | 280.6 | 356.2 | 258.3 |
Blood outlet side | 35.0 | 139.7 | 157.6 | 170.8 | 171.0 | 172.5 | 184.9 | 192.6 | 40.2 |
PA | 1.1 | 3.4 | 2.9 | 5.4 | 4.8 | 4.2 | 6.3 | 7.4 | 4.4 |
RCCA | 0.2 | 0.3 | 0.4 | 0.1 | 0.2 | 0.5 | 0.2 | 0.3 | 0.2 |
Blood inlet side | 7.3 | 27.0 | 4.9 | 6.9 | 10.5 | 0.5 | 1.5 | 2.3 | 10.3 |
PA, pulmonary artery; RCCA, right common carotid artery.
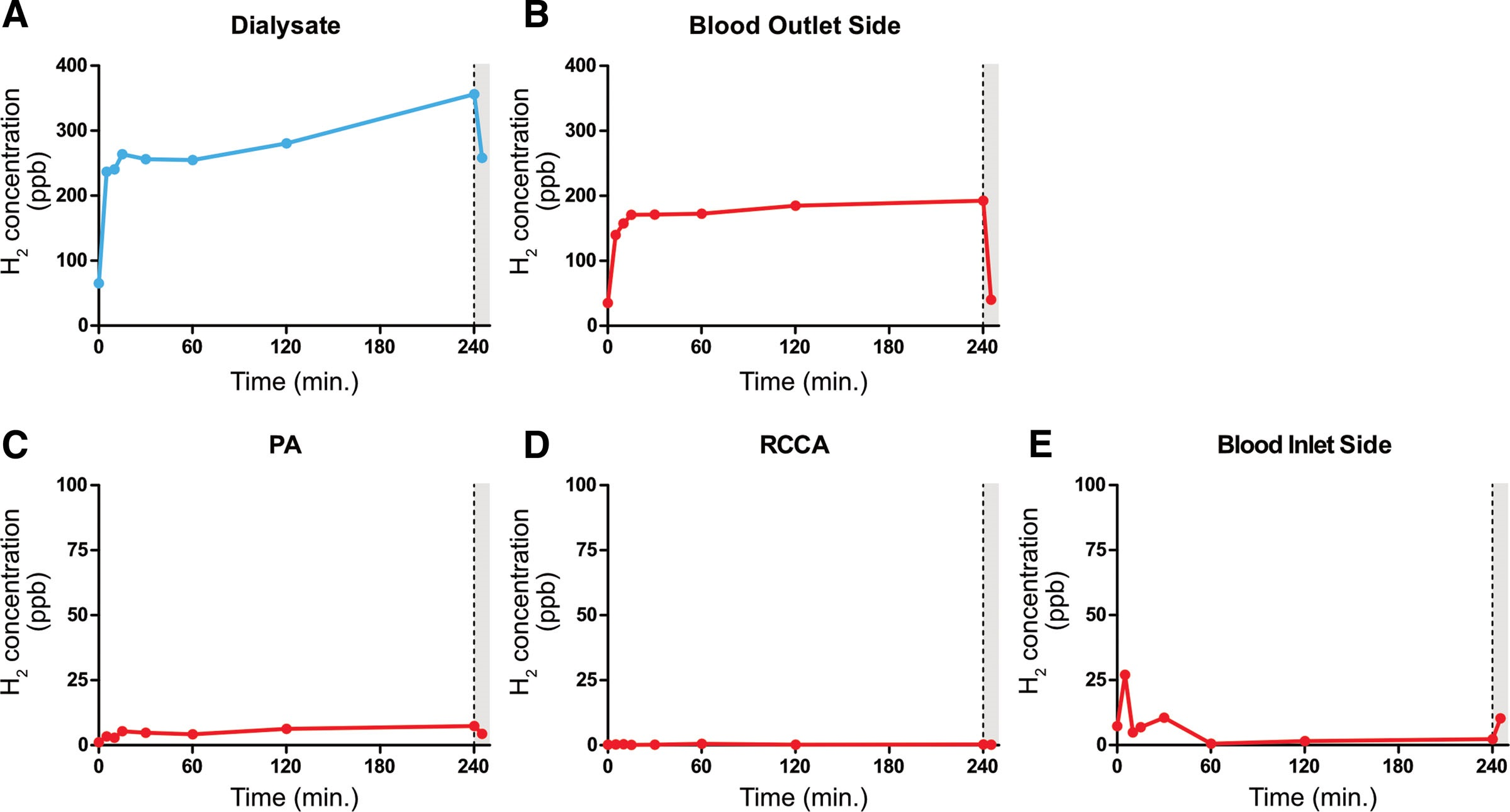
图4. 透析期间透析液和血液各部分中氢气浓度(ppb)随时间的变化。A:透析液。B:血液出口侧。C:肺动脉。D:右侧颈总动脉。E:血液入口侧。虚线表示透析结束。PA,肺动脉;RCCA,右侧颈总动脉。
透析液和血液中的氢气浓度
表 4 和图 4 总结了在特定时间点(透析前;透析期间 5、10、15、30、60、120、240 分钟;透析后 5 分钟)测量的氢气浓度(ppb)。
血液入口处的氢气浓度分别为7.3、27.0、4.9、6.9、10.5、0.5、1.5、2.3和10.3 ppb。透析液中的氢气浓度分别为65.1、236.7、240.5、263.9、256.2、254.9、280.6、356.2和258.3 ppb。血液出口处的氢气浓度分别为35.0、139.7、157.6、170.8、171.0、172.5、184.9、192.6和40.2 ppb。肺动脉中的氢气浓度分别为1.1、3.4、2.9、5.4、4.8、4.2、6.3、7.4和4.4 ppb。右侧颈总动脉中的氢气浓度分别为0.2、0.3、0.4、0.1、0.2、0.5、0.2、0.3和0.2 ppb。
讨论
透析液制备与氢气稳定性
研究发现,溶解氧和氢气在反渗透膜中的渗透行为不同。尽管反渗透过滤后溶解氧浓度相对稳定(由于氢气溶解略有下降),但反渗透水中的溶解氢浓度会因膜后供水压力而变化,这与自来水压力的影响规律相似(表1)。为了向透析机输送约1600 ppb的氢气浓度,膜后反渗透水压力至少需维持在100 kPa。这表明,氧气在大气条件下能稳定溶解,而过滤前快速溶解的氢气可能需要膜后持续施压以保持完全溶解状态,防止其受氮气、氧气等已溶解气体的影响而逸出。
透析机内置的脱气泵在-73 kPa(-550毫米汞柱)的压力下运行以防止气泡产生,根据亨利定律,压力降低使氢气浓度从1600 ppb显著降至250 ppb[21]。随后用透析浓缩液稀释(反渗透水与浓缩液的比例为32.74:2.26),浓度进一步降至约234 ppb,与测量的最终透析液浓度230 ppb接近。按照同样原理,溶解氧浓度预计从反渗透水中的4700 ppb降至最终透析液中的730 ppb。若没有溶解的氢气,氧气浓度可能在1880 ppb左右。
透析过程中的氢气动力学
通过右侧颈总静脉建立透析血管通路。透析液回路预先充满富氢透析液,而血液回路则用生理盐水预充。透析开始前不久测量的初始透析液氢气浓度(65.1 ppb)低于稳态浓度,可能是因为在2小时的准备时间内,氢气从回路扩散到周围空气中。透析期间,透析液氢气浓度稳定在230-280 ppb之间(240分钟时例外,达到356.2 ppb)。回路出口(血液出口)处的血液中氢气浓度迅速上升并趋于稳定,达到同时刻透析液浓度的54.0%-67.7%(稳态时为139.7-192.6 ppb)。透析开始后不久观察到的血压短暂下降可能是多种因素导致的,可能与体外循环容量变化和麻醉有关,通过补液和血管升压药支持成功得到控制。
饱和自来水中的氢气可能以溶解分子和潜在的微气泡(微纳米气泡)形式存在。但考虑到反渗透膜的孔径(约1纳米),只有氢气分子(直径约0.3纳米)可以通过,较大的气泡(约≥10纳米)无法通过。因此,用这种方法制备的最终透析液中的氢气主要以分子形式存在。所用的聚砜透析膜(孔径4-5纳米)允许氢气分子轻松通过,这表明氢气的转移主要是通过浓度梯度扩散实现的。考虑到流速(血流量=50毫升/分钟,透析液流量=100毫升/分钟),观察到的血液出口氢气浓度(约为透析液浓度的60%)反映出高效的扩散动力学。
相比之下,体循环中的氢气浓度明显较低。肺动脉中的浓度仅为血液出口浓度的1.8%-3.8%(透析期间为3.4-7.4 ppb)。这与理论稀释相符,因为血泵流量(50毫升/分钟)仅占犬心输出量(13公斤犬约为1040-1300毫升/分钟)的一小部分(估计为3.7%-4.6%)。此外,右侧颈总动脉中的浓度更低(0.1-0.5 ppb),仅为肺动脉浓度的1.9%-13.8%。这有力地表明,从透析器经静脉回流进入肺循环的大部分氢气通过呼气迅速排出,只有极少量到达体动脉循环。因此,在这种透析方式中,氢气作用的主要部位似乎局限于体外回路和透析器内的血液。
血液入口处测量的氢气浓度比右侧颈总动脉高且变化更大,可能是由于前腔静脉中血液通路导管尖端处发生再循环所致。这些发现与我们之前的猪实验一致,在那项研究中,静脉输注饱和氢盐水时,显著的肺部清除限制了动脉中的氢气递送[22]。要通过透析使外周器官达到治疗性氢气水平,可能需要大幅增加递送剂量或采用绕过肺部清除的方法。采用血液透析滤过(HDF)并使用大量富氢置换液可能是增强全身性氢气递送的一种策略。
以往关于传统电解水透析的研究报道称临床结局有所改善,这可能与氢气有关[16-19]。但这些系统中报道的氢气浓度较低(例如,反渗透水中为99 ppb,透析液中为30-80 ppb[11,17]),而我们的系统中,反渗透水中为1600 ppb,最终透析液中为230 ppb。此外,我们的系统采用氢气直接溶解法,设计紧凑,易于集成到现有水处理系统中。因此,与基于电解的系统相比,其安装成本可能更低,这表明它有望在临床上更广泛地应用。未来的临床应用需要确定安全有效的最佳操作条件,可能需要探索血液透析滤过以增强全身性氢气递送,并开展长期临床试验来评估患者结局。
局限性
本研究仅使用了一只犬,并在透析当天和次日进行了评估。未来需要对更多受试者进行长期评估。尽管实验条件尽可能接近正常临床使用(例如,使用人类用设备进行4小时透析,血液和透析液流量等透析参数按犬的体型调整为约人类常规条件的五分之一)。但所用透析器相对于动物体型而言表面积较大,尽管这已是制造商提供的最小型号。虽然血液和透析液流量已按比例降低,但在解释氢气转移动力学时,应考虑透析器相对尺寸的这种差异。由于侵入性操作时间较长,未采用标准透析液进行交叉设计实验。
High-Concentration Hydrogen Delivery During Dialysis Using an Innovative Direct Dissolution Technique: In Vivo Kinetics in a Canine Model
Shibuya, Masaki*; Fujinaka, Masafumi*; Yonezawa, Mako*; Nishimura, Natsumi*; Uchinoumi, Hitoshi*; Tani, Kenji†; Hitaka, Yukihiro‡; Nakamura, Kimihiko‡; Isoyama, Naohito‡; Fujii, Zenzo§; Sano, Motoaki*
From the *Department of Medicine and Clinical Science, Graduate School of Medicine, Yamaguchi University, Ube, Japan
Disclosure: M.S. has received advisory fees and research fees from Doctors Man Co, Ltd. The other authors have no conflicts of interest to report.
This research was funded by grants from Doctors Man Co., Ltd. to Motoaki Sano. The funders had no role in the design and conduct of the study; in the collection, management, analysis, and interpretation of the data; in the preparation, review, or approval of the manuscript; or in the decision to submit the manuscript for publication.
Correspondence: Masaki Shibuya, Department of Medicine and Clinical Science, Graduate School of Medicine, Yamaguchi University, 1-1-1, Minamikogushi, Ube, Yamaguchi, 755-8505, Japan. Email: mshibuya@yamaguchi-u.ac.jp.
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1494325.html?mobile=1
收藏

