减肥对脂肪组织的改变不止于减少脂肪量
减肥手术后脂肪组织发生的细胞层面变化,或许揭示了该手术带来代谢益处的相关通路。
肥胖在现代社会中十分普遍,可能对人体健康构成严重威胁。不久前,实现安全有效的肥胖解决方案仍极为困难,但手术方法的发展以及针对胰高血糖素样肽-1(GLP-1)受体的药物研发,让人们如今能更轻松地大幅减重。减重会带来立竿见影的健康益处,包括改善或缓解胰岛素抵抗、2型糖尿病和脂肪肝等疾病。尽管减肥手术和药物并非直接作用于脂肪组织,但人们认为,在肥胖缓解过程中,身体脂肪储存区域(即脂肪库)发生的变化,在一定程度上介导了这些有益效果。米兰达(Miranda)等人在《自然》杂志中发文,描述了减肥手术后脂肪组织在细胞组成和结构上的变化,并确定了或许能解释这些干预手段为何能改善代谢健康的通路1。
脂肪组织十分复杂。除了标志性的储脂细胞——脂肪细胞外,它还包含免疫细胞、血管、脂肪基质细胞和祖细胞(ASPCs),这些细胞支撑着脂肪组织的结构,并能分化为脂肪细胞。随着肥胖的发展,这些细胞的相对比例会发生改变。最值得注意的是,免疫细胞会大量涌入,这与肥胖引发的代谢并发症(包括胰岛素抵抗)密切相关。在啮齿动物模型中,阻断脂肪组织的炎症反应可改善胰岛素敏感性,促进代谢健康。
肥胖还与脂肪细胞中基因表达谱的改变有关,这揭示了可能导致代谢问题的细胞通路。这些通路包括衰老(又称细胞老化)、线粒体(细胞的能量生成细胞器)功能障碍、对低氧水平的应激反应、一种称为氧化应激的细胞状态,以及通过纤维化形成瘢痕样组织。许多此类异常会随着体重减轻而缓解,但这种效果与脂肪库细胞环境变化的关联尚不明确。
米兰达等人利用单核RNA测序(snRNA-seq)技术,分析了25名肥胖者在接受减肥手术前后数月的脂肪组织转录谱。此外,研究人员还获取了24名从未肥胖过的瘦体重者的数据。单核RNA测序数据显示,即使是瘦体重者,脂肪库中的多种细胞类型(包括脂肪细胞、基质细胞和血管细胞)也会表达一系列与各类细胞应激相关的基因。在肥胖者中,这些基因的信使RNA水平显著升高。
在这些应激相关基因中,有一些与衰老相关,而衰老过程已被证实与包括脂肪组织在内的多种组织的代谢功能障碍有关2。米兰达及其同事发现,减重可逆转所有受影响细胞类型中与衰老相关的基因表达模式,这表明衰老可能在肥胖引发的代谢并发症中起到了致病作用。这一观点与“ senolytics ”(即能清除衰老细胞的化合物)在增重动物模型中产生的有益效果相符3。
此前对减重前后脂肪组织的研究提出了一个有趣的“记忆”概念:在肥胖期间脂肪库细胞发生的变化,在体重恢复正常后并未完全消失。还有证据表明,曾经肥胖但后来减重的动物,其体重反弹速度往往比从未肥胖过的动物更快。一些研究人员认为,这种现象可能是由脂肪细胞和脂肪库中其他细胞的表观基因组(即控制基因转录的DNA及其包装的修饰)发生持续性改变所驱动的⁴。米兰达等人在人类样本中观察到,减肥手术后转录变化仍会持续存在,但目前尚不清楚这些细胞是否以及如何导致了众多减重人群中常见的最终体重反弹。
在小鼠中,研究发现减重后免疫细胞的转录变化会持续存在⁵⁻⁷。米兰达等人在人类身上也观察到了免疫细胞的变化,其中最显著的是脂质相关巨噬细胞——这类细胞在肥胖时数量会增加,减重后则会减少。尽管数量发生了这种变化,但即使在减肥手术后,这些细胞中推断的代谢通量(分子通过代谢通路的速率)仍然很高,这再次表明减重并未使细胞完全恢复到瘦体重状态,细胞仍保留着肥胖状态的“记忆”。这与脂肪细胞形成了对比,减重后脂肪细胞的预测代谢通量会恢复到瘦体重状态(图1)。
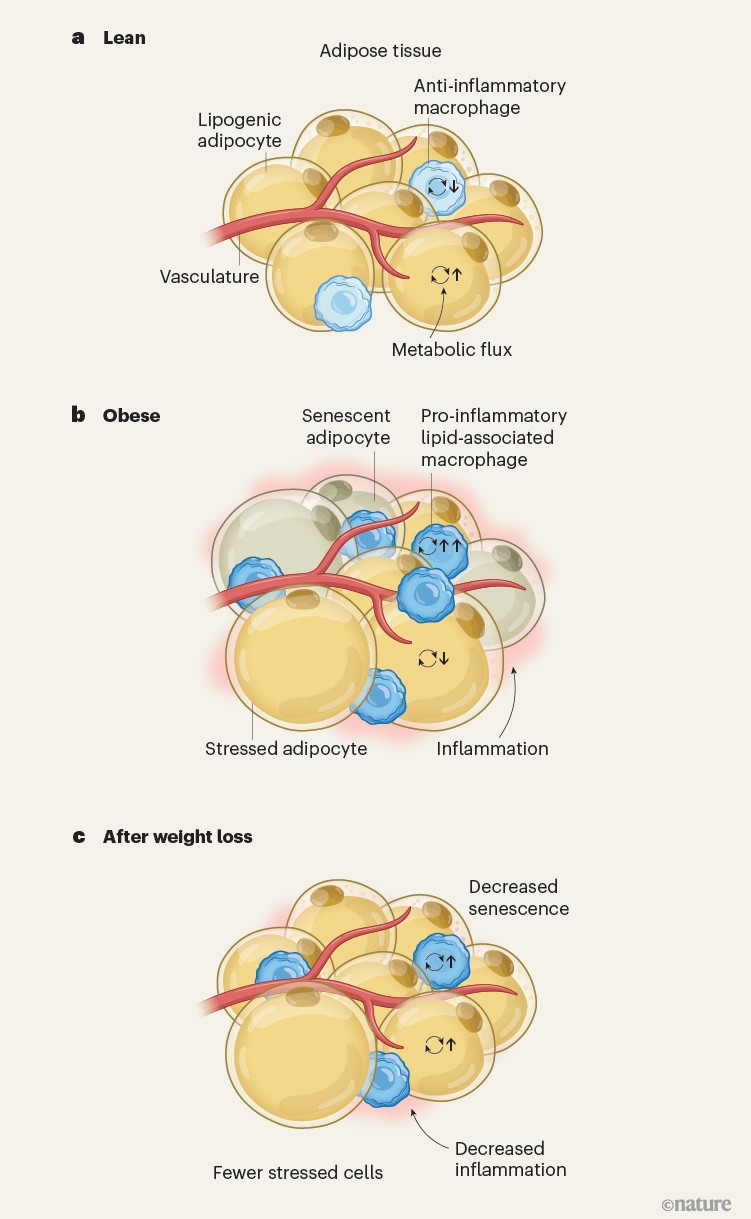
图1 | 肥胖和减重过程中脂肪组织的变化. 米兰达等人1对瘦体重者以及减肥手术前后人群的脂肪组织中细胞的基因表达和空间结构进行了描述。
a. 瘦体重状态下,脂肪细胞通过脂肪生成作用合成并储存脂肪。被称为巨噬细胞的免疫细胞具有抗炎功能。据推断,脂肪细胞的代谢通量处于中等水平,巨噬细胞的代谢通量则较低。
b. 肥胖状态下,脂肪细胞出现细胞老化(衰老)迹象,推断的代谢通量低于瘦体重状态。表达应激相关基因的脂肪细胞体积增大,并与其他类型的应激细胞(未显示)一起形成空间上独特的集群(微环境)。大量脂质相关巨噬细胞浸润,这些细胞会促进炎症,且推断的代谢通量较高。
c. 减重后的脂肪组织与瘦体重状态相似,但仍存在一些应激微环境。脂质相关巨噬细胞仍留在组织中,但其数量比肥胖状态时少,且仍保持较高的推断代谢通量。
对从完整组织中分离出的细胞进行基因表达分类存在一个问题:这种方法无法揭示组织的结构排布。要了解结构排布,就需要进行空间分析,即把细胞的转录谱映射回它们在原始组织中的位置。
到目前为止,对脂肪组织的空间分析开展得较少。脂肪细胞体积较大,往往会与邻近的其他类型细胞重叠,这使得获取真正单细胞分辨率的测序数据变得困难。此外,与大脑或肾脏不同,脂肪组织通常不被认为具有高度的组织结构。迄今为止,只有一项研究以接近单细胞的分辨率报道了脂肪组织的空间结构,通过该方法发现了三种不同的脂肪细胞亚群⁸。
米兰达等人使用了一种空间分辨率高于以往的技术,对瘦体重者、肥胖者和减重后的脂肪组织样本进行了空间分析。他们发现了不同的脂肪细胞亚群,并通过单核测序加以证实。研究结果表明,肥胖引发的细胞应激体现在不同的微环境中,这些微环境由多种细胞类型组成,包括表达应激相关基因的脂肪细胞亚群和脂肪基质细胞与祖细胞亚群。
单细胞分析技术的进步,使得能够生成健康状态和疾病状态下基于组织和器官的细胞图谱。脂肪组织的研究落后于其他器官,因为脂肪细胞体积大且脆弱,无法承受单细胞分析所需的微流体力。单核RNA测序技术的出现,推动了人类和小鼠详细脂肪组织图谱的绘制。名为“人类细胞图谱(HCA)”联盟的国际科学家团队正在开展相关工作,将这些数据整合到一个全面的脂肪组织图谱中⁹。人类细胞图谱项目不仅旨在通过整合全球各地研究小组的数据来获取新见解,还致力于标准化细胞类型和亚型的注释,以统一命名体系并协调各实验室的研究结果。
尽管当前这项研究是已发表的首批人类减重后脂肪组织数据集之一,但关于减重动态还有更多需要了解的地方,这样才能更好地理解相关的生理变化。例如,使用GLP-1受体激动剂等减肥药物后,脂肪组织的变化是否与减肥手术后的变化一致?今年发表的小鼠实验表明,有些变化取决于减重方式,而有些则不1⁰。
米兰达及其同事的数据反映了干预后数月或数年发生的重塑事件。鉴于手术后代谢益处几乎立即显现,评估脂肪组织组成和功能更急性的变化将会很有意义。相反,维持体重颇具挑战性,而脂肪组织的长期变化在多大程度上导致了这一现象,仍有待深入研究。与体重波动(即人们经历多次减重和反弹)相关的变化也值得研究。
最后,作者关注的是位于皮肤下方的皮下脂肪组织。对其他类型体脂(如环绕内脏器官的内脏脂肪)的分析可能会得出不同的结果。尽管如此,这些数据为重大代谢扰动后脂肪组织的转录和空间结构提供了见解,并为潜在的治疗途径提供了思路。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1493095.html?mobile=1
收藏

