富氢水+藜麦淀粉退火处理:多结构、理化性质及体外消化率
l 采用3种水进行退火(ANN)处理,以改变藜麦淀粉(QS)的性质。
l 富氢水首次被用于通过退火法修饰淀粉。
l 退火处理显著降低了藜麦淀粉的体外水解率,但提高了抗性淀粉(RS)含量。
l 3种水的退火处理均显著改变了藜麦淀粉的结构和理化性质。
l 其中,等离子体活化水的退火处理对藜麦淀粉的影响最为显著。
摘要
本研究探讨了退火处理(ANN)结合蒸馏水、富氢水和等离子体活化水对藜麦淀粉(QS)的多结构、理化性质及体外消化率的综合影响。据我们所知,富氢水首次被用于淀粉修饰。与原生藜麦淀粉相比,经退火处理的样品表面更粗糙,仍保留A型X射线衍射图谱,但相对结晶度更高。退火处理显著提高了藜麦淀粉的直链淀粉含量、糊化特性和吸水率,同时降低了膨胀力和黏度。退火处理后,藜麦淀粉的总水解率和快速消化淀粉含量降低,抗性淀粉水平显著升高。与蒸馏水退火处理相比,富氢水和等离子体活化水结合退火处理对藜麦淀粉性质的影响更显著。其中,等离子体活化水处理的样品受影响最大,这可能归因于其酸性环境以及活性氧和氮物种(RONS)的存在。本研究为进一步提高淀粉的热稳定性和功能性提供了一种新策略。
退火是一种通过提高淀粉的晶体完善度和促进淀粉链的相互作用,来改善淀粉的物理化学性质的处理方式。退火处理使淀粉中直链淀粉含量和抗性淀粉的含量均增加。
抗性淀粉(resistant starch)又称抗酶解淀粉、难消化淀粉,在小肠中不能被酶解,但在人的肠胃道结肠中可以与挥发性脂肪酸起发酵反应。抗性淀粉存在于某些天然食品中,如马铃薯、香蕉、大米等都含有抗性淀粉,特别是高直链淀粉的玉米淀粉含抗性淀粉高达60%。这种淀粉较其他淀粉难降解,在体内消化缓慢,吸收和进入血液都较缓慢。其性质类似溶解性纤维,具有一定的瘦身效果。
1. 引言
藜麦(*Chenopodium quinoa* Willd.)是一种假谷物,属于双子叶植物纲苋科。作为传统主食,藜麦在南美洲安第斯地区已有数千年的种植历史[1]。藜麦对多种生长环境具有极强的适应性,在中国的产量不断增加,尤其在山西、甘肃和青海等省份。近年来,藜麦因其营养价值在全球范围内日益受欢迎[2]。食用藜麦有助于预防肥胖、心血管疾病、糖尿病和某些癌症[3,4]。淀粉是藜麦籽粒的主要成分,占干重的53%–69%[5]。藜麦淀粉(QS)颗粒呈不规则多边形,直径为0.5–3 μm,比其他一些植物的淀粉颗粒小得多[1]。此外,原生藜麦淀粉(NQS)的直链淀粉含量(AMC)较低(7%–27%),低于其他谷物淀粉[6],这使其具有一些独特的理化性质,包括高水溶性、高膨胀力(SP)、慢回生、低糊化温度(PT)和高酶敏感性[7]。尽管藜麦淀粉被认为是一种新型淀粉来源[2],但原生藜麦淀粉的上述理化性质极大地限制了其应用,因此有必要采用淀粉修饰方法。
一般来说,淀粉修饰可分为三类:化学方法(氧化、酸水解、交联等)、物理方法(热湿处理、退火(ANN)、高静水压、等离子体处理、微波、超声波等)和酶法。其中,由于消费者对健康安全食品的需求,物理方法越来越受欢迎。作为一种环保且标签清洁的技术,退火因其操作简单、成本低且实用性强,在淀粉修饰中一直备受青睐[8]。退火是在过量水中进行的,温度高于原生淀粉的玻璃化转变温度但低于糊化温度[9]。研究表明,退火可提高淀粉的吸水率,改善相对结晶度(RC)和抗性淀粉(RS)的形成,并降低淀粉黏度,且不会破坏颗粒结构[8,10]。然而,退火对藜麦淀粉理化和功能性质的影响尚未得到评估。
冷等离子体含有多种活性物质,如中性粒子、带电粒子和紫外光子,已被应用于多种淀粉的物理修饰[11]。等离子体活化水(PAW)是通过冷等离子体处理蒸馏水(DW)获得的,含有活性氧和氮物种(RONS),如H₂O₂、NO₂⁻、NO₃⁻和O₃[12]。等离子体活化水具有低pH值、高氧化还原活性和高电导率。近年来,等离子体活化水在食品和农业领域被广泛用于海鲜保鲜、促进植物生长和产品灭菌[12]。然而,关于等离子体活化水对淀粉性质和功能影响的研究较少。分子氢是一种抗氧化剂,能够选择性减少人体内具有细胞毒性的活性氧(ROS)[13],有可能影响淀粉的特性。近年来,富氢水(HW)作为一种向人体输送分子氢的替代方式,已引起科学研究的广泛关注。然而,富氢水在淀粉修饰中的应用较少,其对淀粉性质的影响尚不明确。
尽管已有研究分别探讨了等离子体活化水或退火处理对淀粉结构、理化性质和体外消化率的影响[8,14,15],但等离子体活化水或富氢水与退火处理结合对藜麦淀粉的影响尚未阐明。因此,本研究采用三种不同的水(蒸馏水、富氢水和等离子体活化水)进行退火处理以修饰藜麦淀粉,比较不同退火修饰样品的性质变化。本研究可为淀粉修饰提供一种新兴且创新的策略。同时,这种复合修饰的潜在机制也将为未来等离子体活化水和富氢水在淀粉修饰中的应用拓展可能性。
2. 材料与方法
2.1 材料
藜麦籽粒(品利2号)的水分含量为13.4%,由山西农业大学农业基因资源研究中心(中国)提供。猪胰α-淀粉酶(A3176;16 U/mg)、胃蛋白酶(P7125;≥400 U/mg)和黑曲霉葡萄糖淀粉酶(A9913;100,000 U/g)购自Sigma-Aldrich化学公司(美国密苏里州圣路易斯)。所有化学试剂均为分析纯。
2.2 淀粉提取
采用湿磨法提取藜麦淀粉[16]。将得到的原生藜麦淀粉(NQS)在恒温对流烘箱中40°C烘干至水分含量<10%。将原生藜麦淀粉研磨成粉末,过100目筛。
2.3 等离子体活化水的制备与表征
使用射流等离子体处理装置(PG-1000ZD,南京苏曼等离子体工程研究院有限公司,中国南京)在大气压下以750 W功率处理蒸馏水120 s,制备等离子体活化水(PAW)。使用pH/ORP计和电导率仪(上海仪电科学仪器股份有限公司,中国上海)分别测定pH值、氧化还原电位(ORP)和电导率。使用商业试剂盒测定H₂O₂、NO₂⁻和NO₃⁻的含量。等离子体活化水必须在12 h内使用。富氢水(HW)由山西悦明堂生物科技有限公司(中国太原)提供。
2.4 退火处理
参照先前报道的方法进行退火处理[8]。将原生藜麦淀粉以1:4(g/mL)的比例分散在不同类型的水(蒸馏水、富氢水和等离子体活化水)中,置于容器中。密封容器,在4°C下平衡过夜。随后,将容器置于恒温对流烘箱中50°C孵育24 h。冷却至室温后,将样品在40°C下风干。根据所用水质的不同,退火处理后的样品分别称为D-ANN(蒸馏水退火)、H-ANN(富氢水退火)和P-ANN(等离子体活化水退火)。
2.5 扫描电子显微镜(SEM)观察
使用扫描电子显微镜(Regulus8240,日立,日本东京)在20 kV下观察样品的形态。将样品制备在附着于金属样品台上的双面胶带上,在真空下喷涂20 nm厚的金层。然后,将样品台放入扫描电子显微镜中,以10,000倍 magnification观察样品。
2.6 X射线衍射(XRD)分析
使用X射线衍射仪(D/MAX 2500 V,理学公司,日本)测定不同样品的XRD图谱和相对结晶度(RC)。样品在40 kV和30 mA电流下,以4°/min的速度从2θ 5°扫描至60°。使用Jade 6.0软件(OriginLab Corp.,美国)计算相对结晶度。
2.7 傅里叶变换红外(FTIR)光谱分析
使用Vertex 70型傅里叶变换红外光谱仪(布鲁克,德国卡尔斯鲁厄)在4000–400 cm⁻1波数范围内测定样品的FTIR光谱。预先将淀粉样品在40°C烘箱中风干。将干燥后的样品与KBr粉末以1:150(淀粉:KBr,m/m)的比例混合,研磨后压制成薄片。评估1047 cm⁻1和1022 cm⁻1处的吸光度比值(R1047/1022),以表征淀粉的短程有序结构。
2.8 直链淀粉含量和碱性持水力测定
参照先前报道的方法测定直链淀粉含量(AMC)[17]。简要来说,脱脂后,将样品(90 mg,干重)和1 mol/L NaOH在室温下放置15–24 h以分散淀粉。用蒸馏水将溶液体积定容至100 mL,并剧烈混合。取淀粉分散液(5 mL)、1 mol/L乙酸和2 mL碘溶液混合,用蒸馏水定容至100 mL。静置20 min后,测定混合物在620 nm处的吸光度。
采用Adebowalea等人[18]描述的方法测定样品的碱性持水力(AWR)。将淀粉(1.0 g,干重)转移到试管中并称重(m1)。随后,加入0.1 mol/L NaHCO₃(5 mL),剧烈混合30 s,在(30±2)°C下静置20 min。孵育后,将试管离心(35×g,15 min),并以与水平面成10°–15°角倾斜沥干10 min。再次称量装有内容物的试管(m2)。碱性持水力计算如下:(公式1)
AWR(g/g) of sample = m2-m1
2.9 吸油率和吸水率测定
参照Liu等人[19]的方法测定不同样品的吸油率和吸水率。将淀粉样品与花生油或水以1:5(g/mL)的比例在离心管中混合,在室温下剧烈搅拌30 min。然后,将试管以7300×g离心15 min。测量倾析后的上清液体积,计算每克淀粉保留的油或水的体积(mL)。
2.10 溶解度和膨胀力测定
参照Liu等人[20]的方法,略作修改,测定溶解度和膨胀力(SP)。将每份淀粉(50 mg,干重,m0)转移到离心管(m1)中。随后,向样品中加入5 mL蒸馏水,手动匀浆,将试管置于90°C水浴中孵育30 min。冷却至室温后,将试管以845×g离心15 min。小心倾析上清液,在105°C下烘干至恒重(m3),称量带有沉淀物的离心管(m2)。淀粉溶解度和膨胀力按以下公式计算:
(公式2) Solubility(%)=m3(mg)/m0(mg)X100
(公式3)SSP(%)=[m2(mg)-m1(mg)]//m0(mg)X100
2.11 差示扫描量热法(DSC)分析
使用差示扫描量热仪(Q2000,TA仪器公司,美国特拉华州纽卡斯尔)评估不同样品的糊化特性。将淀粉(3 mg,干重)与蒸馏水(9 mL)混合后密封在样品盘中,在室温下平衡过夜。以空盘为对照,将样品盘从30°C加热至130°C,升温速率为10°C/min。测定起始温度(To)、峰值温度(Tp)、终止温度(Tc)和糊化焓(∆H)。
2.12 糊化特性分析
采用快速黏度分析仪(RVA-4,Newport Scientific Co.,Ltd.,澳大利亚新南威尔士州沃里伍德),参照Liu等人[20]的方法评估样品的糊化特性。测定回生黏度(SB)、崩解黏度(BD)、峰值黏度(PV)、糊化温度(PT)和最终黏度(FV)。
2.13 淀粉消化率分析
2.13.1 淀粉的体外消化
参照先前研究[20]进行不同样品的体外消化率测定。简要步骤:将样品(50 mg,干重)转移至50 mL烧瓶中,加入5 mL蒸馏水。糊化并冷却后,加入10 mL HCl-KCl缓冲液(0.05 mol/L,pH 1.5)。向每个烧瓶中加入胃蛋白酶溶液(0.2 mL),在40°C振荡水浴中孵育60分钟。随后,用乙酸钠缓冲液(0.5 mol/L,pH 6.9)将样品总体积调整至25 mL。向每个烧瓶中加入淀粉酶溶液(5 mL,2.6 UI),在37°C振荡水浴中孵育3小时。水解前30分钟每10分钟从每个烧瓶中取出1 mL样品,剩余2.5小时每30分钟取样一次。将所得样品放入干燥离心管中,立即置于沸水中灭活淀粉酶。冷却后,向每个管中加入乙酸钠缓冲液(0.4 mol/L,pH 4.75,3 mL)和葡萄糖淀粉酶(60 μL),在60°C振荡45分钟。使用GOPOD试剂盒测定样品的葡萄糖含量,淀粉量通过葡萄糖含量乘以0.9计算。消化率以不同时间点水解的总淀粉百分比表示。
2.13.2 快速消化淀粉(RDS)、慢速消化淀粉(SDS)和抗性淀粉(RS)含量测定
根据水解曲线计算快速消化淀粉(RDS)、慢速消化淀粉(SDS)和抗性淀粉(RS)的含量。RDS为前20分钟水解的淀粉量,SDS为20-120分钟水解的淀粉量,RS为180分钟后剩余的淀粉量。
2.14 统计分析
所有数据均为三次重复测量的平均值±标准差。使用SPSS 19.0版本(SSPS Inc.,美国伊利诺伊州芝加哥)进行单因素方差分析。统计学显著性设定为*P* < 0.05。使用Minitab 17版本(Minitab Inc.,美国)进行主成分分析(PCA)。
3 结果与讨论
3.1 等离子体活化水(PAW)的性质
表1显示了蒸馏水(DW)、富氢水(HW)和等离子体活化水(PAW)的性质及活性物质含量。富氢水的pH值为8.0,氢原子含量>3.0 μmol/L。等离子体可与液体相互作用,在两介质界面发生化学反应,生成活性物质,从而改变液体的理化性质[21]。等离子体处理过程中会产生多种化学活性物质,如单线态氧、臭氧、羟基自由基和活性氮分子,这些物质会生成NO₂⁻、H⁺、NO₃⁻、H₂O₂、NO等,进而改变溶液的pH值、氧化还原电位(ORP)和电导率[22-24]。
表1 不同类型水的性质及活性物质含量
本研究中,经等离子体处理后,蒸馏水的pH值从6.78显著降至2.41,表明等离子体处理使水酸化。同时,由于活性氧(ROS)的产生,电导率从18.97显著增至1063.25 μS/cm,氧化还原电位从276.30 mV增至573.16 mV[25]。因此,等离子体活化水中存在活性离子和氧化还原活性。等离子体活化水电导率的提高可能是由于水中生成了可溶性活性基团和离子(活性氧或活性氮物种)[26]。与蒸馏水和富氢水相比,等离子体活化水中H₂O₂、NO₂⁻和NO₃⁻的含量从0分别显著增至135.18、1986.32和2135.26 μmol/L,这导致其pH值显著下降。这也表明本研究中的等离子体处理有效提高了等离子体活化水的反应能力,使其可能具有更强的淀粉修饰能力。
3.2 形态学特性
图1为样品的扫描电子显微镜(SEM)图像。原生藜麦淀粉(NQS)颗粒呈不规则多边形,表面光滑,无孔隙或空洞(图1A)。退火处理后,D-ANN颗粒表面出现裂纹和空洞(图1B)。与D-ANN相比,H-ANN的空洞更多,部分甚至塌陷(图1C)。P-ANN颗粒表面有多个更深的凹陷、孔洞和交联结构(图1D)。这些形态变化取决于水的类型。类似结果在采用等离子体活化水退火处理的糖棕淀粉中也有报道[27]。

图1 原生及修饰样品的扫描电子显微镜图像
(A)原生藜麦淀粉;(B)蒸馏水退火处理样品;(C)富氢水退火处理样品;(D)等离子体活化水退火处理样品
一般而言,退火过程中的热效应会导致直链淀粉和支链淀粉重组,使无定形区域更致密,进而在淀粉颗粒表面形成凹坑或孔洞[8]。这是D-ANN颗粒形态变化的潜在机制。富氢水中的氢原子和氢分子有利于藜麦淀粉颗粒表面的氧化还原反应,从而改变其形态。等离子体活化水中的活性氧和氮物种(RONS)含量更高,pH值更低,这导致藜麦淀粉颗粒表面降解更显著,核心分子的转化或重排更剧烈,从而促进水解。这些结果表明,淀粉形态变化的程度与退火过程中所用水的类型和性质相关。
3.3 X射线衍射(XRD)图谱和相对结晶度(RC)
原生及修饰淀粉的相对结晶度和X射线衍射图谱如图2所示。原生藜麦淀粉具有典型的A型结晶图谱,在2θ 15.15°、17.06°、18.14°和23.08°处有四个衍射峰。经退火处理的样品在相似角度保留了衍射峰。因此,三种水的退火处理均未改变藜麦淀粉的A型结晶结构。类似地,Yan等人[28]报道,等离子体活化水退火处理未影响马铃薯和豌豆淀粉的结晶类型。
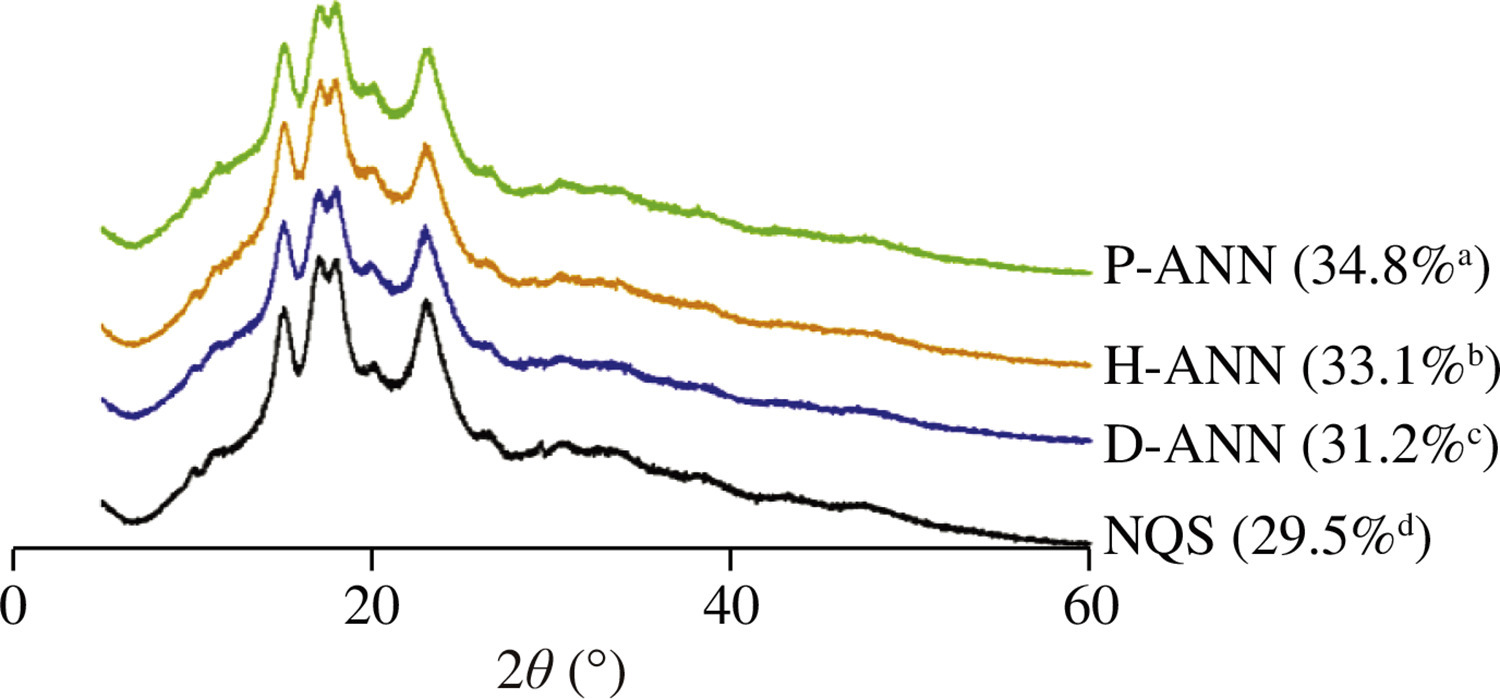
图2 不同样品的X射线衍射图谱及相对结晶度(括号内数值)
括号中不同小写字母表示样品间相对结晶度存在显著差异(*P* < 0.05)
与原生藜麦淀粉的相对结晶度(29.5%)相比,退火处理后的淀粉相对结晶度增至31.2%-34.8%,顺序为:蒸馏水退火处理样品 < 富氢水退火处理样品 < 等离子体活化水退火处理样品。已有研究报道,蒸馏水退火处理可提高荞麦和高粱淀粉的相对结晶度[8]。退火处理对相对结晶度的提升通常与多种因素相关,包括晶体尺寸、晶体完整性、直链淀粉含量、新晶体的形成、小晶体的聚集、双螺旋链的排列等[29-30]。本研究中,退火处理后直链淀粉含量升高以及淀粉链间相互作用增强,可能是导致样品相对结晶度增加的主要原因。富氢水退火处理样品(33.1%)和等离子体活化水退火处理样品(34.8%)的相对结晶度显著高于蒸馏水退火处理样品(31.2%)(*P* < 0.05)。富氢水和等离子体活化水使相对结晶度增加,可能是由于其碱性和酸性环境及所含活性氧和氮物种优先水解藜麦淀粉的无定形区域,改善了双螺旋的平行堆积及淀粉颗粒结晶区内未堆积双螺旋的重新取向。
3.4 傅里叶变换红外(FTIR)光谱
样品的傅里叶变换红外光谱(4000-400 cm⁻1)如图3所示,R1047/1022值如表2所示。1022和1047 cm⁻1处的吸收峰分别对应淀粉的无定形区和有序结晶结构[31]。因此,R1047/1022代表淀粉中有序结晶区与无定形区的比例[28],可反映短程有序结构的相对含量。与原生藜麦淀粉相比,修饰样品的光谱具有相似的吸收峰。原生及退火处理淀粉的R1047/1022顺序为:原生藜麦淀粉 < 蒸馏水退火处理样品 < 富氢水退火处理样品 < 等离子体活化水退火处理样品,表明退火处理可提高藜麦淀粉的有序性。退火过程中,过量的水和适度的加热可能改善藜麦淀粉中双螺旋的堆积,从而提高修饰样品的R1047/1022值。另一方面,富氢水中的氢离子、氢原子和高pH值可能促进淀粉链间的交联,而等离子体活化水中的活性氧和氮物种及酸性成分可能在退火过程中使藜麦淀粉颗粒生成更多短链直链淀粉,甚至形成新的双螺旋结构。这些结果与X射线衍射分析结果一致。
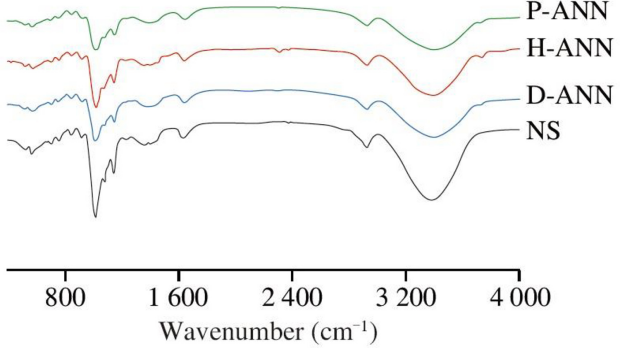
图3 原生及修饰淀粉样品的傅里叶变换红外光谱
表2 不同样品的直链淀粉含量、碱性持水力、R1047/1022值、吸油率、吸水率、溶解度和膨胀力
AMC (%) | 25.40 ± 0.35d | 27.31 ± 0.23c | 28.83 ± 0.11b | 30.26 ± 0.15a |
AWR (g/g) | 1.36 ± 0.24d | 1.55 ± 0.16c | 1.81 ± 0.39b | 1.93 ± 0.21a |
Water absorption capacity (g/g) | 1.56 ± 0.18c | 1.88 ± 0.31b | 1.91 ± 0.27b | 2.09 ± 0.16a |
Oil absorption capacity (g/g) | 1.49 ± 0.24a | 1.34 ± 0.18ab | 1.25 ± 0.19b | 1.01 ± 0.09c |
R1 047/1 022 | 0.89 ± 0.21c | 0.91 ± 0.15b | 0.94 ± 0.32b | 1.03 ± 0.26a |
Solubility (%) | 6.70 ± 0.71c | 6.90 ± 0.34c | 8.30 ± 0.25b | 11.90 ± 0.14a |
SP (%) | 16.60 ± 0.56a | 15.40 ± 0.30b | 13.10 ± 0.51c | 10.90 ± 0.05d |
注:数据以平均值±标准差表示(n=3)。同一行中不同小写字母上标表示存在显著差异(P<0.05)。
3.5 直链淀粉含量(AMC)和碱性持水力(AWR)
不同样品的直链淀粉含量和碱性持水力如表2所示。与原生藜麦淀粉(NQS)相比,退火处理后的样品直链淀粉含量显著更高。在退火处理样品中,等离子体活化水退火处理样品(P-ANN)的直链淀粉含量最高(30.26%),蒸馏水退火处理样品(D-ANN)最低(27.31%)。退火过程中支链淀粉的降解是直链淀粉含量增加的主要原因。先前的一篇综述指出,退火处理会导致直链淀粉-直链淀粉、直链淀粉-支链淀粉以及支链淀粉-支链淀粉之间发生重组和相互作用,影响无定形区和结晶区的流动性,从而提高淀粉的碘结合能力[32]。此外,直链淀粉溶出量的减少也是退火处理样品直链淀粉含量增加的另一个因素[8]。本研究中,与蒸馏水相比,富氢水(HW)和等离子体活化水(PAW)含有更多的活性物质。这些活性物质在退火过程中会在藜麦淀粉颗粒中形成更多的网络和交联结构,进一步促进碘-直链淀粉复合物的形成。Gao等人[33]在使用直接介质阻挡等离子体处理的研究中也报道了类似结果。
碱性持水力是一个重要参数,与饼干直径呈正相关[34],即烘焙过程中面团的扩展潜力。退火处理后,修饰样品的碱性持水力显著增加。在使用蒸馏水对高粱和荞麦淀粉进行退火处理的研究中也发现了类似结果[8]。退火处理导致淀粉形态改变,使淀粉表面积增加,这可能是碱性持水力增加的主要原因之一。本研究中,与原生藜麦淀粉相比,修饰样品的吸水率更高,这也导致了碱性持水力的增加。这些发现表明,与原生藜麦淀粉相比,退火修饰后的淀粉更适合制作饼干,且等离子体活化水退火处理样品优于蒸馏水退火处理样品和富氢水退火处理样品(H-ANN)。
3.6 吸油率和吸水率
原生藜麦淀粉和退火处理淀粉的吸油率和吸水率存在显著差异(表2)。与原生藜麦淀粉相比,退火修饰后的淀粉吸水率更高,吸油率更低。等离子体活化水退火处理样品的吸水率最高((2.09±0.16)g/g),吸油率最低((1.01±0.09)g/g)。结果表明,退火处理后藜麦淀粉的亲水性和疏水性呈现相反趋势。因此,修饰样品中羟基与水分子之间的相互作用比原生藜麦淀粉更强。退火过程中,无定形区和结晶区之间的一些氢键会断裂,使无定形区膨胀,这可能提高藜麦淀粉分子的亲水性,进而使退火处理淀粉的吸水率更高。富氢水和等离子体活化水可能诱导双螺旋结构重组,促使淀粉吸收更多水分,这可能是富氢水退火处理样品和等离子体活化水退火处理样品的吸水率高于蒸馏水退火处理样品的一个重要原因。Bertoft[35]曾报道,淀粉颗粒中支链淀粉的结构意味着双螺旋有重新排列的潜力,从而增加灵活性。苦荞和高粱淀粉经退火处理后,吸水率也有所提高[8]。在面团中添加修饰淀粉可以改善面包的颜色、体积和质构特性[36]。这些结果表明,退火修饰后的藜麦淀粉可用于改善面包产品的品质,尤其是经富氢水和等离子体活化水处理的淀粉。然而,关于退火对淀粉吸油率和吸水率影响的潜在机制研究较少,因此需要进一步研究以充分阐明这一现象。
3.7 溶解度和膨胀力
样品在90°C时的溶解度和膨胀力如表2所示。不同淀粉的溶解度和膨胀力存在显著差异。与原生藜麦淀粉相比,退火修饰后淀粉的膨胀力显著降低,这是由于支链淀粉的保水能力下降。此外,退火过程中淀粉链的重排和结晶完整性的提高会减少淀粉的水合作用,这可能是修饰淀粉膨胀力降低的主要原因。退火处理后,藜麦淀粉颗粒结构发生变化,如直链淀粉-直链淀粉、直链淀粉-支链淀粉和/或支链淀粉-支链淀粉之间的相互作用增强,形成更多的小网络结构,使分子组织更紧密,从而导致膨胀力降低。直链淀粉含量和支链淀粉结构也会降低膨胀力[37]。一般来说,退火处理后淀粉溶解度的增加是由于支链淀粉中双螺旋结构的破坏、热损伤导致直链淀粉溶出量增加以及吸水率提高[38]。与蒸馏水相比,使用富氢水和等离子体活化水处理的修饰藜麦淀粉膨胀力更低,而溶解度显著增加(表2)。这一结果可能是由于无定形区的碱性或酸性水解降低了藜麦淀粉分子的水结合能力[39]。退火处理后直链淀粉含量的增加,以及碱性或酸性物质和活性氧氮物种的存在,促进了淀粉分子的分离和扩散,也提高了修饰样品的溶解度。此外,吸水率和膨胀力都与水合特性相关,但3.6节中吸水率的变化趋势与膨胀力相反。退火处理对淀粉结构和完整性的影响会进一步限制其在高温下的膨胀。膨胀力的测试条件比吸水率更剧烈,会导致淀粉颗粒发生交联、相互作用甚至破裂,这也限制了膨胀力。退火处理样品中淀粉链之间的结合力减弱,水分子与淀粉链之间的接触面积增加,这是吸水率增加的原因。因此,吸水率和膨胀力的结果并不矛盾。在分析结果时,还应考虑不同测试条件的影响。
3.8 差示扫描量热法(DSC)分析
表3显示了不同样品的糊化转变温度(To、Tp、Tc)和糊化焓(ΔH)。退火处理后,所有修饰的藜麦淀粉的糊化温度和糊化焓均显著高于原生藜麦淀粉,其中等离子体活化水退火处理样品的值最高。在豌豆、玉米和非常规糖棕淀粉经退火处理的研究中也报道了类似结果[14,27,28]。然而,有报道称马铃薯淀粉经退火处理后,糊化焓的结果不一致[28]。因此,退火处理和不同类型水的综合作用对糊化焓的影响可能取决于淀粉的来源。
表3 原生及修饰样品的糊化特性
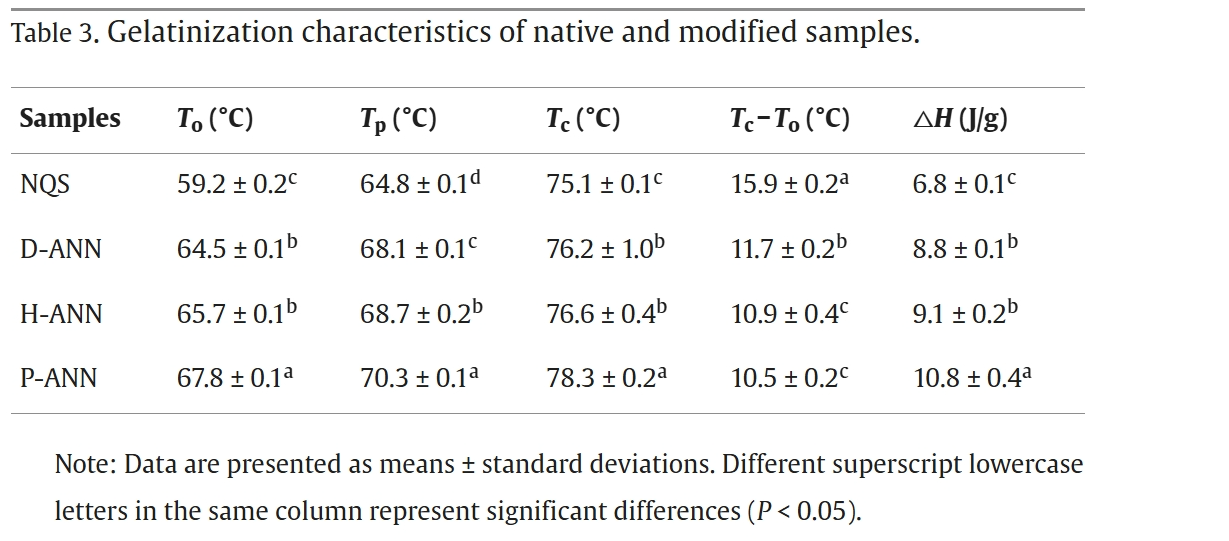
注:数据以平均值±标准差表示。同一列中不同小写字母上标表示存在显著差异(P<0.05)。
退火处理使藜麦淀粉的糊化温度显著升高,这是由于直链淀粉与支链淀粉或直链淀粉之间的相互作用抑制了淀粉颗粒的膨胀(表2)和糊化。修饰后的淀粉颗粒中结晶区比例更高(图2)。退火处理后无定形区减少,诱导新的双螺旋形成,进一步提高了To、Tp和Tc[40]。这些发现与3.2节的结果一致。同时,结晶区的水合作用或塑化作用受到抑制,也是导致Tc−To减小的因素。与蒸馏水相比,等离子体活化水中富含H+,在退火处理过程中会形成更多的氢键,阻碍藜麦淀粉的塑化。这进一步诱导双螺旋发生更大程度的重排,形成更完善的结晶结构,使等离子体活化水退火处理样品的糊化温度显著更高。
糊化焓(ΔH)代表解离双螺旋有序结构所需的能量[41]。因此,退火处理的藜麦淀粉糊化焓值更高,表明支链淀粉排列形成的双螺旋更长[42],因此需要更多的能量来破坏。修饰淀粉糊化焓的增加主要是由于有序双螺旋数量的增加,这与X射线衍射结果一致(图2)。退火修饰样品糊化焓增加的其他原因包括直链淀粉-直链淀粉相互作用、直链淀粉-支链淀粉相互作用以及结晶区组织性的改善[37]。对于富氢水退火处理样品和等离子体活化水退火处理样品,与蒸馏水退火处理样品相比,主要通过活性氧氮物种、碱性和酸性物质形成了更多的异质微晶,使得糊化焓值更高。这一发现表明,在富氢水或等离子体活化水存在下进行退火处理,可进一步提高藜麦淀粉的热稳定性。
3.9 糊化特性
淀粉黏度在食品加工中至关重要。淀粉黏度在剪切和加热条件下的变化主要基于颗粒间的摩擦、直链淀粉的溶出以及颗粒结构的排列[43]。本研究中所有淀粉的糊化参数汇总于表4。与原生藜麦淀粉相比,退火修饰样品的糊化温度(PT)升高,而峰值黏度(PV)、崩解黏度(BD)、回生黏度(SB)和最终黏度(FV)显著降低。等离子体活化水退火处理样品的糊化温度最高,各项黏度值最低。与蒸馏水退火处理样品相比,富氢水退火处理样品和等离子体活化水退火处理样品的黏度更低,这是由于碱性和酸性水解作用使淀粉链断裂增加。因此,退火处理限制了淀粉颗粒的膨胀,提高了淀粉的热稳定性,延缓了糊化,这与差示扫描量热法的结果一致。
Table 4. Pasting properties of starch samples.
Property | NQS | D-ANN | H-ANN | P-ANN |
PV (cP) | 3 255.0 ± 42.4a | 2 682.5 ± 30.4b | 2 394.0 ± 11.3c | 2 225.5 ± 20.5d |
BD (cP) | 3 167.0 ± 46.6a | 2 186.0 ± 8.5b | 1 965.0 ± 15.5c | 1 477.0 ± 41.0d |
SB (cP) | 776.5 ± 31.8a | 595.0 ± 57.9b | 529.0 ± 4.2bc | 484.0 ± 2.8c |
FV (cP) | 3 943.5 ± 78.5a | 2 781.0 ± 49.5b | 2 494.0 ± 11.3c | 1 961.0 ± 43.8d |
PT (°C) | 84.0 ± 0.1c | 92.1 ± 1.1b | 93.1 ± 0.4ab | 93.7 ± 0.1a |
注:数据以平均值±标准差表示(n=3)。同一行中不同小写字母上标表示存在显著差异(P<0.05)。
退火处理后,退火淀粉所需额外热量可能归因于键强度增加、结晶度提高、分子间交联数量增多以及淀粉链之间空间减小[44]。本研究中,退火淀粉的峰值黏度和崩解黏度显著降低,主要与淀粉链之间的相互作用增强有关,这抑制了颗粒的膨胀。修饰样品的膨胀力较低,可能进一步阻碍直链淀粉溶出,从而降低黏度。结晶度的提高是峰值黏度和崩解黏度降低的另一个因素。最终黏度反映淀粉冷却后的黏度增加,回生黏度则决定淀粉的糊化或回生能力[45]。修饰样品的最终黏度和回生黏度降低,可能是由于退火过程中淀粉链之间的交联增强,进一步限制了膨胀力。富氢水退火处理样品和等离子体活化水退火处理样品的最终黏度显著低于蒸馏水退火处理样品。这一结果基于糊化测量过程中淀粉分子沿流动方向排列所需的时间。直链淀粉的大量解聚导致了这种降低,这与等离子体活化水中的活性物质相互作用有关[27],也与富氢水的碱性环境有关[46]。退火处理降低了回生黏度,使藜麦淀粉通过淀粉链之间的相互作用形成更稳定的构象。因此,这些变化表明退火处理后藜麦淀粉糊的假塑性降低,回生倾向减弱,尤其是经等离子体活化水处理的样品。
3.10 体外消化率
原生及退火淀粉的水解曲线如图4A所示,功能性淀粉(快速消化淀粉、慢速消化淀粉和抗性淀粉)的含量如图4B所示。随着消化时间的延长,总水解率增加。在不同消化时间点,原生藜麦淀粉的水解率均高于退火淀粉。根据消化率,淀粉可分为快速消化淀粉、慢速消化淀粉和抗性淀粉[47]。退火处理后,藜麦淀粉的快速消化淀粉含量显著降低,而慢速消化淀粉和抗性淀粉含量增加。等离子体活化水退火处理样品的快速消化淀粉含量最低(29.5%),慢速消化淀粉含量最高(45.0%)。退火修饰淀粉的抗性淀粉含量分别为:蒸馏水退火处理样品18.0%、富氢水退火处理样品22.7%、等离子体活化水退火处理样品25.0%。这些结果表明,退火处理影响藜麦淀粉的消化率,且富氢水和等离子体活化水的影响比蒸馏水更大。
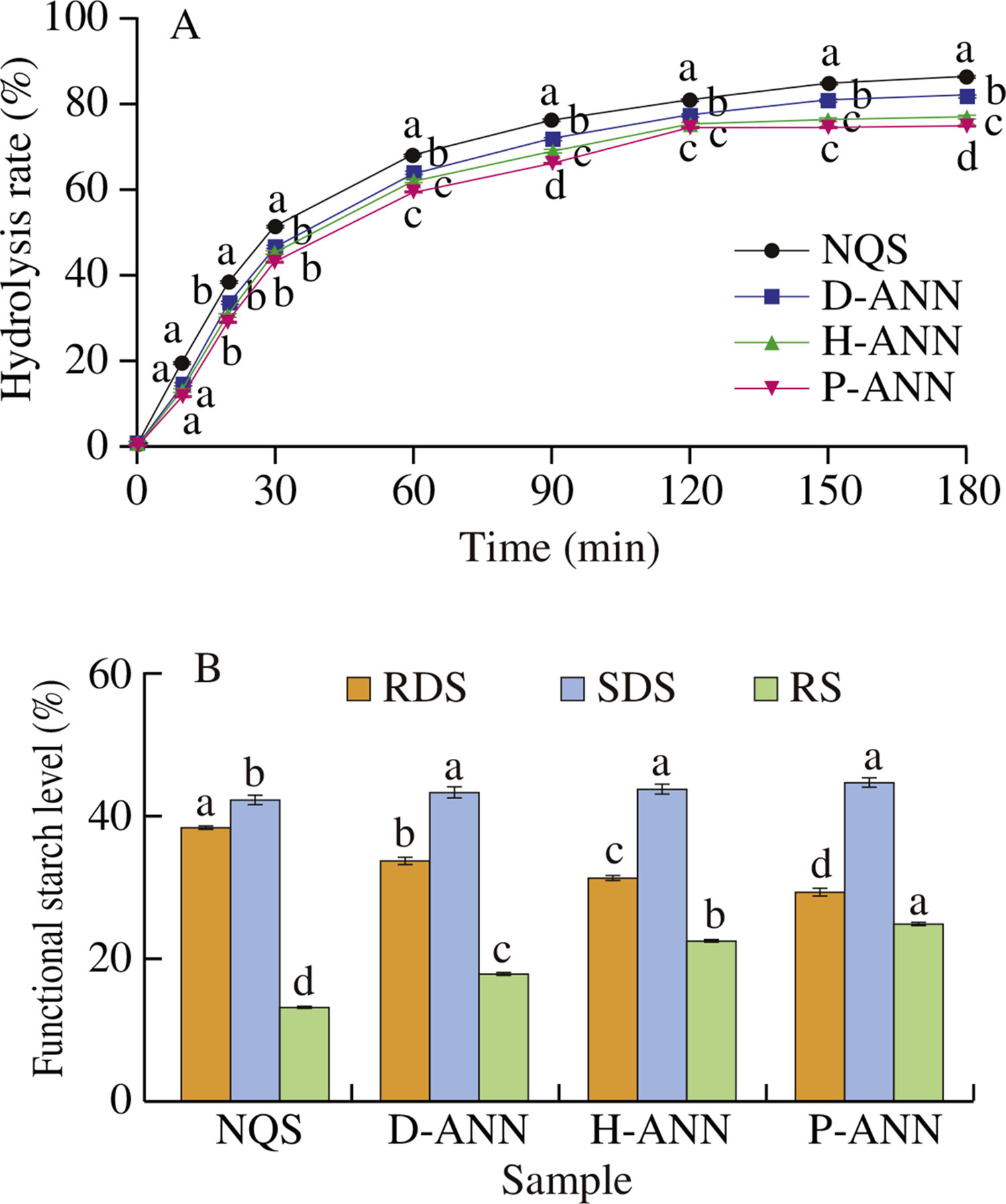
图4 (A)水解率;(B)不同样品的快速消化淀粉、慢速消化淀粉和抗性淀粉含量
不同小写字母标注的柱形在组间存在显著差异(P<0.05)
通常,退火修饰淀粉的酶敏感性降低归因于直链淀粉与支链淀粉的比例、直链淀粉-脂质复合物、结晶结构和退火条件[29]。本研究的表2和图2显示,所有退火样品的直链淀粉含量和结晶完整性均高于原生藜麦淀粉,这导致其消化率较低。尽管退火淀粉表面的孔隙和裂纹可能有助于消化酶进入颗粒内部加速水解,但体外消化结果表明,直链淀粉含量和相对结晶度的增加可以抵消形态变化对水解的影响。
慢速消化淀粉含量的增加可能是由于淀粉结晶完整性提高以及颗粒间的分子键合。退火处理过程中抗性淀粉的增加主要归因于淀粉颗粒的结构变化,包括直链淀粉-直链淀粉和直链淀粉-支链淀粉相互作用增强、相对结晶度升高以及分子重组[48]。在本研究中,所有这些因素可能部分限制了藜麦淀粉分子与酶的接触,从而进一步限制水解。同时,富氢水和等离子体活化水修饰对藜麦淀粉的影响大于蒸馏水。其潜在原因可能是富氢水和等离子体活化水的碱性和酸性环境生成了低分子量水解产物(如低聚糖),这些产物抵抗酶解。这与先前的研究一致[22]。这些结果表明,退火处理是降低藜麦淀粉总水解率的有效方法。退火处理中使用富氢水和等离子体活化水可显著提高慢速消化淀粉和抗性淀粉含量。
3.11 主成分分析(PCA)
主成分分析是一种多元统计分析方法,可将原始测量变量转换为新的变量,即主成分。主成分是数据的统计表示,以包含得分图和载荷图的双标图形式呈现。本研究通过主成分分析来更好地理解4种不同样品的结构、理化性质和体外消化特性之间的相互关系,得分图和载荷图如图5所示。主成分1(PC1)和主成分2(PC2)分别解释了94.1%和3.8%的数据变异,两者共解释97.9%的数据变异。
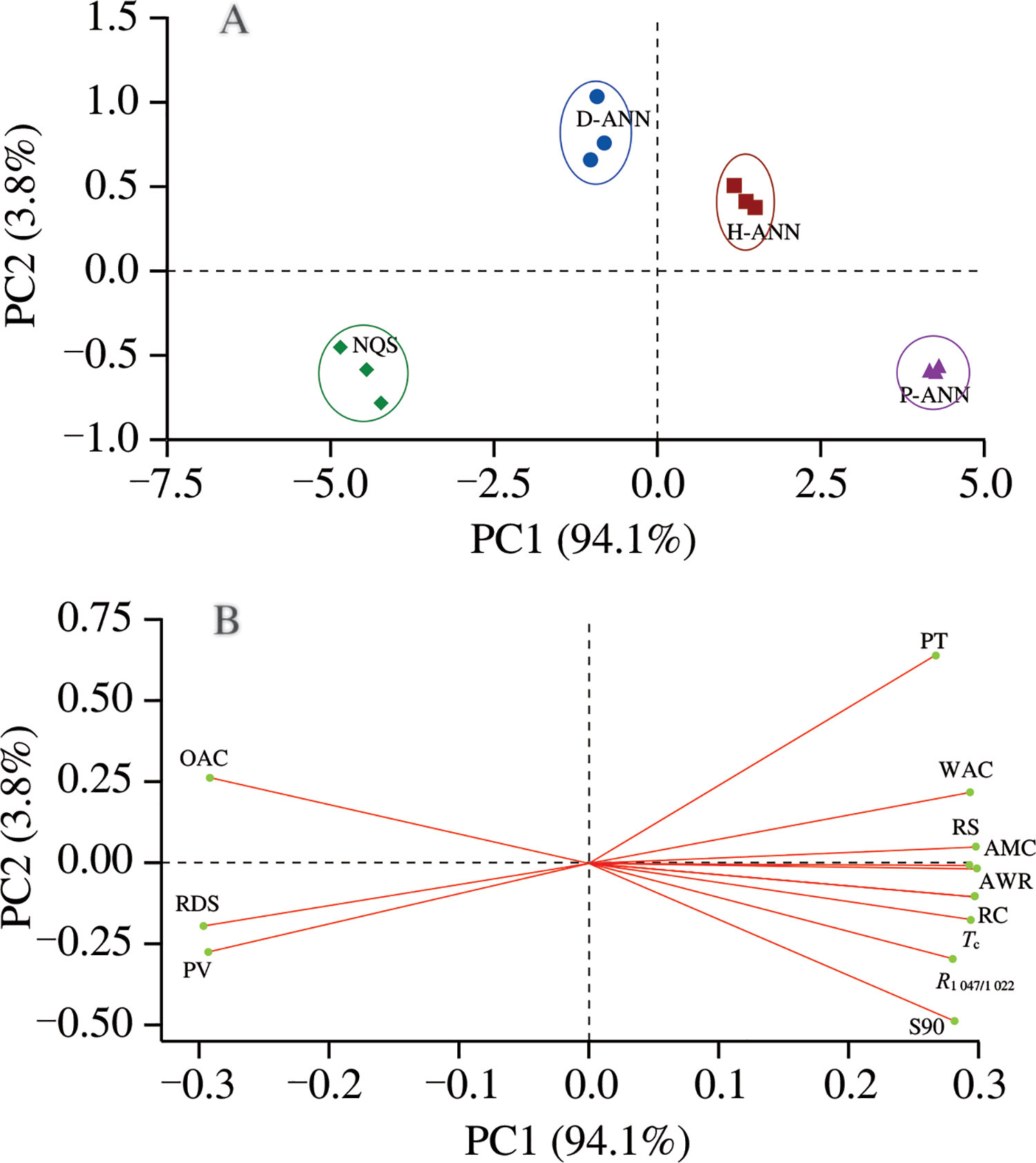
图5 总结样品及其结构、理化性质和消化率特性之间关联的主成分分析图
(A)不同样品的主成分得分图;(B)不同性质的主成分载荷图
OAC:吸油率;WAC:吸水率
一般来说,主成分分析显示变量之间的相互关系以及变量作为独立组的特征。图5A显示4组样品通过不同水的退火处理呈现出分离趋势。原生藜麦淀粉和蒸馏水退火处理样品在主成分1上的得分为负,而富氢水退火处理样品和等离子体活化水退火处理样品得分为正。4组样品在主成分2上也位于不同侧,且任意两组之间的距离与它们之间的差异程度正相关。此外,蒸馏水退火处理样品、富氢水退火处理样品和等离子体活化水退火处理样品与原生藜麦淀粉的距离逐渐增大,表明退火处理确实影响了藜麦淀粉的结构、理化性质和体外消化特性。同时,蒸馏水退火处理样品与富氢水退火处理样品之间的距离比富氢水退火处理样品与等离子体活化水退火处理样品之间的距离更近,表明退火处理对藜麦淀粉的影响程度取决于水的类型,其中等离子体活化水退火处理样品的影响最大。因此,这些结果可能还有助于预测未来使用富氢水或等离子体活化水进行淀粉修饰的研究结果。载荷图提供了样品不同性质之间的相关性信息(图5B)。形成聚类的性质之间呈正相关,而与其他聚类呈负相关。吸油率、快速消化淀粉和峰值黏度在主成分1上载荷为负,是得分图中原生藜麦淀粉和蒸馏水退火处理样品的主要贡献因素。与富氢水退火处理样品和等离子体活化水退火处理样品对应的主要贡献因素是糊化温度、吸水率、抗性淀粉、直链淀粉含量、碱性持水力、相对结晶度、终止温度、R1047/1022和90°C溶解度(S90),这些在主成分1上载荷为正。在这些性质中,直链淀粉含量与碱性持水力、相对结晶度、90°C溶解度、抗性淀粉等高度正相关,与快速消化淀粉和峰值黏度负相关。因此,主成分分析结果证实了不同样品之间存在显著差异(存在一些聚类),尤其揭示了富氢水或等离子体活化水的退火处理对藜麦淀粉的直链淀粉含量、结构、热稳定性、理化性质和消化特性有显著影响。
4 结论
本研究探讨了分别采用蒸馏水、富氢水和等离子体活化水进行退火处理(ANN)对藜麦淀粉的多结构、理化性质和体外消化率的综合影响。与原生藜麦淀粉相比,三种水的退火处理样品均显著改变了淀粉的形态,提高了直链淀粉含量和热稳定性。退火处理未改变原生藜麦淀粉的A型结晶结构,但提高了相对结晶度。同时,三种退火淀粉的体外水解率降低,快速消化淀粉含量减少,慢速消化淀粉和抗性淀粉含量增加。与蒸馏水相比,富氢水和等离子体活化水的退火处理对藜麦淀粉的修饰程度更大,其中等离子体活化水的影响最显著。这分别归因于等离子体活化水的酸性环境(含活性氧氮物种)和富氢水的碱性环境(含氢原子),这些环境导致淀粉分子间的相互作用更强。这些结果表明,退火处理结合富氢水或等离子体活化水可能是未来淀粉修饰的一种新策略。据我们所知,富氢水退火处理首次用于淀粉修饰。未来需要进一步研究以揭示更多可能的潜在机制。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1492564.html?mobile=1
收藏

