单纯氢气吸入疗法可能无法缓解无全层坏死的非闭塞性肠系膜缺血(NOMI)的肠黏膜损伤:一项实验性猪模型研究
Tanaka Y, Matsumura Y, Hayashi Y, Aoki M, Izawa Y, Endo K, Mato T. Hydrogen inhalation therapy alone may not alleviate intestinal mucosal damage in NOMI without total-layer necrosis: An experimental swine model study. Acute Med Surg. 2025 Jul 4;12(1):e70072. doi: 10.1002/ams2.70072. PMID: 40626114; PMCID: PMC12231231.
目的
氢气吸入疗法是一种新型疗法,可减轻心脏骤停后综合征的氧化应激,对肠系膜上动脉(SMA)闭塞具有一定益处。本研究旨在评估在无需紧急手术干预的危重症非闭塞性肠系膜缺血(NOMI)猪模型中,氢气吸入疗法的疗效与可行性。
方法
在8头3-4月龄雌性猪全身麻醉下诱导非闭塞性肠系膜缺血(NOMI)。以经肠系膜上动脉注射肾上腺素为起始点(定义为T=0),采血起始时间相对于此点为T=-30。通过联合采血(T=-30至-10)、持续全身注射去甲肾上腺素(T=-30至240)及经肠系膜上动脉持续注射肾上腺素(T=0至240)的方式诱导失血性休克。通过肠道浆膜大体观察、生物标志物检测、肠道病理学检查及计算机断层扫描血管造影评估肠系膜缺血程度。
结果
纳入基线特征相似的对照组(n=4)和氢气组(n=4)。所有动物均存活至安乐死时间点(T=240)。局部注射肾上腺素期间,肠浆膜颜色变深。在T=240时,对照组和氢气组的乳酸水平分别为7.4(4.7-11.3)mmol/L和5.6(5.0-6.4)mmol/L,而8-羟基-2'-脱氧鸟苷中位数水平分别为0.15(0.14-0.18)ng/mL和0.15(0.13-0.16)ng/mL。两组的pH值、碱剩余及钾离子水平相似。在任何时间点和部位,肠道缺血等级均无显著差异。
结论
尽管危重症可诱发非闭塞性肠系膜缺血(NOMI),但本研究使用的模型未出现透壁性坏死。在此情况下,氢气吸入疗法未能减轻组织学上的缺血性损伤。
背景
非闭塞性肠系膜缺血(NOMI)是指在肠系膜主干血管无梗阻的情况下发生的节段性肠坏死。1 急性腹部疾病约占腹痛病例的1%-2%,被诊断为急性肠系膜缺血;其中约20%为NOMI病例。2,3 NOMI的危险因素包括休克状态、血管加压药使用、年龄、心脏疾病、肝脏疾病和肾脏疾病。1,3,4 NOMI的治疗基础是处理基础疾病和优化血管内容量。3 已有研究证实局部血管扩张剂输注或生长抑素给药的疗效。5 先前的研究表明,血管扩张剂治疗对不需要紧急手术的NOMI病例有效。6 然而,在实际临床实践中,局部血管扩张剂输注并不常用,因为血管造影下的持续动脉输注具有侵袭性,且存在多种相关风险,包括血肿、导管相关感染和血栓形成。6 即便现在,NOMI仍与高死亡率和不良总体预后相关2,7;因此,有必要寻找更安全、更有效的NOMI治疗方法。
据报道,氢气吸入疗法可有效减轻炎症细胞因子和活性氧引起的细胞损伤。8 吸入氢气不仅可能对心脏骤停后综合征9和失血性休克10有益,对缺血性疾病也可能有益。11 在肠系膜上动脉(SMA)栓塞中,据报道吸入氢气可减少肠干细胞损伤并减轻氧化应激。12 然而,目前尚无关于氢气疗法对NOMI影响的报道。
由于NOMI的高死亡率和高发病率,应探索创新疗法。我们假设在导致NOMI的危重症情况下,氢气吸入疗法可能减轻肠缺血。为验证这一假设,我们对肠缺血等级进行了组织学评估,并检测了血气参数和8-羟基-2'-脱氧鸟苷(8-OHdG)水平,以确定肠损伤程度。因此,我们旨在通过实验动物模型研究氢气吸入疗法的疗效。我们通过联合失血性休克和局部血管加压药输注在猪体内诱导NOMI,并研究2%氢气吸入疗法的血清学和病理学疗效。
方法
动物准备
我们按照先前的报道建立了猪NOMI模型。13 为诱导NOMI,需要使用猪,因为猪的器官与人类器官有很大相似性。自治医科大学动物伦理委员会批准了本实验研究(批准号:21054-01)。本研究遵循ARRIVE指南,以确保方法、结果和讨论的恰当报告。本研究在动物研究实验室(CDAMTec:先进医疗技术开发中心;日本枥木县自治医科大学)进行。在实验开始前,猪被安置和管理在CDAMTec,那里有专门的工作人员。实验用猪体重34-40 kg,年龄3-4个月。所用品种为长白猪,均为雌性,在实验前至少隔离7天,可自由获取食物和水。实验当天,我们肌内注射0.08 mg/kg阿托品(三菱田边制药株式会社)、0.06 mg/kg美托咪定(日本全药工业株式会社)和0.3 mg/kg咪达唑仑(安斯泰来制药株式会社)。实验期间使用七氟烷维持麻醉。
氢气与4%氢气和96%氮气的混合气体(太阳日酸株式会社)从麻醉系统的吸气侧通入。全身麻醉诱导后,将氢浓度调整至潮气量的约2%。氢/氮混合气体滴定至容量控制通气潮气量的50%。潮气量设定为7-10 mL/kg,呼吸频率调整为10-15次/分钟,确保呼气末二氧化碳水平和外周血氧饱和度分别维持在40±5 mm Hg和95%-100%。使用39°C的加热毯防止体温过低。全身麻醉诱导后,在右颈部插入中心静脉导管和动脉导管,在右股动脉插入10-Fr鞘管。静脉注射5000单位普通肝素,随后每小时输注1000单位,以防止导管相关血栓形成。在采血前,将血管造影导管插入肠系膜上动脉以注射血管加压药。
猪实验性NOMI模型
根据先前的报道,13 通过联合采血、持续全身注射去甲肾上腺素和经肠系膜上动脉持续注射肾上腺素诱导失血性休克。以经肠系膜上动脉注射肾上腺素为起始点(定义为T=0),采血起始时间相对于此时间点为T=-30。通过股动脉鞘管对猪进行采血,采血量为20 mL/kg,约占其总血容量的27%。采血速度为前7分钟1.43 mL/min/kg,随后13分钟0.77 mL/min/kg(T=-30至-10)。为维持整个过程中的血流动力学稳定,于T=-30开始全身注射去甲肾上腺素。此外,通过血管造影导管向肠系膜上动脉注射肾上腺素,剂量为0.5 μg/kg/min。
动物被随机分为两组:对照组(n=4)和氢气组(n=4)。由于研究设计的原因,研究人员难以设盲。对照组和氢气组交替进行测试。氢气组从T=-30开始吸入氢气,直至安乐死。每60分钟进行一次血气分析,并切除小块肠组织。在处死前(T=240)进行计算机断层扫描(CT)血管造影,以评估肠系膜上动脉的通畅性和肠道的对比增强情况(SOMATOM® Definition AS+ [128层];西门子医疗有限公司)。最后,对猪进行深度麻醉,在其未恢复意识的情况下实施人道安乐死(图1)。
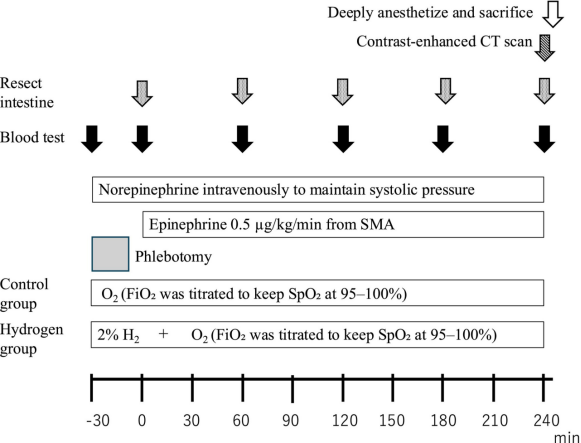
图1方法。氢气组在检查开始时接受2%氢气和25%氧气。相比之下,对照组接受25%氧气。我们调节吸入氧浓度(FiO₂)以维持血氧饱和度(SpO₂)在95%-100%之间。将经肠系膜上动脉(SMA)给药的起始时间设为T=0。我们通过股动脉鞘管采血(T=-30–T=-10)。采血后,静脉给予去甲肾上腺素以维持收缩压超过60 mmHg。通过肠系膜上动脉以0.5 μg/kg/min的速度给予肾上腺素(T=0–T=240)。每60分钟进行一次肠切除和血液检测。在T=240时进行计算机断层扫描血管造影。
生物标志物和组织学评估
每60分钟采集一次血样,具体时间点为T=0、60、120、180和240。采用床旁血气分析(Epoc;西门子医疗有限公司)测量pH值、[具体指标缺失]、碱剩余、钾、血红蛋白和血细胞比容水平。此外,我们在T=240时评估8-羟基-2'-脱氧鸟苷(8-OHdG)水平,以评估全身性氧化应激(日本老化控制研究所,日研SEIL公司)。
在T=0、60、120、180和240时,从距回肠末端10cm、100cm和200cm处切除小段肠管。肠组织标本用福尔马林固定,随后进行苏木精-伊红染色。先前的报道将病理评估分为0至5级,14 该分级由Chiu等人15 的分类修改而来。0级表示黏膜正常;1级的特征是绒毛顶端出现上皮下间隙,且白细胞计数升高;2级表示细胞发生改变,伴有局部病变,导致高达25%的绒毛破坏;3级表示结构性病变,破坏范围中等,25%-50%的绒毛被破坏;4级表示50%-75%的绒毛发生结构性损伤;5级表示黏膜层完全破坏。我们将1级及以上定义为上皮损伤。绒毛长度为每张病理切片上三个位置的长轴平均长度,并绘制每个位置(距回肠末端10cm、100cm和200cm)的中位数。观察肠绒毛长度随时间的变化。三名研究人员(YM、YH和YI)经讨论后对标本等级进行评估。若存在意见分歧,则通过进一步讨论达成共识。若无法达成共识,则以拥有约30年经验的YI的判断为准。
统计分析
我们使用Mann-Whitney U检验比较氢气组和对照组的病理检查和血液检查结果。连续数据以中位数(四分位距)表示。使用PRISM 10(GraphPad软件)进行统计分析,显著性水平设为p<0.05。研究样本量通过G*Power确定,每组需要64只动物以获得>80%的统计效能。
结果
#氢气组和对照组的基线特征
每组包含4只动物,所有动物均存活至T=240。比较对照组和氢气组的基线特征(表1)。对照组和氢气组的体重分别为36.4(35.1-37.9)kg和36.9(34.4-38.4)kg(p=0.89)。两组的大多数参数相似(表1)。pH值、[具体指标缺失]、碱剩余、钾、血红蛋白和血细胞比容水平均无显著差异(p>0.05)。
表1. 对照组和氢气组的基线特征。
研究结束时血气分析和8-OHdG的变化
比较两组随时间变化的pH值、钾、碱剩余和乳酸水平(图2,表2)。钾和乳酸水平随时间呈上升趋势。氢气组的乳酸水平低于对照组。分析对照组和氢气组在T=240时的乳酸水平,结果分别为7.4(4.7-11.3)mmol/L和5.6(5.0-6.4)mmol/L。然而,在任何时间点,两组的乳酸、钾、碱剩余和pH值均无显著差异(表2)。在观察期间,所有猪均未出现低氧血症或二氧化碳潴留。此外,研究结束时,对照组和氢气组的氧化应激标志物8-OHdG无显著差异(0.15[0.14-0.18] vs. 0.15[0.13-0.16]ng/mL,p=0.71)(图3)。
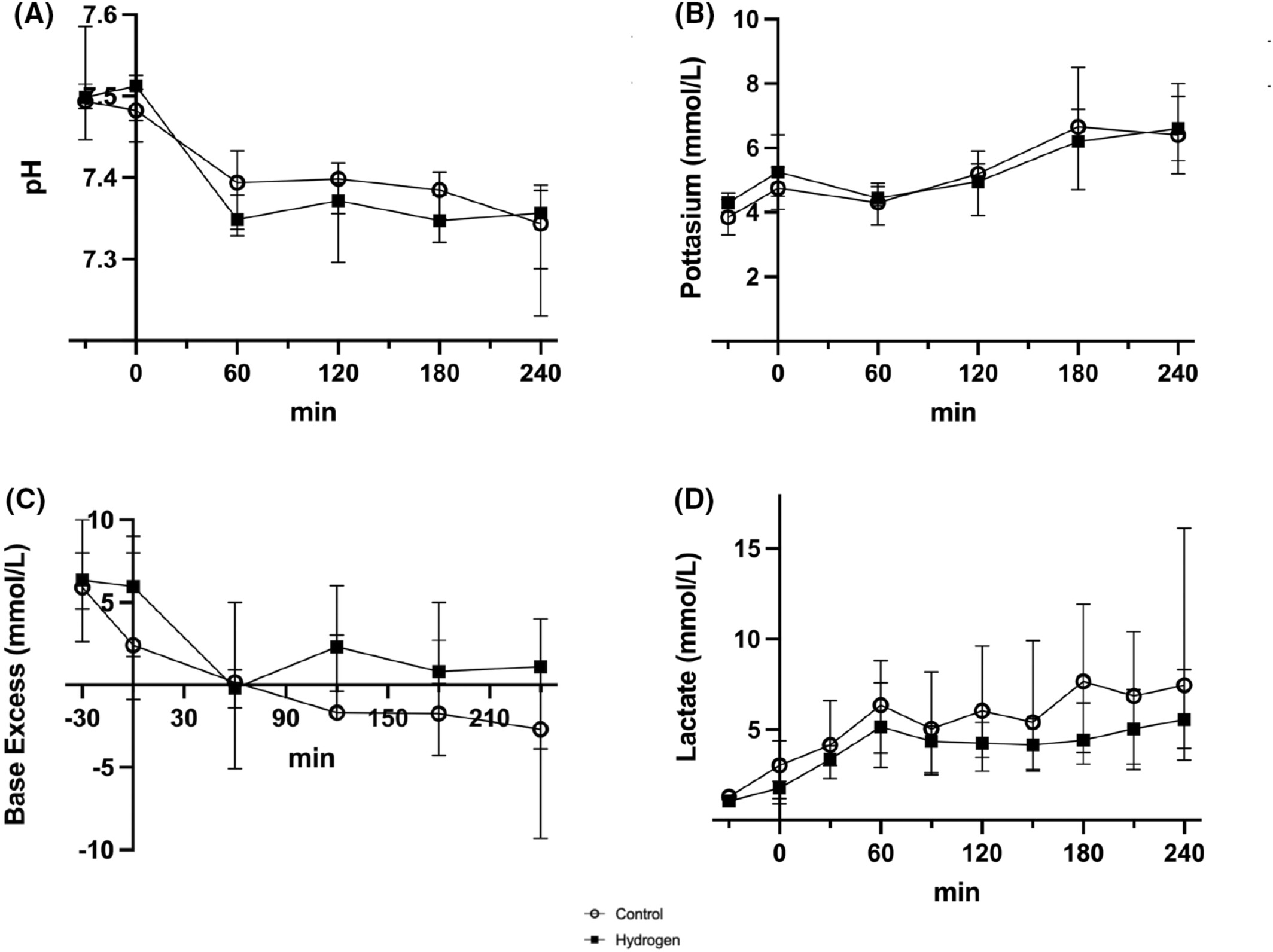
图2
对照组和氢气组的血气分析变化。(A)pH值,(B)钾离子(mmol/L),(C)碱剩余(mmol/L)(D)乳酸(mmol/L)。对对照组(n=4)和氢气组(n=4)的采血结果进行时间序列分析。氢气组的乳酸水平略低于对照组,但差异无统计学意义。氢气组的碱剩余略高于对照组,但差异无统计学意义。
表2. 猪的基线参数及其随时间的变化。
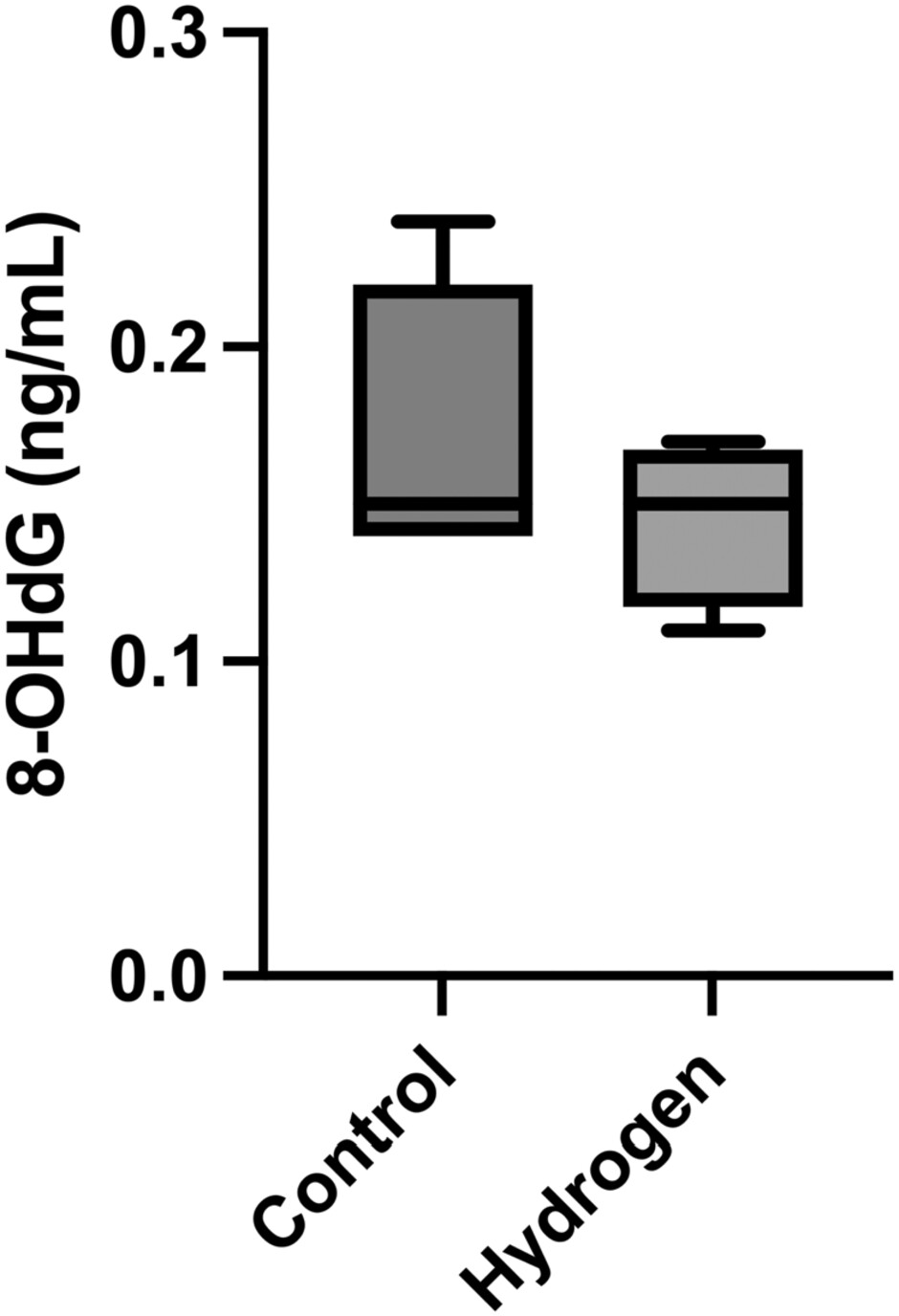
图3
T=240时的8-OHdG(ng/mL)。我们在T=240时测量8-羟基-2'-脱氧鸟苷(8-OHdG)水平,发现对照组的中位数水平为0.15(0.14-0.18)ng/mL,氢气组为0.15(0.13-0.16)ng/mL。
计算机断层扫描血管造影和组织病理学评估
计算机断层扫描血管造影证实所有猪的肠系膜上动脉均无闭塞,并随时间评估与肠缺血相关的病理变化。图4显示了对照组和氢气组各1只猪的浆膜大体图像。随着时间的推移,观察到肠浆膜逐渐变暗。尽管氢气组的浆膜表面比对照组更暗,但随着实验的进行,对照组的颜色也逐渐变深。组织学图像如图5所示。尽管随时间观察到进行性黏膜损伤,但未发生透壁性坏死。在任何时间点和部位,肠道缺血等级均无显著差异(图6)。距回肠末端100cm和200cm处的肠道等级,对照组倾向于高于氢气组。绘制每个位置的绒毛长度中位数,并分析肠绒毛长度的时间变化。与T=0相比,所有位置在T=240时的绒毛长度均缩短。对照组10cm处以及氢气组10cm处(p<0.001)、100cm处(p=0.04)和200cm处(p=0.02),与T=0相比,T=240时绒毛显著缩短。在T=120时,对照组10cm处的绒毛长度显著长于氢气组(p=0.04)。在T=240时,氢气组200cm处的绒毛长度显著长于对照组(p=0.02)。在其他时间点,对照组和氢气组的绒毛长度无显著差异(p>0.05)。
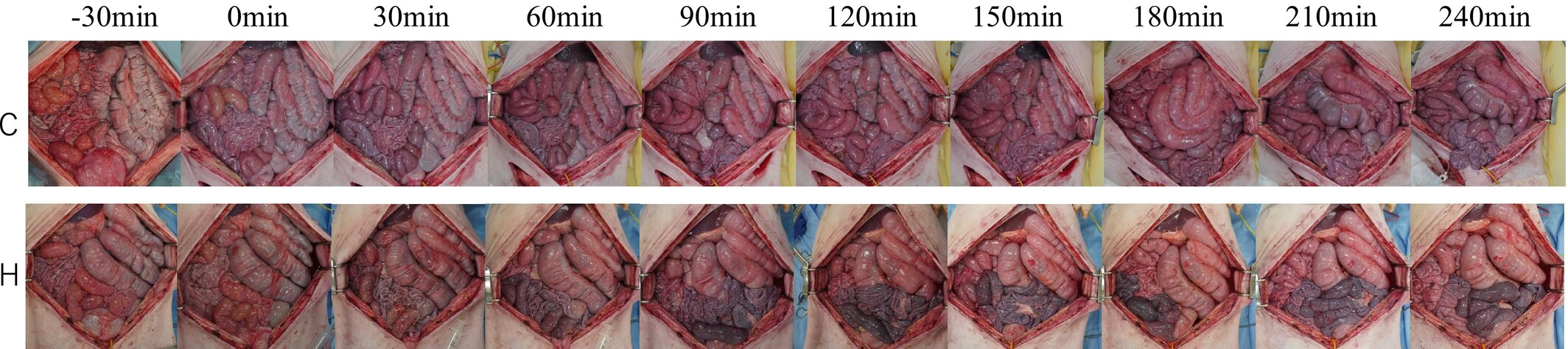 图4
图4
对照组和氢气组各1只猪的大体图像。从左到右分别为-30、0、30、60、90、120、150、180、210和240分钟时的浆膜大体图像。上排为对照组图像,下排为氢气组图像。

图5
对照组和氢气组各1只猪的组织学图像。从左到右分别为0、1、2、3和4小时的组织病理学图像。组织学图像来自距回肠末端100cm处的切除标本。上排为对照组图像,下排为氢气组图像。
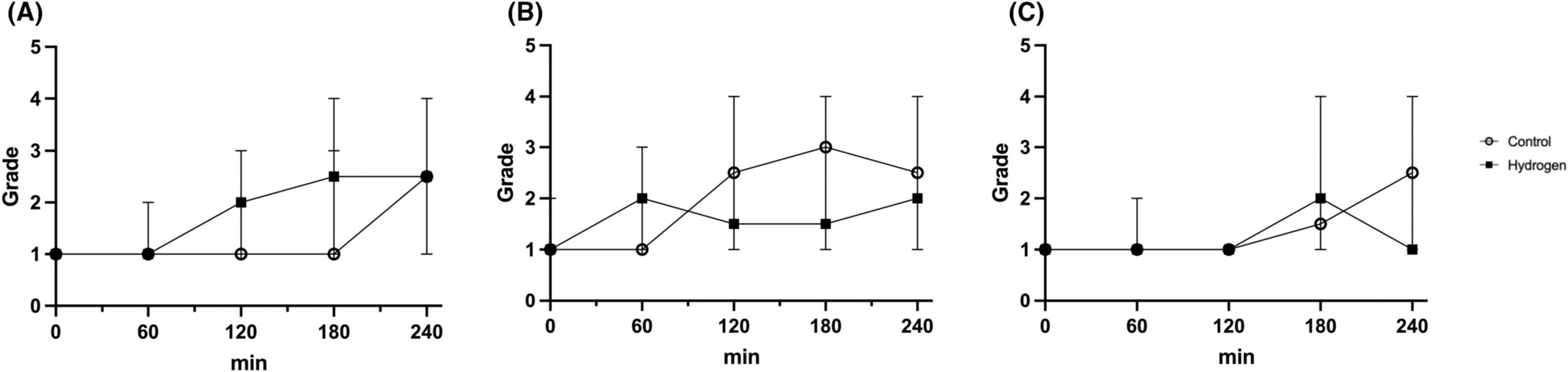
图6
组织学评估。远端(A)、中段(B)和近端(C)回肠的肠损伤等级和绒毛长度。切除的肠组织进行苏木精-伊红染色。我们对切除的肠组织进行分级,并观察肠缺血随时间的病理变化。我们使用Mann-Whitney U检验评估假设,p<0.05被认为具有统计学意义。在任何时间点和部位,肠道缺血等级均无显著差异。
讨论
据我们所知,本研究首次在危重症诱发非闭塞性肠系膜缺血(NOMI)的猪模型中研究氢气吸入疗法的效果。所有猪均完成了实验周期,未出现低氧血症或二氧化碳潴留。对照组的乳酸水平高于氢气组,但其他参数无显著差异。同样,两组的肠组织学缺血变化相当。
先前的报道发现,氢气吸入疗法不仅能降低心脏骤停后综合征9 和脓毒症16 中的氧化应激标志物,还能降低失血性休克中的乳酸水平。10,17 然而,另一项报道显示,氢气疗法并未降低肠系膜缺血时血清8-OHdG水平。12 我们的研究结果表明,在猪NOMI模型中,乳酸水平有轻微的非显著性降低,而8-OHdG水平无变化。与心脏骤停后综合征中的缺血-再灌注损伤不同,危重症诱发NOMI的病理生理学涉及长期肠灌注不足。因此,氢气吸入疗法用于NOMI可能对缺血-再灌注损伤产生不同的影响。
氢气吸入疗法可能具有以下潜力:减少失血性休克时肺内中性粒细胞浸润,17 减轻脓毒症时肺的组织学损伤,16 缩小心肌梗死的缺血面积,11 以及减轻心脏骤停后的神经损伤。18 在大鼠肠系膜动脉结扎模型中,氢气显示出对肠干细胞可能的保护作用。12 与先前的研究结果不同,我们的研究结果未显示氢气吸入疗法能减少肠损伤。虽然氢气吸入可能具有轻微的保护作用,但仍需进一步研究,特别是在可能加剧肠损伤的更严重条件下。此外,在确诊NOMI后开始氢气吸入疗法可能会产生与本研究不同的治疗效果。
氢气组的所有猪均存活至实验结束,未发生任何不良事件。我们通过根据潮气量调整氢气流速来提供充足的氧气供应。在整个实验过程中,两组猪均未出现低氧血症、二氧化碳潴留、pH值降低或高钾血症。先前的研究已证实,氢气吸入疗法是NOMI的一种安全可行的治疗方法。19
本研究存在一些局限性。首先,获得的样本量不足以检测出显著差异。这是因为本研究使用大型动物,因此只能对少量动物进行实验。其次,考虑到NOMI的临床病程通常在数天内发展,20 实验周期可能太短,无法充分评估NOMI的缺血变化。在确诊NOMI后开始氢气吸入疗法可能会产生不同的结果。第三,仅能测量部分血液标志物。抗炎生物标志物有很多,根据所分析的血液生物标志物不同,可能会得出不同的结果。尽管存在这些局限性,本研究仍是首个且独特的评估氢气吸入疗法在NOMI模型中应用的初步研究。
结论
在不涉及肌层和浆膜层不可逆透壁性坏死的猪NOMI模型中,氢气吸入疗法并未显著减轻组织学缺血损伤。尽管危重症可导致NOMI,但本研究结果是在未发生透壁性坏死的情况下获得的。因此,我们的结果表明,在这种情况下,单纯氢气吸入疗法可能不足以减轻肠损伤。需要进一步研究来评估氢气吸入疗法在发生透壁性坏死的更严重NOMI模型中是否能发挥保护作用。
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1492941.html?mobile=1
收藏

