 精选
精选
逆向电子传递驱动肥胖中的代谢变化
线粒体最广为人知的功能是将营养物质转化为能量,同时也会生成超氧化物和过氧化氢——这些氧化还原信号分子若产生过量则会有害。研究揭示,这种过量生成并非随机发生,而是集中于某一线粒体酶的特定位点,这为代谢性疾病的靶向治疗打开了大门。
原始文章:
研究问题
线粒体是细胞代谢的核心枢纽,其正常功能包括生成超氧化物和过氧化氢(统称为线粒体活性氧,mROS)1。这些物质在氧化还原信号传导中起关键作用,参与多种细胞和生理过程,如肌肉对运动的适应2。然而,过量生成时它们会造成损害,与肥胖和衰老相关的多种疾病状态密切相关。
迄今为止,大多数使用非选择性抗氧化剂抑制mROS的治疗策略均告失败,甚至产生不利影响。mROS的生成早在60多年前就已被证实,其在疾病中的作用也已明确,但为何无法将这一知识转化为有效疗法困扰了科学家数十年。为什么清除mROS未能改善代谢性疾病的预后?如何在不干扰其生理功能的前提下选择性中和其有害作用?要回答这些问题,必须首先了解mROS的生成机制,以及它们在健康和疾病中的调控方式。
研究发现
mROS的产生通常被视为均匀过程,但实际上,线粒体酶中参与呼吸作用两个关键环节(电子传递链和底物氧化)的至少11个不同位点均可生成mROS(图1a)。我们测量了基因或饮食诱导的肥胖小鼠肝脏线粒体中这11个位点的最大mROS生成能力。
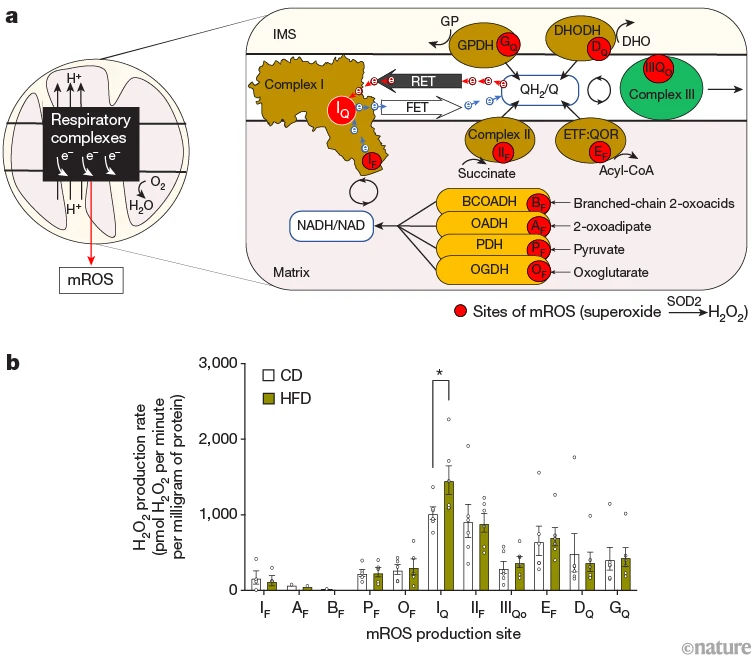
[图1. 逆向电子传递(RET)通过复合物I位点驱动肥胖小鼠肝脏线粒体活性氧(mROS)过量生成。a. 传统观点(左)忽略了mROS生成的特定酶位点,缺乏定位线粒体来源的机制细节;新视角(右)显示11个可能生成mROS的位点(红色圆圈),这对选择性中和mROS有害作用而不干扰其生理功能至关重要。(酶或酶复合物用棕色、绿色和橙色表示;底物通过箭头指向酶。)b. 对照饮食(CD)和高脂饮食(HFD)小鼠肝脏线粒体中11个mROS生成位点的最大能力,显示通过RET从IQ位点产生的过氧化氢(H₂O₂)显著增加。(*P=0.04,多重配对t检验,未校正多重比较。)]
我们发现,过量mROS通过一种称为逆向电子传递(RET)的非常规机制来自复合物I的IQ位点(图1b)。在RET过程中,还原型辅酶Q(CoQH₂)的电子在高质子动力(∆p)驱动下被迫返回复合物I。RET具有特殊的热力学要求,如高CoQH₂/CoQ比率和高∆p,曾被认为是体外实验的人工产物,但随后在缺血-再灌注损伤(由代谢物琥珀酸积累驱动)的体内模型中被观察到3;RET生成的mROS会导致组织损伤。
我们测试了琥珀酸或其他直接升高CoQH₂水平的代谢物积累是否也能驱动肥胖小鼠肝脏中RET介导的mROS形成并损害代谢稳态,但发现这些代谢物水平未改变。这促使我们研究辅酶Q(CoQ)本身的生物学特性,发现肥胖小鼠和脂肪性肝病(肝脂肪变性)患者的肝脏CoQ代谢受损,且肥胖患者的CoQH₂/CoQ比率更高。随后,我们使用不同的遗传和药理学模型改变CoQ水平、CoQH₂/CoQ比率和RET驱动的mROS生成,以研究其体内影响。值得注意的是,在所有测试系统中,复合物I通过RET的特定位点mROS生成均改变了葡萄糖稳态。
研究意义
我们的发现表明,肥胖中肝脏mROS的过量生成具有位点特异性,这为旨在减少RET、增加CoQ水平或两者兼有的治疗方法开辟了途径。CoQ水平随年龄自然下降,某些药物干预(如他汀类药物⁴)会进一步降低CoQ水平,而这些干预与2型糖尿病风险增加相关⁵。我们的研究表明,这种风险可能源于干预措施导致的CoQ耗竭及随后RET驱动的mROS生成,进而干扰胰岛素的作用。针对性补充CoQ的方法可能有益。
值得注意的是,过量mROS的来源可能因组织、病理状态(如癌症)和衰老而异。在每种情况下确定导致异常mROS产生的特定位点,将有助于开发靶向疗法。
我们计划将分析扩展到其他代谢相关组织。在肥胖和其他疾病中定位过量mROS的来源位点,对于在不干扰其生理功能的前提下减轻mROS的有害影响至关重要。未来,我们可能不再使用广谱抗氧化剂,而是开发针对不同病理状态中线粒体目标位点的定制化复合药物。——Renata de Lima Sales Gonçalves和Gökhan S. Hotamışlıgil,美国马萨诸塞州波士顿哈佛大学陈曾熙公共卫生学院
专家观点
最近的证据表明,逆向电子传递(RET)在多种生物学过程中起关键作用。Gonçalves等人提供了强有力的证据,表明通过RET产生的线粒体活性氧与肥胖中肝脏代谢平衡的破坏之间存在关联。通过多种小鼠模型,研究人员证明减少RET可改善肥胖中的代谢稳态。——Solveigh Koeberle,奥地利格拉茨大学
研究背后的故事
在发现肥胖小鼠肝脏线粒体中mROS的过量生成具有位点特异性并通过RET发生后,我们的工作重心转向确定这是否在体内发生,以及其机制和后果。RET驱动的mROS生成通常由琥珀酸积累驱动,因此当我们发现琥珀酸水平未改变时感到困惑——这指向了一个涉及辅酶Q(CoQ)的独特机制。转折点出现在我们在肥胖小鼠肝细胞中表达海鞘的氧化酶,并检测到代谢改善,这为RET驱动的mROS生成提供了首个体内证据。这是我坚持下去的动力,尽管揭示CoQ失衡的作用仍有漫长的路要走。这个项目在我心中有着特殊的地位,因为在研究过程中我迎来了自己的孩子。我还要感谢我的导师G.S.H.和出色的团队,是他们让这项工作成为可能。——R.L.S.G.
转载本文请联系原作者获取授权,同时请注明本文来自孙学军科学网博客。
链接地址:https://wap.sciencenet.cn/blog-41174-1487711.html?mobile=1
收藏

